mRNA肿瘤疫苗研发的挑战和前景展望
杨海涛
(上海瑞羿奥纳生物医药有限公司,上海201318)
肿瘤是危害人类健康的主要疾病之一,每年全球新发肿瘤患者1 930万人,中国每年有460万新发病患者,每年国内肿瘤患者死亡约290万[1]。而肿瘤的治疗经历了手术、化疗、放疗、细胞免疫治疗到肿瘤疫苗多个阶段, 治疗的方式和手段也越来越多样和先进,为癌症患者带来了更多的生存机会。美国FDA曾经在2010年批准了用于治疗前列腺癌的肿瘤疫苗Provenge,然而昂贵的疫苗费用和仅仅延长2 ~ 4个月的癌症患者生存期使该疫苗未能推广应用。 但是人类对肿瘤疫苗的研发和应用却从未停止[2]。前列腺癌疫苗获得批准,使得科学家对于新型肿瘤疫苗的研发信心更加坚定。 过去10年里肿瘤疫苗有了长足的发展,用于治疗黑色素瘤的GP96多肽疫苗和用于预防宫颈癌的人乳头瘤病毒(human papilloma virus,HPV)多价疫苗,都获得了美国FDA和我国国家药品监督管理局(National Medical Products Administration,NMPA)的批准,并在临床进行推广和应用。其中,宫颈癌9价疫苗对肿瘤预防的有效率达96%,全球女性逐步开始接种HPV疫苗, 世界卫生组织还计划通过在全球女性中推广HPV疫苗,以期到2035年能够消灭宫颈癌。
信使RNA(message RNA,mRNA)技术在新型冠状病毒疫苗研发中的巨大成功[3-4],直接加快推动疫苗研发并解决了mRNA技术应用于疫苗研发的一些技术瓶颈。比如mRNA疫苗的递送系统,通过脂质纳米颗粒(lipid nanoparticles,LNP),把mRNA序列通过纳米脂质体的包装运送到细胞内,让细胞翻译产生相应的蛋白作为抗原来调动体内的免疫系统,如产生中和抗体,对人体进行免疫保护作用。新型冠状病毒mRNA疫苗的研发让疫苗的开发时间缩短为不到1年。这样的技术进步,在过去的疫苗研发历史中不曾经历,极大地推动了未来各种疫苗发展的方法和策略[5]。新型冠状病毒mRNA疫苗表现出开发时间短、序列可人工合成、 mRNA进入体内不进入细胞核只在细胞浆内翻译、没有外源基因插入细胞基因组的风险等优势,同时新冠病毒mRNA疫苗表现出很高的保护性,通过中和抗体滴度起到细胞免疫的保护作用,所有这些特征,都使mRNA疫苗技术在未来肿瘤预防治疗中的应用具有极好的前景和优势。
1 肿瘤疫苗的概念和类型
肿瘤疫苗不同于针对传染病的传统疫苗,更侧重于清除活动性疾病(癌细胞),而不是预防疾病。同时,肿瘤疫苗治疗方法可以提前预防癌症,减少癌症发病,通过疫苗调动机体的免疫功能使抗癌药更有效,从而减轻民众的医疗负担,是一种对发展中国家更有意义的防癌治癌途经。
肿瘤疫苗是可以激发机体产生对肿瘤细胞或者肿瘤微环境中有利于肿瘤生长的细胞或分子的主动特异性免疫,以抑制或消除肿瘤生长、复发或转移的各种形式的疫苗。部分肿瘤疫苗类型及其作用范围如表1所示。
1.1 预防性肿瘤疫苗
医学研究发现病毒感染是导致多种癌症发生发展的原因之一,预防性疫苗在降低癌症风险方面发挥着重要作用。例如,宫颈癌和头颈癌可由HPV引起;而肝癌可由乙型肝炎病毒(hepatitis B virus,HBV)引起;EB病毒(epstein-barr virus,EBv),又称人类疱疹病毒4型(Human herpesvirus 4,HHV-4)则是广东等地的鼻咽癌的主要致癌因素。目前已经开发出几种抗病毒疫苗可以预防HBV和HPV感染,从而防止HBV和HPV相关癌症的形成。基于HPV开发的宫颈癌疫苗则能够预防宫颈癌的发生。目前已经有4种预防性肿瘤疫苗已获得美国FDA的批准。
1.2 治疗性肿瘤疫苗
众所周知,每个人的肿瘤都自己独特的抗原。因此,需要更复杂的肿瘤疫苗及基因测序技术用于识别患者肿瘤的靶点,帮助区分癌细胞和正常细胞。这些靶点是癌细胞异常高表达的正常蛋白质,例如前列腺酸性磷酸酶(prostatic acid phosphatase,PAP),其通常被前列腺癌细胞过度表达,因此科学家们开发了Sipuleucel-T疫苗用于治疗前列腺癌,并于2010年获得美国FDA批准。这款疫苗用于治疗晚期前列腺癌患者,可使患者生存期延长2 ~4个月。卡介苗(bacillus Calmette-Guerin vaccine,BCG)作为一款治疗结核病的疫苗,在1990年成为美国FDA批准的首个免疫疗法,目前仍用于治疗早期膀胱癌。癌症表达的“改变的自身”抗原往往比传染源表达的“外来”抗原诱导的反应弱。因此,免疫调节剂和佐剂已被广泛应用于肿瘤疫苗的开发。治疗性肿瘤疫苗包括自体患者源性免疫细胞疫苗、表达肿瘤抗原的重组病毒疫苗、肽疫苗、DNA疫苗和来源于已建立的人类肿瘤细胞系的异种全细胞疫苗等。有效的肿瘤疫苗疗法可以让患者建立有效免疫抑制屏障以抑制肿瘤细胞的免疫逃逸并杀死肿瘤细胞[6]。
1.3 个性化新抗原疫苗
与正常但过度表达的蛋白(如PAP)相比,肿瘤也存在因突变而产生的独特靶点,这些被称为“新抗原”,它们只由肿瘤细胞表达,而不是由患者的任何正常细胞表达。新抗原疫苗可以让免疫反应精确地针对患者的肿瘤细胞,同时避免正常细胞受到免疫攻击,从而防止不良反应的发生[7]。个性化新抗原肿瘤疫苗,可能是未来癌症防治中最具挑战性的领域之一。通过个性化肿瘤抗原疫苗,可以在肿瘤发生之前预防肿瘤,也可以对早期出现的肿瘤细胞通过疫苗调动免疫系统,把癌细胞杀死在摇篮之中。当然个性化新抗原肿瘤疫苗的管理审批和使用应该跟传统的疫苗有所差别,也为其审批和管理带来了新的挑战。
1.4 诱导性干细胞疫苗
研究发现,通过给小鼠注射失活后的诱导性多能干细胞(induced pluripotent stem cells,iPSCs)会引发强烈的抵抗乳腺癌、肺癌以及皮肤癌的免疫反应,。还能够阻止小鼠体内肿瘤的复发。研究发现,iPSCs表面的大量抗原分子同样存在于癌细胞表面,当小鼠接种iPSCs之后,免疫系统会产生抵抗其表面分子抗原的免疫反应,但由于iPSCs与癌细胞的相似性,小鼠同时会产生靶向癌细胞的免疫反应。给抗癌疫苗引入多个抗原分子后,可以激活T细胞或者抗体分子识别以及结合癌细胞表面的抗原。但癌症免疫疗法最大的挑战之一在于同一时间内癌细胞表面的抗原分子呈递并且被免疫系统识别的数量有限。因此,诱导性干细胞疫苗是另一种有希望能够利用基于iPSCs的疫苗靶向治疗癌症的方法[8-9]

表 1 肿瘤疫苗类型及其作用范围Table 1 Types and functions of tumor vaccines
2 mRNA肿瘤疫苗的免疫调节原理和功效
一个成功的癌症免疫治疗最终需要肿瘤细胞溶解效应物(如T细胞和抗体)作用到肿瘤细胞,特异性识别独特或异常表达的TAA或肿瘤特异性抗原(tumor specific antigen,TSA)以及肿瘤细胞个体特有的新抗原,然后调动体内的抗肿瘤免疫反应杀死肿瘤细胞或者抑制肿瘤细胞生长。虽然一些癌症患者能够自发产生足够水平或功能的抗原特异性T细胞,从而产生足够的免疫效应抗肿瘤活性,但大多数患者没有这样的功能,为了确保免疫效应物能够达到适当水平和功能,制备治疗性肿瘤疫苗是方法之一。这种形式的主动免疫治疗可以产生针对TAA或TSA的抗肿瘤免疫反应。19世纪末美国医生威廉·科利博士利用这一原理开发了一种由热灭活细菌组成的基本抗癌免疫疗法。随后科学家发现了抗原呈递细胞(antigen-presenting cells,APCs),可以获得在先天性免疫应答期间释放的免疫原性肿瘤衍生肽,从而解释了针对细菌产物的非特异性先天性免疫应答如何转化为特异性抗肿瘤免疫应答。如果将肿瘤源性抗原在充分免疫原性的情况下输送到免疫系统,因为癌细胞的优先靶向性,将能够相对安全有效地治疗癌症,从而诱导持久的免疫[10-11]。
肿瘤疫苗经过多年的发展已经从预防性疫苗发展到了治疗性肿瘤疫苗。治疗性肿瘤疫苗的目标是诱导肿瘤消退,根除最小残留病灶,建立持久的抗肿瘤记忆,避免非特异性或不良反应的发生。然而,肿瘤诱导的免疫抑制和免疫抵抗对实现这一目标构成了重大挑战[12]。为了使疫苗接种能够为癌症患者带来明确的临床收益,必须在2个层面上取得改进:1)最大限度地诱导T细胞反应,并具有最佳的幅度、特异性和效应因子分布;2)确保疫苗诱导的T细胞能够到达肿瘤部位并在没有任何限制的情况下发挥其功能[13]。
2.1 癌症新抗原的发现
肿瘤疫苗研发的关键是抗原靶点的选择以及佐剂的效力。肿瘤免疫的有效性与针对癌症新抗原的T细胞相关。新抗原是由非沉默体细胞突变产生的具有肿瘤特异性表达的T细胞表位。它们具有高度免疫原性,因为它们在正常组织中不表达,因此绕过了中枢胸腺耐受。新抗原一直以来被认为是抗肿瘤免疫反应的最佳靶点,采用大规模高通量测序检测肿瘤内所有编码突变,以及加上人工智能(artificial intelligence,AI)机器学习方法,可以可靠地预测那些与自身主要组织相容性复合体(major histocompatibility complex,MHC)分子具有高亲和力结合的突变肽。接种新抗原疫苗既可以扩大已有的新抗原特异性T细胞群,又可以在癌症患者中诱导更广泛的新T细胞特异性,从而发挥抗肿瘤效应[14],新抗原的筛选与鉴定方法如图1所示。
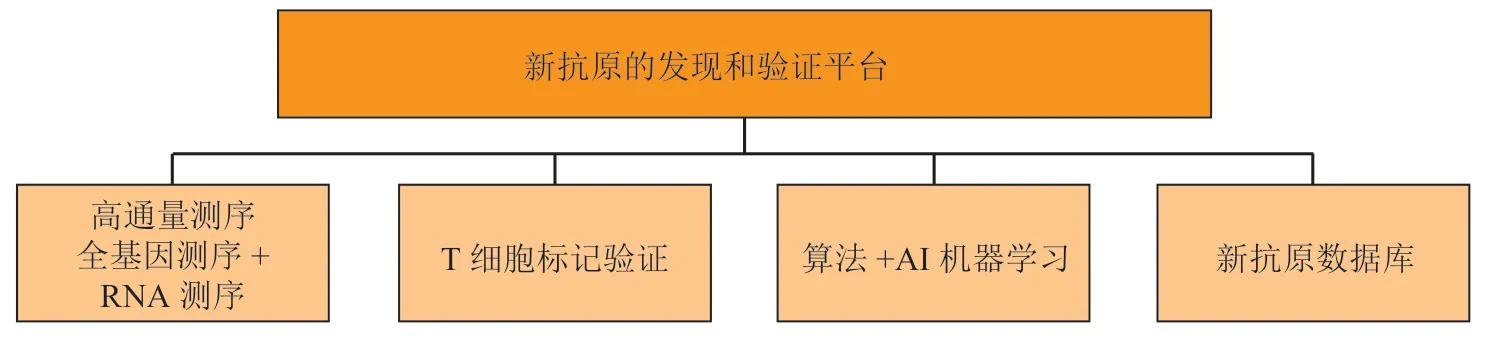
图 1 新抗原的筛选与鉴定方法Figure 1 Methods for screening and identification of neoantigen
2.2 mRNA肿瘤疫苗的优势
在过去多年研究人员的努力下,肿瘤疫苗得到了一定的发展,比如说研发出了能够预防宫颈癌的HPV疫苗。肿瘤疫苗通过刺激体内的免疫系统,诱导CD4+细胞和TH1辅助细胞并介导细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)的作用,协同自然杀伤细胞(natural killer cell,NK)对肿瘤细胞进行杀伤,在肿瘤治疗中取得了一定的成效。但是大多数肿瘤疫苗的临床有效性不超过25%。其中最重要的原因有3个:其一是肿瘤的相关抗原的特异性不够,没有完全调动免疫细胞系统对肿瘤的杀伤作用;其二是每个人肿瘤的个体差异性在遗传学上比较显著,每个人的肿瘤有自己独特的新抗原特征,在肿瘤疫苗的设计中,需要把TAA及TSA与每个人独特的新抗原结合起来,充分地调动体内的免疫系统来杀伤肿瘤细胞;其三是肿瘤微环境和肿瘤介导的免疫逃逸和免疫抵抗导致肿瘤疫苗不能完全发挥作用。
新抗原位靶标的肿瘤疫苗存在肿瘤靶点少,用病毒载体递送疫苗到细胞内效率低和抗原片断大小受限等不利于疫苗制备的限制因素,在过去10年中,许多重大的技术创新和研究使得mRNA成为疫苗开发的新途径。mRNA由于具有以下几个优势,目前已经超越了蛋白质亚单位、灭活和减毒疫苗以及DNA疫苗。1)安全性高:由于mRNA是一个非传染性、非整合的平台,因此没有潜在的感染或插入突变风险。此外,mRNA可以被正常细胞降解,其在体内半衰期可通过使用各种核酸的化学修饰和序列修饰增强其免疫原性和抗原的稳定性并减少疫苗的副作用;2)有效性强:通过各种修饰方法可以使mRNA更加稳定,高度可翻译,同时可以通过将mRNA形成纳米载体分子,实现有效的体内传递允许在细胞质中快速摄取和表达,由于mRNA是最小的基因矢量,因此,避免了抗向量免疫,可以重复使用;3)产量高:mRNA疫苗具有快速、廉价且可扩展的制造生产方式,通过体外转录反应达到高产量[15-17]。
2.3 mRNA肿瘤疫苗的组成与设计
mRNA的疫苗组成包括目标靶点基因,并包含5′和3′非翻译区,含编码蛋白质的开放阅读框和新抗原表位以及抗原蛋白翻译所需要的Poly(A)尾。mRNA可被设计成与完全加工的成熟mRNA分子相似的靶向抗原,从而介导体内的细胞免疫和体液免疫。
MHC-I限制性CTL对于消除肿瘤细胞生长和预防癌症复发具有重要意义。T淋巴细胞激活需要来自APCs的不同信号,T细胞抗原受体对抗原MHC复合物的识别不足以激活原始T细胞。需要额外的共刺激信号,这是由T细胞表面的CD28与APCs上的CD80和CD86结合提供的,因此,构建肿瘤免疫疫苗需要设计的抗原能够在激活T细胞活化的同时还可以诱导某种抑制途径,最终可减弱和终止T细胞反应。这对mRNA肿瘤疫苗的设计有比较高的设计要求。
mRNA肿瘤疫苗是一类相对较新的疫苗,其结合了mRNA可编码几乎任何蛋白质的潜力,具有良好的安全性以及灵活的生产过程。在肿瘤免疫治疗中,mRNA疫苗最直接的用途是用编码TAA的mRNA疫苗对患者进行免疫。RNActive®技术就是一个例证,该技术可在动物模型中诱导平衡的体液和细胞免疫反应,目前已在多个肿瘤适应证的临床试验中进行评估。mRNA疫苗的另一个应用是用于生产个性化疫苗,因为mRNA疫苗是通过一个通用过程生产的,该过程可用于快速生产针对患者特异性新抗原的mRNA疫苗。目前,已经开发了多种mRNA肿瘤疫苗用于胃癌、 黑色素瘤等在免疫原性和疗效研究中得到验证的癌种,RNA序列合成产生的mRNA比其他类型的疫苗更易于翻译出抗原蛋白,同时高效无毒RNA LNP载体通过细胞内吞作用进入细胞让肿瘤疫苗更具有靶向免疫作用[18-21]。
mRNA疫苗的设计方法涉及生物信息学、免疫学、AI机器学习、肿瘤免疫学和合成生物学等多个学科。一个具有诱导肿瘤免疫应答功能,能调动有效的肿瘤杀伤T细胞和免疫因子的疫苗需要考虑到肿瘤新抗原表位的免疫原性,结合多个肿瘤新抗原和TAA的表位,表达分泌性蛋白来介导有效的细胞免疫反应。肿瘤mRNA疫苗在序列设计上的优势可以形成多个新抗原和TAA的组合设计,再加上mRNA序列的碱基的化学修饰和核苷酸序列的优化以及通过加帽和PolyA加尾等功能增加序列的翻译表达功能。
2.4 mRNA肿瘤疫苗的应用
目前,采用mRNA技术平台研发的肿瘤疫苗有前列腺癌疫苗和三阴性乳腺癌(triple-negative breast cancer,TNBC)疫苗[22]。其中,德国Curevacs公司开发的前列腺癌疫苗CV9103和CV9104已经成功进入了Ⅰ/Ⅱ期临床试验,这2款疫苗包括了前列腺特异抗原(prostate specific antigen,PSA)、PAP、前列腺特异膜蛋白抗原(prostate specific membrane antigen, PSMA)以及前列腺六段跨膜上皮抗原(six-segment transmembrane epithelial antigen of prostate 1,STEAP1)等4种前列腺癌相关抗原,在接受临床试验的22例患者中,41%的接种者血液中检测到了CD4+和CD8+的细胞免疫反应与转化生长因子-β(transforming growth factor-β,TGF-β)、白细胞介素-10(interlukin-10,IL-10)、吲哚胺2,3-双加氧 酶1(indoleamine 2,3-dioxygenase 1,IDO1)和血管内皮生长因子(vascular endothelial growth factor,VEGF)等免疫因子介导的免疫反应,提示前列腺癌mRNA疫苗诱导出了较强的抗肿瘤细胞免疫反应。TNBC发生率占总体乳腺癌的10% ~20%,是恶性程度较高、预后较差的一类乳腺癌,临床治疗上尚没有特别有效的治疗方法。 在mRNA技术平台设计的TNBC疫苗中,用mRNA设计的黏蛋白(mucin 1,MUC1)抗原联合甘露糖受体C1样 蛋 白1(mannose receptor C type 1,MRC1)刺激免疫系统,再结合抗细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)免疫结合点抑制剂剂治疗TNBC,结果表明mRNA通过MUC1和MRC1活化了抗肿瘤免疫,极大地增强了CTLA-4对TNBC的治疗效果[23-24]。
除了直接用于给患者接种外,mRNA还可以用于细胞治疗,在体外转染患者来源的细胞,并将转染的细胞注入患者体内。其中一种方法是用编码TAA的mRNA转染患者的DC细胞,从而在DC细胞上呈现TAA源性肽,并在体内激活抗原特异性T细胞。另一种方法是用编码嵌合抗原受体的mRNA转染患者源性T细胞,这允许T细胞直接识别肿瘤上表达的特定抗原[25]。
3 目前国际上mRNA肿瘤疫苗的研究状况
mRNA肿瘤疫苗从2015年就开始向临床转化,但是mRNA疫苗的递送系统一直没有有效地解决其安全性和实用性的问题,直到新型冠状病毒mRNA疫苗取得成功,采用LNP 的递送方法得到了临床验证,其安全性和有效性都获得了科学界和产业界的认可[26-27]。目前mRNA疫苗在LNP递送系统的基础上逐步扩展到靶向LNP递送,比如选择性器官靶向(selective organ targeting,SORT)-LNP等新的靶向器官LNP的技术[28-29]。另外基于病毒样颗粒的递送系统(virus-like particles,VLPs)和细胞外媒体的递送系统等都在快速发展中[30-31]。肿瘤疫苗研发的近10年中, 美国FDA已经批准了前列腺癌疫苗Provenge,这也是首个在美国被批准用于治疗的肿瘤疫苗,开创了癌症免疫治疗的新时代。这种自体细胞免疫疗法,于2010年4月29日获得美国FDA批准,用于治疗无症状或症状轻微的转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)。目前,已有数千名男性患者使用Provenge进行治疗,该药在临床上已被证明可以延长晚期前列腺癌患者的生命。PAP蛋白表达于绝大多数的前列腺肿瘤细胞,也表达于正常的前列腺组织中,只是以极低的水平存在于其他正常组织中。在治疗性肿瘤疫苗Provenge中,PAP抗原融合于作为佐剂的一种免疫刺激细胞因子——粒细胞-巨噬细胞集落刺激因子(granulocytemacrophage colony-stimulating factor,GM-CSF),DC细胞则将PAP蛋白消化为多肽而呈现于其表面,当其被重新回输入患者体内后,可被免疫系统T细胞识别,而接触过该抗原后的T细胞能找到并杀灭表达PAP抗原的癌细胞。根据对6 000多例美国患者的回顾性分析,在患者mCRPC治疗方案中Provenge联合醋酸阿比特龙或恩扎卢胺,死亡风险降低了45%,总生存期(OS)延长了14.5个月[32],取得了显著的效果。而这只是用了PAP作为抗原,在新一代的mRNA前列腺癌疫苗中,添加了多个前列腺癌TAA和筛选出的新抗原,相信治疗效果会得到进一步的提高。目前正在进行临床试验阶段的部分mRNA肿瘤疫苗如表2所示。

表 2 目前正在进行临床试验阶段的部分mRNA肿瘤疫苗Figure 2 Some mRNA tumor vaccines currently under clinical trials
4 mRNA肿瘤疫苗研发过程中遇到的技术挑战
目前在美国国立卫生研究院(National Institutes of Health,NIH)临床试验的网站上可以查到总共有7 000多种肿瘤疫苗处于研发阶段,其中mRNA疫苗有640个,涉及新抗原的疫苗有197个,进入临床的mRNA疫苗涉及免疫调节的疫苗7个,TAA抗原11个和新抗原10个,大部分处于Ⅰ/Ⅱ期临床试验。随着mRNA肿瘤疫苗新抗原和靶向抗原TAA在AI辅助下的研发,抗原设计更加智能化,靶向细胞和组织的递送系统更加成熟,mRNA肿瘤疫苗获得临床批准的可能性越来越大,预计在未来几年中将会有多款mRNA肿瘤疫苗进入临床治疗的应用阶段。
mRNA肿瘤疫苗中的一个挑战是抗原设计上怎样有效地把TAA、Neo-Ag和免疫调节因子[如程序性细胞死亡蛋白-1(programmed death-1,PD-1)]等抗原的表位优化组合起来,让细胞能够分泌有效的抗肿瘤抗原,同时避免细胞因子风暴等免疫调节的副作用,让mRNA肿瘤疫苗更有效、安全。其次,在mRNA肿瘤疫苗的递送系统中开发出高效、无毒,易于生产制造和价格低廉的递送系统。目前LNP递送系统在小干扰RNA(small interfering RNA,siRNA)和传染病疫苗中获得了成功,靶向LNP(如SORT-LNP)、新的递送系统(如VLP)、外泌体递送系统等都在大力研发中,mRNA肿瘤疫苗可以根据肿瘤的类型选择最有效的递送系统。
最后基于个性化的新抗原的mRNA疫苗因为疫苗的研发与生产是针对个人的基因组数据,这种疫苗不仅会带来监管、审批方面的挑战,而且在个人癌症基因组数据的使用,小规模临床样本的疫苗临床试验上都会对疫苗的研发带来新的技术和生产工艺方面的挑战。
5 结语与展望
据相关国际研究机构的预测,2021—2026年,全球mRNA疫苗和治疗药物市场预计将以约13%的复合年增长率进行增长。市场增长主要归因于传染病和慢性病的流行,包括艾滋病、糖尿病、癌症和心血管疾病。由于技术的局限性,传统疫苗方法无法在关键时刻发挥作用,因此进一步推动了mRNA疫苗的市场增长。mRNA疫苗和疗法在新型冠状病毒方面发挥了很好的作用,未来在肿瘤方面相信也会发挥很好的效果。未来mRNA技术平台上的肿瘤疫苗也将会出现效果不错的肿瘤预防性和治疗性疫苗(如16 ~ 18价mRNA HPV疫苗、预防EBv感染的鼻咽癌mRNA疫苗、基于新抗原和TAA的肿瘤治疗性疫苗),然而在疫苗临床开放、监管和制备的风险以及疫苗的管理、批准和临床转化方面仍然会有很多新的挑战。

