烟草倍半萜合酶基因NtTPS21的克隆及功能鉴定
杨 晴,刘少华,杨长青,耿锐梅,张 钊,刘东阳,杨爱国*,李依婷*
烟草倍半萜合酶基因的克隆及功能鉴定
杨 晴1,2,刘少华1,杨长青1,耿锐梅1,张 钊3,刘东阳4,杨爱国1*,李依婷1*
(1.中国农业科学院烟草研究所,青岛 266101;2.中国农业科学院研究生院,北京 100081;3.云南省烟草公司曲靖市公司云南 曲靖 655000;4.四川省烟草公司凉山州公司,四川 凉山 615000)
萜类化合物在植物生长发育、胁迫响应以及抵御病原菌侵染过程中发挥重要作用,克隆烟草倍半萜合酶基因并研究其功能可为烟草萜烯合酶的功能鉴定及抗病育种提供理论依据。本研究从普通烟草红花大金元中克隆获得了一个倍半萜合酶基因,通过生物信息学分析、表达模式分析、酶学性质分析以及NtTPS21代谢产物的体外抑菌试验等方法,鉴定的生物学功能。结果表明,开放阅读框为1671 bp,编码556个氨基酸,具有典型的萜类合酶催化活性位点,与拟南芥倍半萜合酶AtTPS21具有较高同源性。NtTPS21定位于核质中,能够被烟草青枯病菌感染诱导,且在青枯病抗病品种“岩烟97”中的表达水平显著高于感病品种“长脖黄”。NtTPS21能够以法尼基焦磷酸(FPP)为底物,催化合成倍半萜类化合物β-石竹烯,其代谢产物对烟草青枯病菌的生长具有显著抑制效果,以上结果说明基因及其代谢产物可能与烟草青枯病抗性相关。
烟草;;倍半萜合酶;β-石竹烯;青枯病抗性
青枯病是烟草种植过程中普遍发生、危害严重的一种根茎类病害。烟株一旦感染青枯病,烟叶的产量和品质会受到严重影响,甚至造成整株死亡,给烟草产业带来巨大的损失[1-3]。挖掘、鉴定和利用优异的青枯病抗性基因,培育抗青枯病的烟草新品种是防治烟草青枯病最根本和有效的途径之一。
萜类化合物(又称类异戊二烯)是自然界中普遍存在的一类天然次生代谢产物,由单个或多个异戊二烯单元组成,其中倍半萜约有7000多种,是萜类化合物中结构数量最多的一类[4-5]。植物体内的倍半萜类化合物大多为挥发性物质,在抵抗昆虫侵害[6],抑制病原菌活性[7-8]等方面发挥重要作用,是天然植物源农药的重要来源。大量研究发现,双环倍半萜类化合物β-石竹烯具有较强的抑菌作用。例如牡荆挥发油(含43.12% β-石竹烯)对大肠杆菌、枯草杆菌、四联球菌均表现出较强的抑菌效果[9],β-石竹烯对蜡样芽孢杆菌也具有一定的抗菌活性[10]。在拟南芥中,β-石竹烯由编码的(E)-β-石竹烯合成酶催化形成,是拟南芥花柱头释放的主要挥发性物质。突变可导致拟南芥花柱头的细菌性丁香假单胞菌DC3000大量生长,而组成型过量表达的转基因株系对DC3000的抗性显著高于野生型,表明在植物抵御细菌性病原菌侵害过程中发挥重要作用[11-12]。
烟草基因组中存在着大量萜烯合酶(Terpene synthase, TPS)编码基因。然而,目前对烟草TPS基因的克隆及其在抵抗病原菌方面的研究报道十分有限。为了挖掘和鉴定烟草中参与青枯病抗性的TPS基因,我们首先利用β-石竹烯标准品对烟草主要细菌性病原菌开展了平板抑菌试验,结果发现β-石竹烯对烟草青枯病菌具有特异性抑制作用。因此本研究根据拟南芥序列,对烟草中的β-石竹烯合成酶基因进行了分析预测,克隆获得了烟草β-石竹烯合成酶基因,命名为。通过分析的表达特征,酶学性质以及代谢产物的抑菌作用,鉴定的生物学功能,为后续深入研究萜类次生代谢物在植物抗逆胁迫中的分子调控机制及抗病育种奠定基础。
1 材料与方法
1.1 试验材料
普通栽培烟草()品种“红花大金元”,用于基因克隆;“长脖黄”和“岩烟97”分别为烟草青枯病感病和抗病对照种质,由国家烟草种质资源中期库提供。Y45青枯菌种由中国农业科学院烟草研究所遗传育种中心提供。
1.2 方法
1.2.1 材料处理与取样 (1)正常生长的烟草材料。烟草品种“红花大金元”种子经消毒处理后播种在装有灭菌土壤的花盆中,种植于人工气候室。待烟株生长至5叶期时,收集植株叶部组织,液氮速冻后放置于−80 ℃封存,用于基因克隆。(2)青枯病原菌胁迫处理的烟草材料。烟草品种“长脖黄”和“岩烟97”种子经消毒处理后播种在装有灭菌土壤的花盆中,种植于人工气候室,在幼苗长至2片真叶时,更换为霍格兰营养液进行水培培养,待生长至5叶期时,进行青枯病菌接种处理:将活化的青枯病菌Y45稀释至600=0.01,直接替换营养液,发病条件为30 ℃,浸泡2 h后将青枯菌倒掉,更换为霍格兰营养液继续培养,于接种0、2、3、7 d后收集根及茎部样品,每个试验处理设置3个生物学重复,收集的样品用液氮速冻后−80 ℃保存,用于基因表达特征分析。
1.2.2基因的克隆 将拟南芥AtTPS21的蛋白质序列在烟草数据库进行同源比对,获得烟草基因的参考序列信息,设计特异性引物-F(5'-ATGGATTTGAGCAAAGGCTTGC CGG-3')和-R(5'-TTATGGAACAGGATCA ACCAATATT-3')。提取普通烟草红花大金元叶片总 RNA,反转录合成cDNA后作为基因克隆模板。使用引物-F和-R,以烟草叶片cDNA为模板进行PCR扩增,反应体系为:cDNA 2.5 μL、2×Phanta Max Master Mix 25 μL、-F和-R引物各2.5 μL,补充ddH2O至反应体系为50 μL。反应程序为:95 ℃预变性3 min;95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸100 s,共35个循环;72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳检测,纯化回收后连接到pEASY-Blunt Zero克隆载体。阳性克隆经测序验证正确,获得含有序列的克隆质粒Blunt-。
1.2.3 NtTPS21的生物信息学分析 利用ORF finder(http://www.bioinformatics.org/sms2/orf_find.html)软件分析NtTPS21开放阅读框及氨基酸序列;利用PSORT II Prediction(https //www.genscript.com/psort. html)预测NtTPS21蛋白的亚细胞定位;使用InterProSca(https//www.ebi.ac.uk/interpro/search/ sequence/)软件对NtTPS21蛋白保守结构域进行预测,并与其他物种的β-石竹烯合酶进行比对,验证其保守结构域。利用MEGA7软件将与拟南芥的34个萜烯合酶进行比对,并通过邻接(NJ)法构建系统发育进化树(Bootstrap=1000)。
1.2.4表达模式分析 根据基因的编码序列设计特异性引物-qF(5'-GCTAAGTTCTATTA CAAGGTGGTG-3)和-qR(5'-AAAGTACAC TCCCAATGCCC-3')。分别提取“长脖黄”和“岩烟97”在接种青枯病后不同时期根部和茎部的RNA并反转录为cDNA。以烟草基因为内参,利用2×ChamQ SYBR Color qPCR Master Mix进行qRT-PCR。试验设置3次生物学重复和3次技术重复,采用2-△△CT方法计算的相对表达量。
1.2.5 NtTPS21的亚细胞定位 将编码区CDS 序列(去掉终止密码子)克隆到pBWA(V)HS-GLosgfp表达载体中,构建基因融合绿色荧光蛋白(GFP)的表达载体pBWA(V)HS--GLosgfp。将重组质粒pBWA(V)HS--GLosgfp和对照空载质粒pBWA(V)HS-Glosgfp分别转入根癌农杆菌GV3101。以空载作为负对照,将含有目标质粒的农杆菌重悬液注射到本氏烟幼叶中进行瞬时侵染,侵染后的烟草黑暗条件下培养12 h,再于正常光照下培养2 d,将侵染部位叶片置于 LEICA TCS SP8 激光共聚焦显微镜下观察,确定荧光融合蛋白的定位。
1.2.6 NtTPS21的原核表达及体外反应鉴定 NtTPS21的原核表达:将克隆到大肠杆菌高效表达载体pET28a中,并转化BL21(DE3)感受态细胞。阳性菌株用LB培养基培养至600=0.5~0.6,加入异丙基-β-D-硫代半乳糖苷(IPTG),于16 ℃诱导培养17 h后离心收集菌体。菌体经超声裂解后离心收集上清,进行蛋白凝胶电泳和染色,观察蛋白诱导情况。
NtTPS21蛋白体外反应:将裂解后的菌体上清加入含有法尼基焦磷酸(FPP)的反应混合缓冲液中,于37 ℃恒温箱反应1 h后,用正己烷提取反应产物。使用气相色谱-质谱联用仪(GC-MS,岛津TQ8050)对反应产物进行检测和成分分析。色谱柱为HP-INNOWAX 毛细管柱(30 mm×0.25 mm× 0.25 μm),进样口温度设置为250 ℃,柱室温度50 ℃起步,以10 ℃/min的速度升温至250 ℃,保温5 min,气化室和检测室温度均为250 ℃。
1.2.7 NtTPS21代谢产物的体外抑菌试验 将重组至pET28a并转入能够高效合成FPP的大肠杆菌工程菌株中。阳性的NtTPS21工程菌株经IPTG诱导发酵培养后,通过超声裂解并用乙酸乙酯萃取浓缩获得NtTPS21代谢产物。以无水乙醇为溶剂,将NtTPS21代谢产物稀释至1 g/mL、100 mg/mL、50 mg/mL;将活化的青枯菌均匀地涂于培养基中,待菌液吹干后,均匀地摆放4个6 mm无菌空白药敏纸片,随后在每个纸片上依次加入20 µL不同浓度的NtTPS21代谢产物以及对照无水乙醇,待样品扩散后,于28 ℃培养箱倒置培养12~18 h,观察测量菌圈大小。
2 结 果
2.1 NtTPS21基因的克隆及生物信息学分析
以普通烟草红花大金元叶片cDNA为模板,PCR扩增获得。该基因全长1671 bp,编码556个氨基酸(等电点:5.28;分子量:64.88 kD)。序列分析结果表明(图1A),具有3个萜烯合成酶基因家族的保守结构域,其中22-201位氨基酸为萜类合酶N末端结合域(N-terminal domain);233-500位氨基酸为萜类合酶金属离子结合结构域(metal-binding domain);228-555位氨基酸为萜烯环化酶C端结构域(C-terminal domain)。亚细胞定位预测显示,在细胞质、细胞核、线粒体和高尔基体中定位的概率分别为60.9%、26.1%、8.7%和4.3%,因此,该蛋白可能是位于核质中。
将拟南芥、番茄、水稻、棉花中已报道的石竹烯合酶与NtTPS21进行多序列比对分析,结果表明,NtTPS21与石竹烯合酶蛋白序列具有较高的相似性,且含有萜类合酶催化活性中心“DDXXD”、“RRX8W”和“NST/DTE”(图1B)。
为分析NtTPS21与模式植物拟南芥萜烯合酶基因间亲缘关系,通过MEGA7软件对NtTPS21进行系统发育进化树分析。结果表明,NtTPS21与拟南芥倍半萜合酶AtTPS21聚为同一簇(图2),推测其具有类似的催化功能。

注:A,NtTPS21的保守结构域预测,其中a代表萜类合酶 N 末端结合域;b代表萜类合酶金属离子结合结构域;c代表萜烯环化酶C端结构域。B,NtTPS21与其他物种石竹烯合酶的多序列比对,其中方框标注的为萜烯合酶的保守结构域“RRX8W”,“DDXXD”以及“NST/DTE”。AtTPS21:拟南芥石竹烯合酶;SlTPS12:番茄石竹烯合酶;OsTPS3:水稻石竹烯合酶;GhTPS:棉花石竹烯合酶。
2.2 NtTPS21的表达模式分析
“长脖黄”和“岩烟97”分别是烟草青枯病抗病育种研究中典型的感病和抗病对照品种。为明确是否参与烟草抗青枯病原菌胁迫过程,分别对“长脖黄”和“岩烟97”接种青枯病菌,通过qRT-PCR检测在抗病和感病种质中的相对表达量。结果发现,在“长脖黄”和“岩烟97”中,青枯病菌侵染均能强烈诱导的表达。但是在不同的接种时间点,在抗青枯病品种“岩烟97”中的表达量均显著高于易感青枯病的“长脖黄”。特别是在茎中,与“长脖黄”相比,在“岩烟97”中表达水平提高了20~80倍(图3)。以上结果表明可能参与了烟草青枯病的抗性防御过程。
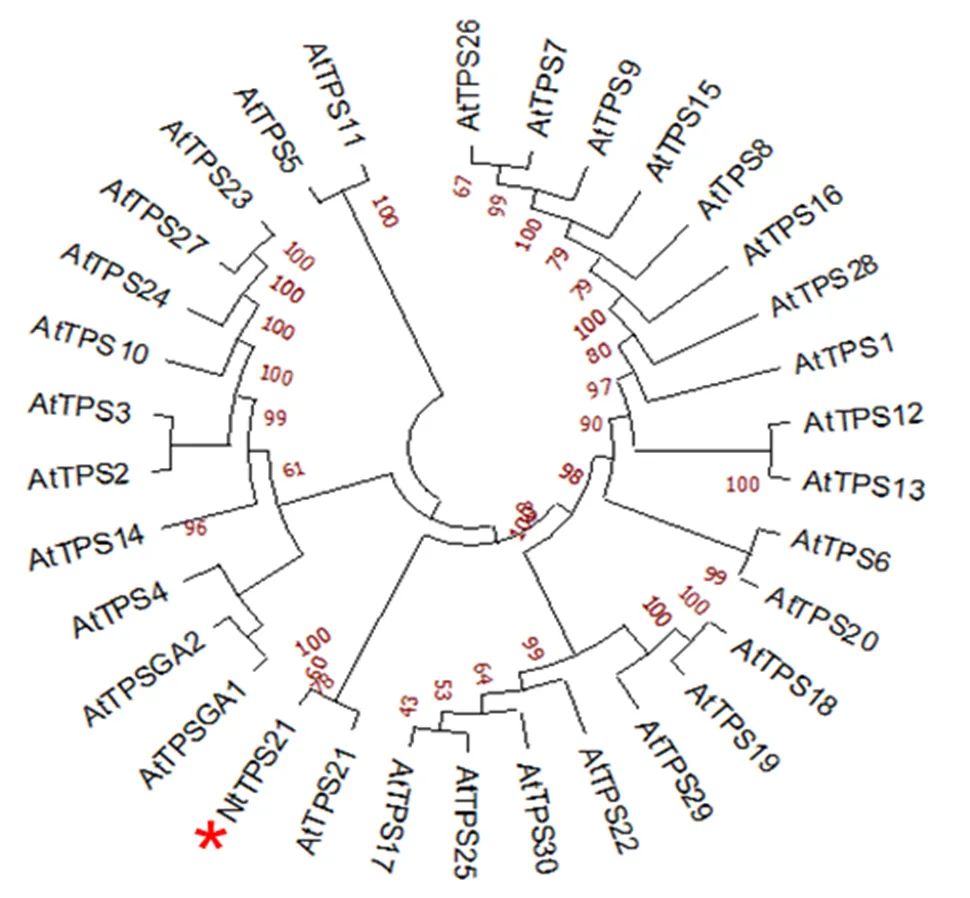
图2 NtTPS21与拟南芥萜烯合酶家族系统进化分析
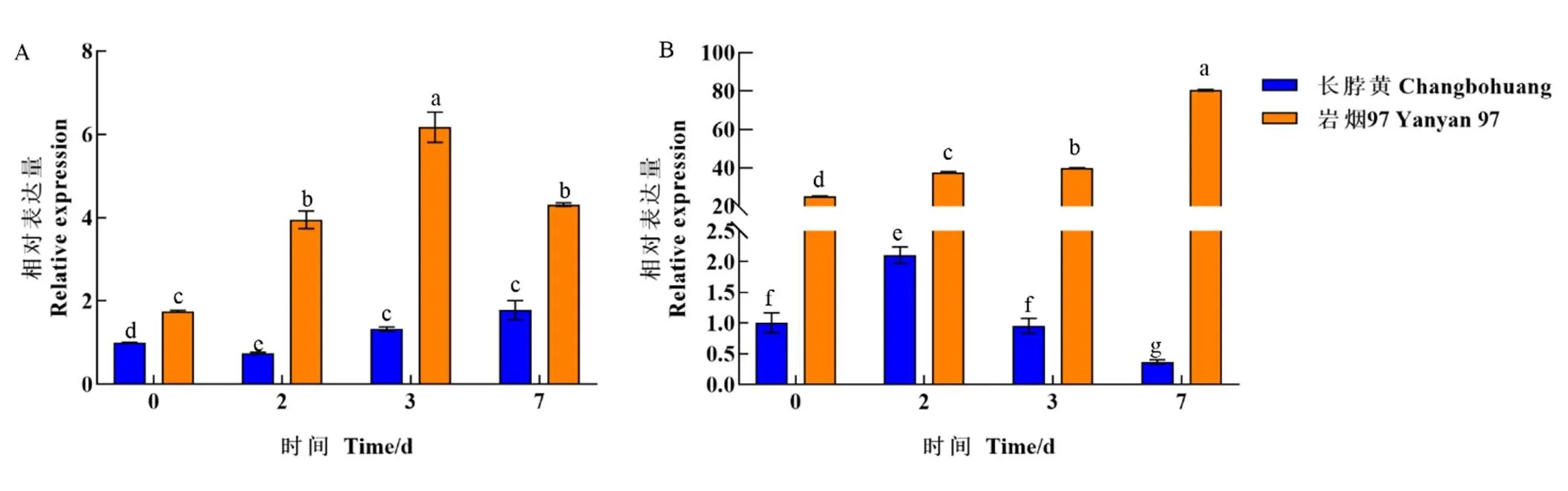
注:A,接种青枯病菌不同时间后,根中NtTPS21的相对表达;B,接种青枯病菌不同时间后,茎中NtTPS21的相对表达。不同字母表示在p<0.05水平差异显著,下同。
2.3 NtTPS21亚细胞定位
基因的亚细胞定位对研究该基因编码的蛋白及行使功能的场所至关重要。将含有NtTPS21融合绿色荧光蛋白(GFP)的植物表达载体和仅表达GFP的对照载体分别在本氏烟叶片中瞬时表达。通过激光共聚焦显微镜观察发现,NtTPS21编码的蛋白产物定位于核质中(图4),这一结果与NtTPS21蛋白的亚细胞定位预测结果一致。
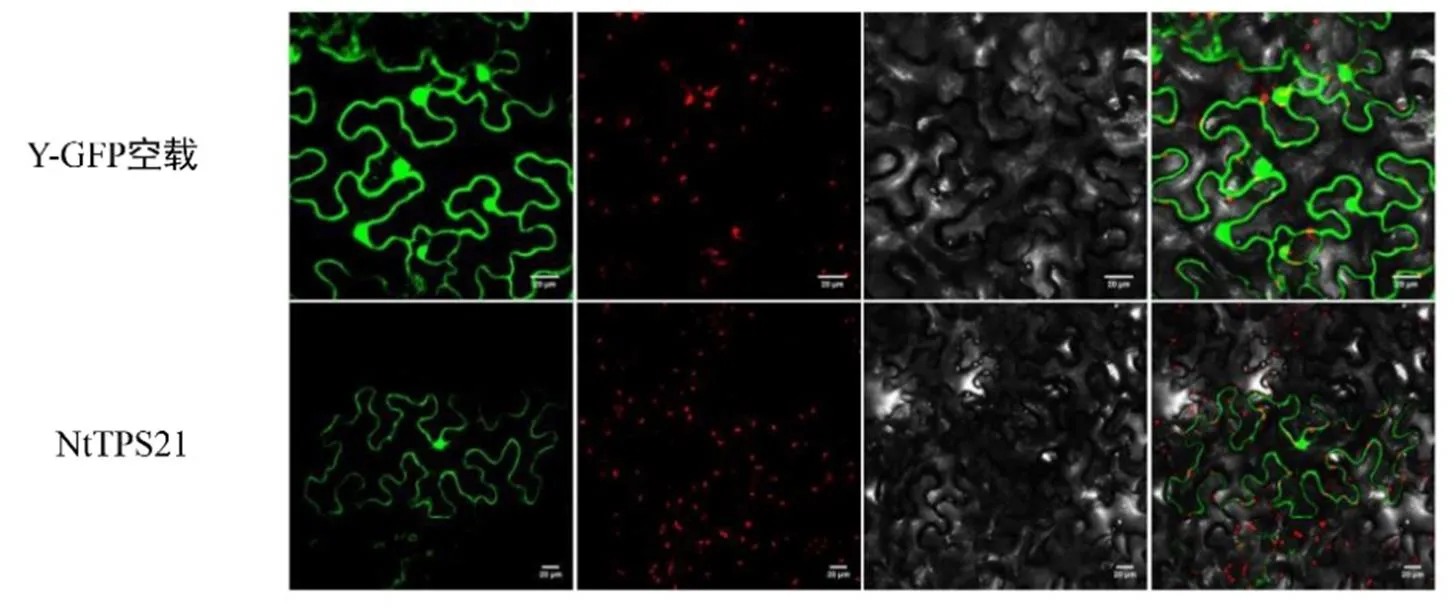
图4 NtTPS21的亚细胞定位
2.4 NtTPS21的原核表达及酶学功能分析
为了分析NtTPS21的生化功能,将重组质粒-pET28a转入大肠杆菌BL21(DE3)并用IPTG诱导表达。SDS-PAGE检测结果表明在相对分子质量为65 kD附近位置出现了特异蛋白带(图5),该结果与NtTPS21蛋白的预测大小相一致。
以NtTPS21蛋白粗提物与底物FPP进行体外反应,用GC-MS检测反应产物。结果发现,NtTPS21的代谢主产物为β-石竹烯(图6),与β-石竹烯标准品的保留时间和分子碎片质谱数据均一致(图6,7),表明NtTPS21能够以FPP为底物生成倍半萜类物质β-石竹烯。
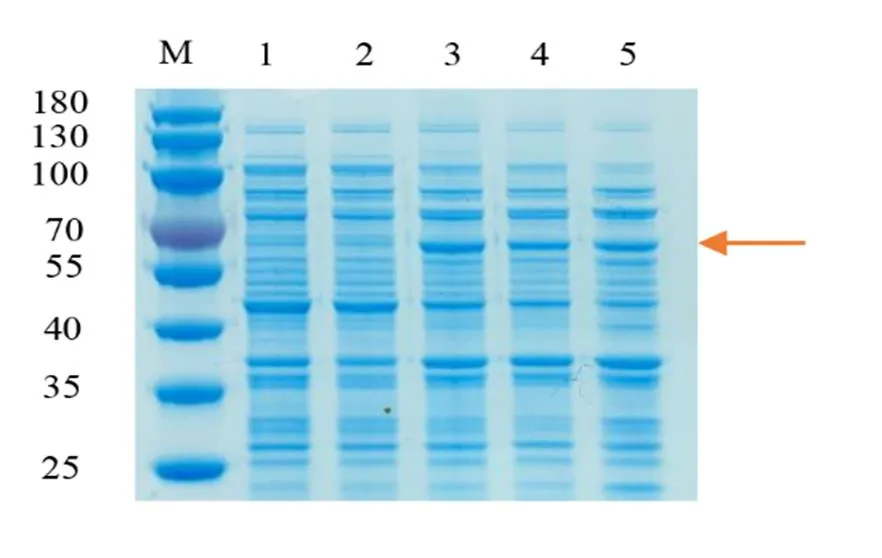
注:M,marker;1~2,0.5mmoL/L IPTG诱导的PET空载;3~4,0.5 mmoL/L IPTG诱导的NtTPS21-PET;5,未经IPTG诱导的NtTPS21-PET。红色箭头指示的为诱导出的NtTPS21的蛋白。
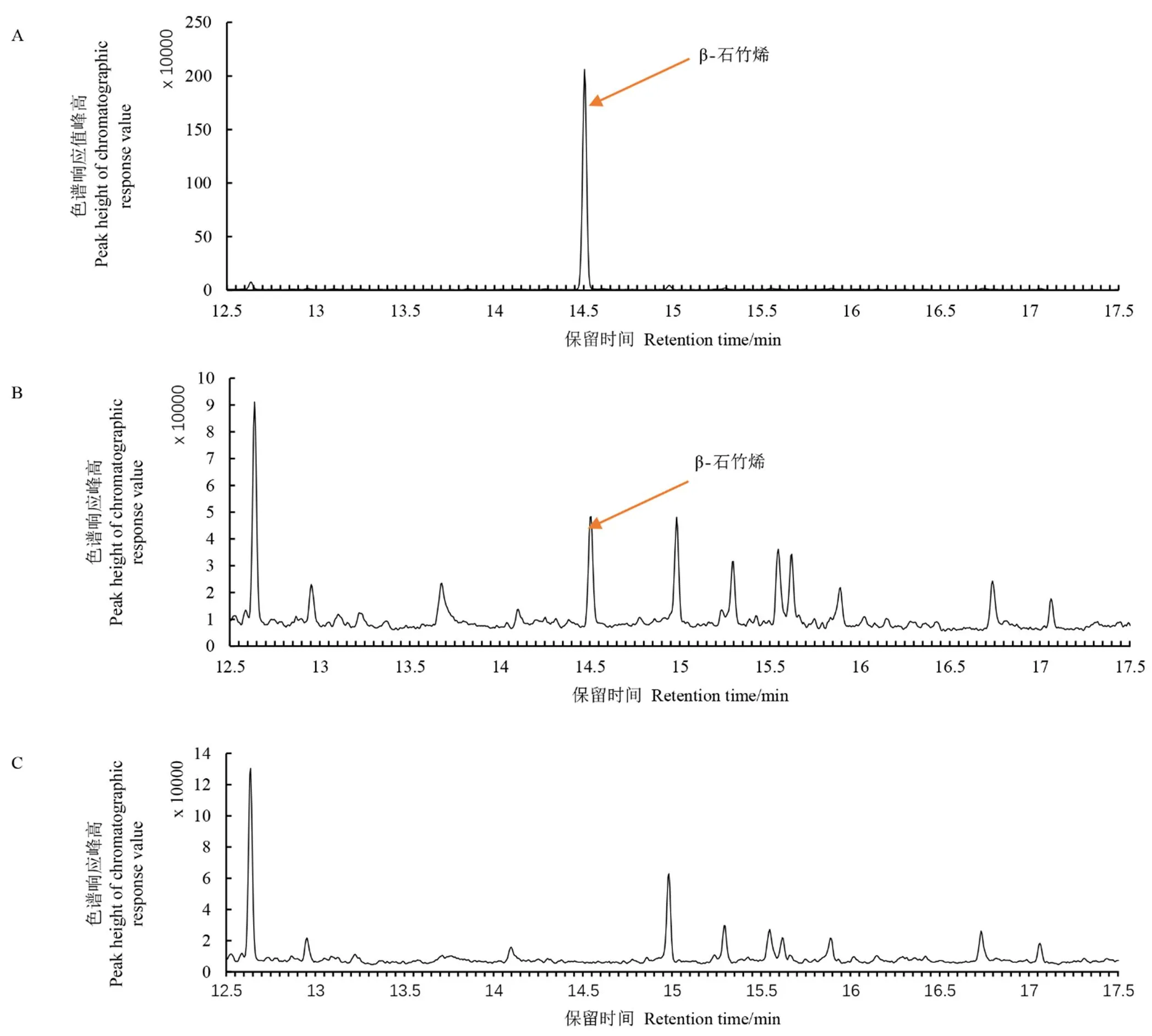
注:A,β-石竹烯标准品的GC-MS图;B,NtTPS21蛋白与FPP底物体外反应产物的GC-MS图;C,PET空载蛋白与FPP底物体外反应产物的GC-MS图。
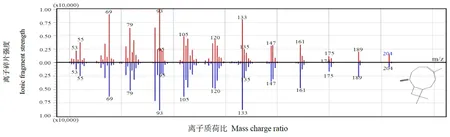
图7 NtTPS21体外合成产物标准品β-石竹烯GC-MS分子碎片质谱对比图
2.5 NtTPS21代谢产物对烟草青枯病菌的抑制作用鉴定
为了分析是否与烟草的青枯病抗性相关,将NtTPS21蛋白在能够高效合成FPP的大肠杆菌工程菌株中诱导表达,获得NtTPS21的代谢产物。将纯化的NtTPS21代谢产物添加到烟草青枯病菌培养基中,通过测量抑菌圈直径,分析NtTPS21代谢产物对烟草青枯病菌的抑制作用。结果表明,与添加无水乙醇的空白对照相比,NtTPS21的代谢产物对烟草青枯病菌的生长具有显著抑制作用,并且其抑制强度随浓度的升高而增强(图8)。
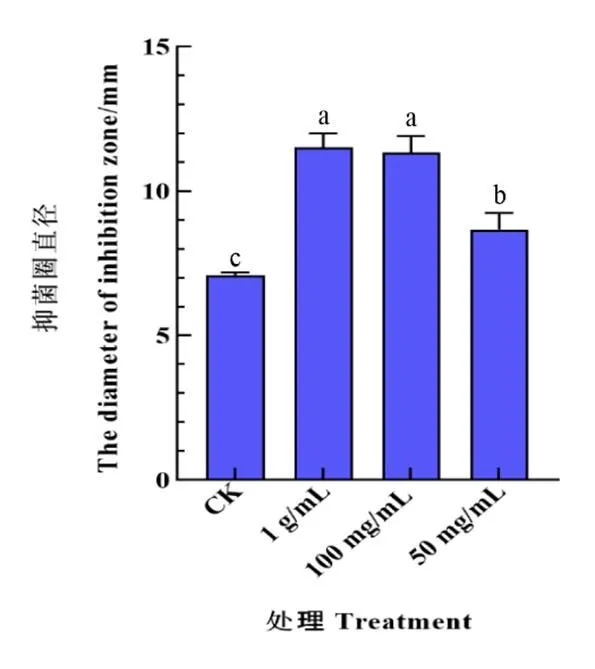
注:β-石竹烯稀释溶剂为无水乙醇,CK为无水乙醇。
3 讨 论
植物倍半萜合酶催化底物FPP释放焦磷酸基团,形成结构多样的倍半萜类化合物。本研究从烟草中克隆了一个倍半萜合酶基因,序列分析表明其具有萜类合酶催化活性位点“DDXXD”,“RRX8W”以及“NST/DTE”。“DDXX(D, E)”基序又称为“α结构域”,是Ⅰ型TPS酶的典型特征,可结合与异戊二烯基二磷酸相互作用的金属辅因子(Mg2+或Mn2+)底物并促进底物阳离子的形成[13-15]。NtTPS21即为典型的Ⅰ型TPS酶,这与报道的植物中的TPS基因家族中所有单萜、倍半萜和半萜合酶只含有功能α域相一致[16]。对NtTPS21亚细胞定位的预测和试验均表明,NtTPS21定位于核质中,与大部分倍半萜合酶的亚细胞定位相一致。进化分析结果显示NtTPS21与拟南芥倍半萜合酶AtTPS21聚为一类,推测其可能参与烟草中倍半萜类化合物的生物合成。体外酶学功能验证进一步证实了NtTPS21是一个倍半萜合酶,并且能够以FPP为底物合成β-石竹烯。
β-石竹烯是广泛存在于植物中一类次生代谢产物,具有一定的抗菌活性,用NtTPS21代谢产物进行平板抑菌试验,发现其对烟草青枯病菌具有显著抑制效果,且这种抑制作用与其浓度呈正相关。目前,编码β-石竹烯的基因已经在拟南芥、番茄、水稻、棉花、葡萄等物种中被分离鉴定,但是烟草中的石竹烯合成酶基因尚未被发现,是否参与烟草青枯病抗性防御过程也不清楚。本研究在烟草中分离鉴定了编码β-石竹烯合成酶的基因,利用实时荧光定量qPCR技术,分析在接种青枯病菌后不同时间的表达量,结果发现能够强烈响应青枯病菌侵染。在青枯病抗感种质中,在接种青枯病菌的抗性材料根、茎中的表达量均显著高于在感病材料中的表达水平,说明可能参与了烟草青枯病菌的抗性防御过程,但具体调控机制还有待进一步研究,今后可通过创制组成型过量表达和定点突变基因的遗传材料以及生理生化和分子生物学试验,开展在烟草青枯病抗性防御中的功能机制解析,为烟草青枯病抗病育种提供理论支撑和优异分子靶标。
4 结 论
本研究在烟草中克隆获得一个定位于核质中的倍半萜合酶基因,具有萜烯合酶典型的保守结构域,与拟南芥具有较高同源性。NtTPS21能够以FPP为底物合成倍半萜类化合物β-石竹烯。的表达水平受青枯病菌侵染强烈诱导,且在抗病品种“岩烟97”中的表达水平显著高于感病品种“长脖黄”。NtTPS21的代谢产物能够显著抑制青枯病菌的生长。说明可能参与了烟草对青枯病菌的抗性防御过程。
[1] MANSFIELD JOHN, GENIN STEPHANE, MAGORI SHIMPEI, et al. Top 10 plant pathogenic bacteria in molecular plant pathology[J]. Molecular plant pathology, 2012, 13(6): 614-629.
[2] 陈瑞泰,朱贤朝,王智发,等. 全国16个主产烟省(区)烟草侵染性病害调研报告[J]. 中国烟草科学,1997(4):3-9.
CHEN R T, ZHU X C, WANG Z F, et al. A report of investigating and studying tobacco infectious diseases of 16 main tobacco producing provinces(regions) in China[J]. Chinese Tobacco Science, 1997(4): 3-9.
[3] 徐进,顾钢,潘哲超,等. 福建烟草青枯菌演化型及生化变种鉴定研究[J]. 中国烟草学报,2010,16(6):66-71.
XU J, GU G, PAN Z C, et al. Phylotype identification and biovar determination ofstrains isolated from Fujian province[J]. Acta Tobacaria Sinica, 2010, 16(6): 66-71.
[4] 占爱瑶,由香玲,詹亚光. 植物萜类化合物的生物合成及应用[J]. 生物技术通讯,2010,21(1):131-135.
ZHAN A Y, YOU X L, ZHAN Y G. Biosynthetic pathway and applications of plant terpenoid isoprenoid[J]. Biotechnology Communications, 2010, 21 (1): 131-135.
[5] BOHLMANN J, MEYER-GAUEN G, CROTEAU R. Plant terpenoid synthases: molecular biology and phylogenetic analysis[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(8): 4126-4133.
[6] 权军娴. 萜类化合物在植物中的作用及其应用[J]. 植物学研究,2013,2(4):106-108.
QUAN J X. The role of terpenoids in plants and its application[J]. Botanical Research, 2013, 2(4): 106-108.
[7] SHANG S Z, ZHAO W, TANG J G, et al. Antiviral sesquiterpenes from leaves of[J]. Fitoterapia, 2016, 108: 1-4.
[8] 范炳芝,王一鑫,廉霄甜,等. 三萜类化合物抗病毒的构效关系及其作用机制研究进展[J]. 化工学报,2020,71(9):4071-4101.
FAN B Z, WANG Y X, LIAN X T, et al. Structure-activity relationships and mechanisms of triterpenoids against virus [J]. Journal of Chemical Industry and Engineering, 2020, 71(9): 4071-4101.
[9] 凌玮玮. 牡荆化学成分及其抑菌活性研究[D]. 合肥:安徽农业大学,2010.
LING W W. Constituents and antibacterial activities ofLinn. var.[D]. Hefei: Anhui Agricultural University, 2010.
[10] MOO C L, YANG S K, OSMAN M A, et al. Antibacterial activity and mode of action of β-caryophyllene on bacillus cereus[J]. Polish Journal of Microbiology, 2020, 69(1): 1-6.
[11] LIU M, NIU W, OU L. β-Caryophyllene ameliorates the Mycoplasmal pneumonia through the inhibition of NF-κB signal transduction in mice[J]. Saudi Journal of Biological Sciences, 2021, 28(8): 4240-4246.
[12] HUANG M S, SANCHEZ-MOREIRAS A M, ABEL C, et al. The major volatile organic compound emitted fromflowers, the sesquiterpene (E)-β-caryophyllene, is a defense against a bacterial pathogen[J]. New Phytologist, 2012, 193(4): 997-1008.
[13] CHRISTIANSON D W. Structural and Chemical Biology of Terpenoid Cyclases[J]. Chemical Reviews, 2017, 117(17): 11570-11648.
[14] ZERBE P, BOHLMANN J. Plant diterpene synthases: exploring modularity and metabolic diversity for bioengineering[J]. Trends in Biotechnology, 2015, 33(7): 419-428.
[15] 唐亮,马香,周志钦. 植物萜类合成酶的进化研究[J]. 南京大学学报(自然科学版),2014,36(4):89-96.
TANG L, MA X, ZHOU Z Q. An evolutionary study of plant terpene synthases[J]. Journal of Nanjing University (Natural Science), 2014, 36(4): 89-96.
[16] GAO Y, HONZATKO R B, PETERS R J. Terpenoid synthase structures: a so far incomplete view of complex catalysis[J]. Natural Product Reports, 2012, 29(10): 1153-75.
Cloning and Functional Characterization of Sesquiterpene Synthase Genein Tobacco
YANG Qing1,2, LIU Shaohua1, YANG Changqing1, GENG Ruimei1, ZHANG Zhao3, LIU Dongyang4, YANG Aiguo1*, LI Yiting1*
(1. Institute of Tobacco Research of CAAS, Qingdao 266101, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China; 3. Qujing Tobacco Company of Yunnan Province, Qujing, Yunnan 655000, China; 4. Liangshan Tobacco Company of Sichuan Province, Liangshan, Sichuan 615000, China)
Terpenoids play an important role in plant growth, development, stress response and resistance to pathogen infection. Cloning the sesquiterpene synthase genes of tobacco and studying their function can provide theoretical basis for functional identification and disease resistance breeding of tobacco. In this study, a sesquiterpene synthase genewas cloned from common tobacco variety Honghuadajinyuan, and its function was identified by bioinformatic analysis, expression pattern analysis, enzyme property analysis and bacteriostatic test in vitro of NtTPS21 fermentation products. The results showed that the open reading frame ofwas 1671 bp which encoded 556 amino acids. NtTPS21 had a typical terpene synthase catalytic active site and high homology withsesquiterpene synthase AtTPS21. NtTPS21 was localized in the cytoplasm and could be induced by Granville wilt of tobacco. The expression level ofin the resistant variety “Yanyan 97” was significantly higher than that in the susceptible variety “Changbohuang”. NtTPS21 can catalyze the synthesis of sesquiterpene β -caryophyllene, which has a significant inhibitory effect on the growth of granville wilt. These results indicate thatand its metabolites may be related to the resistence tom.
;; sesquiterpene synthase; β-caryophyllene;m resistance
S572.01
A
1007-5119(2022)03-0039-08
10.13496/j.issn.1007-5119.2022.03.007
中国农业科学院科技创新工程(ASTIP-TRIC01);中央级公益性科研院所基本科研业务费专项(1610232020001);中国烟草总公司四川省公司重点科技项目(SCYC202003)
杨 晴(1998-),女,在读硕士研究生,研究方向为植物次生代谢调控。E-mail:17806289623@163.com
,E-mail:杨爱国,yangaiguo@caas.cn;李依婷,liyiting@caas.cn
2021-11-21
2022-02-23
——结构和生物活性

