普通烟草热激转录因子家族的全基因组鉴定与分析
郭 存,王 奇,李晓旭,张震彪,文利超,邓智超,初雨蒙,刘 涛,崔萌萌,郭永峰*
普通烟草热激转录因子家族的全基因组鉴定与分析
郭 存1,2,王 奇1,李晓旭3,张震彪1,2,文利超1,2,邓智超1,2,初雨蒙1,刘 涛1,2,崔萌萌1,郭永峰1*
(1.中国农业科学院烟草研究所,烟草行业基因资源利用重点实验室,青岛 266101;2.中国农业科学院研究生院,北京 100081;3.湖南中烟工业有限责任公司技术中心,长沙 410007)
热激转录因子(heat shock transcription factor, Hsf)家族成员广泛参与植物生长发育和非生物胁迫的调控。本研究应用生物信息学和比较基因组学方法从普通烟草中鉴定了49个Hsf家族成员,发现这些Hsf家族成员均具有较为保守的寡聚化结构域。通过系统进化分析可将烟草和拟南芥的Hsf家族成员划分成3个分支与14个亚家族。共线性分析显示烟草Hsf基因与双子叶植物(拟南芥,番茄和葡萄)基因组成共线基因对的数量要大于与单子叶植物(水稻和玉米)基因组成共线基因对的数量。全基因组复制预测共有12个基因可组成7条复制基因对。启动子分析发现基因启动子区域存在着多个与非生物胁迫相关的顺式作用元件。表达模式分析证实家族成员在不同组织的表达具有差异,并且大多数家族成员可响应热和干旱胁迫。研究结果可为烟草Hsf转录因子家族成员的功能研究奠定生物信息学基础。
普通烟草;热激转录因子;共线性;全基因组复制;表达模式
高温是影响植物生长的一种非生物胁迫,高温环境下作物产量和品质都会受到严重影响。热激转录因子(Heat shock transcription factor, Hsf)是植物体内一类能够调节高温反应的蛋白[1-2]。有研究表明,在高温环境下,Hsf家族成员通过与下游相关基因的热激元件结合进而激活其转录,从而提高植物对高温的抗性[3-4]。Hsf家族成员含有较为保守的寡聚化结构域,根据寡聚化结构的特征可将Hsf家族划分成3个亚支(A、B和C)[5-7]。
目前,热激转录因子已在多种植物基因组中发现,在拟南芥[5]、水稻[8]、马铃薯[9]、番茄[10]、小麦[11]、玉米[12]和葡萄[13]中分别鉴定出了21、25、27、24、82、25和19个Hsf成员。研究发现,拟南芥大部分与高温胁迫相关的基因均受到A分支Hsf家族成员的调控,其中包括、、和。在三重突变体中,高温响应基因的转录水平显著降低[4,14]。此外,与野生型相比,四重突变体表现出生长迟缓且对温度更敏感的表型。在番茄和拟南芥中分别过表达和基因可以增强植物耐旱性和耐热性[15-16]。此外在烟草中异源过表达或基因都能够提高烟草的耐热性[17-18]。据报道,和除了在植物的耐热性方面起作用外,还参与调控植物耐缺氧性和氧化应激耐受性反应[19-20]。在高盐和干旱环境下,基因的表达量显著上调,并且在ABA介导的盐、干旱和高温胁迫中起正向调节作用[21]。
烟草是一种重要的经济作物,高温、干旱等非生物胁迫影响其正常生长发育,并诱导多种根茎类病害发生,进而影响烟叶的产量和品质。Hsf转录因子参与多种非生物胁迫的响应,而烟草中Hsf家族成员信息还未见报道。本研究首次从烟草基因组序列中鉴定出49个Hsf转录因子家族成员,并对其进行了系统进化、保守基序、共线性、复制事件、顺式作用元件和表达模式等分析,为进一步解析基因在烟草非生物胁迫响应过程中的功能奠定基础。
1 材料与方法
1.1 材料与仪器试剂
本试验所用的材料为普通烟草品种K326,保存于烟草行业烟草基因资源利用重点实验室。K326种子经过灭菌后均匀地撒在MS培养基中,在光照培养箱中培养8 周(光周期:16 h光照/8 h黑暗;25 ℃)。挑选长势一致的烟苗,一部分转移到37 ℃培养箱中进行高温处理,另一部分吸干根部水分后转移到滤纸上做干旱处理。在处理0、3、6 h时对烟苗整株取样,并于液氮中保存。所有样品取3次生物学重复。
本研究用的RNA提取试剂盒购自北京康为世纪公司,反转录试剂盒与SYBR®Green Premix Pro Taq HS qPCR Kit荧光定量试剂盒购自湖南艾科瑞生物工程有限公司。荧光定量仪器Roche LightCycler 480购自美国罗氏公司。
1.2 方法和条件
1.2.1 NtHsf转录因子家族成员的鉴定和序列分析 从拟南芥基因组数据库(https://www.arabidopsis.org/)中下载已报道的AtHsf家族成员的蛋白序列[22],并利用MAFFT工具在默认参数下进行序列比对,利用HMMER工具基于比对结果建立HMM文件。普通烟草K326蛋白序列数据库从茄科基因组数据库(https://solgenomics.net/organism,Sol Genomics Network)中下载得到,并用建立的HMM文件在默认参数下对数据库进行检索,初步得到烟草NtHsf序列。Pfam数据库(https://pfam.xfam.org/)被用来分析所鉴定的蛋白序列,并去除不含有寡聚化结构域的序列。利用ProtParam工具(https://web.expasy.org/protparam/)对新鉴定的NtHsf序列进行理化性质分析。
1.2.2 NtHsf转录因子家族成员的系统进化分析 利用MAFFT在默认参数下对已报道的拟南芥AtHsf成员和新鉴定的烟草NtHsf成员进行蛋白全长序列的比对[23]。基于比对结果,利用MGEA X进行邻接树的构建。构建邻接树的参数设置如下:采用Poisson Model和Pairwise Deletion,Bootstrap检验设为1000次[24]。
1.2.3的共线性及复制事件分析 按照先前的研究,分别下载普通烟草和其他5个物种(拟南芥、番茄、普通、水稻和玉米)的基因组注释文件,利用McScanX在默认参数下进行共线性分析,使用TBtools将结果进行可视化展示[25]。使用ColinearScan软件对烟草NtHsf基因的复制事件进行预测和可视化[26]。
1.2.4 NtHsf的寡聚化结构域序列分析 手动提取NtHsf的寡聚化结构域的序列,并利用MAFFT在默认参数对其进行比对与可视化[23]。
1.2.5 启动子分析 选取基因上游2000 bp区域[27],并提交到PlantCare网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行基因启动子顺式作用元件的鉴定[28]。
1.2.6 转录组数据分析及可视化 从NCBI的GEO数据库中下载得到普通烟草K326的根、茎和茎尖组织的转录组数据(https://www.ncbi.nlm.nih.gov,登录号为GSE95717)[29]。从下载的数据中提取烟草基因的表达情况,利用TBtools软件中的HeatMap程序对基因的表达量进行标准化分析和可视化展示[25]。
1.2.7 烟草样品RNA的提取和反转录 利用康为世纪Ultrapure RNA Kit进行样品总RNA的提取,cDNA第一条链的合成在说明书参照下进行,并将反转录的cDNA保存在−20 ℃待用。
1.2.8 荧光定量PCR 荧光定量PCR在Roche LightCycler 480上进行,试验体系设置如下:2× SYBR®Green Pro Taq HS Premix 10mL, cDNA 1mL, Primer-F 0.4mL,Primer-R 0.4mL,无菌水8.2mL。PCR程序设置如下:95 ℃ 30s;95 ℃ 5s,60℃ 30s,40个循环。烟草基因(GenBank No. L18908)为内参基因[30],每个样品进行3次技术重复。试验数据采用2-△△Ct法进行分析[31]。本试验所用到的引物如表1所示。
2 结 果
2.1 烟草NtHsf家族成员的鉴定和理化分析
本研究在烟草基因组中鉴定了49个家族成员(表2),并按照基因在染色体上的物理位置将新鉴定的烟草基因进行命名(~)。新鉴定的49个基因中有24个成员锚定在15条烟草染色体上。利用ProtParam工具对NtHsf成员进行理化性质分析发现,49个NtHsf成员在理化性质上存在较大差异,例如其氨基酸数目在146~504之间,相对分子量大小在16 521.7~55 842.1 Da之间,等电点范围为4.45~10.12。
2.2 烟草NtHsf家族成员的进化分析
为了进一步研究烟草中NtHsf转录因子成员的进化历程,将新鉴定的49个烟草NtHsf成员和已报道的21个拟南芥AtHsf成员进行系统进化分析。如图1所示,这些Hsf家族成员可划分为A、B和C三个分支,其中A和B分支又可划分为A1-A9和B1-B3亚家族。值得注意的是,每个亚家族中均含有来自拟南芥和烟草的Hsf家族成员,说明拟南芥和烟草的物种分化时间要晚于Hsf转录因子的分化时间。并且在各个亚家族中,烟草NtHsf家族成员要显著多于拟南芥Hsf家族成员,例如A1、A4、A6、B1、B2、B3等亚家族,暗示在这两个物种分化之后,各个亚家族的NtHsf成员可能又经历了复制事件,导致了基因的扩张。

表1 荧光定量PCR引物信息
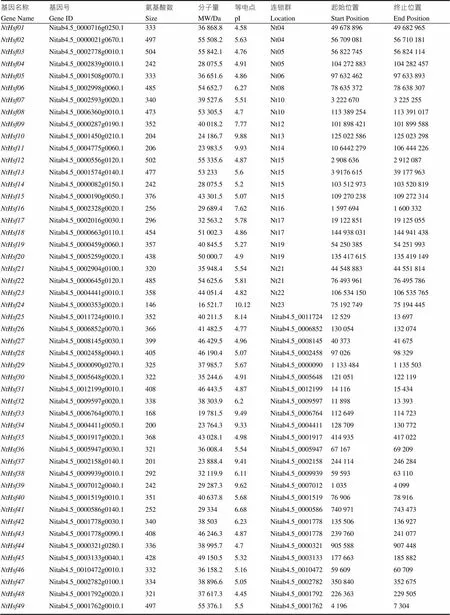
表2 普通烟草NtHsf转录因子家族成员鉴定及理化性质分析
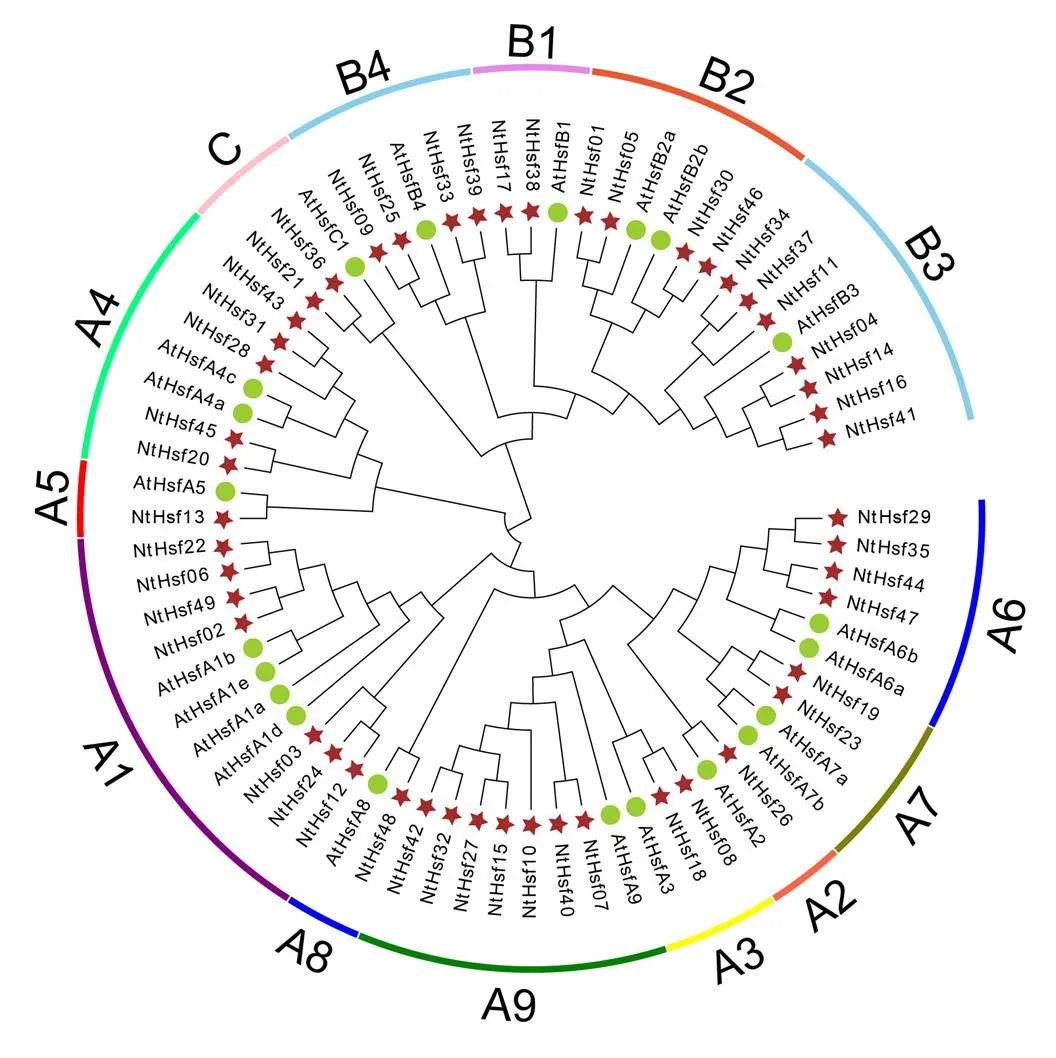
图1 烟草和拟南芥Hsf家族成员的系统进化分析
2.3 烟草NtHsf家族成员的寡聚化结构域分析
Hsf家族成员的寡聚化结构域由螺旋卷曲结构和α螺旋结构组成,其包含了大量的疏水氨基酸残基[1]。为了验证烟草NtHsf家族成员的保守结构域,选取NtHsf家族成员的寡聚化结构域进行多序列比对并进行可视化。如图2所示,新鉴定的NtHsf家族成员均具有较为保守的寡聚化结构域,由HR-A和HR-B组成,其中A类Hsf成员有30个,C类2个,B类17个。
2.4 烟草NtHsf基因的共线性分析
为进一步了解烟草家族成员的系统进化关系,分析了烟草与其他5个物种(拟南芥、番茄、葡萄、水稻和玉米)的共线性关系。如图3所示,灰色线条代表所有具有共线关系的基因,基因则用红色线条标记。其中,烟草中共22个基因与番茄基因成共线性关系,其次是葡萄(16个基因)、拟南芥(9个基因)、水稻(4个基因)和玉米(3个基因)。此外烟草基因与番茄、葡萄、拟南芥、水稻和玉米组成共线基因对的数量分别为30、19、11、11和7。值得注意的是,烟草中共有2个基因(和)与这5个物种的基因组成共线对,表明这2个基因可能在这些物种分化之前就已经存在。

图2 烟草NtHsf家族成员的寡聚化结构域序列比对图
2.5 烟草NtHsf基因家族的全基因组复制事件
系统进化分析暗示烟草基因家族可能发生了全基因组复制事件,随后利用McScan X对烟草家族成员进行复制分析。如图4所示,灰色线条代表烟草基因组中所有的复制基因对,而红色线条表示基因。结果显示,共有12个基因组成7条复制基因对,暗示这些基因可能由全基因组复制事件产生,也说明全基因组复制事件在烟草基因家族扩张过程中有一定的贡献。
2.6 烟草NtHsf家族成员的启动子分析
利用PlantCARE网站对的启动子元件进行探究,并选取12个顺式作用元件进行分析。如图5所示,大多数基因启动子中存在激素响应元件,例如响应脱落酸的元件ABRE、响应乙烯的ERE元件、响应水杨酸的元件TCA-element和响应茉莉酸甲酯的CGTCA-motif元件。值得注意的是,响应生长素的AuxRR-core元件仅在个别基因的启动子区域中检测到,例如、、、、、和。此外,厌氧诱导元件(ARE)、损伤响应元件(WUN-motif)、胁迫响应元件(TC-rich repeats)、WRKY转录因子结合位点(W-box)、MYB转录因子结合位点(MBS)和低温响应元件(LTR)等6种胁迫响应元件也被检测到广泛地存在启动子区域中,暗示这些基因可能参与到不同胁迫的响应过程中。同时,在一些基因的启动子区域检测出与分生组织发育相关的顺式作用元件(CAT-box)。
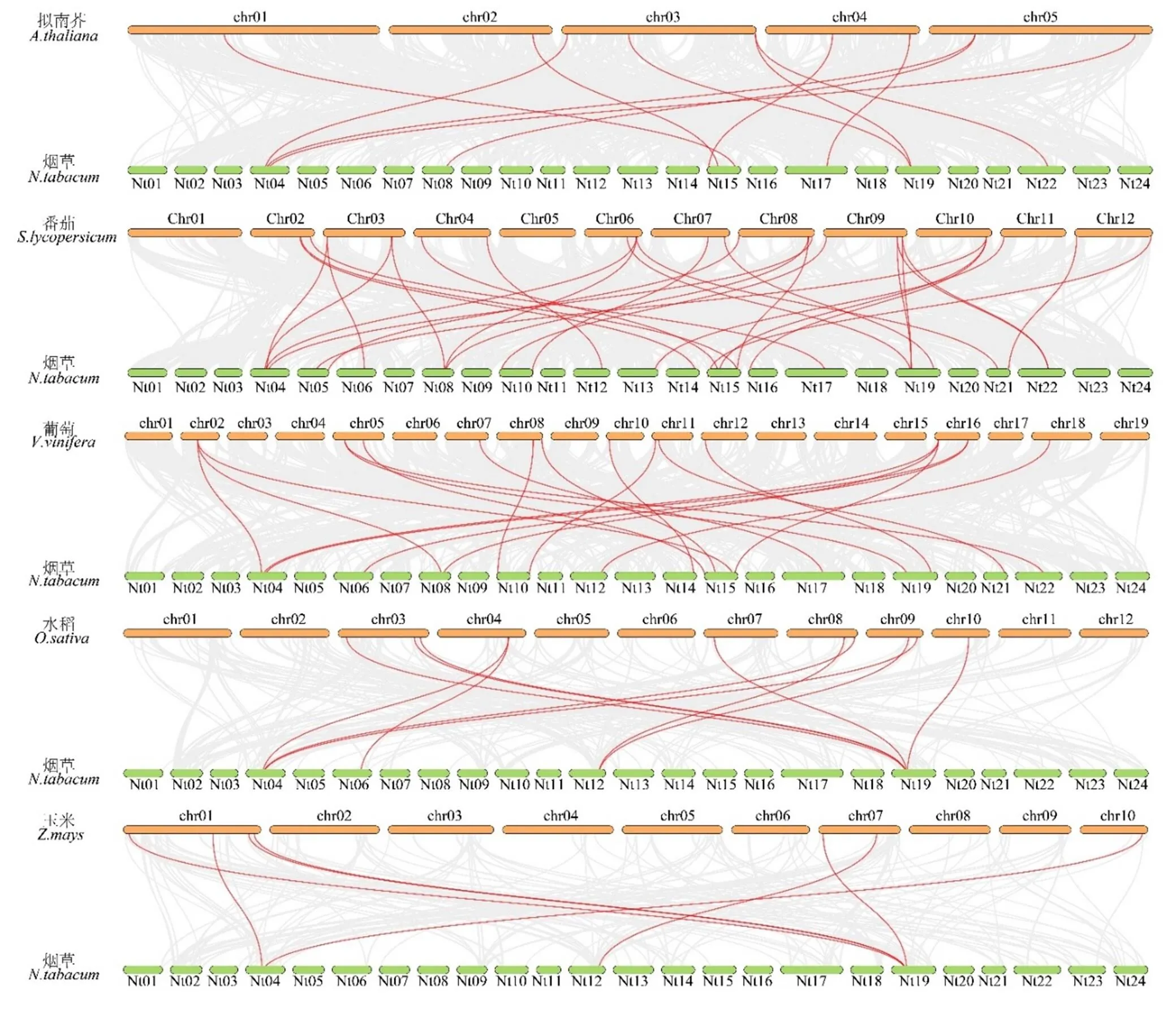
图3 烟草和其他5个物种Hsf基因的共线性分析
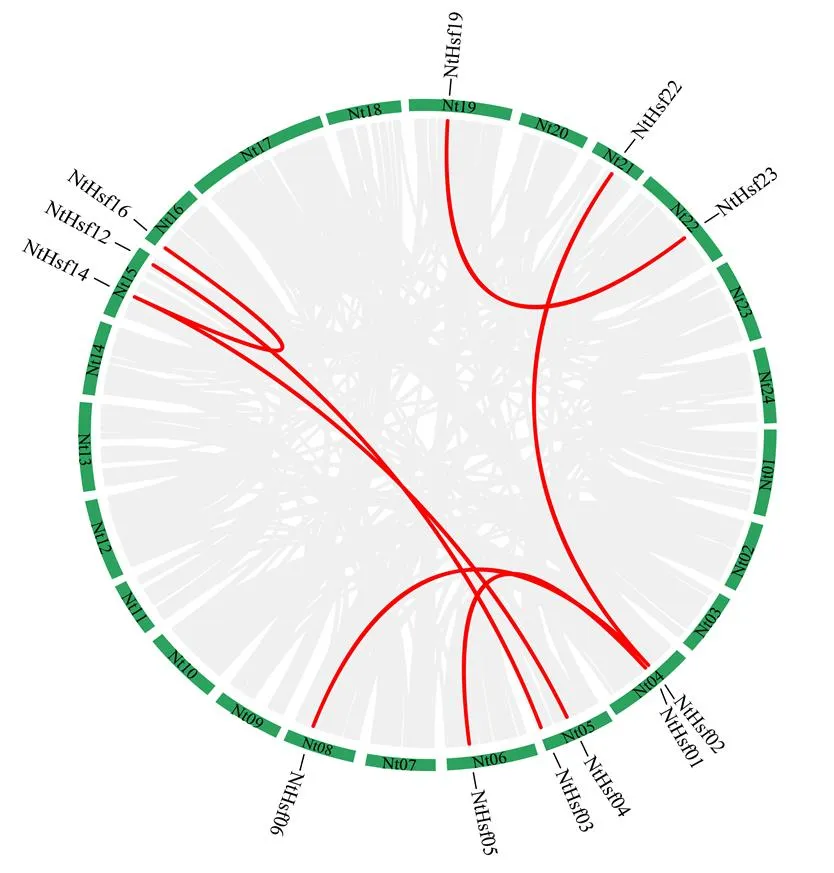
图4 烟草NtHsf基因家族的全基因组复制分析
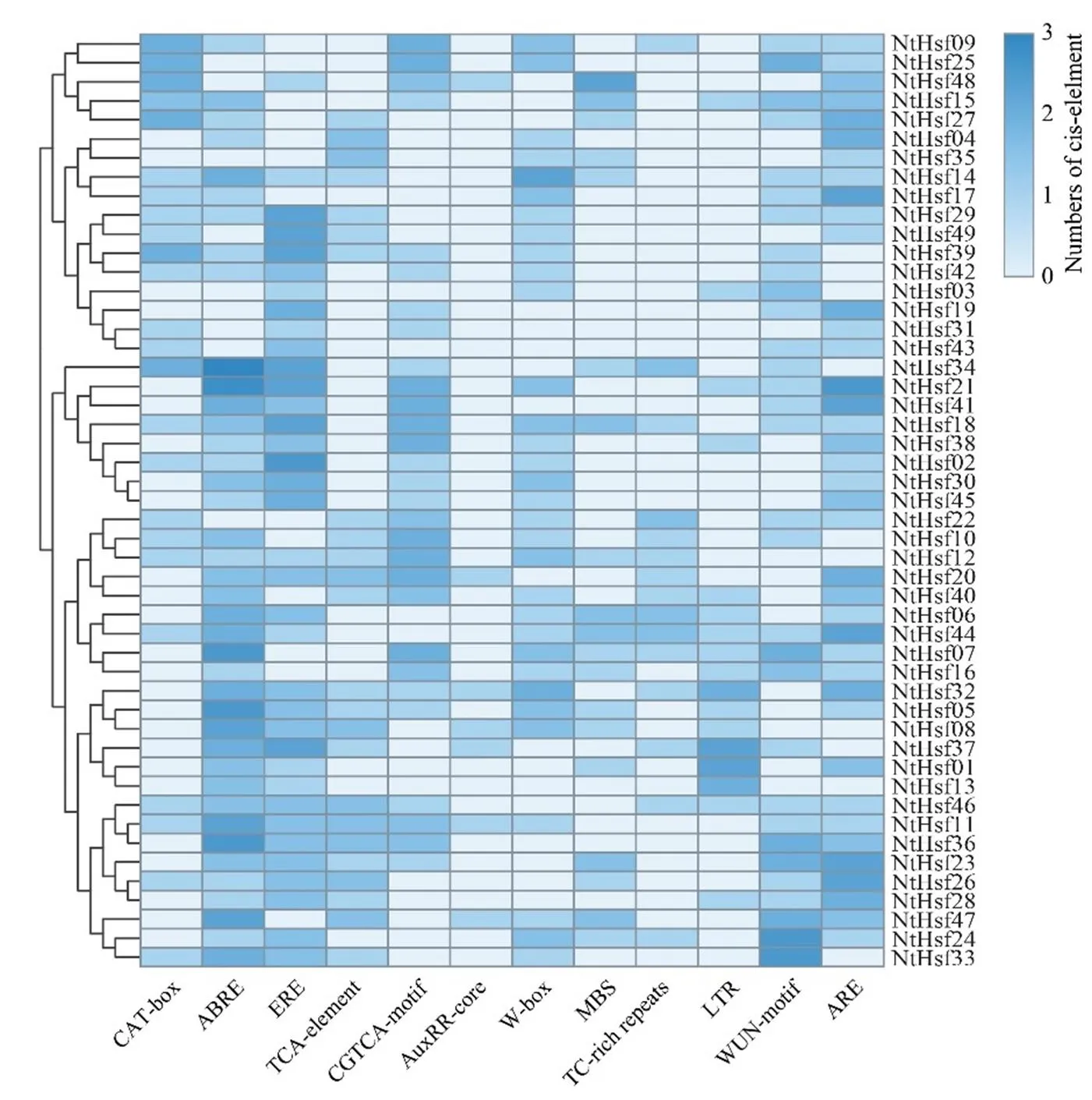
图5 烟草NtHsf基因启动子区顺式作用元件分析
2.7 烟草NtHsf家族成员在不同组织中的表达分析
利用已发表的普通烟草转录组数据库(https://www.ncbi.nlm.nih.gov,登录号为GSE95717)对基因的表达模式进行分析。如图6所示,家族成员在烟草根、茎和茎尖组织中的表达差异较大。多数基因在3个烟草组织中均检测到表达,如、和等,然而一些基因并未在这3个组织中检测到表达量,如、、和。进一步研究发现个别基因的表达模式具有组织特异性,例如、和在烟草的根和茎组织中特异高表达,在根和茎中检测出表达量,而在茎尖中却不表达。
2.8 烟草NtHsf家族成员在热和干旱胁迫下的表达模式
利用荧光定量PCR的方法对烟草NtHsf家族成员在热和干旱胁迫下的表达模式进行分析。如图7所示,一些基因可以被高温诱导表达,尤其是、、、和基因的表达量在高温处理3 h后显著增加(>10倍),而这些基因的表达水平在处理6 h后均下调,说明这些基因在高温胁迫下的表达具有时间特异性。其余基因在高温胁迫下的表达量均呈现出不同程度的上调表达,例如、和等基因。
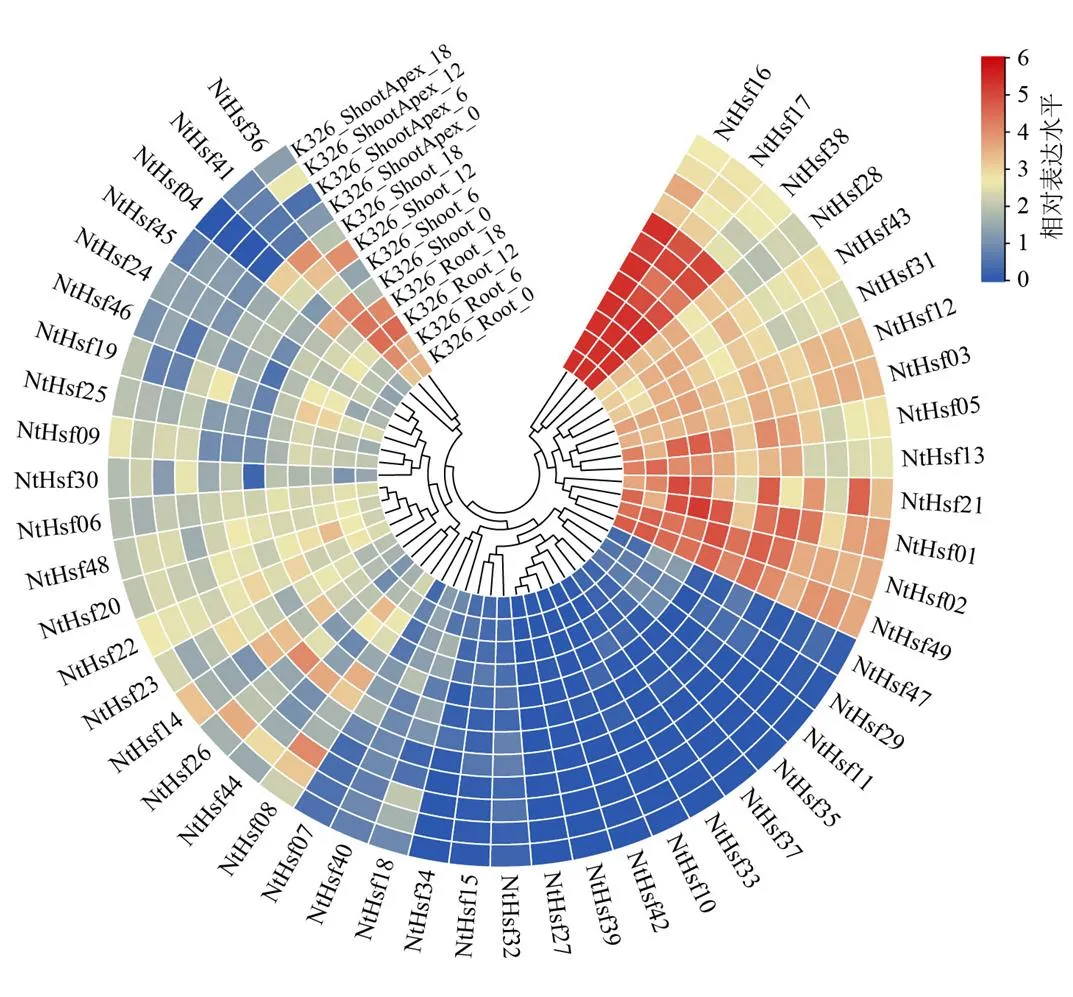
图6 烟草NtHsf家族成员的组织表达模式分析
图8所示的为基因在干旱处理下的表达模式,结果发现和在干旱处理3 h后的表达量达到最高峰,分别为对照的6.5倍和8.4倍。且这两个基因在干旱处理下的表达模式具有时间特异性,其表达量在处理3 h后达到顶峰,然后在处理6 h后下降,、、和等基因的表达模式也呈现出类似的趋势。
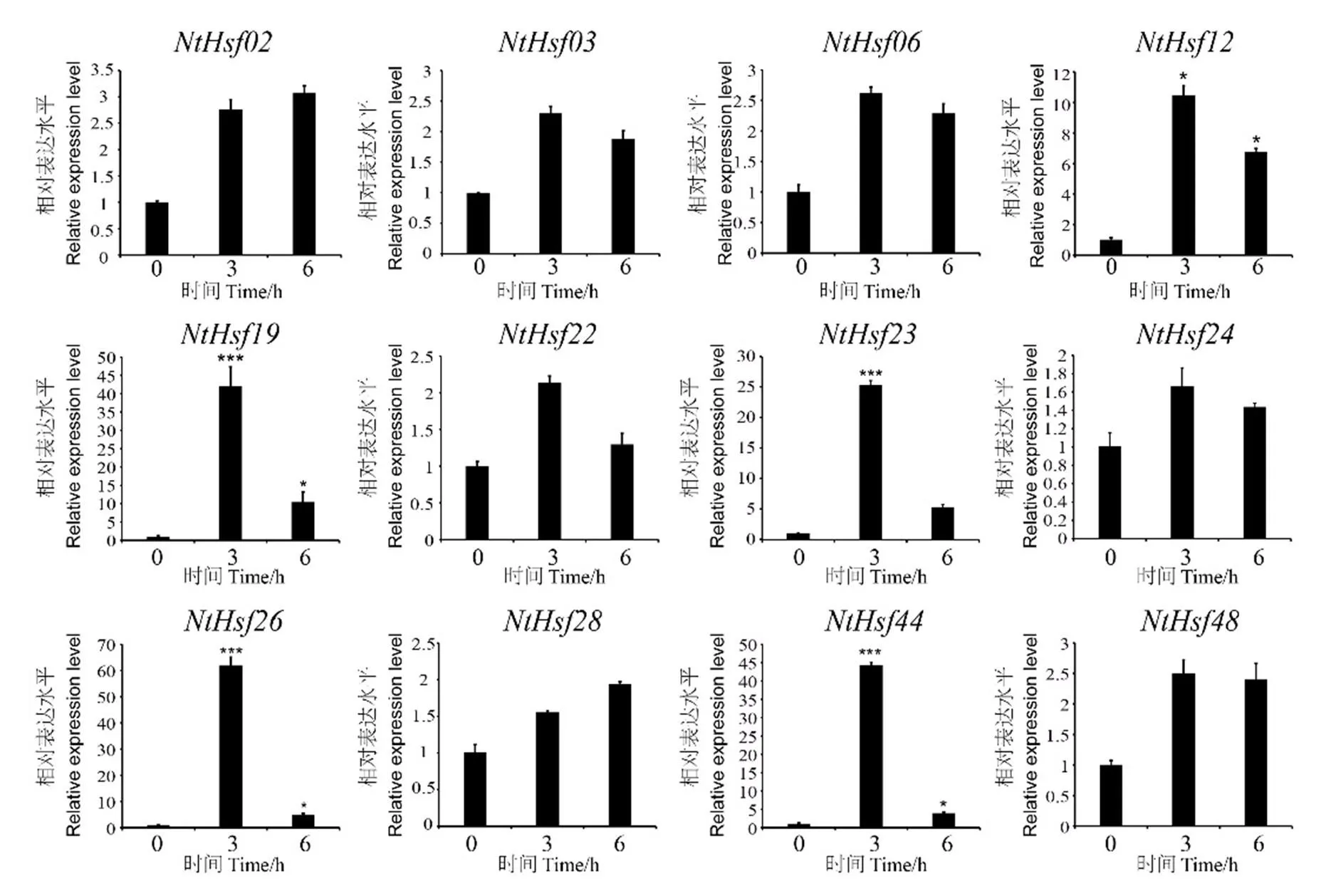
图7 普通烟草NtHsf家族成员在高温处理下的表达模式分析
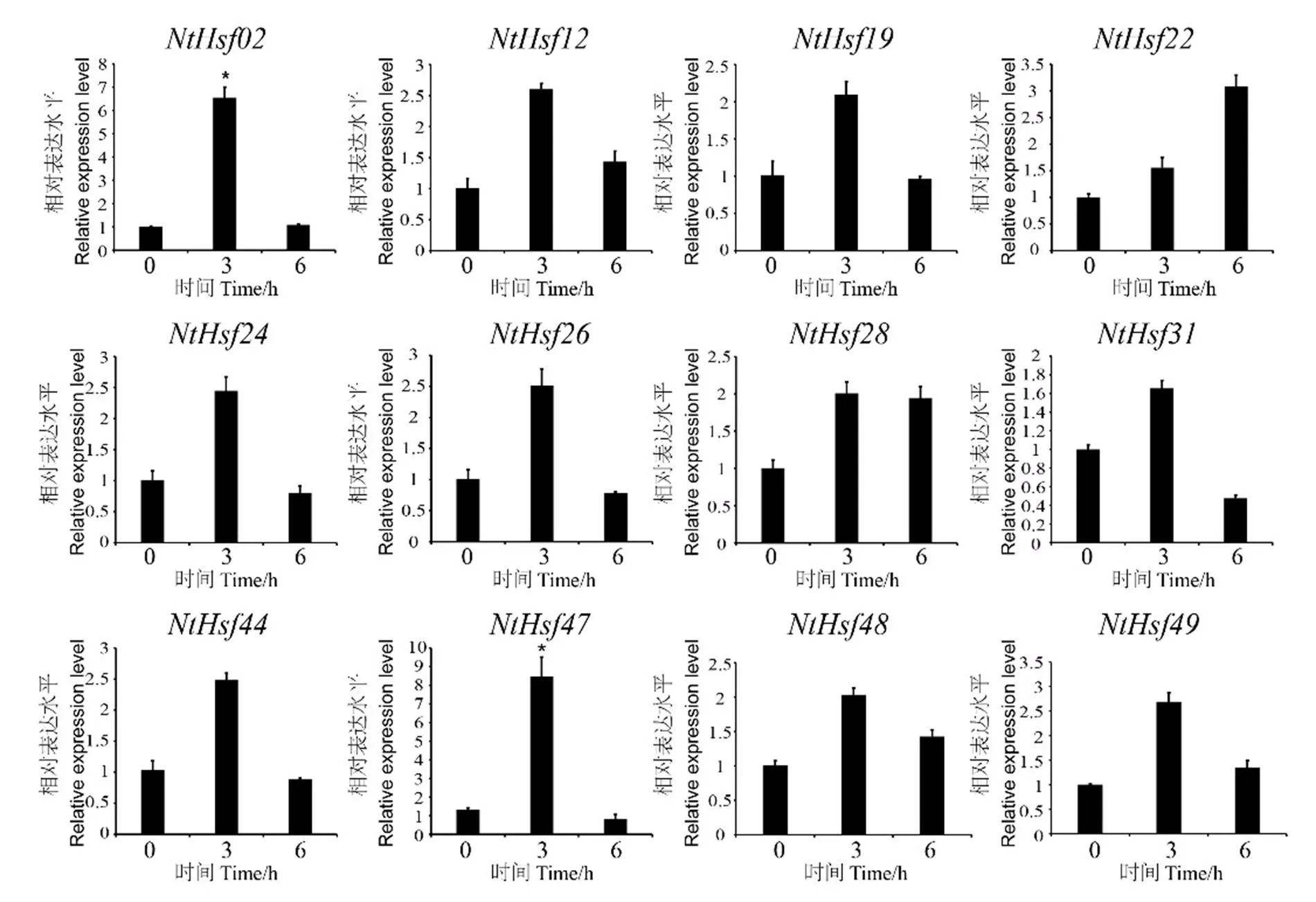
图8 普通烟草NtHsf家族成员在干旱处理下的表达模式分析
3 讨 论
烟草作为我国重要的经济作物,时常会受到高温等环境因素的胁迫,对烟叶的品质和生产造成负面影响。热激转录因子被报道与植物的耐热性和抗旱性有紧密的联系,本研究采用比较基因组学的方法对烟草基因组中的NtHsf热激转录因子进行了鉴定。并从系统进化、共线性、复制事件、顺式作用元件和表达模式等方面对新鉴定的NtHsf转录因子进行分析,为之后解析烟草NtHsf家族成员的生物学功能和调控机制提供基础。
本研究共鉴定得到49个烟草NtHsf转录因子,进一步分析发现其均含有较为保守的寡聚化结构域。系统进化分析表明烟草和拟南芥的Hsf家族成员可划分为A、B和C三个分支和14个亚家族。有意思的是,每个亚家族中的NtHsf成员均比AtHsf成员多,暗示烟草中的NtHsf成员可能进行一次或多次复制事件。随后的全基因组复制事件显示共有12个基因经历了复制过程,暗示这12个基因可能具有类似功能,也从侧面证明复制事件在烟草NtHsf成员的扩张过程中起着重要作用。
系统进化和共线性的综合分析是探索同源基因保守功能的有效手段之一,本研究通过分析烟草与拟南芥Hsf成员之间的系统进化和共线性关系,初步推测和探讨NtHsf成员的功能。在亚家族A1中,和与聚在一起,并且分别与这两个烟草Hsf成员组成共线基因对,说明和与基因直系同源。进一步分析发现和组成一对复制基因对,暗示其功能可能相似。此外,在番茄中过表达可增强番茄幼苗的耐热性[15],而且表达模式发现在高温胁迫下,和基因表达上调,暗示这两个烟草基因可能参与到烟草的高温胁迫响应中。值得注意的是,基因在干旱胁迫下的表达量也显著上调,暗示该基因可能参与到烟草多胁迫响应调控中。
此外,被报道通过调控热激反应相关基因的表达来提高拟南芥耐热性[16]。在本研究中,与聚在同一亚家族中,并且其编码基因预测具有共线性关系,说明其直系同源。有趣的是,在的启动子上发现了多个与胁迫相关的顺式作用元件,例如ABRE、G-box、W-box和MYB,且其转录本在高温胁迫下明显增加,暗示可能参与到烟草的高温胁迫过程。此外,也与聚在同一亚家族中,且其编码基因来自同一复制事件。在高温胁迫下的表达量也有所增加,暗示可能与在烟草响应高温胁迫方面具有相似的功能。
4 结 论
本研究利用生物信息学等方法在普通烟草基因组中鉴定到49个热激转录因子基因,它们编码的蛋白均含有较为保守的寡聚化结构域。此外,烟草NtHsf成员和拟南芥AtHsf成员被划分成3个亚支和14个亚家族。共线性分析表明,基因和基因形成11对同源基因对,暗示这些共线基因可能具有保守的功能。启动子分析发现大量胁迫响应相关的顺式作用元件存在NtHsf成员的启动子上,并且多数基因能够响应高温和干旱胁迫,说明家族成员可能在烟草的高温和干旱胁迫过程中具有重要的功能。
[1] SCHARF K D, BERBERICH T, EBERSBERGER I, et al. The plant heat stress transcription factor (Hsf) family: structure, function and evolution[J]. Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms, 2012, 1819(2): 104-119.
[2] VON KOSKULL-DÖRING P, SCHARF K D, NOVER L. The diversity of plant heat stress transcription factors[J]. Trends in Plant Science, 2007, 12(10): 452-457.
[3] IKEDA M, MITSUDA N, OHME-TAKAGI M.HsfB1 and HsfB2b act as repressors of the expression of heat-inducible Hsfs but positively regulate the acquired thermotolerance[J]. Plant Physiology, 2011, 157(3): 1243-1254.
[4] YOSHIDA T, OHAMA N, NAKAJIMA J, et al.HsfA1 transcription factors function as the main positive regulators in heat shock-responsive gene expression[J]. Molecular Genetics and Genomics, 2011, 286(5): 321-332.
[5] GUO M, LIU JH, MA X, et al. The plant heat stress transcription factors (HSFs): structure, regulation, and function in response to abiotic stresses[J]. Frontiers in Plant Science, 2016, 7: 114-121.
[6] KOTAK S, PORT M, GANGULI A, et al. Characterization of C-terminal domains ofheat stress transcription factors (Hsfs) and identification of a new signature combination of plant class A Hsfs with AHA and NES motifs essential for activator function and intracellular localization[J]. The Plant Journal, 2004, 39(1): 98-112.
[7] YE J, YANG X, HU G, et al. Genome-wide investigation of heat shock transcription factor family in wheat (L.) and possible roles in anther development[J]. International Journal of Molecular Sciences, 2020, 21(2): 608-619.
[8] WANG C, ZHANG Q, SHOU H X. Identification and expression analysis ofin rice[J]. Journal of Zhejiang University Science B, 2009, 10(4): 291-300.
[9] TANG R, ZHU W, SONG X, et al. Genome-wide identification and function analyses of heat shock transcription factors in potato[J]. Frontiers in Plant Science, 2016, 7: 490-508.
[10] YANG X, ZHU W, ZHANG H, et al. Heat shock factors in tomatoes: genome-wide identification, phylogenetic analysis and expression profiling under development and heat stress[J]. PeerJ, 2016, 4: e1961.
[11] DUAN S, LIU B, ZHANG Y, et al. Genome-wide identification and abiotic stress-responsive pattern of heat shock transcription factor family inL.[J]. BMC Genomics, 2019, 20(1): 1-20.
[12] LIN Y X, JIANG H Y, CHU Z X, et al. Genome-wide identification, classification and analysis of heat shock transcription factor family in maize[J]. BMC Genomics, 2011, 12(1): 1-14.
[13] GUOTIAN L, FENGMEI C, YI W, et al. Genome-wide identification and classification of HSF family in grape, and their transcriptional analysis under heat acclimation and heat stress[J]. Horticultural Plant Journal, 2018, 4(4): 133-143.
[14] LIU HC, LIAO HT, CHARNG YY. The role of class A1 heat shock factors (HSFA1s) in response to heat and other stresses in[J]. Plant, Cell & Environment, 2011, 34(5): 738-751.
[15] LI H Y, CHANG C S, LU L S, et al. Over-expression ofheat shock factor gene () enhances chilling tolerance in transgenic tomato[J]. Botanical Bulletin of Academia Sinica, 2003, 44: 129-140.
[16] HIGASHI Y, OHAMA N, ISHIKAWA T, et al. HsfA1d, a protein identified via FOX hunting usingcDNAs improves heat tolerance by regulating heat-stress-responsive gene expression[J]. Molecular Plant, 2013, 6(2): 411-422.
[17] ZHU X, WANG Y, LIU Y, et al. Overexpression oftranscription factor fromimproved heat tolerance of transgenic tobacco[J]. PLoS One, 2018; 13(11): e0207277.
[18] XU L, GAO J, GUO L, et al. Heat shock protein 70 (HmHsp70) fromconfers thermotolerance to tobacco[J]. AMB Express, 2020; 10(1): 1-10.
[19] LI C, CHEN Q, GAO X, et al.modulates expression of stress responsive genes and enhances tolerance to heat and oxidative stress in[J]. Science in China Series C: Life Sciences, 2005, 48(6): 540-550.
[20] SCHRAMM F, LARKINDALE J, KIEHLMANN E, et al. A cascade of transcription factor DREB2A and heat stress transcription factor HsfA3 regulates the heat stress response of[J]. The Plant Journal, 2008, 53(2): 264-274.
[21] HUANG Y C, NIU C Y, YANG C R, et al. The heat stress factor HSFA6b connects ABA signaling and ABA-mediated heat responses[J]. Plant Physiology, 2016, 172(2): 1182-1199.
[22] 李晓旭,郭存,蒲文宣,等. 普通烟草WOX转录因子家族的全基因组鉴定及分析[J]. 中国烟草学报,2021,27(1):90-100.
LI X X, GUO C, PU W X, et al. Genome-wide identification and systemic analysis of WOX family genes in tobacco[J]. Acta Tabacaria Sinica, 2021, 27 (1): 90-100.
[23] KATOH K, STANDLEY D M. MAFFT multiple sequence alignment software version 7: improvements in performance and usability[J]. Molecular Biology and Evolution, 2013, 30(4): 772-780.
[24] KUMAR S, STECHER G, LI M, et al. MEGA X: molecular evolutionary genetics analysis across computing platforms[J]. Molecular Biology and Evolution, 2018, 35(6): 1547-1549.
[25] CHEN C, CHEN H, ZHANG Y, et al. TBtools: an integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant, 2020, 13(8): 1194-1202.
[26] 李志远,宋青松,刘江,等. 普通烟草脂氧合酶基因家族鉴定及表达模式分析[J]. 中国烟草科学,2021,42(5):86-94.
LI Z Y, SONG Q S, LIU J, et al. Identification and expression analysis of the lipoxygenase gene family in tobacco (L.) [J]. Chinese Tobacco Science, 2021, 42(5): 86-94.
[27] GUO C, WANG Q, LI Z Y, et al. Bioinformatics and expression analysis ofgenes reveal their potential functions in flower abscission and stress response in tobacco (L.)[J]. Frontiers in Genetics, 2021, 12: 670794.
[28] LESCOT M, DÉHAIS P, THIJS G, et al. PlantCARE, a database of plant-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Research, 2002, 30(1): 325-327.
[29] EDWARDS K, FERNANDEZ-POZO N, DRAKE-STOWE K, et al. A reference genome forenables map-based cloning of homeologous loci implicated in nitrogen utilization efficiency[J]. BMC Genomics, 2017, 18(1): 1-14.
[30] LI Z, CHAO J, LI X, et al. Systematic analysis of the bZIP family in tobacco and functional characterization ofinvolvement in salt stress[J]. Agronomy, 2021, 11(1): 148-165.
[31] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408.
Genome-wide Identification and Systemic Analysis of the Hsf Gene Family inL.
GUO Cun1,2, WANG Qi1, LI Xiaoxu3, ZHANG Zhenbiao1,2, WEN Lichao1,2, DENG Zhichao1,2, CHU Yumeng1, LIU Tao1,2, CUI Mengmeng1, GUO Yongfeng1*
(1. Key Laboratory of Tobacco Gene Resources, Tobacco Research Institute of CAAS, Qingdao 266101, China; 2. Graduate School of Chinese Academy of Agricultural Science, Beijing 100081, China; 3. Technology Center, China Tobacco Hunan Industrial Co., Ltd., Changsha 410007, China)
Heat shock transcription factor (Hsf) family members are widely involved in the regulation of plant development and abiotic stress responses. In the current study, 49 Hsf members were identified from the tobacco genome by bioinformatics and comparative genomics methods, all of which contained conserved oligomerization domains. The Hsf members from tobacco andwere categorized into 3 clades and 14 subfamilies according to the phylogenetic analysis. The number of collinear gene pairs betweenandgenes from dicots (, tomato and grape) was more than the collinear gene pairs with thegenes from monocots (rice and maize). Besides, a total of 12genes were predicted to have arisen from duplication events. Promoter analysis showed that there were a variety of-elements related to abiotic stress responses on thepromoters. The various expression patterns ofin different tissues were detected, and mostgenes were induced by heat and drought stress. The results presented by this study might provide insights for the further studies on NtHsf members.
tobacco; heat shock transcription factor; collinearity; duplication events; expression pattern
S572.01
A
1007-5119(2022)03-0047-10
10.13496/j.issn.1007-5119.2022.03.008
中国农业科学院科技创新工程(ASTIP-TRIC02);湖南中烟工业有限责任公司科技项目(KY2022YC0010);中央级公益性科研院所基本科研业务费专项(1610232022009)
郭 存(1994-),男,在读博士研究生,主要从事烟草育种研究。E-mail:82101191076@caas.cn。
,E-mail:guoyongfeng@caas.cn
2021-12-07
2022-04-15

