黔江烟田病毒与周边作物及杂草携毒关系分析
王 晶,何伟光,陈海涛,冉 茂,汪代斌,孙现超*
黔江烟田病毒与周边作物及杂草携毒关系分析
王 晶1,何伟光2,陈海涛1,冉 茂3,汪代斌3,孙现超2*
(1.中国烟草总公司重庆市公司,重庆 400023;2.西南大学植物保护学院,重庆 400716;3.重庆烟草科学研究所,重庆 400715)
为明确烟田烟叶携带病毒与周边作物和杂草携带病毒的亲缘关系,利用RT-PCR克隆烟田烟叶与周边杂草和作物携带病毒外壳蛋白(CP),通过MEGA序列比对分析黔江烟田烟叶和周边杂草与作物所带病毒种类及其亲缘关系。结果显示,黔江地区烟草感染病毒有烟草普通花叶病毒(TMV)、黄瓜花叶病毒(CMV)和马铃薯Y病毒(PVY);在烟田周边杂草和作物番薯、四季豆、糯米团、三悬叶钩草、杂草中检测到了TMV;自番薯、四季豆、蓬蘽、千里光、糯米团、三悬叶钩草中扩增出CMV;自番薯、四季豆、假酸浆、杂草中扩增出了PVY。进化关系分析显示,三悬叶钩草、四季豆、糯米团以及番薯为黔江烟田烟叶TMV的主要来源,蓬蘽为烟叶病毒病CMV的侵染源,假酸浆为烟田PVY的主要来源。
烟草;病毒病;杂草;亲缘关系
烟草病毒病是威胁重庆市烟草生产的主要病害,其发生普遍、危害严重、防治困难,对烟草的产质量影响很大[1]。据报道,自然状态下能侵染烟草的病毒有近20种[2],其中烟草普通花叶病毒(,TMV)以及烟蚜传播的黄瓜花叶病毒(,CMV)和马铃薯Y病毒(,PVY)分布广、危害大,是重庆市烟区的主要病毒病病原[3]。病毒病传播快、难防治,目前尚无有效单一的防治措施[4]。烟草病毒病的防治一直遵循“预防为主,综合防治”的植保方针,重点在于减少毒源、阻断病毒传染或切断侵染循环,同时运用多种防治方法相互配合综合防治[4]。前人研究表明,病残体是烟草病毒病的主要初侵染源[3,5],但重庆烟田杂草在烟草病毒传播中的作用尚未有研究报道。烟田杂草是在烟田中生长、不断自然延续其种族,并影响到烟草生长的一类植物,已成为影响烟草的产量和质量的重要因素[6],多项研究表明杂草能携带植物病毒,包括马唐、狗尾草、雀稗、双穗雀稗、小飞蓬、黄花蒿、野艾蒿、苦荬菜、胜红蓟、桃叶蓼、尼泊尔廖、藜、蔊菜等在内的多种杂草能感染TMV、CMV等[7-8],而生活在烟田周边的杂草则可能会作为非植烟季节病毒的中间寄主,成为次年烟叶病毒病发生的侵染源。
本研究针对黔江烟区烟草病毒病的主要病原及其周边杂草及作物带毒情况进行分析,明确黔江地区烟叶病毒病的来源,为烟叶田间阻断病毒传播及控制烟草病毒病提供理论基础。
1 材料与方法
1.1 试验材料
于2019年在重庆市黔江区濯水镇附近村落采集烟田周边具有类似病毒病症状的作物番薯(Lam.)、四季豆();黔江烟田周边具有病毒病症状的杂草蓬蘽(Thunb)、茼蒿()、千里光(Buch.-Ham. ex D. Don)、糯米团[(Bl.) Miq.]、假酸浆[(Linn.) Gaertn.]、三悬叶钩草()和尚未鉴定出的杂草与种子共计21个样品于非植烟季节采集;于烟草生长期采集感染病毒病的烟草()叶片样品,采集地点分别是黔江区濯水镇堰塘村(YT)、彭家村(PJ),五福村(WF),后槽村(HC),桐木村(TM),邬杨村(WY)。
1.2 试剂与菌株
植物总RNA提取Trizol、DNA连接试剂盒、反转录试剂盒购于宝日医生物技术(TaKaRa)有限公司;DNA纯化回收试剂盒和pGEM-T Easy载体购于天根生化科技(TIANGEN)有限公司;大肠杆菌DH5α购自北京全式金生物技术有限公司;引物合成及测序均由北京六合华大基因科技有限公司完成;其他试剂均为国产分析纯。
1.3 RNA提取及cDNA的合成
烟叶总RNA提取采用RNAiso Plus,步骤见https://www.takarabiomed.com.cn/DownLoad/9108-9109.pdf。反转录采用NovoScrip Plus All-in-one 1st Strand cDNA Synthesis SuperMix试剂盒,体系如下:3 μL模版RNA,1 μLDNA Purge,6 μL RNase Free Water,10 μL 2×NovoScript Plus 1st Strand cDNA Synthesis SuperMix,程序如下:50 ℃ 30 min,75 ℃ 5 min,16 ℃ 5 min。
1.4 病毒检测及克隆
重庆烟区烟草主要受TMV、CMV、PVY侵染[1]。根据NCBI报道的上述病毒外壳蛋白(coat protein,CP)核酸序列,设计出特异性引物,详见表1。PCR扩增体系为:2×PCR Mix 12.5 μL,上下游引物(10 mmol)各1 μL,DNA 2 μL,加双蒸水至25 μL。PCR扩增程序:94 ℃预变性 3 min;94 ℃变性 30 s,58 ℃退火 30 s,72 ℃延伸60 s/90 s,共34个循环;72 ℃延伸10 min,16 ℃保温5 min。
参考使用说明书用DNA凝胶回收试剂盒回收获得的目标条带,将回收的片段连接到pGEM-T Easy 载体上并转入大肠杆菌,随机挑选2个阳性克隆送华大基因测序。
1.5 进化关系分析
采用MEGA 7.0.26比较序列同源性,采用默认参数。基于邻接法(Neighbor-Joining, NJ),采用MEGA 7.0.26程序构建系统发育树。选择Poisson模型,将bootstrap设置为1000,以此来评估系统发育分析结果的置信度。
2 结 果
2.1 几种杂草田间症状
如图1所示,与正常杂草相比,黔江烟田周边蓬蘽病状表现为新叶褪绿,成黄绿相间的花叶,叶缘向下翻卷;三悬叶钩草叶脉呈黄色,新叶黄化,叶片泡状突起,皱缩,叶缘红色扭曲畸形;糯米团叶片黄化,叶片变窄;千里光叶片变窄,叶缘向上翻卷。
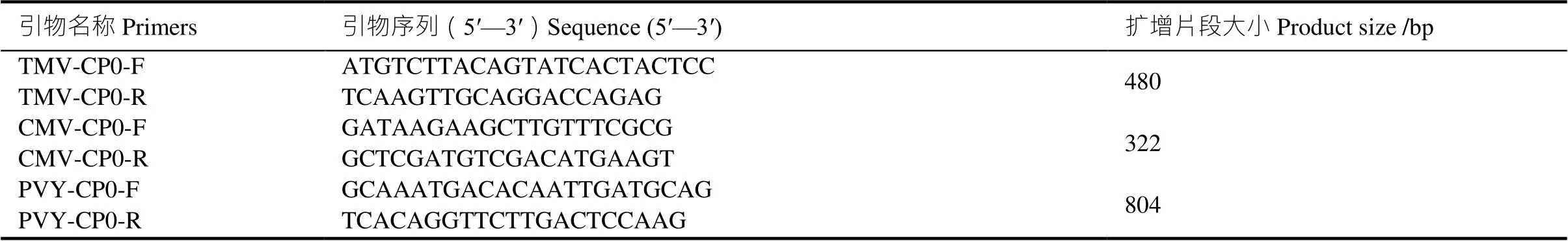
表1 用于RT-PCR扩增的特异性引物

注:A-B,蓬蘽;C-E,三悬叶钩草;F,糯米团;G,千里光。
2.2 TMV序列分析及亲缘关系比较
利用设计的特异性检测引物,经PCR扩增、电泳检测得到600 bp左右的与目标基因大小一致的片段。共检测了21个样品,分别是烟叶样5个、番薯样2个、四季豆样1个、蓬蘽样1个、茼蒿样1个、千里光样2个、糯米团样1个、假酸浆样2个、三悬叶钩草样3个、杂草样2个、杂草种子1个。其中有11个样品检测到了TMV(图2),检出率为52.38%,分别为5个烟叶、1个番薯、1个四季豆、1个糯米团、2个三悬叶钩草、1个杂草。
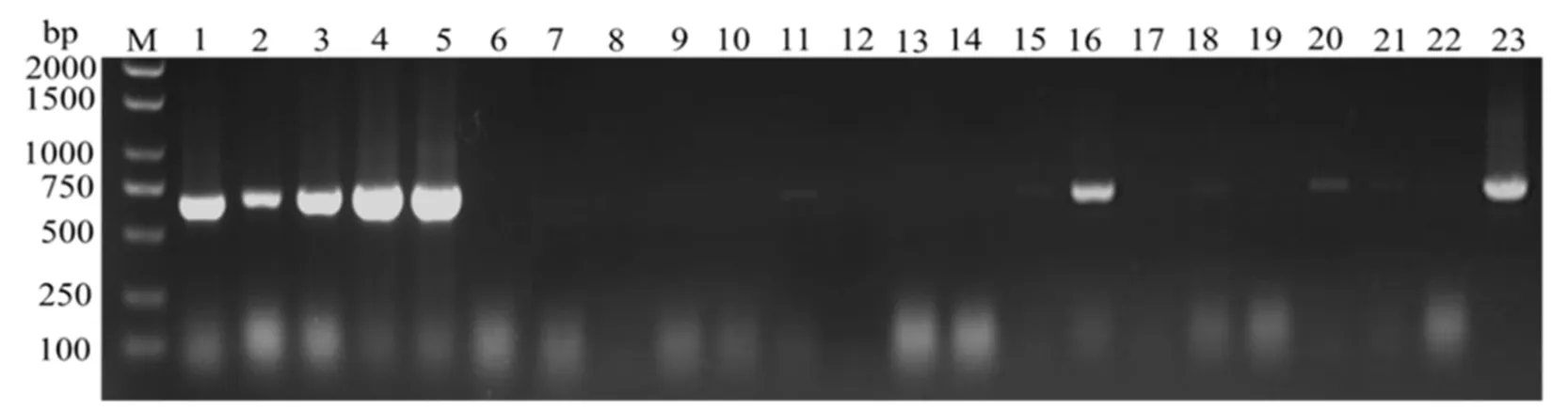
注:M,Maker 2000+;1-5,烟叶;6,未知杂草种子;7,蓬蘽;8,茼蒿;9-10,千里光;11,糯米团;12-13,假酸浆;14-16,三悬叶钩草;17-18,番薯;19-20,未知杂草;21,四季豆;22,阴性;23,阳性。下同。
将上述PCR产物纯化回收后连接到pGEM-T Easy 载体上,转化至大肠杆菌,经菌检测序,结果显示番薯(fan_T)、四季豆(si_T)、糯米团(nuo_T)、三悬叶钩草(san_T)中的TMV CP分离物核酸长度为480 bp。将所得序列进行NCBI的Blastn比对,下载亲缘关系最近的16个TMV分离物CP序列,利用MEGA对黔江烟田烟叶TMV分离物(HC、TM、WY、YT、PJ、WF)CP与杂草/作物检测到的TMV分离物CP进行亲缘关系比对。结果显示(图3),黔江番薯(fan_T)、四季豆(si_T)、糯米团(nuo_T)、三悬叶钩草(san_T)中TMV分离物与其他的TMV分离物亲缘关系较远,但与黔江烟田烟叶TMV分离物亲缘关系较近。黔江地区烟叶TMV分离物ZL5与其他分离物亲缘关系较远,与KU175649.1中国安徽辣椒TMV分离物亲缘关系最近,而DPI与KJ508019.1福建烟草分离物亲缘关系最近。总的来说,这4种杂草/作物中的TMV分离物与烟叶TMV分离物的亲缘关系较近,因此认为烟田烟叶的TMV可能来自这些感病杂草。
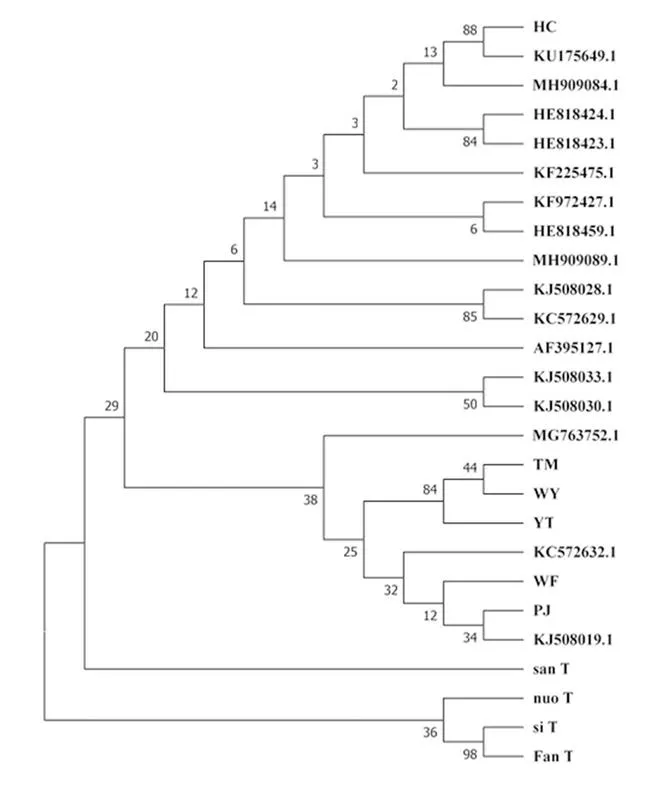
图3 基于TMV各分离物部分CP基因序列的系统进化树
2.3 CMV序列分析及亲缘关系比较
利用我们设计的特异性引物,经PCR扩增过后,电泳检测得到322 bp左右的与目标基因大小一致的片段。本次共检测的21个样品中,有8个样品检测到了CMV(图4),分别为番薯、四季豆、烟叶、蓬蘽、千里光、糯米团各1个,三悬叶钩草2个,检出率为38.10%。
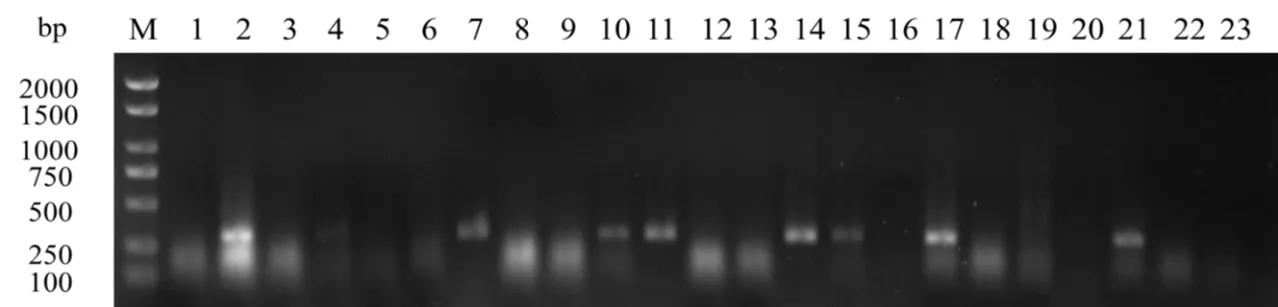
图4 黔江杂草、作物CMV CP扩增电泳图
通过分子克隆测序确定蓬蘽(peng_C)和四季豆(si_C)的CMV重庆黔江分离物CP片段长度为322 bp。将上述两种杂草与作物的CMV分离物CP片段进行NCBI的Blastn比对,下载E值最小的17 个CMV分离物CP片段,与黔江CMV烟草分离物(WF、HC、TM、PJ、WY和YT)CP序列一同,利用MEGA对比进化距离。由图5可知,四季豆(si_C)的CMV与其他分离物的亲缘关系较近,蓬蘽(peng_C)与这些CMV分离物的亲缘关系较远,但蓬蘽(peng_C)与烟田烟叶CMV分离物的亲缘关系较近,因此蓬蘽为烟田烟叶CMV的直接来源。
2.4 PVY序列分析及亲缘关系比较
根据已报道的PVY CP序列,设计一段特异性引物扩增PVY CP。经PCR扩增电泳检测得到800 bp左右的与目标基因大小一致的片段。本次检测了21个样品,有5个样品中检测到了PVY(图6),分别为烟叶、番薯、四季豆、假酸浆、杂草,检出率为23.81%。
测序结果表明,番薯(fan-P)和假酸浆(jia-P)重庆黔江杂草PVY分离物CP长度均为803 bp,与各代表株系核苷酸同源性相比较,与PVYN:O、PVYO、PVYC、PVYNT株系核苷酸同源性分别为99.00%~99.38%、98.63%~98.75%、92.74%~98.75%、91.11%~91.48%,与PVYN株系核苷酸同源性较低,为88.04%~89.61%;相较而言与PVYN:O株系的同源性最高。与黔江烟草PVY分离物CP核苷酸同源性相比较,黔江烟草PVY分离物CP核苷酸同源性与假酸浆(jia-P)最高,达99.00%,但与番薯(fan-P)核苷酸同源性不高,仅有49%。因此,认为假酸浆(jia-P)可能是黔江地区烟草病毒病PVY的传播源。
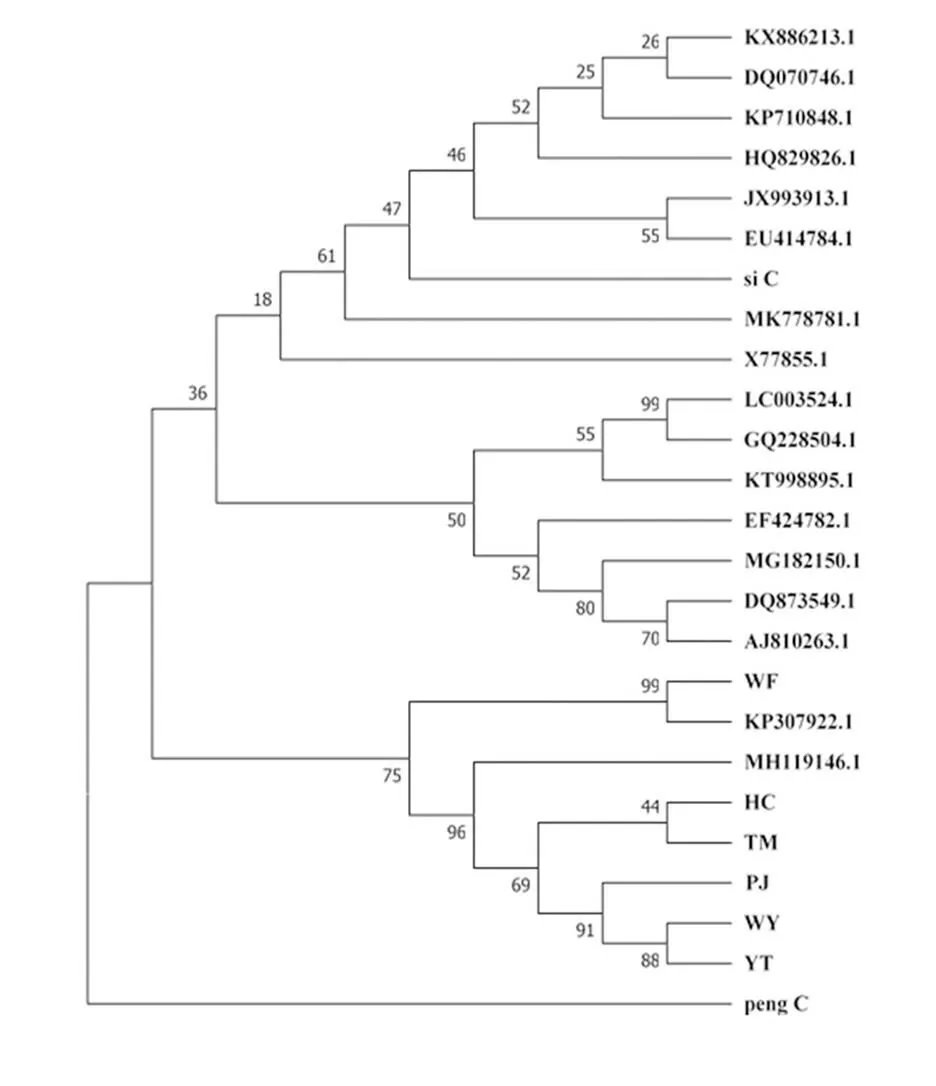
图5 基于CMV各分离物部分CP基因序列的系统进化树
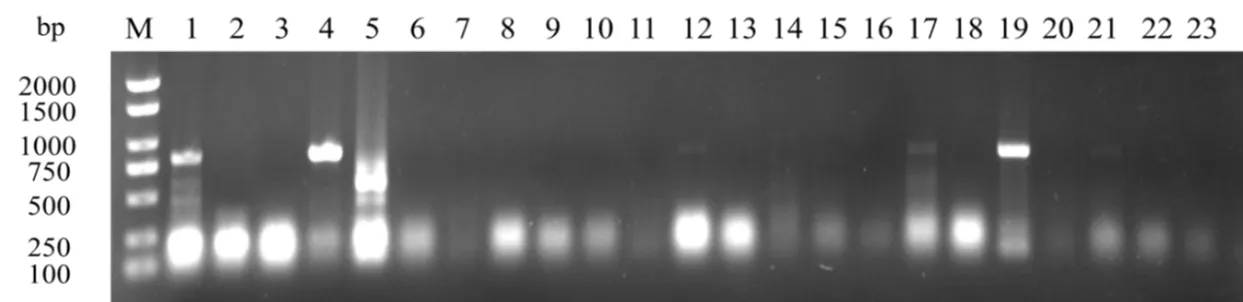
图6 黔江杂草、作物PVY扩增电泳图
结合进化树可以看出(图7),黔江作物与杂草PVY分离物分属于两个分支,假酸浆(jia-P)同黔江烟草PVY分离物MY同源性最高,属于PVYN:O株系。番薯(fan-P)PVY分离物由于与其他PVY分离物关系较远,被分为其他株系。
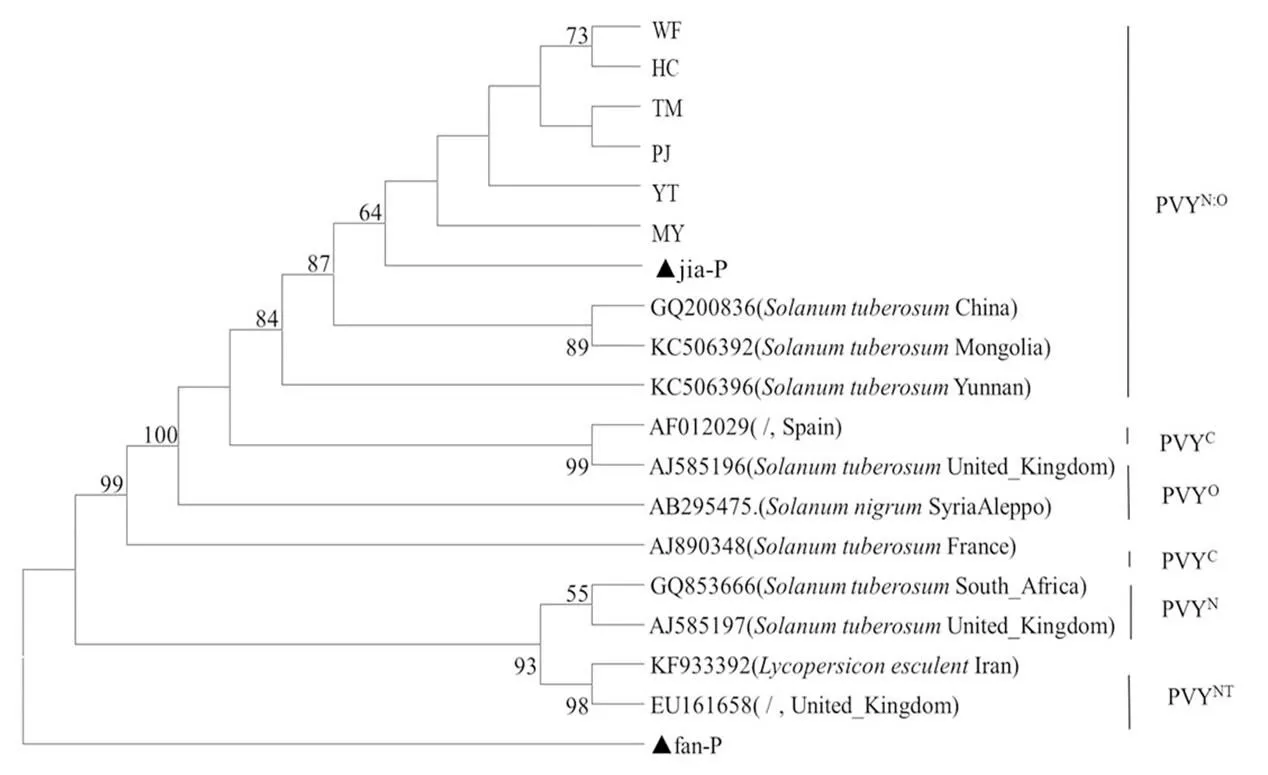
图7 基于PVY各分离物部分CP基因序列的系统进化树
3 讨 论
前人对贵州烟田的杂草进行病毒检测,发现杂草病毒平均检测率达20.98%[9],部分地区的TMV检出率甚至达到了58.5%[10];严丹侃等[11]对烟草生产不同时期烟田杂草TMV进行检测,发现不同烟草生产时期烟田周边杂草均含TMV,且烟草收获期的TMV检出率高达66.7%,表明烟叶病毒极有可能为周边杂草传播所致。本研究检测了番薯、四季豆、蓬蘽、茼蒿、千里光、糯米团、假酸浆、三悬叶钩草和尚未鉴定出的杂草与种子,共计21个采自非植烟季节的杂草及作物样品、以及在烟草生长期采集的感染病毒病的烟叶样品。杂草中TMV检出率为52.38%,与已报道检出率相似[9-11]。其中6种杂草及作物中检测并分离出了病毒的外壳蛋白,番薯、四季豆同时含有两种病毒,为复合侵染;糯米团、三悬叶钩草、蓬蘽和假酸浆只含一种病毒。本次检测首次在番薯、四季豆、三悬叶钩草中检测出TMV,首次在番薯中检测出PVY,首次在蓬蘽中检测出CMV。
为验证上述作物和杂草病毒外壳蛋白分离物与黔江烟叶病毒外壳蛋白的亲缘关系,将烟叶病毒分离物CP序列与上述杂草及作物病毒分离物CP序列进行系统进化树分析。结果显示,杂草和作物中的TMV分离物亲缘关系较近,与烟叶TMV分离物也较近,但二者分属两个不同支系,同样可认为杂草是烟田烟叶TMV的直接来源。从四季豆(si-C)和蓬蘽(peng-C)检测出了CMV,但通过进化树分析发现二者相似度较低,可能来源于不同侵染源,其中蓬蘽(peng-C)分离物与黔江烟叶CMV分离物亲缘关系较近,蓬蘽为黔江烟田烟叶病毒病CMV的侵染源。此外,从假酸浆(jia-P)和番薯(fan-P)中检测出PVY,通过序列比对发现二者CP相似度不高,通过进化树分析发现假酸浆PVY分离物CP与黔江地区烟田烟叶PVY分离物CP(MQG2, HTX4)同源性很高,分属在同一支,属于PVYN:O株系。而番薯分离物与黔江地区烟田烟叶PVY分离物CP亲缘关系较远,且无法断定株系。因此猜测黔江地区烟田烟叶PVY的来源可能是该假酸浆(jia-P)带毒植株。
病毒由于其特殊的结构,具有传播快、防治难等特点[12],目前病毒病的防治,以预防为主,重视传播源,减少病毒传染或阻断传染途径[13]。贵阳烟区调查发现[14],烟田周围的作物、杂草常年出现病毒病样,推测这些杂草和作物可能是烟田烟苗病毒病的侵染来源,与本研究的检测结果类似。因此对于类似烟区的病毒病防治,应加大对烟田周边作物、杂草病毒病发病时期的实时监测,及时处理这些作物和杂草,降低其传播到烟草的可能性,只有从源头上治理烟草病毒病害,才能将其所造成的经济损失降到最低。
4 结 论
研究结果表明,在烟田周边的番薯、四季豆、三悬叶钩草中检测出TMV,在番薯中检测出PVY,在蓬蘽中检测出CMV;三悬叶钩草、四季豆、糯米团以及番薯为黔江烟田烟叶TMV主要来源,蓬蘽为黔江烟田烟叶CMV的侵染源,假酸浆为黔江烟田烟叶PVY主要来源之一。
[1] 宋娟,廖秋菊. 重庆烟草地区ELISA检测[J]. 生物技术世界,2014(1):173.
SONG J, LIU Q J. ELISA detection of tobacco in Chongqing[J]. Biotech World, 2014(1): 173.
[2] 曲平治,宋娟,丁伟,等. 烟草病毒病的主要种类及防治方法[J]. 植物医生,2014,27(5):48-50.
QU P Z, SONG J, DING W, et al., The main types and prevention methods of tobacco virus diseases[J]. Plant Doctor, 2014, 27(5): 48-50.
[3] 时洪伟,刘陈晨,李科,等. 重庆丰都烟区田间烟草病毒病及其Dot-ELISA检测[J]. 中国烟草科学,2016,37(2):6-10.
SHI H W, LIU C C, LI K, et al. Detection of field viral diseases on tobacco in fengdu county of Chongqing with the Dot-ELISA technique[J]. Chinese Tobacco Science, 2016, 37(2): 6-10.
[4] 杨德廉,王凤龙,钱玉梅,等. 我国烟草病毒病的防治研究策略[J]. 中国烟草科学,2001,22(1):46-48.
YANG D L, WANG F L, QIAN Y M, et al. Strategy for prevention and control of tobacco virus diseases in China[J]. Chinese Tobacco Science, 2001, 22(1): 46-48.
[5] 董鹏,朱三荣,蔡海林,等. 湖南烟草病毒病种类检测与系统进化分析[J]. 中国烟草科学,2020,41(3):58-64.
DONG P, ZHU S R, CAI H L, et al. Detection and phylogenetic analysis of tobacco viruses in Hunan province[J]. Chinese Tobacco Science, 2020, 41(3): 58-64.
[6] 时焦. 我国烟田杂草研究现状及防治对策展望[J]. 中国烟草科学,2021,42(3):100-108.
SHI J. Research advances on weeds in tobacco field and future weed control endeavor in China[J]. Chinese Tobacco Science, 2021, 42(3): 100-108.
[7] 陈瑞泰,朱贤朝,王智发,等. 全国16个主产烟省(区)烟草侵染性病害调研报告[J]. 中国烟草科学,1997,18(4):3-9.
CHEN R T, ZHU X C, WANG Z F, et al., Investigation report on tobacco infection diseases in 16 major tobacco-producing provinces in China[J]. Chinese Tobacco Science, 1997, 18 (4): 3-9.
[8] 王秀敏. 陕西省烟草病毒病毒源的鉴定及种群区系的分布[D]. 杨凌:西北农林科技大学,2003.
WANG X M. Identification of the virus source of tobacco virus in shaanxi province and the distribution of population area[D]. Yangling: Northwest Agricultural &Technology University, 2003.
[9] 何永福,王楠,叶照春,等. 贵州省烟田杂草主要病毒检测及分析[J]. 杂草科学,2013,31(1):15-19.
HE Y F, WANG N, YE Z C, et al. Detection and analysis of main viruses of weeds in tobacco fields in Guizhou province[J]. Weed Science, 2013, 31(1): 15-19.
[10] 杨雨环,李鸿波,叶照春,等. 安顺市烟田杂草主要病毒检测及分析[J]. 耕作与栽培,2014,34(6):19-21.
YANG Y H, LI H B, YE Z C, et al. Detection and analysis of main viruses of weeds in tobacco fields in Anshun City[J]. Tillage and Cultivation, 2014, 34 (6): 19-21.
[11] 严丹侃,姜超强,周凤艳,等. 皖南烟区不同时期杂草中烟草普通花叶病毒检测与分析[J]. 安徽农业科学,2018,46(28):137-139.
YAN D K, JIANG C Q, ZHOU F Y, et al. Detection and analysis of tobacco mosaic virus in weeds in different periods in Southern of Anhui[J]. Anhui Agricultural Sciences, 2018, 46(28): 137-139.
[12] YANG T, ZHU L S, MENG Y, et al. Alpha-momorcharin enhances tobacco mosaic virus resistance in tobacco nn by manipulating jasmonic acid-salicylic acid crosstalk[J]. Journal of Plant Physiology, 2018, 223: 116-126.
[13] 娄虎,徐熔,王海竹,等. 植物病毒病检测及防治的研究进展[J]. 江苏农业科学,2017,45(24):25-31.
LOU H, XU R, WANG H Z, et al. Research progress of plant virus detection and prevention[J]. Jiangsu Agricultural Sciences, 2017, 45(24): 25-31.
[14] 高凯悦. 贵阳市烟田杂草种类调查与防控技术研究[D]. 贵阳:贵州大学,2016.
GAO K Y. Weed species investigation in tobacco fields and prevention and control technology research in Guiyang city[D]. Guiyang: Guizhou University, 2016.
Analysis of Virus Carrying Relationship between Tobacco and Neighboring Crops and Weeds in Tobacco Fields of Qianjiang, Chongqing
WANG Jing1, HE Weiguang2, CHEN Haitao1, RAN Mao3, WANG Daibin3, SUN Xianchao2*
(1. Chongqing Company of China Tobacco Corporation, Chongqing 400023, China; 2. College of Plant Protection, Southwest University, Chongqing 400716, China; 3. Chongqing Tobacco Science Research Institute, Chongqing 400715, China)
Toclarifying the genetic relationship between the viruses in tobacco leaves and the viruses in neighboring crops and weeds, RT-PCR was used to detect and clone virus CPs in tobacco leaves and neighboring crops and weeds. MEGA was employed to analyze the relationships between viruses from tobacco leaves and neighboring crops and weeds in Qianjiang. The results showed that tobacco leaves in Qianjiang area contained TMV, CMV and PVY. In addition, TMV CP was isolated and cloned from(Bl.).,,Lam., and. CMV CP was isolated and cloned from,Buch.-Ham. ex D. Don,(Bl.) Miq.,,Lam. and, and PVY CP was isolated and cloned from(Linn.) Gaertn.,Lam, weeds and. Through the analysis of the evolutionary relationship, it can be concluded that,,(Bl.) Miq. andLam. are the main sources of TMV in tobacco fields,is one of the sources of infection of CMV in tobacco fields, and(Linn.). is one of the main sources of PVY in tobacco fields in Qianjiang.
tobacco; virus disease; weeds; evolutionary relationship
S435.72
A
1007-5119(2022)03-0033-06
10.13496/j.issn.1007-5119.2022.03.006
中国烟草总公司重庆市公司科技项目(B20212NY2312、B20212NY2318)
王 晶(1981-),男,硕士,农艺师,主要从事烟草科研管理工作。E-mail:306140461@qq.com。
,E-mail:sunxianchao@163.com
2021-08-09
2021-12-15

