不同剂量肺表面活性物质治疗早产儿呼吸窘迫综合征疗效及对氧合功能的影响分析
李远珍 广西平南县人民医院新生儿科 537300
新生儿呼吸窘迫综合征(Neonatal respiratory distress syndrome,NRDS)是新生儿科常见危重疾病,多见于早产儿,尤其是极低出生体重儿发病率极高,其主要形成原因是早产儿肺部发育不良导致其体内肺表面活性物质(Pulmonary surfactant,PS)分泌不足,进而引起肺泡萎陷[1]。故对确诊为NRDS的新生儿给予有效的急救措施,对改善患儿预后,降低病死率具有重要意义。早期补充外源性PS治疗NRDS已成为儿科医师共识。外源性PS主要分为人工合成和天然动物源性两类,其中人工合成PS由于不含有PS结合蛋白,副作用相对较多,故临床治疗中多采用天然动物源性PS,但用药剂量临床尚缺乏统一标准[2-3]。鉴于此,本文选取76例NRDS患儿为观察对象,分别给予不同剂量PS治疗,旨在探讨大剂量PS治疗NRDS的治疗疗效及安全性,为临床合理用药提供参考依据,现报道如下。
1 资料与方法
1.1 一般资料 选取2019年1月—2020年10月本院收治的NRDS患儿76例,根据治疗剂量不同分为低剂量组(n=38)和高剂量组(n=38)。低剂量组:男21例,女17例;胎龄29~36周,平均胎龄(33.15±0.50)周;出生体质量960~2 230g,平均出生体质量(1 560±245)g;分娩方式:剖宫产31例,阴道分娩7例。高剂量组:男23例,女15例;胎龄28~36周,平均胎龄(32.95±0.50)周;出生体质量980~2 150g,平均出生体质量(1 520±220)g;分娩方式:剖宫产29例,阴道分娩9例。两组患儿一般资料比较差异无统计学意义(P均>0.05),具有可比性。纳入标准:(1)均符合NRDS临床诊断标准[4],且经X线等检查确诊;(2)胎龄<37周早产儿;(3)患儿家属知情,并签署同意书。排除标准:(1)羊水吸入、肺炎引起的呼吸窘迫;(2)先天性畸形、染色体异常患儿;(3)多胎妊娠或产妇合并严重感染者;(4)自身原因中途退出研究者。
1.2 治疗方法 两组均给予常规支持疗法,如保温箱保暖、加强营养支持、抗感染,呼吸机辅助通气等。在此基础上,低剂量组给予PS(固尔苏,意大利Chiesi公司,国药准字:H20030598)100mg/kg治疗,高剂量组给予PS 200mg/kg治疗。给药方法:给药前,清理患儿口腔及呼吸道分泌物,给予气管插管,将PS加温至37℃,用5ml无菌注射器将PS药液经气管插管推入导管内,给药过程中气囊持续加压给氧,使药物均匀分布在肺组织内,若无特殊情况,给药6h内避免翻身拍背或吸痰。
1.3 观察指标 (1)疗效判定:参照文献[5]标准分为显效:呼吸困难、三凹征等症状消失,经皮血氧饱和度(SPO2)>90%,X线检查示双肺纹理清晰;有效:呼吸困难、三凹征等症状较治疗前改善,SPO2维持85%~90%,X线检查示异常阴影改善;无效:症状无改善,甚至加重。治疗总有效率=显效率+有效率。(2)氧合功能指标:分别于治疗前、治疗12h、24h采用美国Bio-Rad公司生产的GEM3500型血气分析仪记录两组患儿动脉血氧分压(PaO2)、二氧化碳分压(PaCO2)、pH值及吸入氧浓度(FiO2)的变化情况,并计算氧合指数(PaO2/FiO2)。(3)比较两组机械通气时间、氧疗时间、住院时间。(4)血清炎症因子:分别于治疗前、治疗3d后采集两组患儿静脉血3ml,抗凝处理后,以离心半径10cm,频率:3 500r/min,离心10~15min,取上清于-80℃冰箱保存;采用ELISA法检测Ⅱ型肺泡细胞表面抗原(KL-6)、巨噬细胞移动抑制因子-1(MIF-1)和高迁移率族蛋白1(HMGB-1),试剂盒均购自Abcam公司,操作严格按照试剂盒说明进行。(5)记录两组并发症发生情况。
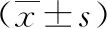
2 结果
2.1 两组疗效比较 高剂量组治疗总有效率为94.74%,高于低剂量组的76.32%(χ2=5.208,P=0.022<0.05)。见表1。

表1 两组疗效比较[n(%)]
2.2 两组治疗前后血气指标及氧合指数比较 治疗前,两组PaO2、PaCO2、pH及PaO2/FiO2水平比较差异无统计学意义(均P>0.05)。治疗12h、24h后,两组PaO2、pH、PaO2/FiO2较治疗前升高,PaCO2较治疗前降低;且高剂量组PaO2、pH、PaO2/FiO2高于同期低剂量组,PaCO2低于同期低剂量组(均P<0.05)。见表2。
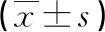
表2 两组治疗前后血气指标及氧合指数比较
2.3 两组治疗时间比较 高剂量组机械通气时间、氧疗时间及住院时间均短于低剂量组(均P<0.05)。见表3。
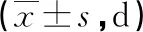
表3 两组治疗时间比较
2.4 两组治疗前后血清炎症因子水平比较 治疗前两组患儿血清KL-6、MIF-1、HMGB-1水平比较,差异无统计学意义(P>0.05);治疗3d后,两组血清KL-6、MIF-1、HMGB-1水平均较治疗前降低,且高剂量组低于低剂量组(P<0.05)。见表4。
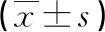
表4 两组治疗前后血清炎症因子水平比较
2.5 两组并发症发生率比较 高剂量组患儿出现呼吸机相关肺炎2例、气胸2例、颅内出血1例,并发症总发生率为13.16%(5/38);低剂量组出现呼吸机相关肺炎4例、气胸3例、颅内出血2例、肺出血1例,并发症总发生率为26.32%(10/38);高剂量组并发症总发生率低于低剂量组(χ2=4.156,P=0.041)。
3 讨论
NRDS是一种由多种因素引起的以肺泡毛细血管损伤及顽固性低氧血症为特征的危重疾病,是导致早产儿死亡的重要原因。目前,NRDS的发病机制尚未完全阐明,多数学者考虑主要与剖宫产、感染、妊娠期糖尿病等多种因素引起先天性PS缺乏及内源性PS分泌异常有关[6-7]。文献资料显示,NRDS发病率与胎龄呈负相关,其中胎龄30~31周发病率约为25%,胎龄≤28周,发病率高达50%[8]。以往临床多采用机械辅助通气与常规支持疗法治疗NRDS,虽能在一定程度上改善患儿肺通气、换气功能,但治疗较局限,预后不佳。
近年来,随着临床研究的不断深入,采用PS代替机械通气治疗NRDS具有显著的疗效。PS是一种动物源性脂蛋白提取物,可调节肺泡表面张力,增加肺泡稳定性,有利于维持不同大小肺泡回缩力平衡,避免肺功能顺应性失衡[9]。但目前,临床关于PS用药剂量尚无统计标准,我国最新《早产儿呼吸窘迫综合征早期防治专家共识》[4]中根据临床表现及PS种类推荐,使用剂量为70~200mg/kg。既往临床研究普遍认为,大剂量PS治疗NRDS效果优于小剂量,如朱影等[10]对79例NRDS患儿给予小剂量PS(100mg/kg)治疗,对82例NRDS患儿给予大剂量PS(200mg/kg)治疗,结果显示,大剂量PS治疗组需氧浓度、辅助通气时间及住院时间均较小剂量组减少。闫燕等[11]用大剂量PS(200mg/kg)治疗25例NRDS患儿,给药1h后FiO2、PaCO2、PaO2/FiO2较给药前明显降低,且低于同期小剂量PS(100mg/kg)治疗组,差异具有统计学意义(均P<0.05),提示大剂量PS的临床效果优于小剂量。马红茹等[12]的研究证实,200mg/kg PS是治疗NRDS最佳初始剂量,可改善NRDS患儿肺通气及氧合功能,降低病死率。
本文结合临床治疗经验,在常规治疗基础上,给予高剂量组患儿大剂量PS(200mg/kg)治疗,低剂量组给予常规剂量PS(100mg/kg)治疗,结果显示,高剂量组治疗总有效率高于低剂量组,机械通气时间、氧疗时间、住院时间均明显短于低剂量组(均P<0.05);治疗后,高剂量组血气分析指标、氧合指数均较低剂量组明显改善(均P<0.05),与既往研究报道一致。提示大剂量PS可明显改善NRDS患儿临床症状及肺功能,提高治疗效果。分析其原因可能是,呼吸过程中,外源性PS容易被肺组织渗液灭活重新出现低氧,而大剂量吸入PS后药效增强且持久,可促进肺泡表面活性物质合成及分泌,增加肺顺应性,调节肺泡表面张力,防止肺泡萎缩,从而改善肺通气、换气功能。KL-6是一种多肽类物质,可用于判断肺泡上皮细胞受损程度。研究表明,血清KL-6表达水平与PaO2/FiO2密切相关[13]。MIF-1参与T细胞增殖过程,可通过抑制单核巨噬细胞迁移作用,激活并促进肿瘤坏死因子α、白细胞介素-6等多种炎性因子表达,从而引起肺泡细胞损伤。HMGB-1是一种促炎因子,具有多种生物学效应,当肺泡表面细胞损伤或坏死时,核内HMGB1可释放至胞外诱导炎性介质释放,从而促进炎症反应向远处转移[14]。本文结果显示,治疗3d后,高剂量组患儿血清KL-6、MIF-1、HMGB-1水平均低于低剂量组(均P<0.05),提示大剂量PS可减轻机体炎症反应,缓解肺泡细胞损伤程度。另外,本文结果还显示,高剂量组并发症总发生率低于低剂量组(P<0.05),提示大剂量PS治疗NRDS安全性良好,能降低并发症发生风险。这一结果可能与大剂量PS治疗缩短了机械通气时间,降低有创操作及细菌侵入引发感染有关。
综上所述,大剂量PS治疗NRDS疗效确切,能有效改善患儿肺通气、换气功能,抑制机体炎症反应,并能降低临床并发症的发生率。本研究尚存在一些不足,如:纳入样本量较少,且均来源于同一家医院,结果可能存在一定偏差;未对大剂量PS治疗NRDS的经济价值进行评估。今后需继续收集病例进行大数据分析,进一步证实上述结论。

