三种水杨醛席夫碱荧光探针的合成及对Zn2+的识别
李中燕 覃海波 朱洪宇 樊 旭 袁 霖
(湖南科技学院化学与生物工程学院,永州 425199)
0 引 言
金属元素广泛存在于环境及生命体当中,有些金属元素对生命体的构成是必不可少的,而有些金属元素则对生物具有高毒性。锌是人体必需的微量元素之一,在调节机体代谢、维持人体正常生理功能等方面有着非常重要的作用,具有“生命的火花塞”“智力之源”等美誉。组成人体的元素有60多种,而锌在人体内的含量约为0.004%,是仅次于铁的第二大微量元素[1-2]。Zn2+在基因表达、金属酶调节、DNA合成和细胞新陈代谢等多种生理过程中均起着重要作用,如果人体内Zn2+代谢紊乱,会导致多种疾病。缺少Zn2+会引起消化不良、食欲不振,缺锌儿童的生长发育受到严重影响而出现缺锌性侏儒症等症状;另一方面,Zn2+过量会导致一些毒性症状和神经退行性疾病,如阿尔茨海默病、帕金森氏病、癫痫症、肌萎缩、家族性脊髓侧索硬化症等[3-5]。因此,设计、合成具有高选择性、高灵敏度的Zn2+荧光探针具有非常重要的意义。
目前,传统的金属离子检测方法主要有色谱法、高效液相色谱法、电化学分析法、原子吸收光谱法和质谱法等[6-9]。但是这些方法都存在一定的局限性,检测时间长、检测成本高等因素限制了其在实际检测工作中的广泛使用。荧光探针作为一种新型的金属离子检测法,具有选择性好、灵敏度高、操作简单、分析效率高、响应用时短、不会损坏样品等诸多其他传统检测方法所没有的优点,在金属离子检测中备受关注,在分析化学、生物化学和医药科学等多个领域里得到了普遍应用[10-13]。
席夫碱类荧光探针由于其合成条件温和且具有良好的配位能力而得到化学工作者的广泛关注[14-18]。我们以水杨醛及其衍生物与三羟甲基氨基甲烷为原料合成了3种新型的荧光探针L1~L3(Scheme 1),并通过光谱实验研究了探针对Zn2+的选择性识别检测。
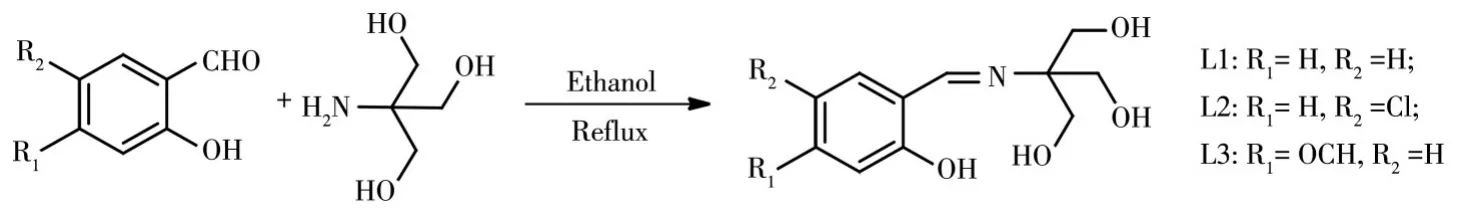
Scheme 1 Synthesis of probes L1-L3
1 实验部分
1.1 仪器与试剂
主要仪器有AVANCE Ⅲ HD 400 MHz核磁共振波谱仪(德国Bruker公司)、UV-2401 PC紫外分光光度计(日本岛津公司)、RF-6000荧光分光光度计(日本岛津公司)、UPH-Ⅲ-10TN超纯水机(四川优普超纯科技有限公司)。
水杨醛(salicylaldehyde)、5-氯水杨醛(5-chlorosalicylaldehyde)、4-甲氧基水杨醛(4-methoxysalicylaldehyde)、三羟甲基氨基甲烷(tris(hydroxymethyl)methyl aminomethane)均为分析纯(上海泰坦科技股份有限公司)。其他试剂均为国产分析纯。所用金属离子为其相应的硝酸盐或盐酸盐。实验用水为超纯水。
1.2 探针L1~L3的合成及表征
探针的合成路线如Scheme 1所示。于50 mL圆底烧瓶中加入水杨醛或取代水杨醛(1 mmol)、三羟甲基氨基甲烷(121 mg,1 mmol)和15 mL无水乙醇,然后在80℃的油浴中加热回流4 h。反应结束后,真空旋转蒸发除去多余溶剂,加入少量乙醇洗涤,抽滤,烘干,得到固体粉末。
L1:淡黄色固体,产率91%。m.p.158~159℃。1H NMR(400 MHz,DMSO-d6):δ14.54(s,1H),8.56(s,1H),7.41(dd,J=7.9,1.6 Hz,1H),7.33~7.18(m,1H),6.87~6.68(m,2H),4.76(s,3H),3.62(d,J=4.3 Hz,6H)。13C NMR(101 MHz,DMSO-d6):δ164.91,163.84,132.81,132.62,118.92,117.87,117.58,67.50,61.78。元素分析按C11H15NO4的计算值(%):C 58.66,H 6.71,N 6.22;实验值(%):C 58.23,H 6.93,N 6.01。HRMS按 C11H15NO4的计算值(m/z):226.107 9[M+H]+;实验值:226.108 0。
L2:橙色固体,产率96%。m.p.145~146℃。1H NMR(400 MHz,DMSO-d6):δ14.71(s,1H),8.54(s,1H),7.52(d,J=2.7 Hz,1H),7.28(dd,J=9.0,2.7 Hz,1H),6.77(d,J=9.0 Hz,1H),4.84(s,3H),3.61(s,6H)。13C NMR(101 MHz,DMSO-d6):δ164.43,164.10,132.92,131.57,120.63,119.96,119.16,67.55,61.51。元素分析按 C11H14ClNO4的计算值(%):C 50.88,H 5.43,N 5.39;实验值(%):C 50.64,H 5.66,N 5.12。HRMS 按 C11H14ClNO4的计算值(m/z):260.069 0[M+H]+;实验值:260.069 3。
L3:浅棕色固体,产率90%。m.p.141~142℃。1H NMR(400 MHz,DMSO-d6):δ14.20(s,1H),8.27(s,1H),7.16(d,J=8.8 Hz,1H),6.11(dd,J=8.8,2.4 Hz,1H),6.04(d,J=2.4 Hz,1H),5.02(s,3H),3.71(s,3H),3.61(s,6H)。13C NMR(101 MHz,DMSO-d6):δ174.80,165.50,162.46,135.07,111.32,105.33,102.35,65.56,61.40,55.41。元素分析按C12H17NO5的计算值(%):C 56.46,H 6.71,N 5.49;实验值(%):C 56.21,H 6.90,N 5.25。HRMS 按 C12H17NO5的计算值(m/z):256.118 5[M+H]+;实验值:256.118 8。
1.3 光谱性质测试
将探针L1~L3溶于乙醇制得探针储备液(2 mmol·L-1)。配制金属离子(Na+、K+、Ag+、Ca2+、Ba2+、Co2+、Ni2+、Pb2+、Zn2+、Cu2+、Sn2+、Fe3+、Cr3+、Al3+)储备液(2 mmol·L-1)用于金属离子的选择性检测。将4-羟乙基哌嗪乙磺酸(HEPES)溶于超纯水中制备0.1 mg·mL-1的溶液,并用稀HCl和NaOH调节至pH=7.47,作为缓冲溶液。检测体系为EtOH-H2O(9∶1,V/V,pH=7.47)。
进行荧光滴定实验时,移取20 μL探针储备液(2 mmol·L-1),加入适量的Zn2+和缓冲溶液,然后加入乙醇定容至2 mL,荧光光谱测定条件:λex=381 nm,λem=390~650 nm,激发/发射狭缝宽度为3 nm/3 nm。紫外可见吸收滴定实验:移取20 μL探针储备液(2 mmol·L-1),加入适量的Zn2+和缓冲溶液,然后加入乙醇定容至2 mL,测定UV-Vis吸收光谱。
1.4 单晶X射线衍射
为研究探针L2与Zn2+离子的结合方式,制备了配合物L2-Zn2+晶体。于50 mL圆底烧瓶中加入探针L2(518 mg,2 mmol)、醋酸锌(183 mg,1 mmol)和 15 mL无水乙醇,然后在80℃的油浴中加热回流1 h。反应结束后静置冷却,24 h后有淡黄色晶体析出。选取尺寸为0.40 mm×0.38 mm×0.34 mm的配合物L2-Zn2+晶体,置于Bruker APEX Ⅱ CCD单晶衍射仪上,在室温下进行单晶X射线衍射分析,采用经石墨单色化的MoKα辐射(λ=0.071 073 nm)作为衍射光源。数据收集、晶胞确定、数据还原和吸收校正通过multi-scan进行,并通过SIR2004的直接方法求解结构。对全部非氢原子坐标及其各向异性热参数用SHELXL-97程序进行全矩阵最小二乘法修正;氢原子均为理论加氢。配合物L2-Zn2+的晶体学数据见表1。
CCDC:2121021,L2-Zn2+。

表1 配合物L2-Zn2+的晶体学数据Table 1 Crystallographic data of complex L2-Zn2+
2 结果与讨论
2.1 探针L2与L2+Zn2+的UV-Vis吸收光谱
探针L2分子中亚胺上的N和酚羟基中的氧原子均易与Zn2+配位,导致分子刚性增强,从而引起探针L2光谱性质的变化。在EtOH-H2O(9∶1,V/V,pH=7.47)中对L2的UV-Vis光谱性质进行了研究,如图1所示。探针L2本身在333和414 nm处有2个吸收带,随着加入的Zn2+浓度增加,L2在414 nm处的吸光度下降,而370 nm处的吸光度增大,且在333和400 nm处出现等吸收点,表明L2与Zn2+形成配合物。UV-Vis吸收光谱吸收带红移的原因可能是探针L2与Zn2+配合后,使得L2分子中C=N异构化受阻,增加了分子的刚性和体系的共轭程度。
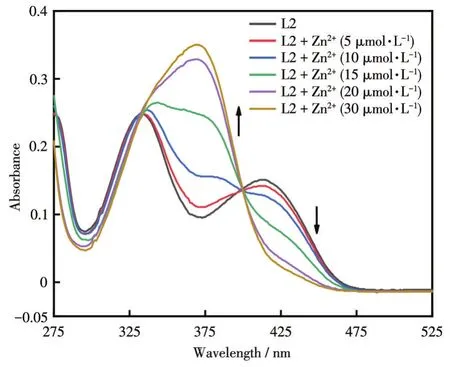
图1 不同浓度Zn2+存在时探针L2的UV-Vis吸收光谱Fig.1 UV-Vis absorption spectra of L2 in the presence of Zn2+with different concentrations
2.2 探针L2与L2+Zn2+的荧光光谱
如图2所示,在前述的荧光光谱测试条件下,探针L2本身几乎没有荧光,这可能是因为探针L2分子中存在C=N双键异构化,加剧了激发态下的非辐射跃迁,使探针本身几乎不发射荧光。随着Zn2+的加入,探针L2在462 nm处的荧光强度显著增强,发出强的蓝色荧光,荧光强度增强高达88倍,这可能是由于探针分子与Zn2+结合,使得探针分子的异构化受阻,同时增加了分子的刚性,产生螯合型荧光增强,由此可实现对Zn2+的识别检测。

图2 Zn2+对探针L2荧光光谱的影响Fig.2 Effect of Zn2+on fluorescence spectra of probe L2
如图3所示,荧光滴定实验表明,在0~20 μmol·L-1范围内,随着加入的Zn2+浓度的升高,体系的荧光强度不断增强,在16~20 μmol·L-1范围内,462 nm处的荧光强度趋于稳定。而且体系的荧光强度与Zn2+的浓度在 0~10 μmol·L-1范围内具有良好的线性关系(图4),相关系数为 0.987 34,检出限为11.96 nmol·L-1,远低于国标GB5749-2006《生活饮用水卫生标准》规定的饮水中Zn2+的限量值1.0 mg·L-1(约15 μmol·L-1),说明探针L2可以高效识别检测Zn2+。

图3 不同浓度Zn2+存在时探针L2的荧光光谱Fig.3 Fluorescence spectra of probe L2 in the presence of Zn2+with different concentrations
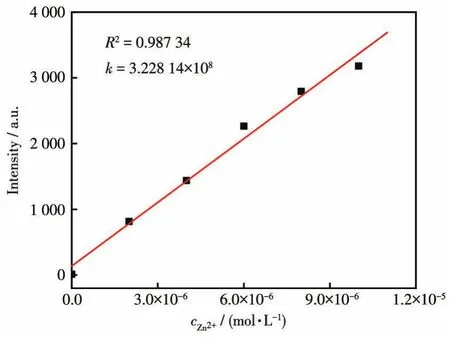
图4 Zn2+浓度与探针L2荧光强度的线性关系Fig.4 Linear relationship between the concentration of Zn2+and the fluorescence intensity of probe L2
2.3 pH对荧光强度的影响
在前述的荧光光谱测试条件下,考察了pH对探针L2及L2+Zn2+的荧光光谱的影响。如图5所示,探针L2本身的荧光强度非常弱,而且pH对L2的荧光强度几乎没有影响。而探针L2+Zn2+体系的荧光强度受pH影响较大,在pH=7.0~8.0时体系荧光强度最大且基本不受溶液酸碱度的影响;当pH<7.0或pH>8.0时荧光强度会迅速降低。这可能是体系酸性过大时会导致C=N基团的分解,而碱性过大时会使体系中的Zn2+形成Zn(OH)2,两者都不利于探针L2与Zn2+的配合。L2+Zn2+体系在pH=7.47时荧光强度最强,故选择测试pH=7.47,缓冲体系为HEPES缓冲液。

图5 pH对探针L2(10 μmol·L-1)和L2+Zn2+体系荧光强度的影响Fig.5 Effect of pH on the fluorescence intensities of probe L2 and L2+Zn2+system
2.4 离子选择性和抗干扰性
考察了采用探针L2检测Zn2+的选择性。如图6所示,在含有10 μmol·L-1探针L2的EtOH-H2O(9∶1,V/V,pH=7.47)体系中分别加入 20 μmol·L-1的 Na+、K+、Ag+、Ca2+、Ba2+、Co2+、Ni2+、Pb2+、Zn2+、Cu2+、Sn2+、Fe3+、Cr3+和Al3+,只有Zn2+能使探针L2的荧光强度显著增强,表明探针对Zn2+有特异性响应。进一步考察了共存离子的影响,除了Cu2+和Ni2+,其他离子对体系荧光强度的影响不明显。Cu2+和Ni2+会明显减弱体系的荧光,可能是由于这2种离子具有顺磁性,能够与配体发生电子或能量转移而导致荧光猝灭。但是这2个体系依然具有较强的荧光强度,分别是探针L2荧光强度的7.5倍和11.2倍,这表明探针L2在上述共存离子存在下可以有效地选择性识别检测Zn2+。

图6 探针L2对金属离子的选择性,以及Zn2+与其他金属离子共存时L2在462 nm处的荧光强度Fig.6 Selectivity of probe L2 for metal ions and the fluorescence intensity of L2 at 462 nm when Zn2+coexists with other metal ions
2.5 探针L2与Zn2+的结合模式
图7为利用等物质的量连续变换法测定的结合比曲线,据此可以确定探针L2与Zn2+的结合比为2∶1。

图7 探针L2与Zn2+相互作用的Job图Fig.7 Job′s plot for interaction between L2 and Zn2+
进一步运用核磁滴定法探究了L2与Zn2+的结合模式。将L2溶于DMSO-d6,并加入等量的Zn2+,结果如图8a、8b所示,酚羟基在δ=14.71的质子峰(H1)消失,发生去质子化,亚胺的质子峰(H2)由δ=8.56移动到8.29,苯环上的质子峰(H3、H4、H5)均向高场发生了移动,羟甲基中的羟基质子峰变宽且向低场移动。由此可见,探针L2中的亚胺N原子、酚羟基中的氧原子与羟甲基中的氧原子参与了L2与Zn2+的配位。综上所述,根据等物质的量连续变换法及核磁滴定结果,推断L2与Zn2+可能的结合模式如图8c所示。

图8 (a)L2+Zn2+和(b)单独的L2的1H NMR谱图;(c)L2与Zn2+可能的结合模式Fig.8 1H NMR spectra of(a)L2+Zn2+and(b)L2 only;(c)Proposed binding mode of L2 and Zn2+
为了进一步研究探针L2与Zn2+的结合模式,我们在乙醇溶液中培养了配合物L2-Zn2+的晶体。配合物L2-Zn2+的晶体结构如图9所示。结构分析显示,探针L2与Zn2+以物质的量之比2∶1配位,探针L2中的C=N基团中的N原子、酚羟基中的氧原子以及羟甲基中的氧原子均参与了L2与Zn2+的配位,同时酚羟基发生了去质子化,这也与核磁数据相吻合。
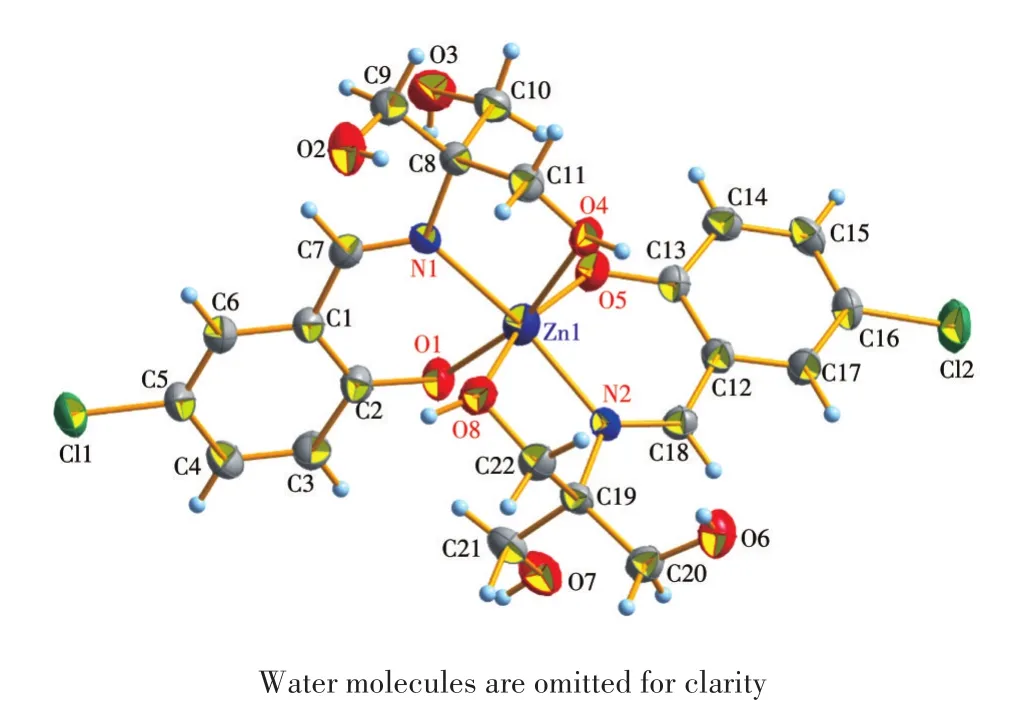
图9 L2-Zn2+的50%概率晶体结构椭球图Fig.9 Crystal structure of L2-Zn2+shown as ellipsoids with 50% probability
2.6 取代基对探针L1~L3荧光光谱的影响
为了探究取代基(H、Cl、OCH3)对探针荧光性能的影响,考察了探针L1~L3对Zn2+的荧光响应性,如图10所示。结果表明,含Cl原子的探针L2的荧光响应最强,其次是无取代基的探针L1,含OCH3基团的探针L3最弱。这可能是因为中间体M的稳定性与探针中取代基的电负性有关:M(Cl)>M(H)>M(OCH3),而中间体M越容易生成就越有利于探针与Zn2+的结合,与图8c所示的结合模式相吻合。

图10 探针L1~L3对Zn2+的荧光响应Fig.10 Fluorescence response of L1-L3 to Zn2+
2.7 水样中Zn2+的检测
以自来水和潇水河水为研究对象,测试了探针L2对实际水样中Zn2+的检测效果,如表2所示,2种水样的加标回收率分别为99.2%~102.5%和100.8%~104.3%,相对标准偏差(RSD)均小于5%。数据表明探针L2可以用于实际水样中Zn2+的检测。

表2 L2对自来水和河水中的Zn2+的检测Table 2 Determination of Zn2+by L2 in tap water and river water
3 结 论
以取代水杨醛和三羟甲基氨基甲烷为原料,通过简单的反应合成了3种新型的席夫碱类荧光探针探针L1~L3,其中探针L2对Zn2+表现出出色的选择性和灵敏度。探针L2与Zn2+可形成配合物引起体系荧光增强,发出明亮的蓝色荧光,检出限为11.96 nmol·L-1。通过1H NMR 等方法对L2 与Zn2+的结合模式进行了探索。结果表明,探针L2中的亚胺N原子、酚羟基中的氧原子与羟甲基中的氧原子参与了L2与Zn2+的配位。配合物L2-Zn2+的单晶结构和Job曲线证实探针L2与Zn2+以物质的量之比2∶1配位。同时,探针L2在实际水样中的性能测试表明该探针在检测环境中的Zn2+方面具有潜在的应用价值。
- 无机化学学报的其它文章
- La-Doped BaSnO3/Multi-walled Carbon Nanotube Modified Separator:Synthesis and Application in Lithium-Sulfur Battery
- Co(Ⅱ)/Ni(Ⅱ) Coordination Polymer of Isomeric Terphenyl-2,2″,4,4″-tetracarboxylic Acids with a Single Water Bridge:Syntheses,Structures,and Magnetic Properties
- Micromotors Based on Ni-Mn Binary Oxide and Its Application for Effective Dye Adsorption
- Direct Synthesis of Dimethyl Carbonate from CO2 and Methanol by Mg-Doped Ceria Monolithic Catalyst
- Hydrogen Storage Capabilities of the Low-Lying Ca2B4Clusters
- 盘状镝簇合物的合成及缓慢磁弛豫

