不同纵横比一水草酸钙晶体的合成、表征、吸附性能及其对肾上皮细胞的毒性差异
程小燕 徐 猛 欧阳健明
(暨南大学化学与材料学院,生物矿化与结石病防治研究所,广州 510632)
0 引 言
肾结石是最常见的疾病之一,世界上大约有10%的人正遭受到肾结石带来的痛苦[1]。肾结石形态的多种多样与其化学成分密切相关。草酸钙(CaC2O4)是肾结石的主要成分,其中一水草酸钙(COM)的发生率是二水草酸钙(COD)的2倍左右[2]。CaC2O4结石可呈鹿角状、不规则形和桑葚样。
CaC2O4肾结石的形成是一个与晶体成核、生长、聚集和黏附密切相关的复杂的生物调控过程,其形成机制至今尚未被完全阐明[3]。肾小管上皮细胞(REC)损伤是促进CaC2O4结石形成的一个重要诱因[4],损伤的细胞不但为晶体成核提供了有效位点,而且增强了细胞膜与矿物微晶的黏附,加速肾结石形成。COM对肾小管上皮细胞的损伤大于COD。
尿液中的各种蛋白影响CaC2O4结石的形成[5]。尿液中不但存在带负电荷的蛋白质如Tamm-Horsfall蛋白、凝血酶原、人血清白蛋白、糖蛋白、骨桥蛋白等,还存在带正电荷的蛋白如组织蛋白酶G、嗜酸性细胞阳离子蛋白和髓过氧化物酶前体等。肾结石的形成还与尿液中的微晶密切相关,尿液中的COM微晶有拉长六边形、圆形、菱形和不规则形。由于个体的差异及饮食等生活习惯的差异,导致肾管液中结石盐的过饱和度、pH和抑制剂浓度及生物大分子等存在差异;此外,尿微晶滞留在尿液中的时间不同,也会导致不同尺寸、不同晶相、不同形貌的尿微晶生成[6-7]。但目前这些不同性质的晶体对肾小管上皮细胞的毒性差异仍不清楚。
生物大分子在生物晶体形成中具有指导作用。由于原位研究生物矿化过程存在一定的困难,人们常常采用模拟体系在体外模拟生物矿物的形成[8]。Chen等[9]利用明胶作为辅助模板合成了具有良好分散性的片状ZSM-5沸石,体系中明胶浓度变化会影响明胶链的展开和体系pH的变化,从而影响晶体的形貌、尺寸等。晶体的生成与体系温度、pH、搅拌速度、环境和剪切力等密切相关。根据经典的Ostwald熟化理论,晶体形成的驱动力是粒子相总表面积的降低,即产生的总界面自由能的降低,由于小尺寸粒子比表面积(即吉布斯自由能)高于大尺寸粒子,因此小尺寸粒子在熟化过程中会向大粒子沉积[10]。Pitto等[11]研究了温度对晶体生长的影响,发现反应温度越高,晶体越容易出现团簇,生长的速度也越快,尺寸越大。随着溶液搅拌速度增加,颗粒发生旋转,剪切力增大,溶质均匀分布在颗粒周围,会增加成核并抑制生长,获得小尺寸的颗粒[12]。
晶体尺寸的不同会导致晶体聚集程度、与细胞的接触面积、细胞毒性等发生变化。姚菊明等[13]通过控制反应溶液的pH和运用水热法、化学沉淀法合成了3种不同长径比的纳米磷酸钙颗粒:长径比约为6∶1的棒状磷酸钙、3∶1的梭状磷酸钙和球形磷酸钙。实验表明长径比的差异会造成磷酸钙颗粒比表面积、晶面化学组分及与细胞间接触面积的不同,导致对蛋白质的吸附存在差异,进而影响了与细胞的黏附和增殖。Tamura等[14]研究了不同尺寸Ti对嗜中性粒细胞的毒性差异,大尺寸的Ti颗粒(10、45和150 μm)对细胞损伤较小,也无法进入细胞,而2 μm的小尺寸Ti对细胞的损伤显著增加,导致细胞超氧化物阴离子、乳酸脱氢酶(LDH)、肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)的表达量明显增加。
为了探究尿液中不同尺寸、不同形貌尿微晶对肾结石形成的影响,我们合成4种具有不同长宽比的COM晶体,并比较研究了其对正常人肾近端上皮细胞(HK-2)的损伤能力差异,期望为进一步阐明肾结石形成机理、抑制肾结石形成提供新的启示。
1 实验部分
1.1 试剂与仪器
明胶为生物试剂。孔径0.22 μm的有机系微孔滤膜购自上海兴亚公司。胎牛血清、细胞培养基(DMEM/F-12)、胰酶均购自Gbico生化产品有限公司(北京)。CCK-8细胞活性检测试剂盒(日本同仁化学研究所)和Annexin V-FITC/PI细胞凋亡试剂盒均购自凯基生物(Keygen)技术有限公司。活性氧(ROS)检测试剂盒、4,6-二脒基-2-苯基吲哚(DAPI)染色液、牛血清白蛋白(BSA)、4%多聚甲醛均购自上海碧云天生物技术有限公司。其他常规试剂为分析纯试剂,实验用水为蒸馏水。
主要仪器有XL30型环境扫描电子显微镜(SEM,荷兰Philips公司)、D/max2400X射线粉末衍射仪(XRD,日本理学)、傅里叶变换红外光谱仪(FT-IR,美国Nicolet公司)、Nano-ZS型纳米粒度和ζ电位分析仪(英国Malvem公司)、Tristar 3000比表面积及孔隙度分析仪(美国Micromeritics公司)。
1.2 不同长宽比COM的合成
COM-1∶2:取8 g明胶加20 mL水,加热至完全溶解,离心除去明胶中的杂质,配成400 mL的明胶溶液(ρgelatin=20 mg·mL-1)。在 37 ℃下向上述明胶溶液中加入 20 mL 20 mmol·L-1的 K2C2O4溶液,并加入10 mL 0.5 mol·L-1的NaCl溶液维持离子强度。搅拌10 min,然后在快速搅拌(900 r·min-1)下加入 20 mL 20 mmol·L-1的 CaCl2溶液,继续搅拌反应 10 min,取出溶液于室温中静置过夜,离心分离得到下层晶体,用蒸馏水和无水乙醇各洗涤3次,于55℃的烘箱中干燥,得到晶体。
COM-1∶3:取2 g明胶,在55 ℃反应5 min,搅拌速度600 r·min-1,其他同COM-1∶2合成。
COM-1∶4:取0.2 g明胶,在70 ℃反应5 min,搅拌速度600 r·min-1,其他同COM-1∶2合成。
COM-1∶5:取0.2 g明胶,在75 ℃反应5 min,搅拌速度300 r·min-1,其他同COM-1∶2合成。
1.3 合成晶体的SEM、XRD和FT-IR表征
SEM表征:将各尺寸的COM晶体分别分散在无水乙醇中,配成0.10 mg·mL-1的悬浮液,超声5 min后,点样在10 mm×10 mm的玻片上,真空干燥后喷金,在SEM下观察。工作条件:电压为5.00 kV,工作距离为5~10 nm,放大倍数为10 000。
XRD表征:取20 mg晶体放入测量XRD的专用凹槽中,用洁净载玻片压实后上机测试。测试条件:CuKα射线,石墨单色器,30 kV,25 mA,扫描范围5°~60°,扫描速度8(°)·min-1。
FT-IR表征:称取5 mg晶体和200 mg的KBr,在玛瑙钵中研磨混匀,压片后在红外光谱仪上检测。扫描范围为4 000~400 cm-1,分辨率为0.5 cm-1。
1.4 晶体的N2吸附-脱附等温线测定
先将各晶体在80℃进行脱气预处理,然后在温度77 K(-196℃)下进行吸附-脱附实验,以高纯N2为吸附质。对脱气前后晶体的XRD检测表明,测试过程中COM晶体未发生晶相转化或分解。样品比表面积(SBET)采用BET(Brunauer-Emmet-Teller)方程计算。
1.5 培养液中各晶体ζ电位检测
称取各COM晶体分别分散在pH=7.3的培养液中,配成 0.10 mg·mL-1的溶液,超声 5 min,在恒温(25℃)下采用纳米粒度和ζ电位分析仪检测晶体的ζ电位。
1.6 细胞培养和晶体损伤前后的细胞活力检测
HK-2用含10%胎牛血清的DMEM培养液在37℃、CO2体积分数5%和饱和湿度下培养。细胞传代采用胰蛋白酶消化法。当细胞达80%~90%融合后用磷酸盐缓冲液(PBS)洗涤2次,加入0.25%胰酶-EDTA消化液,置于37℃培养箱中3~5 min,在倒置显微镜下观察消化程度。消化适度后,加入10%胎牛血清的DMEM培养液终止消化,充分吹打分散细胞,形成单细胞悬液。
将上述单细胞悬液按浓度为1.0×105mL-1、每孔100 μL接种于96孔培养板孵育24 h后,改用无血清的DMEM培养液孵育12 h,使细胞同步化,吸除培养液,用PBS洗涤细胞2次。将实验模型分为2组:(A)对照组,只加入无血清培养液;(B)COM晶体处理组,分别加入长宽比为 1∶2、1∶3、1∶4和1∶5的COM晶体(200 μg·mL-1,用无血清培养液配制)。每个实验重复3孔。孵育6 h后,每孔加入10 μL的CCK-8试剂,孵育4 h,用酶标仪在450 nm处测量吸光度(A),求得3个复孔A值的平均值。细胞活力(cell viability)用以下公式计算:Rcell=At/Ac×100%,其中Rcell表示活细胞率,即细胞活力;At为晶体处理组的吸光度;Ac为对照组的吸光度。
1.7 透明质酸(HA)表达检测及HA荧光强度的定量分析
细胞按浓度1.0×105mL-1、每孔1 mL接种于12孔培养板。待细胞同步化后,将细胞按1.6节所述分组。孵育6 h后吸除上清液,用PBS洗涤细胞2次,加入固定液(由5%冰醋酸、10%福尔马林和70%酒精组成)固定细胞20 min,用PBS洗涤细胞3次。再加入100 μL 5 μg·mL-1的bHABP溶液(用3%牛血清白蛋白溶液配制,现用现配),4℃条件下孵育过夜。用PBS洗涤细胞3次,每次5 min。再加入100 μL FITC-avidin(异硫氰酸荧光素-亲和素)孵育细胞1 h,用PBS洗涤细胞3次。加入DAPI染色液复染4 min,PBS洗涤细胞后用抗淬灭剂封片,于共聚焦显微镜下观察。
HA定量分析:HA的荧光强度根据仪器附带的Axiovision软件(ZEISS,德国)确定,每个样品对100个细胞的HA进行定量检测,取平均值。
1.8 荧光显微镜观察晶体损伤前后细胞中ROS水平
细胞分组同上。到达作用时间后,吸除上清液,用 2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)在37℃染色30 min,用PBS清洗3次以去除未进入细胞内的DCFH-DA,在荧光显微镜下观察。
1.9 流式细胞仪检测细胞凋亡和坏死
细胞分组同上。用0.25%胰酶消化后加入10%胎牛血清的DMEM/F-12培养液使细胞悬浮,然后离心(1 000 r·min-1,5 min),吸除上清液后用PBS洗涤2遍,重新离心得到细胞沉淀。加入200 μL PBS重悬,1 000 r·min-1离心5 min后弃去上清液。加入200 μL binding缓冲溶液混匀,加 5 μL Annexin VFITC在室温避光条件下孵育10 min,离心(1 000 r·min-1)5 min后弃去上清液;加入200 μL binding缓冲溶液混匀,再加5 μL PI后采用流式细胞仪进行检测。
1.10 细胞表面黏附晶体的SEM观察
细胞分组同上。达到黏附时间后,吸除上清液,用PBS洗涤3次,加入2.5%的戊二醛,于4℃固定细胞24 h后再用1% OsO4溶液固定,接着用PBS洗涤3次,梯度乙醇(30%、50%、70%、90%和100%)脱水,最后用乙酸异戊酯固定后马上采用CO2临界干燥,喷金包被。在SEM下观察晶体的黏附情况。
2 结 果
2.1 不同长宽比拉长六边形COM晶体的合成
通过改变反应温度、搅拌速度和控制添加剂的比例(表1),得到了长宽比分别为1∶2、1∶3、1∶4和1∶5的COM晶体(图1),依次命名为COM-1∶2、COM-1∶3、COM-1∶4和 COM-1∶5。晶体的长度分别为(3±0.3)μm、(5.2±0.3)μm、(7.0±0.7)μm和(8.8±1.2)μm,但晶体宽度相近。随着晶体尺寸增大,晶体(101)面被拉长,长宽比也由1∶2增大到约1∶3、1∶4和1∶5(图2)。

表1 不同长宽比COM晶体的合成条件及其部分理化性质Table 1 Synthesis conditions and some physical and chemical properties of COM crystals with different aspect ratiosa

图1 不同长宽比六边形COM晶体SEM照片Fig.1 SEM images of hexagonal COM crystals with different aspect ratios

图2 不同长宽比COM晶体的示意图Fig.2 Schematic diagram of COM with different aspect ratios
影响COM晶体尺寸和长宽比的因素包括:
(1)反应温度。反应温度越高,生成的晶体越长。合成COM-1∶2、COM-1∶3、COM-1∶4和COM-1∶5的反应温度依次为37、55、70和75℃,当温度升高时,晶体的成核速率下降,生长速率增加[11],从而导致晶体数量减少,晶体的尺寸增加。
(2)搅拌速度。搅拌速度越大,生成的晶体尺寸越小。合成上述4个晶体的搅拌速度分别为900、600、600和300 r·min-1,搅拌速度增加后,成核速率增大[12],形成的晶核数量增加,晶体尺寸减小。
(3)添加剂明胶的影响[9]。随着明胶质量浓度减小,COM被拉长,晶体的长宽比由1∶2增大至1∶5。线状大分子明胶是胶原蛋白的降解产物,其主链由不同氨基酸通过肽键链接而成,侧链含有大量—OH、—NH2和—COOH等极性基团,明胶分子形成的网状结构可以有效构建仿生环境下生物晶体的合成[8]。在COM合成过程中,明胶先通过其—COOH与Ca2+配位,再与晶体表面暴露的草酸根形成“钙桥”(图3B),完成在初始晶核表面的吸附过程。COM不同晶面的C2O42-密度大小为(101)(5.42 nm-2)>(120)(4.29 nm-2)>(010)(3.30 nm-2)[15],因此,明胶主要结合在C2O42-密度高的(101)和(120)晶面,从而抑制其(101)晶面沿着[100]方向生长和(120)晶面沿着[120]方向生长[16]。当明胶质量浓度较高(20 mg·mL-1)时,抑制作用较为明显,导致COM晶体变薄,长宽比较小,形貌为薄的平板状六边形(图3C)。当明胶质量浓度降低至0.5 mg·mL-1时,对COM晶体沿着这2个方向的抑制作用减小,(120)晶面沿着[120]方向生长,(101)面沿着[001]方向逐渐被拉长,棱角变得尖锐,形貌演变为拉长的六边形(图3D)。
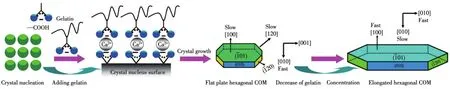
图3 不同长宽比COM晶体生长示意图:(A)COM晶核;(B)吸附在COM特定晶面的明胶分子;(C)六边形COM;(D)拉长六边形COMFig.3 Schematic diagram of crystal growth of COM with different aspect ratios:(A)COM crystal nuclei;(B)gelatin molecules adsorbed on specific crystal planes of COM;(C)hexagonal COM;(D)elongated hexagonal COM
2.2 COM晶体的XRD和FT-IR表征
图4A为制备的不同长宽比COM晶体的XRD图。主要检测到的衍射峰的晶面间距d=0.593、0.365、0.296、0.235和0.197 nm,分别归属于COM的(101)、(020)、(202)、(130)和(303)晶面(PDFNo.20-231)[17]。这些XRD图均没有除COM晶体以外的杂峰。

图4 四种不同长宽比COM晶体的(A)XRD图和(B)FT-IR谱图:(a)COM-1∶2;(b)COM-1∶3;(c)COM-1∶4;(d)COM-1∶5Fig.4 (A)XRD patterns and(B)FT-IR spectra of four COM crystals with different aspect ratios:(a)COM-1∶2;(b)COM-1∶3;(c)COM-1∶4;(d)COM-1∶5
随着晶体长宽比增加,COM的(101)和(010)晶面强度比值(I101/I010)逐渐减小(表1)。其原因可能是随着晶体尺寸的增大,晶体的厚度逐渐增加,(010)晶面增大。从图2亦可以看出,COM-1∶2晶体较薄,(010)晶面所占的面积比例也较小;而COM-1∶4和COM-1∶5晶体变厚,(010)晶面所占的面积比例增加。根据晶体生长的择优取向性[18],晶体沿着[100]方向生长趋势增强,(010)晶面变大(图2d),即I101/I010也逐渐减小。
图4B为不同长宽比COM的FT-IR谱图,4种COM均呈现典型的COM特征吸收峰[5]。各晶体在3 047~3 485 cm-1区间有5个小峰,归属于COM结晶水中O—H振动。COM中的羧基(COO-)不对称伸缩振动(νas)和对称伸缩振动(νs)分别在 1 620 和 1 319 cm-1附近。在指纹区,COM晶体的吸收带出现在780、661和514 cm-1左右。
XRD和FT-IR分析结果表明,所合成的草酸钙均为单一的COM晶体。
2.3 不同长宽比COM的比表面积
图5为各COM晶体对N2的吸附-脱附等温线。这些曲线在高压部分(p/p0>0.85)仅有1.5~6.0 cm3·g-1的略微突跳,说明这些COM晶体是无孔材料。因为这种突跳通常是颗粒间堆积产生的间隙所致,而非材料中存在的介孔(2~50 nm)结构所贡献。SEM图像(图1)也表明各COM不存在大的介孔。经计算,各COM晶体的比表面积为2~5 m2·g-1,如此低的比表面积亦说明COM晶体是一种无孔材料,即比表面积主要是由晶体外表面所贡献。晶体尺寸越大,晶体的比表面积越小(表1)。例如,COM-1∶2的比表面积是5 m2·g-1,而COM-1∶5减小至2 m2·g-1。
2.4 不同长宽比COM在培养基中的ζ电位
分散在培养液中的各晶体的ζ电位值均是负值(-9.93~-16.2 mV,表1),且随着晶体长宽比的增加,ζ电位的绝对值不断增大,这有利于抑制晶体在溶液中的聚集。其原因是:晶体长宽比增加后,其带正电荷的(101)晶面所占晶体表面积的百分比相对变小(表1中I101/I010值),晶体表面吸附的培养液中带负电荷的物质(如氨基酸和蛋白质等)减少,因此ζ电位绝对值变小。
2.5 不同长宽比COM对HK-2活力和HA表达量的影响
采用CCK-8法检测了各COM晶体对HK-2的氧化性损伤。如图6A所示,相比于对照组,COM-1∶2对细胞的损伤最为明显,造成了HK-2约80.1%的损伤。各COM晶体对HK-2损伤大小依次为COM-1∶2>COM-1∶3>COM-1∶4>COM-1∶5。

图6 不同长宽比COM引起的HK-2活力变化和细胞表面HA表达量变化:(A)细胞活力;(B)对HA的荧光显微镜观察;(C)HA表达量柱状图Fig.6 Changes of cell viability and HA expression on HK-2 surface caused by COM with different aspect ratios:(A)cell viability;(B)fluorescence microscope observation;(C)histogram of HA expression
HA是肾上皮细胞膜表面的主要黏附分子之一,在细胞受到损伤时将上调HA的量。相比于对照组,各COM均导致了HA表达量的增加(图6B中绿色),且COM-1∶2引起的HA表达最强,COM-1∶5最弱(图6C)。
2.6 不同长宽比COM对ROS水平的影响
ROS能够迅速与细胞内大分子反应,导致正常细胞功能损害,最终导致细胞死亡。这种氧化损伤的细胞能够促进草酸钙晶体在肾脏部位的沉积[19]。图7A为采用DCFH-DA荧光探针测量的不同长宽比COM晶体诱导HK-2细胞产生的ROS情况。可以看出,各组细胞的ROS荧光强度为COM-1∶2>COM-1∶3>COM-1∶4>COM-1∶5>对照组,即COM-1∶2表现出更高的细胞损伤,引起了更多的ROS产生。

图7 不同长宽比COM引起的HK-2的ROS水平、细胞凋亡和坏死变化:(A)ROS水平;(B)Annexin V/PI双染法定量检测细胞凋亡和坏死的散点图;(C)总的死细胞(Q1+Q2+Q4)比例(rt)Fig.7 Changes in ROS expression,apoptosis and necrosis induced by COM crystals with different aspect ratios:(A)ROS on HK-2 surface;(B)dot plots of cellular apoptosis and necrosis detected quantitatively by annexin V/PI double staining;(C)ratio of total dead cells(Q1+Q2+Q4)(rt)
2.7 流式细胞仪检测细胞的凋亡和坏死
采用Annexin V/PI双染法并通过流式细胞术对凋亡和坏死细胞进行了定量检测(图7B)。对照组总的死细胞(Q1+Q2+Q4)比例为1.7%。而COM-1∶2、COM-1∶3、COM-1∶4和COM-1∶5与细胞作用6 h后,分别导致了19.4%、18.4%、15.9%和11.1%的细胞死亡(图7C)。
2.8 不同长宽比COM与HK-2黏附的SEM观察
图8为不同长宽比COM与正常HK-2孵育6 h后的SEM观察结果。在细胞表面特别是细胞的边侧黏附有COM晶体。由于细胞与晶体之间存在相互作用,细胞表面晶体的形状与初始晶体(图1)存在一定的差异,但晶体的长度变化不大。

图8 HK-2与不同长宽比COM晶体黏附后的SEM图像Fig.8 SEM images of HK-2 adhered to COM crystals with different aspect ratios
从图8可以看出,受到COM晶体损伤的细胞明显收缩,表面变得粗糙,有颗粒状物质出现,归因于细胞中的蛋白质、脂类和糖等物质附着。相比之下,没有黏附晶体的对照组细胞表面光滑平整。部分COM晶体与细胞黏附后存在聚集现象,这是由于被晶体损伤后的细胞表达的带负电荷的黏附分子不但能够促进晶体黏附,而且还促进晶体的聚集。
3 讨 论
3.1 不同尺寸COM晶体对HK-2的损伤模型
不同长宽比COM对HK-2产生损伤作用的机理:当处在培养液中的COM晶体与HK-2作用时,会引起细胞皱缩、细胞核变小(图8)、细胞膜和溶酶体破裂;COM晶体引起NADPH氧化酶的激活,进而诱发·O2-产生,·O2-的过量产生可以造成线粒体的功能紊乱甚至衰竭、线粒体膜电位下降,引起ROS的生成(图7A);而ROS可以介导一系列炎症的发生,激活许多信号分子如p38细胞分裂素活化蛋白激酶(p38MAPK)、蛋白N-末端激酶(JNK)和转录因子NF-кB等[20]。一系列的级联反应最终使得细胞功能受损,引起细胞的坏死性死亡以及部分凋亡性死亡(图7B)。在细胞凋亡和坏死的过程中,会引起细胞表面黏附分子如HA(图6B)和骨桥蛋白(OPN)的表达升高,磷脂酰丝氨酸(PS)外翻,以及细胞表面脂质过氧化产物MDA产生。HA、OPN表达量升高后,又进一步增加了细胞对晶体的黏附,加重细胞的损伤。ROS水平和HA表达量均与细胞的损伤程度呈正相关。我们以前的研究[21]表明,微/纳米COM可以导致不同亚细胞结构的损伤,且发生明显损伤变化的时间顺序为细胞膜损伤(1 h)<线粒体膜电位下降(3~6 h)≈细胞周期滞留(3~6 h)<细胞凋亡(12 h),其中尺寸小的晶体导致细胞器的损伤更快,这归因于尺寸越小的晶体越容易通过内化作用进入细胞内。
黏附于细胞表面的晶体会与细胞相互作用,导致晶体形貌发生改变。首先,细胞表面表达的带负电荷的黏附分子如OPN、HA(图6B)和PS等可以与COM晶体富含Ca2+离子的(101)晶面作用,尤其是与COM晶体的棱和尖端暴露的Ca2+离子产生螯合作用;其次,细胞自身也可以通过网格蛋白介导的途径或巨胞饮作用内吞晶体[22];最后,细胞损伤后会引起细胞膜的破裂,导致溶酶体中的基质金属蛋白酶(MMP-7)、羧肽酶M、亮氨酸氨肽酶和碱性磷酸酶等释放到细胞外,从而增加了对晶体的溶解,引起晶体的形态变化。Narula等[23]也观察到在肾结石基质蛋白存在下,COM晶体边缘和表面的溶解很明显,这种形态变化促进了晶体-细胞间的相互作用,增加了细胞对晶体的吸附、溶解及内吞。
3.2 不同长宽比COM晶体对HK-2损伤存在差异的原因
从细胞活力(图6A)、HA 表达量(图6B)、ROS 数据(图7A)和细胞死亡率(图7B)可以看出,不同长宽比COM对HK-2的细胞毒性呈现的变化规律为COM-1∶2>COM-1∶3>COM-1∶4>COM-1∶5>对照组。造成这种差异是以下各因素的综合影响:
(2)晶体尺寸。从图1可以看出,各晶体尺寸大小为COM-1∶2<COM-1∶3<COM-1∶4<COM-1∶5,尺寸越小的晶体,其比表面积越大(表1),裸露在晶体表面的活性位点越多,与细胞间的相互作用越强,对细胞的损伤也越严重。
(3)晶体的比表面积。当晶体的质量浓度相同时,小尺寸的晶体数量更多,拥有更大的表面积,即小尺寸COM晶体的表面裸露出更多的反应活性位点,这些活性位点可以捕获氧分子并制造超氧自由基以及通过歧化反应或芬顿反应产生ROS[25],因此小尺寸的晶体产生更大的细胞毒性。
(4)晶体的颗粒数。由于晶体的细胞毒性实验是用固定的晶体质量浓度(200 μg·mL-1)进行,因此,大尺寸晶体的数量较少,即作用于细胞表面的晶体个数减少,对细胞的损伤机会降低,故COM-1∶5对HK-2的损伤作用最弱。
(5)细胞与晶体剪切应力的影响。随着COM晶体长度增加,晶体与细胞间的界面接触并不能完全地贴合。大尺寸的COM-1∶5与细胞的临界剪切应力较小,导致其损伤细胞的能力减弱[26]。因此,其损伤细胞的能力也减弱。
4 结 论
合成了4种长宽比分别为1∶2、1∶3、1∶4和1∶5的COM晶体并对其进行了表征。升高反应温度、降低搅拌速度和减小添加剂明胶的浓度,均可以增大COM的长宽比。不同长宽比COM对人肾近端上皮细胞的毒性大小为COM-1∶2>COM-1∶3>COM-1∶4>COM-1∶5>对照组。COM晶体的(01)晶面比例增加、晶体的比表面积增大、细胞与晶体剪切应力增大,均会增加COM晶体的细胞毒性。由于尿液中存在不同尺寸、不同形貌的尿微晶,因此,本研究有助于进一步阐明COM结石的形成机理,并对预防肾结石形成提供启示。

