适体功能化的金纳米棒用于癌症靶向治疗的研究进展
徐 慧 赵 璐 白云峰 冯 锋
(山西大同大学化学与化工学院,化学生物传感山西省重点实验室,大同 037009)
0 引 言
癌症是人类的第2大疾病,严重威胁着人类的生命健康。据美国国家癌症中心统计,预估在2022年美国将新增609 360个癌症死亡病例[1]。癌症的传统治疗方法主要包括手术、放疗与化疗(chemotherapy,CHT),其中CHT是癌症治疗中最常用的方法,但CHT存在毒性大、疗效低、易耐药等问题,严重影响患者的治疗效果[2]。随着生物医学的发展,癌症的治疗方法主要包括:CHT、光热疗法(photothermal therapy,PTT)、光 动 力 疗 法 (photodynamic therapy,PDT)和基因疗法(gene therapy,GT),PTT 因具有侵入性小、并发症少、见效快且对正常组织毒副作用小等优点,引起了科学家们的广泛关注。PTT 是利用光热剂(photothermal agent,PTA)将光能高效地转化为热能,使癌组织温度快速升高而诱导其凋亡的一种治疗方法。PTA除了用于PTT外,也可用于负载药物、光敏剂(photosensitizer,PS)、小干扰 RNA(small interfering RNA,siRNA)等,从而实现PTT/CHT、PTT/PDT、PTT/GT、PTT/PDT/CHT 或 PTT/GT/CHT的多模式联合疗法,在癌症治疗中显示出巨大的潜力[3]。
目前已开发出多种类型的PTA,包括金纳米颗粒(gold nanoparticles,GNs)[4]、碳基纳米材料[5]、超薄2D纳米材料[6-7]、半导体聚合物[8]、导电共轭聚合物[9]、有机小分子[10]等[11-12]。各类PTA用于PTT中的优缺点总结于表1。由于GNs具有局域表面等离子共振(localized surface plasmon resonance,LSPR)的独特光学性质,根据具体应用情况,通过改变GNs的形状,可在近红外区调节LSPR特征吸收峰[13]。众所周知,700~1 200 nm是PTT的最佳窗口,在此范围内生理液体和组织对光的吸收率最低[14-15],因此GNs被广泛用于PTT[16]。GNs具有棒状、球形、梭形、星形等形状[17],其中棒状 GNs(gold nanorods,GNRs)因具有合成简单、吸收峰可调、表面易修饰和光吸收率高等特点脱颖而出。常见GNRs的长度可调范围为20~200 nm,宽度可调范围为5~100 nm,其LSPR峰在近红外区的位置随GNRs长径比(aspect ratio,AR)的不同发生变化[18]。到目前为止,GNRs的合成方法有晶种生长法[19]、电化学法[20]、光化学法[21]和湿化学法[22]等,其中最成熟的方法是晶种生长法[23]。利用晶种生长法合成的GNRs,具有形状可控、单分散性好、稳定性高等特点。其制备分为3步:(1)以十六烷基三甲基溴化铵(CTAB)作为表面稳定剂,通过NaBH4还原HAuCl4制备种子溶液;(2)将CTAB与HAuCl4混合使其发生配位作用,加入弱还原剂,使Au(Ⅲ)变为Au(Ⅰ),并添加AgNO3制备生长溶液;(3)将种子溶液与生长溶液混合,过夜反应合成GNRs。通过该方法制备的GNRs表面残留有CTAB,将其应用于细胞实验时,CTAB会产生细胞毒性,因此需要将其去除。去除CTAB的方法包括离心或在其表面修饰其他材料,常用的修饰材料有聚合物、无机材料、生物分子等[23-24]。
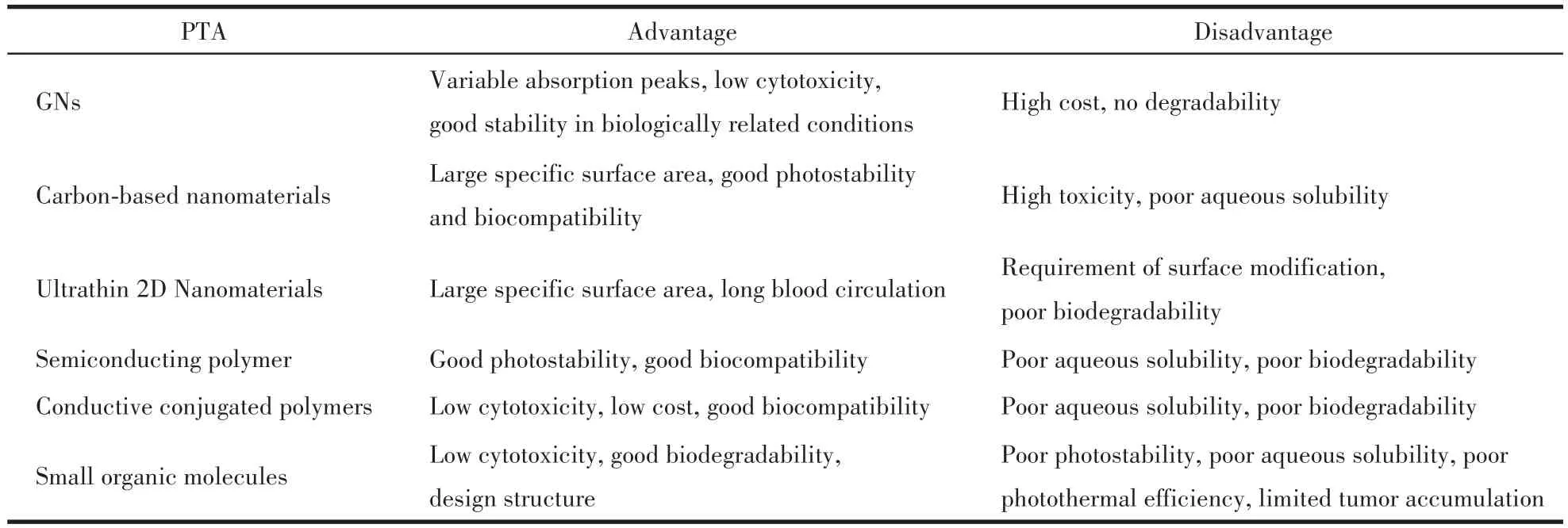
表1 各类PTA应用于PTT中的优缺点Table 1 Advantages and disadvantages of various types of PTA used in PTT
与其他物质相比,聚合物PEG(聚乙二醇)明显提高了纳米材料在血液中的循环周期,治疗效果明显改善[25-26]。Niidome课题组[27]利用PEG修饰GNRs测试了其对Hela细胞的毒性,体外研究结果显示细胞存活率明显提升,体内研究表明,PEG修饰的GNRs在血液中的流动时间延长。
在癌症治疗应用中,GNRs可通过纳米材料的高通透性和滞留(enhanced permeability and retention,EPR)效应被动地聚集在癌细胞,实现对癌症的物理靶向治疗。但仅依靠EPR效应,无法特异性地靶向癌细胞,通过在GNRs表面修饰靶向分子,可以提高其对癌细胞的主动靶向能力,改善治疗效果。近年来,已有报道使用单克隆抗体[28]、叶酸[29-31]、多肽[32]和透明质酸等[33-34]物质修饰GNRs以提高靶向能力,但这些方法存在制备过程复杂、靶向精度低的缺点。核酸适体(aptamer,Apt)的出现极大地改善了这些问题,为癌症的靶向治疗带来新的希望。我们将Apt与其他靶向配体之间的优缺点比较总结于表2。
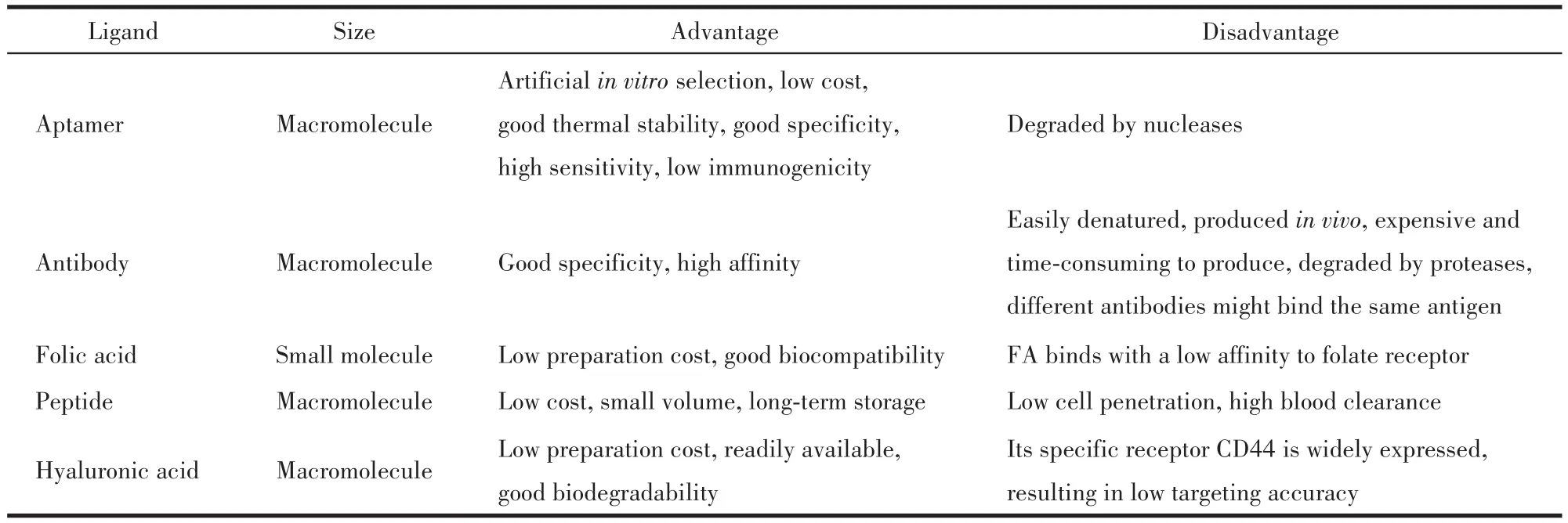
表2 适体与其他配体的优缺点比较Table 2 Comparison of advantages and disadvantages of aptamers and other ligands
1 核酸适体
Apt是一种人工在体外筛选的功能性寡核苷酸序列(短的单链DNA或RNA片段),通常拥有20~80个碱基,它可以折叠成二级或三级结构,这使其具有高亲和力和特异性。由于具有与抗体相似的亲和力和特异性,Apt被称为“化学抗体”。
与抗体相比,Apt具有独特的优势和特点:(1)Apt的大小为6~30 kDa,具有高比表面积与体积比,可折叠成特定的结构以高亲和力识别靶标;(2)可识别的位点多,可识别细胞、金属离子、蛋白、细菌、真菌和病毒等[35-39];(3)具有相对较低的免疫原性;(4)稳定性高且生产成本低;(5)具有可编程性,通过删除、添加、合并Apt序列进而识别不同目标;(6)具有易修饰和标记的特点,可在其5′或3′端修饰生物小分子(例如生物素、链霉亲和素等)、化学基团(例如氨基、巯基、羧基等)[34]等,已广泛应用于生物传感[40-51]、体内成像[52]、靶向递送药物[53]和癌症治疗[54]等领域。
经过修饰后的Apt可通过共价作用与聚合物、小分子和纳米材料表面的基团结合,从而实现癌症药物靶向递送。在与GNRs结合的癌症靶向治疗体系中,Apt具有以下作用:(1)精准靶向癌细胞或其表面膜蛋白;(2)通过物理作用装载化疗药物阿霉素(doxorubicin,DOX)[55];(3)在复合材料表面封装药物的功能;(4)用于连接光敏剂或RNA等。本课题组利用Apt的优势,在生物传感方面进行研究并取得了一些成果[41-51,56-57],实现了对腺苷[42]、癌胚抗原[44]以及伴刀豆蛋白[49]等分子的高灵敏检测。利用Apt功能化GNRs(Apt-GNRs),可以将Apt的特异性识别能力和结合能力与GNRs的光热性结合起来,实现癌症的精准靶向治疗,提高治疗效率,减少毒副作用。本文基于Apt对癌细胞高特异性识别的优势,总结了Apt-GNRs在癌症靶向治疗新策略方面取得的研究进展,同时展望了其未来的发展趋势。
2 Apt-GNRs用于单一模式治疗
2.1 Apt-GNRs用于PTT
PTT是利用光热转换效率较高的纳米材料,在激光的照射下将光能快速转化成热能,使癌细胞内的蛋白质和DNA发生热变性和凝固,从而促使癌细胞凋亡[58]。GNRs具有可调的纵向LSPR波长,这增强了其对相应波长的光吸收,从而实现高效的热转换。在癌症治疗中,Apt-GNRs对靶标具有高选择性,进行PTT时使用较低的激光功率就可实现对细胞的高致死率,同时减少对周围健康组织的伤害。
2008年,Tan课题组[59]首次设计了一种银掺杂的 GNRs(Ag-GNRs)(图1A),与 GNRs相比,Ag-GNRs具有更高的摩尔吸收效率。将Apt-Sgc8偶联到Ag-GNRs来靶向CCRF-CEM细胞,在激光的照射下,癌细胞死亡率从23%上升为93%,正常细胞NB-4未发生明显死亡。为了降低GNRs表面CTAB带来的毒性,2014年,Haam课题组[60]利用羧基修饰的PEG(COOH-PEG-SH)替换GNRs表面的CTAB,为了提高靶向性,同时将Apt-EGFR与EGFR抗体修饰于GNRs上(图1C),用于靶向A431和MCF-7细胞。体外研究显示,在激光的照射下,癌细胞的死亡率显著增高,体内研究发现肿瘤明显变小。为了提升Apt对靶细胞的亲和力,2016年Cheng课题组[61]筛选出一种新型的Apt-KW16-13靶向MCF-10CA1h细胞(图1B),与Apt-KMF2-1a相比,Apt-KW16-13对MCF-10CA1h细胞表现出较强的亲和力,将其修饰于GNRs进行PTT。体外研究结果显示,在激光的照射下,癌细胞的死亡率高达96%。2019年,Kim课题组[62]筛选一种新的Apt用于靶向KB细胞(图1D),将Apt修饰于GNRs表面进行PTT,体外实验证明在激光的照射下,超过80%的细胞死亡。
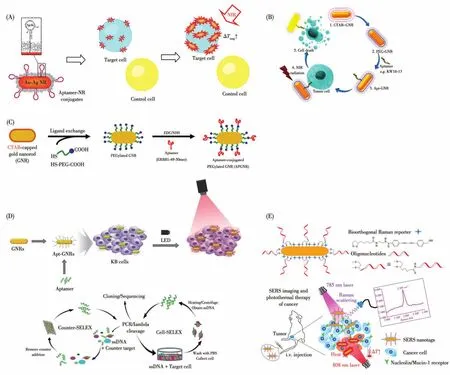
图1 Apt-GNRs在PTT中应用的示意图[59-62,64]Fig.1 Schematic diagram of the application of Apt-GNRs in PTT[59-62,64]
PEG具有减少非特异性蛋白吸附、改善血液相容性等优势,但可能会引起细胞凝血,并产生抗PEG免疫球蛋白抗体。为了改善这一缺陷,Xu课题组[63]将DSPE-PEG-SH和Apt-EGFR修饰于外泌体(exosomes,Exos),通过 Au—S 键将其与 GNRs结合,利用Exos提升了GNRs的生物相容性。将Apt-EGFR用于靶向HepG2细胞,体外实验结果显示,在激光的照射下,GNRs温度升高,HepG2细胞存活率显著降低。
2020年,Tang课题组[64]将 Apt-AS1411/Apt-MUC1修饰的GNRs用于靶向MCF-7细胞(图1E),体外实验表明,在激光的照射下,MCF-7细胞几乎全部死亡,体内实验中Apt-GNRs对肿瘤的抑制率高达99%,有望在实际临床中应用。
以上研究结果表明,Apt-GNRs在激光的照射下产生的热量足以消融癌细胞,PTT可有效抑制肿瘤的生长。
2.2 Apt-GNRs用于PDT
PDT是在指定的波长(一般为440、660 nm)下,PS吸收光能后从基态跃迁到激发态,将能量转移到周围的氧分子中,产生细胞毒性活性氧(reactive oxygen species,ROS),例如单线态氧(1O2)和羟基自由基(·OH)等,对癌细胞造成氧化损伤,致使细胞凋亡[65-66]。与其他治疗方式相比,PDT可以精确地控制其作用的位置和时间[67-71]。
PDT在临床应用时,为了避免可见光对注射光敏药物的患者带来伤害,患者在一定时间内必须避免与光照接触,另外,由于光敏药物的非特异性分布,对正常组织也有毒性作用,限制了PDT在癌症治疗中的应用。为了改善这一问题,Shi课题组[72]首次将Apt-GNRs应用于PDT,选用Apt-MUC1修饰GNRs,并在Apt末端修饰了光敏剂分子Ce6,使Ce6接近GNRs时发生猝灭,在激光的照射下,PDT处于“关闭”状态。相反,在MCF-7细胞存在时,Apt-MUC1与MCF-7细胞表面的MUC1蛋白结合,使Apt-MUC1构象发生变化,增加了Ce6分子与GNRs之间的距离(图2),在激光照射下,PDT处于“开启”状态,细胞凋亡率提升了53.8%。2021年,Ng课题组[73]利用聚多巴胺(PDA)修饰的GNRs连接hp DNA用于靶向高表达miR-21的MCF-7细胞,在hp DNA上修饰了DSBDP(二苯乙烯基硼二吡咯亚甲基)。在675 nm激光的照射下,DSBDP被“激活”产生1O2(图2B),使80%的细胞死亡,体内实验证明该系统可有效抑制肿瘤生长,并对正常组织无明显毒性作用。

图2 Apt-GNRs在PDT中应用的示意图[72-73]Fig.2 Schematic diagram of the application of Apt-GNRs in PTT[72-73]
在Apt上修饰PS,在激光的照射下可实现PDT,而以上研究结果显示Apt-GNRs可有效使癌细胞凋亡。
2.3 Apt-GNRs用于化疗药物载体
GNRs具有独特的尺寸、较大的比表面积等特点,药物可通过物理封装或化学键合(非共价或共价)与GNRs结合,通过Apt的主动靶向作用增强化疗药物在癌细胞中的富集,降低对正常细胞的毒性,实现了药物的定点释放。
2016年,Wan课题组[74]设计一种基于GNRs的双功能适体探针DOX/GNR/DNA(图3),选择了Apt-Romas与 Apt-ATP(DNA3)两种 Apt,GNRs表面的单链DNA与DNA3杂交后可提供化疗药物DOX负载位点,以实现载药。Romas细胞存在时,Apt-Romas与Apt-ATP发挥双重靶向作用,可高特异性与Romas细胞结合,实现了DOX的靶向递送,体内外研究均显示DOX/GNR/DNA系统对癌细胞的增殖有明显的抑制作用。

图3 Apt-GNRs用于癌症CHT的机理图[74]Fig.3 Mechanism of Apt-GNRs used in CHT for cancer[74]
3 联合疗法
单一疗法在癌症治疗中取得了初步成果,但也存在一些问题,例如:(1)PTT主要依赖PTA的光热转换性能,GNRs在体外消灭癌细胞和体内消除恶性肿瘤的效果十分显著,然而,癌细胞内温度升高使体内的热休克蛋白(HSP)表达上调,增强了癌细胞的耐热性从而降低了PTT的效果;(2)PDT疗法主要依靠PS产生ROS,但部分无机PS仅在O2的存在下才能产生单线态氧(1O2),癌组织中乏氧状态下PDT效果会受到影响;(3)化疗药物(DOX、紫杉醇、5-氟尿嘧啶等)进入身体后的非特异性分布会对人体脏器造成较大的危害,长时间使用化疗药物时,癌细胞会产生耐药性(multidrug resistance,MDR)。为避免单一治疗的缺陷,可以将2种或多种疗法联合使用以提高治疗效果[75-76]。
3.1 双模式联合疗法
3.1.1 PTT与CHT联合
PTT可以显著增强CHT效果,两者联合疗法已被广泛应用于癌症治疗[77-78]。2011年,Tan课题组[79]在GNRs表面修饰聚丙烯酰胺聚合物(DP-A、DP-B)以形成凝胶用来负载药物,同时利用Apt-Sgc8靶向CCRF-CEM细胞。在激光的照射下,GNRs温度升高并加速药物释放,细胞的死亡率可达67%左右(图4A)。为了在提高载药量的同时实现靶向作用,Qu课题组[80]首次将Apt作为封闭剂,用介孔SiO2包裹GNRs构建介孔二氧化硅纳米粒子(mesoporous silica nanoparticles,MSNs),在其表面修饰了 Apt-AS1411用于靶向MCF-7细胞。利用Apt-AS1411与互补DNA序列形成双链结构,在激光照射下,GNRs温度升高使DNA双链解旋,实现主动靶向MCF-7细胞的目的,MSNs自动解封,实现药物释放。体外实验证明,在PTT和CHT共同作用下癌细胞存活率明显降低(图4B)。随后,Um课题组[81]直接在GNRs表面修饰Apt-A10用于靶向LNCaP细胞,在PTT和CHT的联合作用下,体内外实验证明该系统抑制肿瘤有显著效果。
除了直接靶向癌细胞中的一些蛋白之外,线粒体也可作为癌症治疗中有效的靶点,Qu课题组[82]设计了靶向线粒体的纳米载药系统,该系统同样使用介孔SiO2包裹GNRs构建MSNs,将Apt-Cytc修饰于MSNs,其可以将药物靶向递送到HeLa细胞的线粒体。在980 nm激光的照射下,Apt-Cytc在HeLa的细胞质中释放,触发线粒体诱导细胞凋亡并刺激药物释放。实验结果表明,与单独的CHT和PTT相比,联合疗法产生了更高的细胞毒性(图4C)。在遇到复杂环境时,MSNs不稳定,SiO2会与GNRs分离,对人体产生毒副作用。为此Tan课题组[83]利用碳层(Carbon)包裹GNRs以增强纳米复合材料的稳定性,并修饰Apt-AS1411、装载DOX构建了GNR@Carbon-DOX纳米药物递送系统,该系统可通过简单的疏水作用和π-π堆积在Carbon上装载DOX,其载药量高达46%,在红外激光照射时,该纳米系统的温度由20℃快速上升到75℃,PTT疗效显著,在体外研究中用于靶向MCF-7细胞。实验结果证明,与单独CHT和PTT相比,联合疗法对MCF-7细胞生长的抑制作用更显著(图4D)。
DNA纳米结构因其结构可编程性和良好的生物相容性在药物载体应用方面备受关注。Ding课题组[84]用Apt-MUC1功能化DNA折纸,在折纸上可装载DOX与GNRs,用于靶向MCF-7细胞,在激光的照射下,GNRs温度升高,抑制了P-糖蛋白的表达,增强了癌细胞对DOX的敏感性。实验结果发现,联合疗法比单一治疗更有效地抑制了癌细胞的生长(图4E)。
2015年,Tan课题组[85]利用DNA自组装构建了一种大小可控的智能纳米复合物,在GNRs短轴端修饰了Apt-Sgc8,用来靶向CCRF-CEM细胞。GNRs长轴端修饰捕获链与金纳米球(GNPs)上的DNA链杂交,用来装载DOX(图4F)。在激光照射下,GNRs温度升高促使DOX释放,研究结果显示,CHT与PTT联合,CCRF-CEM细胞凋亡率可提升24%。2019年,Hao课题组[86]在MSNs表面修饰PDA用于封装DOX,同时提升GNRs的光热效果,Apt-S6通过迈克尔加成反应与PDA连接,用于靶向A549细胞(图4G),体外实验表明,在激光照射下,DOX释放,CHT与PTT共同作用,癌细胞存活率显著降低。
3.1.2 PTT与PDT联合
PDT依靠在细胞内直接产生ROS来杀死癌细胞,将PS高效递送至癌细胞内是实现PDT疗效的关键。由于温和的热疗能够增加细胞膜的通透性以增强癌细胞对纳米载体的吸收,可通过温和的PTT效应增加细胞内PS浓度,从而提高细胞内ROS浓度,进一步增强PDT疗效。此外,轻度热疗可加速血液循环,增加血管饱和O2浓度,这也有利于提高PDT-Ⅱ型(O2依赖型)的1O2产量[87]。Tan 课题组[88]将Apt-Sgc8“发夹”结构的末端连接Ce6,依次将PEGSH、Apt-Sgc8修饰在GNRs上,构建了纳米复合系统(图5A)用于靶向CCRF-CEM细胞。由于Ce6贴近GNRs表面,其荧光被猝灭。在CCRF-CEM细胞存在时,Apt-Sgc8构象改变,使Ce6远离GNRs表面。在激光照射下,GNRs吸收光能转化为热能,Ce6产生1O2,实现PDT/PTT联合作用,CCRF-CEM细胞的死亡率高于70%。2013年,Tan课题组[89]将Apt-Sgc8修饰到GNRs,用于靶向CCRF-CEM细胞。在Apt-Sgc8互补序列(cDNA)末端修饰Ce6(图5B),Apt-Sgc8识别CCRF-CEM细胞后与cDNA分离,Ce6分子被释放。在白光和812 nm激光的照射下,Ce6产生1O2,GNRs产生PTT效果。体外研究表明,联合疗法比单一疗法更有效,可使细胞存活率降至32%以下。

图5 Apt-GNRs用于PTT/PDT联合治疗的作用机理图[88-89]Fig.5 Mechanism of combined PTT/PDT based on Apt-GNRs[88-89]
3.1.3 PTT与GT联合
GT是指将外源正常基因导入靶细胞,以纠正或补偿缺陷和异常基因引起的疾病,达到治疗目的。为了提高CRISPR-Cas9靶向性,实现sgRNA在靶标处定点释放,Le课题组[90]利用DNA将sgRNA“保护”起来,将其偶联至GNRs以构建纳米递送系统。在激光的照射下,GNRs产生热量,sgRNA“脱保护”与Cas9蛋白结合,启动特定基因编辑敲除PLK1,诱导A549细胞开始凋亡(图6A)。体外研究表明,在PTT和GT的共同作用下,细胞的死亡率可达84%。为了提升Apt-GNRs对癌细胞的靶向能力,2021年,Ding课题组[91]利用Apt-MUC1和TAT(多肽)共同靶向MCF-7细胞,实现对癌细胞双重靶向作用。在sgRNA/Cas9作用下,PKL1表达下调,在激光的照射下,增强了PTT的效果,在联合疗法的模式下,实现了最佳的抑制肿瘤效果(图6B)。

图6 Apt-GNRs用于PTT/GT联合治疗的作用机理图[90-91]Fig.6 Mechanism of combined PTT/GT based on Apt-GNRs[90-91]
3.2 多模式联合疗法
两种治疗方式联合的抗癌效果远高于单一疗法,如果将3种治疗方式同时整合于一个纳米平台上,可以进一步提升治疗效率,以较低的剂量就可实现最佳的治疗效果,进一步减少对正常细胞的毒副作用[92]。
3.2.1 PTT、CHT和PDT联合
在激光照射时,GNRs产生的热量可加速释放化疗药物/PS,提升其对癌细胞的作用强度,从而增强CHT与PDT的治疗效果,同时PS产生的ROS可避免内体对GNRs的吞噬,促进药物递送。Tan课题组[93]将dsDNA自组装到GNRs的表面,用来提供DOX的结合位点,光敏剂(TMPyP4)插入Apt-AS1411形成的G-四链体结构中构成纳米载药递送系统,用于靶向HeLa细胞。在808 nm激光照射下,GNRs的温度迅速升高,DOX从DNA双链中释放,同时产生1O2。实验结果显示,3种疗法联合作用表现出最佳的治疗效果,HeLa细胞的死亡率高达80%以上(图7A)。

图7 Apt-GNRs用于癌症多模式治疗的示意图[93,95]Fig.7 Schematic diagram of multimodal cancer treatment based on Apt-GNRs[93,95]
3.2.2 PTT、CHT和GT联合

续表3
化疗药物长期使用会产生MDR,GT中特异性的siRNA可作用于耐药基因,恢复癌细胞对药物的敏感性,从而有效提高化疗的效果[94]。siRNA是一种双链RNA分子,可用于沉默癌症相关基因的表达。Xu课题组[95]将siRNA与GNRs偶联,同时使用PEG-SH和Apt-AS1411修饰GNRs,作用于PC-3细胞。在激光的照射下,GNRs周围温度升高,使DNA双链解旋释放DOX和siRNA,DOX进入细胞核,siRNA作用于细胞质。MRP1是一种细胞表面的外排泵,可通过降低细胞内药物浓度来调节MDR,通过siRNA抑制MRP1的表达,DOX毒性显著增强,3种治疗模式同时发挥作用,PC-3细胞晚期凋亡率高达 84.4%(图7B)。
以上研究表明,相较于单一模式治疗,将PTT、PDT、CHT和GT联合的多模式治疗可提高对肿瘤的抑制作用,利用GNRs本身具有的PTT效果,可以:(1)在其表面或Apt末端修饰PS实现PTT与PDT联合;(2)利用Apt装载或连接化疗药物实现PTT与CHT联合;(3)利用Apt连接外源基因实现PTT与GT联合,或实现3种疗法的联合。
4 总结与展望
近年来,构建用于癌症治疗的多功能纳米材料研究取得了巨大进步,与单一疗法相比,多模式疗法在集合每种疗法优点的同时利用各种疗法间的相互补充,成功地弥补单一疗法的不足,达到了更佳的治疗效果。癌症医学研究的主要领域之一是将抗癌药物靶向递送于癌细胞,这不仅有助于提高治疗效果,而且还降低抗肿瘤药物的非特异性分布带来的副作用。Apt作为新型的靶向剂现已成为最热门的抗癌工具,为癌症的诊断和治疗带来新的希望。目前已有Apt药物Macugen上市[96],用于治疗湿性年龄相关性黄斑变性,临床应用治疗效果显著。美国Cytimmue Sciences公司专注于研发金属纳米材料药物用于临床癌症治疗,其研发的产品已进入临床试验阶段,将Apt与GNRs结合作为临床癌症治疗药物指日可待。
Apt-GNRs具有良好的生物相容性、较大的负载量、优良的靶向性,在癌症治疗方面展现出良好的应用前景,但仍然面临许多问题:
(1)表面改性过程中稳定性差。目前已经提出多种GNRs表面改性的方法,但大多受实验室条件以及试剂纯度的影响,存在可重复性差、表面改性时易聚集等缺点,目前已通过在其表面修饰聚合物材料、纳米材料等,以改善其稳定性,但效果仍不理想。
(2)载药量低。Apt-GNRs主要通过Apt与单链DNA形成的双链结构或Apt自身的双链结构以装载药物,其载药量较低,目前已通过在其表面修饰比表面积较大的有机/无机材料来提升其载药量,但与可生物降解的有机大分子相比,大部分无机纳米材料在体内中几乎不能降解,其安全性有待研究。
(3)生物安全性。尽管许多研究探讨了Apt-GNRs在体内外使用的安全性,但一些研究也提出了互相矛盾的结果。由于GNRs的物理尺寸大于8 nm时不能通过体内的酶促反应分解成更小的碎片,进入体内后,GNRs会迅速积聚在肝脏、脾脏等健康器官中,无法清除,限制了大多数GNRs应用于临床,将GNRs的粒径尽量控制在肾脏利于消除的范围内(6~8 nm),是目前研究的重点。
Apt-GNRs药物递送系统在癌症治疗领域潜力不可限量,未来有望在以下方面取得实质进展:(1)由于许多恶性肿瘤是位于体内而不是体表,NIR-Ⅰ光只能穿透人体几厘米,降低了GNRs在深部肿瘤PTT的疗效,NIR-Ⅱ光比NIR-Ⅰ光对组织的穿透深度更高,开发GNRs在NIR-Ⅱ区的PTT性能,实现对深部的肿瘤进行穿透性治疗将是未来的研究方向之一;(2)为了提升GNRs的光转化率进而提升其PTT性能,利用Ag、Cu与GNRs掺杂可提升其光转化率,掺杂何种材料能更有效地提升GNRs的光转化率是未来的研究方向之一;(3)联合疗法只是将各种疗法的作用简单叠加,多种疗法联合如何能起到协同促进作用,达到“1+1>2”的疗效将是未来的研究方向之一;(4)尽管采用多种方法提升了GNRs的生物相容性,但人体环境复杂,难以预测,很难确定纳米材料进入人体后的溶解性、亲水性和聚集性等问题,着重提升其生物相容性和稳定性是将其应用于人体治疗中亟待解决的难题之一;(5)应用于体内研究时,Apt功能化可大幅度提升纳米材料的靶向递送效果,但在健康器官中仍有大量的纳米材料富集,进一步提升Apt的主动靶向能力是从活体实验迈向临床应用的重点研究方向之一。
虽然基于Apt-GNRs纳米药物递送系统在癌症治疗应用中还面临着许多困难与挑战,但这些问题会随着医学技术的不断发展和科学家们对GNRs的深入研究而逐个击破,Apt-GNRs将在癌症治疗领域展现出广阔的应用前景。
——以夹江县“插花式”精准扶贫为例
——以乐山市为例

