ITGAV过表达与胆管癌转移及预后的关系
陈平平,张震生,武金才,郑进方,唐 荣,李梦婷,章家超,曾勇超,陈 良
(海南省人民医院/海南医学院附属海南医院肝胆外科,海南 海口 570311)
近年来,胆管癌(发生于胆管上皮的腺癌)的发病率明显上升。胆管癌起病隐匿,临床表现无特异性,早期诊断困难,临床确诊时大部分患者已属晚期,失去了有效的手术治疗机会,同时术后复发率高,对放化疗不敏感,患者预后极差[1-2]。因此,研究胆管癌的生物学特性,探究其发病机制,寻找早期诊断和及时干预的方法,是提高胆管癌诊治效果的关键。整合素是由α、β两个亚基组成的一组跨膜糖蛋白及细胞黏附受体蛋白,其主要作用为介导细胞与细胞外基质之间的连接,能够调节细胞内外信号、基因表达及细胞分化,激活相关通路,同时,其在调控细胞的生物学功能,促进肿瘤细胞侵袭转移,增强肿瘤血管形成能力及诱导药物耐受等方面具有非常重要的作用[3-5]。整合素αv(integrin αv,ITGAV)为整合素家族的重要成员之一,在改变肿瘤微环境、促进肿瘤的发展及侵袭转移过程中发挥重要作用,其过表达与前列腺癌、口腔鳞癌、胃癌、肺癌的侵袭转移具有显著相关性[4-7]。ITGAV在眼睑鳞状癌中过表达,其过表达与肿瘤侵袭转移密切相关。在喉癌和咽癌中ITGAV过表达,其过表达与肿瘤分化、转移密切相关,ITGAV过表达患者的淋巴结转移率明显高于低表达患者[8-9]。有研究发现,ITGAV过表达可促进乳腺癌侵袭转移[10]。进一步研究发现整合素可与四跨膜蛋白相结合形成复合体,其复合体是肿瘤转移的一个重要分子[11]。目前有关ITGAV在胆管癌中的表达及其在胆管癌侵袭转移和预后判断等方面的潜在价值尚不明确,本研究通过检测ITGAV在胆管癌中的表达水平,结合临床病理特征,初步探讨其在胆管癌中的潜在临床价值。
1 材料与方法
1.1 标本
选取我院2010年1月至2016年1月行根治性手术切除的胆管癌患者374例,随机分为Ⅰ组(80例)和Ⅱ组(294例),取患者术中切除的癌组织及癌旁组织(癌旁组织均取自距离肿瘤组织边缘2 cm以外区域)。纳入标准:样本经术后病理证实为胆管癌;患者术前未行放疗、化疗、靶向治疗及免疫治疗;肿瘤切除完整,切缘净,无癌组织残留,局部受累淋巴结清扫完全;临床及随访资料完整。所有患者术后随访5年,随访时间截止到2020年12月。肿瘤TNM分期参考国际抗癌联盟(Union for International Cancer Control,UICC)标准。根据术后复发时间分为早期复发组(复发时间<1年)和未复发或晚期复发组(复发时间≥1年)。2组患者的临床病理特征见表1。采用RT-PCR和Western blot检测Ⅰ组ITGAV的表达;Ⅱ组用于大样本组织芯片检测。本研究通过我院伦理委员会审查批准[医伦研(2018)202号]。

表1 2组患者临床病理特征[例(%)]
1.2 主要试剂
ITGAV单克隆抗体、GAPDH抗体购自英国Abcam公司;ITGAV及GAPDH引物由美国Invitrogen公司合成;TRIzol提取试剂盒购自美国Gibco公司;逆转录、聚合酶链反应试剂盒购自北京百泰克生物技术有限公司;蛋白印迹杂交显影化学发光显色系统购自美国Pierce公司;RPMI-1640培养基、胎牛血清标记辣根过氧化物酶的羊抗兔二抗均购自武汉博士德公司。
1.3 RT-PCR检测
按照TRIzol提取试剂盒说明书从胆管癌组织及癌旁组织提取总RNA,反转录为cDNA。以cDNA为模板,建立RT-PCR反应体系,以GAPDH为内参。引物由Primer 5.0引物设计软件设计,选择最佳引物,ITGAV上游引物序列5’-AAGCTGAGCTATCGTTTCC-3’,下游引物序列5’-GCACAGGAAAGTCTTGCTAAGG-3’;GAPDH上游引物序列5’-CCACTAGGCGCTCACTGTTCT-3’,下游引物序列5’-GCGAACTCACCCGTTGACT-3’。PCR反应条件:94 ℃ 45 s,57 ℃ 40 s,72 ℃ 45 s,共25个循环,72 ℃延伸10 min。1.5%琼脂糖凝胶电泳,紫外灯下分析PCR结果。拍照后用图像分析仪分析ITGAV条带和GAPDH条带的灰度,计算两者的比值。
1.4 Western blot
参考文献[12-13]从实验样本组织提取细胞总蛋白,以BCA法测定蛋白浓度。将样品与蛋白加样缓冲液混合后100 ℃水浴5 min变性,经12%聚丙烯酰胺凝胶电泳(20 mA恒定电流条件下电泳60 min),在恒定电压20 V条件下转膜17 min,5%脱脂奶粉室温封闭20 min后,转至聚偏二氟乙烯膜上。10%脱脂奶粉室温封闭1 h,一抗为ITGAV(1∶200)和GAPDH(1∶1 000),二抗为辣根过氧化物酶标记的IgG(1∶4 000)。聚偏二氟乙烯膜依次与抗体作用后,加入蛋白印迹化学发光试剂,以化学发光法将膜孵育5 min,曝光、显影、定影成像。
1.5 TGAV组织芯片和免疫组化染色
组织芯片检测294例胆管癌患者的ITGAV表达。组织芯片制备参考文献[14],ITGAV免疫组化染色采用SP法,操作过程严格按照说明书进行。DAB显色,苏木素复染后镜检。ITGAV表达阳性细胞为细胞膜有棕褐色颗粒,计算阳性细胞数占同类计数细胞的百分比:阳性细胞数<50%为阴性,阳性细胞数≥50%为阳性[14]。每组实验均设有阴性和阳性对照,以磷酸盐缓冲液代替一抗作为阴性对照,以已知阳性肝癌组织片作为阳性对照。
1.6 统计学处理
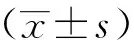
2 结果
2.1 胆管癌组织及癌旁组织中ITGAV的表达
胆管癌组织中ITGAV mRNA及蛋白表达水平均明显高于癌旁组织,差异有统计学意义(P<0.05),见图1。
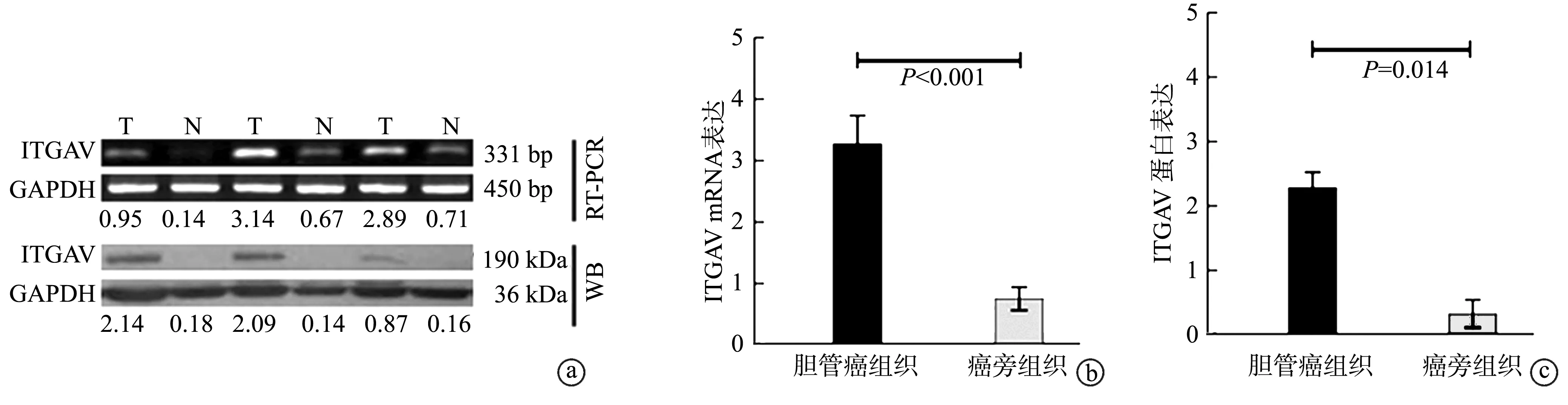
a~c: RT-PCR与Western blot检测ITGAV在胆管癌组织及癌旁组织中的表达 WB:Western blot;T:胆管癌组织;N:癌旁组织图1 胆管癌组织和癌旁组织中ITGAV的mRNA和蛋白表达水平
2.2 组织芯片检测ITGAV表达
免疫组化染色结果显示,ITGAV阳性表达于胆管癌细胞膜或细胞浆中,黄染,阳性高表达者着色深,呈深棕色,在胆管癌组织中呈不均一性;而在癌旁组织中ITGAV呈淡染(图2)。在161例患者的胆管癌组织中ITGAV阳性表达,在133例患者的胆管癌组织中ITGAV低表达或不表达,ITGAV阳性表达率为54.8%。

a:ITGAV在胆管癌组织中阳性表达;b:ITGAV在癌旁组织中阴性表达;c:ITGAV在胆管癌组织中低表达;d:ITGAV在癌旁组织中低表达图2 组织芯片检测ITGAV在胆管癌组织及癌旁组织中的表达(免疫组化染色×200)
2.3 ITGAV在胆管癌组织中差异表达与术后侵袭转移和预后的关系
ITGAV差异表达与肿瘤个数、肿瘤直径、肿瘤包膜完整(边界完整)、肝门淋巴结转移或局部侵犯、血管或胆管侵犯、TNM分期、Edmondson分级等转移潜能指标相关(P<0.05),而与性别、年龄、血清CA199水平、肝硬化、HBsAg等无关(P>0.05),见表2。ITGAV在早期复发组中过表达,ITGAV过表达的161例患者中有119例出现术后早期复发;而ITGAV在未复发或晚期复发组中低表达,ITGAV低表达的133例患者中有44例出现术后早期复发,差异具有统计学意义(P=0.025),见表3。Kaplan-Meier分析显示,与ITGAV低表达胆管癌患者比较,ITGAV过表达胆管癌患者术后更易复发,复发时间较短(HR=1.90;95%CI:1.41~2.62;P<0.001),且术后生存时间较短(HR=1.95;95%CI:1.42~2.73;P<0.001),差异具有显著统计学意义(图3)。COX回归模型分析显示,ITGAV过表达是胆管癌患者术后复发时间(HR=1.73;95%CI:1.13~2.63;P=0.011)和术后生存时间(HR=1.65;95%CI:1.08~2.51;P=0.021)的独立影响因素(表4)。

表2 ITGAV差异表达与胆管癌患者临床病理特征的关系[例(%)]

表3 294例胆管癌患者肿瘤组织中ITGAV表达与肿瘤转移潜能的关系
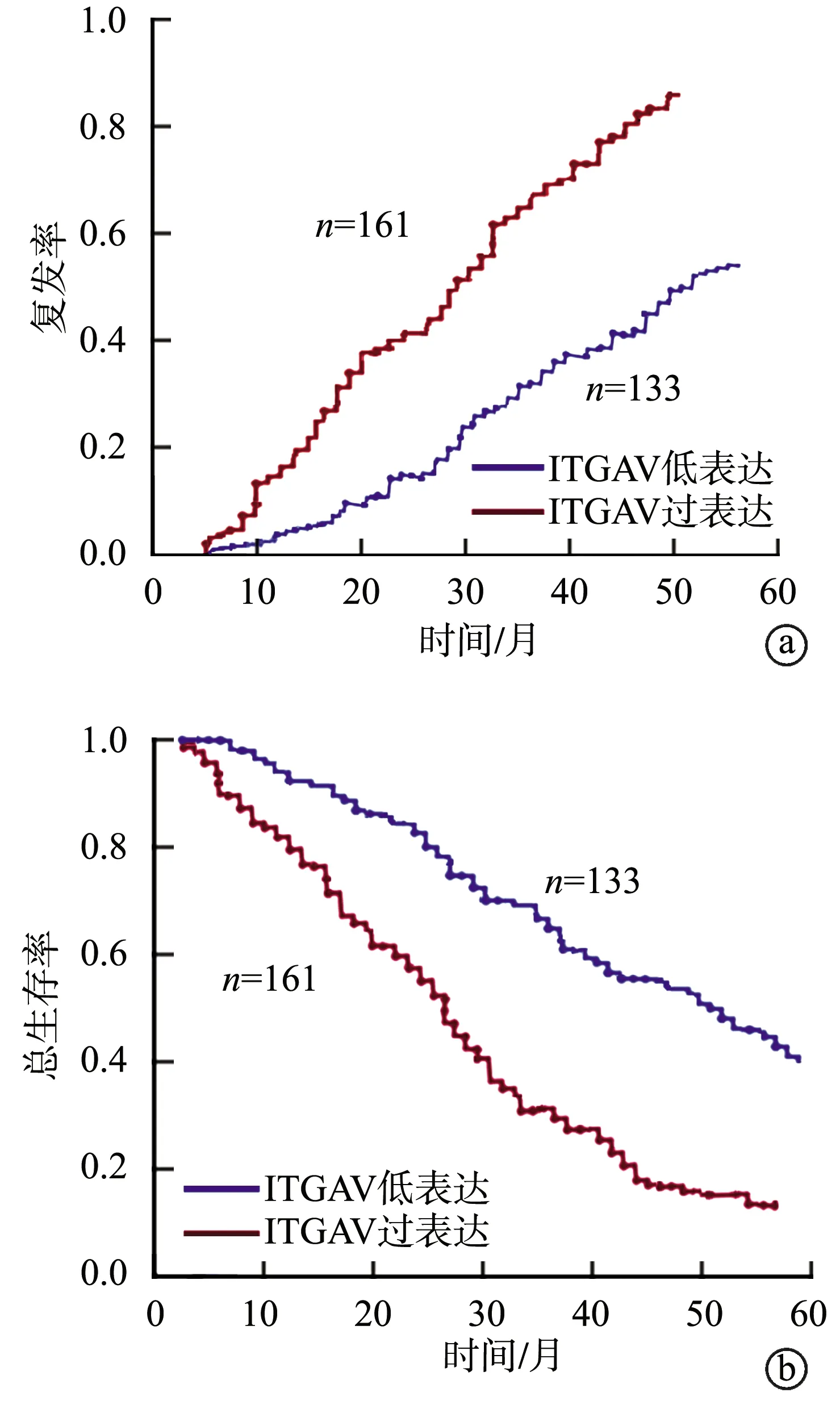
a:复发曲线;b:总生存曲线图3 ITGAV表达水平与术后复发率及生存率的关系

表4 294例胆管癌患者肿瘤组织中ITGAV表达与复发时间及生存时间的COX回归分析
3 讨论
本团队前期的研究发现,整合素α6在肝癌组织中过表达,其过表达与肝癌肝内转移密切相关[12]。本实验通过检测整合素家族另一重要成员ITGAV在胆管癌组织和癌旁组织中的表达情况,分析ITGAV表达与胆管癌转移潜能及预后的关系,结果显示,ITGAV过表达可促进胆管癌转移,且与术后复发及生存时间密切相关,ITGAV可作为胆管癌术后早期复发和生存时间的潜在分子预测指标。
整合素是一类细胞外基质的跨膜黏附受体家族,目前发现整合素家族共有26个成员,其成员是由α亚基和β亚基结合构成的异源二聚体跨膜糖蛋白,并以异二聚体的方式发挥功能,参与肿瘤细胞的增殖、凋亡、迁移、侵袭,细胞转化,血管生成及转移等过程[16-18]。有研究表明,整合素与细胞外配体的结合可把细胞外信号传入细胞内,同时整合素(特别是β亚基)通过其胞内域直接作用于许多胞内结合蛋白,促进细胞骨架重组,影响细胞与基质的黏附或者改变骨架蛋白,从而提高或降低细胞的迁移和浸润能力[19-21]。ITGAV作为家族重要成员,可与多个β亚基结合组成异二聚体,在多种肿瘤细胞的侵袭转移中发挥非常重要的作用[8]。有研究表明,ITGAV过表达于食管癌,其过表达与淋巴结转移、TNM分期及预后不良显著相关[22]。ITGAV过表达可提高肿瘤细胞的迁移能力已在结肠癌细胞系实验中得到验证[23]。有研究发现,前列腺癌中肿瘤侵袭转移能力与ITGAV过表达密切相关[24]。目前已经证实ITGAV在子宫内膜癌、鼻咽癌、胃癌、胰腺癌等多种癌症中过表达,其过表达与肿瘤的侵袭转移密切相关[3]。
本实验随机选择胆管癌患者的胆管癌组织及癌旁组织(Ⅰ组),通过RT-PCR与Western blot检测发现ITGAV在胆管癌组织中的mRNA及蛋白表达水平明显高于癌旁组织,提示在胆管癌及癌旁组织中ITGAV存在显著差异表达;ITGAV的差异表达可能与胆管癌的侵袭转移密切相关。我们在上述实验基础上进行另外一组(Ⅱ组)组织芯片检测分析,结果显示,ITGAV过表达与肿瘤个数、肿瘤直径、肿瘤包膜完整(边界完整)、肝门淋巴结转移或局部侵犯、血管或胆管侵犯、TNM分期、Edmondson分级等转移潜能指标密切相关,而与性别、年龄、血清CA199水平、肝硬化、HBsAg等无关。提示ITGAV是胆管癌侵袭转移的相关指标。Kaplan-Meier分析显示,ITGAV过表达患者术后更易复发,生存时间更短,表明ITGAV过表达可促进胆管癌的侵袭转移,并与患者的生存预后密切相关,提示检测ITGAV表达对胆管癌患者的预后判断有一定的临床价值。有研究表明,沉默ITGAV后可抑制乳腺癌细胞增殖、侵袭和转移[8];在肝癌细胞研究中ITGAV过表达可促进肝癌细胞侵袭转移[25]。据此,本实验下一步拟应用慢病毒干扰等技术建立ITGAV高低表达胆管癌细胞株,通过体内外实验进一步证实ITGAV表达与胆管癌侵袭转移的相关性。
已有研究发现,整合素可与多种四跨膜蛋白相结合形成复合体,该复合体目前被认为是与恶性肿瘤进展相关的关键分子,是目前的研究热点[9]。进一步研究发现,复合体主要通过加强整合素介导的黏附能力,使得细胞从整合素配体上分离的能力大大减弱[9,26]。在胰腺癌细胞系中研究发现,整合素α6β4可与Tspan8结合形成四跨膜网络,诱导上皮间质转化,促进恶性肿瘤细胞的迁移[27]。在Tspan1与整合素α6β1相互作用研究中发现,复合体可通过诱导胆管癌上皮间质转化,从而加速胆管肿瘤细胞转移[28]。我们前期研究发现,整合素α6可以与Tspan8形成复合体(ITGα6-Tspan8)并相互作用,诱导肝癌细胞上皮间质转化,共同推进肝癌细胞的侵袭转移[12]。据此我们认为,ITGAV可与四跨膜蛋白结合形成ITGAV-TM4SF复合体,复合体相互作用共同促进胆管癌侵袭转移。但ITGAV与何种TM4SF结合形成复合体?复合体共同作用是否因诱导了上皮间质转化从而推进肿瘤的进展?其具体作用的分子机制仍需进一步深入研究。目前四跨膜蛋白与整合素的关系在肿瘤进展中的作用机制仍未阐明,下一步我们拟通过信号网络通路进一步阐述ITGAV促进胆管癌侵袭转移的分子机制。
综上,本研究结果初步证明胆管癌中ITGAV过表达可以促进胆管癌侵袭转移,并与胆管癌患者术后复发及生存预后密切相关,可作为胆管癌术后复发和预后的潜在分子预测指标。