2 600件医疗器械不良事件报告分析
丛林
大连市市场监管事务服务中心,辽宁大连 116021
《医疗器械不良事件监测和再评价管理办法》(国家市场监督管理总局令第1号)已于2018年8月13日经国家市场监督管理总局和国家卫生健康委员会审议通过并公布,自2019年1月1日起施行[1]。“国家医疗器械不良事件监测信息系统”也于2019年1月1日正式上线试运行[2]。该文希望以部门规章出台和系统配套上线为契机,通过对2019年1月1日—2020年12月31日,大连市市场监管事务服务中心(“该中心”)利用“国家医疗器械不良事件监测信息系统”,收集到已经审核通过的2 600件医疗器械不良事件报告的报告来源、事件伤害程度、管理类别及产品类别、医疗器械分类、报告数量排名、实际使用场所、事件原因、报告缺失项目等多个项目进行回顾性分析,以此为基础深入探讨新形势下提高医疗器械风险管理能力的途径与方法,为医疗器械监管部门科学监管提供技术支持,为医疗机构临床安全合理有效用械提供有益参考。现报道如下。
1 资料与方法
1.1 资料来源
该研究数据来源于该中心通过“国家医疗器械不良事件监测信息系统”收集到的报告。设置系统接收日期为2019年1月1日—2020年12月31日,剔除72件审核未通过和248件医疗器械上市许可持有人(以下简称持有人)未及时维护产品信息的报告,对余下2 600件有效报告进行回顾性分析。
1.2 方法
对该研究收集到的2 600件医疗器械不良事件报告进行回顾性分析,分析内容包括报告来源、事件伤害程度、管理类别及产品类别、医疗器械分类、报告数量排名前5位的无源医疗器械、报告数量排名前5位的有源医疗器械、实际使用场所、事件原因及报告缺失项目。
1.3 统计方法
运用Microsoft Excel电子表格软件对2 600件有效报告进行统计分析。医疗器械不良事件报告遵循“可疑即报”原则,该文所称医疗器械不良事件均指可疑医疗器械不良事件。
2 结果
2.1 报告来源分析
按照“报告类型”统计,2 600件医疗器械不良事件报告分别来自250家基层监测单位。使用单位上报2 120件(严重伤害161件,其他1 959件),占81.54%;经营企业上报480件(严重伤害207件,其他273件),占18.46%;持有人没有报告。见表1。

表1 2 600例医疗器械不良事件报告来源分析
2.2 事件伤害程度分析
按照“伤害程度”统计,2 600件医疗器械不良事件报告中,事件伤害程度为其他的报告2 232件,占85.85%;事件伤害程度为严重伤害报告368件,占14.15%;无死亡报告。见表2。

表2 2 600例医疗器械不良事件事件伤害程度分析
2.3 管理类别及产品类别分析
按照“管理类别”统计,2 600件医疗器械不良事件报告中,涉及Ⅲ类医疗器械的报告1 486件,占57.15%;涉及Ⅱ类医疗器械的报告1 034件,占39.77%;涉及Ⅰ类医疗器械的报告80件,占3.08%。按照“产品类别”统计,2 600件医疗器械不良事件报告中,涉及无源医疗器械的报告1 869件,占71.88%;涉及有源医疗器械的报告721件,占27.73%;涉及体外诊断试剂的报告10件,占0.38%。见表3。

表3 2 600例医疗器械不良事件管理类别及产品类别分析
2.4 医疗器械分类分析
按照“分类目录”统计,2 600件医疗器械不良事件报告中,除04-骨科手术器械、05-放射治疗器械和21-医用软件3个类别外,涉及到医疗器械分类目录中的其他所有类别。报告数量排名前5位的医疗器械类别为14-注输、护理和防护器械(32.92%),16-眼科器械(18.96%),07-医用诊察和监护器械(13.15%),18-妇产科、辅助生殖和避孕器械(9.54%),22-临床检验器械(4.46%),共占报告总数的79.03%。见表4。

表4 不良事件医疗器械分类分析
2.5 报告数量排名前5位的无源医疗器械分析
按照“产品名称”统计,2 600件医疗器械不良事件报告中,报告数量排名前5位的无源医疗器械分别为软性亲水接触镜、宫内节育器、一次使用输液器(带针/不带针)、一次性使用注射器(带针/不带针)和一次性使用导尿管,共占报告总数的43.58%。见表5。

表5 不良事件报告数量排名前5位的无源医疗器械
2.6 报告数量排名前5位的有源医疗器械分析
按照“产品名称”统计,2 600件医疗器械不良事件报告中,报告数量排名前5位的有源医疗器械分别为监护仪、血液透析装置、注射泵、心电图仪和一次性使用心电电极,共占报告总数的14.23%。见表6。

表6 不良事件报告数量排名前5位的有源医疗器械分析
2.7 实际使用场所分析
按照“使用场所”统计,2 600件医疗器械不良事件报告中,使用场所为医疗机构的报告2 047份,占78.73%;使用场所为其他报告371份,占14.27%;使用场所为家庭报告182份,占7.00%。见表7。

表7 不良事件医疗器械实际使用场所分析
2.8 事件原因分析
按照“事件原因分析”统计,2 600件医疗器械不良事件报告中,事件原因分析涉及产品原因(包括说明书等)的报告1 355份,占52.12%;事件原因分析涉及无法确定的报告624份,占24.00%;事件原因分析涉及患者自身原因报告491份,占18.88%;事件原因分析涉及操作原因的报告333份,占12.81%。见表8。
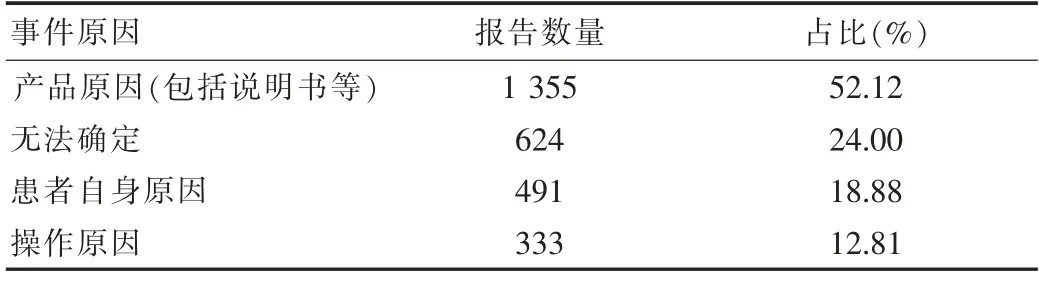
表8 医疗器械不良事件原因分析
2.9 报告缺失项目分析
按照“经营企业/使用单位报告信息”统计,2 600件医疗器械不良事件报告中,报告缺项占比排名前5位分别是医疗器械唯一标识(UDI)、合并用药/械情况说明、规格、有效期、产品编号。见表9。

表9 2 600例医疗不良事件报告缺项情况分析
3 讨论
3.1 使用单位报告积极、经营企业报告单一、持有人未履行报告义务
从报告来源分布情况来看,使用单位报告积极性较高,与使用单位是医疗器械不良事件主要接触者和直接救治者有关[3],更得益于医务人员敏锐的监测意识。经营企业上报的严重伤害病件均为软性亲水接触镜和隐形眼镜多功能护理液,其他病件中软性亲水接触镜和隐形眼镜多功能护理液占比94.51%,说明经营企业上报品种过于单一。持有人作为医疗器械不良事件报告的法定主体之一[4],未能履行报告义务。
3.2 报告涉及的医疗器械品种较为集中
从报告涉及的医疗器械类别与产品来看,报告数量排名前5位的医疗器械类别占报告总数的79.03%,报告数量排名前5位的无源与有源医疗器械产品共占报告总数的57.81%,说明监测所覆盖到的医疗器械品种较为集中,一线监测人员未能突破惯性思维,习惯拘泥于常见的重复性病件,未能全面反映医疗器械不良事件发生的客观性。
3.3 报告内容不规范
产品批号、产品编号和规格型号等项目是保证医疗器械可追溯性的重要信息,预期治疗疾病或作用、合并用药/械情况说明和事件原因分析描述等项目是开展医疗器械再评价工作的重要依据,上述项目的缺失或错误填写都会严重影响报告的准确性和完整性。有些项目填报不规范、过于简单也会使监测数据的分析利用价值大打折扣[5]。
3.4 报告数量同比减少
与往年相比,2019年和2020年的医疗器械不良事件报告数量有明显减少趋势。分析原因:①《医疗器械不良事件监测和再评价管理办法》对医疗器械不良事件的定义、报告范围、审核流程等进行修订,对收到的医疗器械不良事件报告数量有一定影响[6]。②机构改革导致基层监测人员流动较大,监测工作无专人推进,导致报告数量减少。
3.5 系统注册用户信息不准确不完整
《医疗器械不良事件监测和再评价管理办法》要求持有人、经营企业和二级以上医疗机构注册为国家医疗器械不良事件监测信息系统用户,主动维护其用户信息[1]。在实际工作中发现,很多系统注册用户的注册信息不准确、不完整,信息发生变动时也没有进行及时更新,甚至有使用单位错误注册为经营企业的情况。部分持有人未能及时维护产品信息,致使报告无法审核通过。
4 对策
4.1 强化制度保障
从各级监测技术部门到基层监测单位,应当依据《医疗器械不良事件监测和再评价管理办法》《医疗器械监督管理条件》等相关法律法规的要求,制订与该单位实际相适应的工作制度[7]。要明确目标、细化任务、强化措施、落实责任,确保各项工作制度的可操作性,保障医疗器械不良事件监测工作顺利开展。
4.2 重视宣传教育
要牢固树立宣传教育也是监测的理念,为基层监测人员答疑解惑、消除误区、解除顾虑[8]。既要重视对上报单位监测专干的培训,也要注重对临床一线医务人员的培训,特别是急诊科、检测科、手术室等高频使用医疗器械的科室人员。开展培训前,要经过充分需求调研,避免形式呆板,内容宽泛,与实际一线监测工作严重脱节的应付式培训,建议通过图文并茂地展示典型案件来增加直观性,力求有针对性、互动性[9]。
4.3 借力监管
各级监测技术部门不能闭门造车,要积极深入监测一线调研学习。可以借力医疗器械监管部门,把监测工作融入监管部门的日常监管和飞行检查项目中,与监管互为补充,互相促进,高质量高标准提升监测效能。通过加强实地指导与督导,迫使基层监测单位,特别是持有人监测意识与能力的改进和提升[10]。
4.4 优化系统功能与报表项目
建议通过优化系统功能与报表项目,减轻基层上报人员的工作量。①建议简化报表项目,如“型号”“规格”两项很多医疗器械并不区分,可以合并为“型号规格”一项。②建议加入“参考报告”,为基层上报人员提供规范模板,保证报告的准确性和完整性[11]。③建议尽早出台系统术语集的应用指南性文件,引导上报人员使用规范术语。
医疗器械事关人民群众身体健康和生命安全,该中心将继续坚决贯彻落实习近平总书记提出的“四个最严”要求[12],坚持问题导向、目标导向、结果导向,通过完善组织体系建设、创新宣传培训模式、加强监测队伍专业化等方式优化提升医疗器械风险预警和处置能力,不断提高公众对医疗器械不良事件监测工作的认知度和认可度。

