信迪利单抗注射液治疗晚期恶性肿瘤的疗效和安全性分析
张双燕,王童非,叶骉飞,魏娜
1西北大学附属医院·西安市第三医院肿瘤科,西安 710018
2西安国际医学中心医院肿瘤科,西安 710100
近年随着人民生活水平及生活质量的提高,恶性肿瘤的发病率越来越高,肿瘤免疫治疗是继手术、放化疗及分子靶向治疗后的一种新的肿瘤治疗手段。目前,细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte associated protein 4,CTLA4)抗体和程序性死亡受体1(programmed cell death 1,PDCD1,也称PD-1)抗体是免疫检查点抑制剂的代表性药物,能增强免疫细胞活性以杀伤肿瘤细胞,在肿瘤免疫治疗领域广泛应用[1-2]。目前,国内上市的PD-1抑制剂有进口的纳武利尤单抗、帕博利珠单抗、阿替利珠单抗以及国产的特瑞普利单抗、信迪利单抗和卡瑞利珠单抗。大部分肿瘤患者因经济因素不能承受进口免疫抑制剂费用,部分患者自愿选择国产免疫抑制剂信迪利单抗注射液进行治疗。故本研究观察分析信迪利单抗注射液治疗晚期恶性肿瘤的疗效及安全性,现报道如下。
1 资料与方法
1.1 一般资料
收集2019年8月至2021年1月西安国际医学中心医院及西安市第三医院收治的接受信迪利单抗注射液治疗的晚期恶性肿瘤患者的病历资料。纳入标准:已行基础一线、二线化疗失败诊断明确的患者或多线治疗后无标准治疗的晚期恶性肿瘤患者;卡氏功能状态(Karnofsky performance status,KPS)评分≥80分;有明确的病理诊断结果,有可评估病灶,影像学资料完整。排除标准:合并其他基础疾病。根据纳入、排除标准,共纳入68例晚期恶性肿瘤患者作为观察组,其中男性40例,女性28例;中位年龄58岁;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分:0分22例,1分33例,2分13例;肿瘤类型:肺腺癌20例,肺鳞状细胞癌16例,肾透明细胞癌/尿路上皮癌8例,肝癌6例,结直肠癌9例,食管癌9例。另选取同期30例选择化疗或靶向治疗患者作为对照组,其中男性19例,女性11例;中位年龄56岁;ECOG体力状况评分:0分11例,1分12例,2分7例;肿瘤类型:肺腺癌9例,肺鳞状细胞癌6例,肾透明细胞癌/尿路上皮癌7例,肝癌2例,结直肠癌3例,食管癌3例。两组患者性别、年龄、ECOG体力状况评分及肿瘤类型比较,差异均无统计学意义(P﹥0.05),具有可比性。本研究经医院伦理委员会审批通过,所有患者均知情同意并签署知情同意书。
1.2 治疗方法
对照组患者选择化疗或靶向治疗。观察组患者化疗或靶向治疗方案同对照组,并加用信迪利单抗联合治疗。68例患者中有43例患者采用信迪利单抗注射液联合化疗,25例患者采用信迪利单抗注射液联合靶向治疗,其中11例肺癌患者采用信迪利单抗注射液联合盐酸安罗替尼治疗,2例肝癌患者采用信迪利单抗注射液联合索拉非尼治疗,2例肝癌患者采用信迪利单抗注射液联合仑伐替尼治疗,4例食管癌患者采用信迪利单抗注射液联合盐酸安罗替尼治疗,4例直肠癌患者采用信迪利单抗注射液联合瑞戈非尼治疗,2例肾透明细胞癌患者采用信迪利单抗注射液联合阿昔替尼治疗。
具体用法:信迪利单抗注射液每次200 mg,每3周1次,与化疗或靶向药物同步。每2个月行影像学检查评估病情,记录治疗期间的不良反应。
1.3 观察指标
①临床疗效:采用实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)[3]评估疗效。完全缓解(complete response,CR):所有靶病灶消失;部分缓解(partial response,PR):靶病灶体积缩小≥30%;疾病进展(progressive disease,PD):靶病灶体积增加≥20%,最小5 mm,或非靶病灶进展或出现新病灶;稳定(stable disease,SD):靶病灶体积缩小没有达到PR,增加没有达到PD;客观缓解率(objective response rate,ORR)=(CR+PR)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。②不良反应发生情况:根据中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)颁布的《免疫检查点抑制药相关的毒性管理指南(2019)》[4]中不良反应分级评价标准,分为5个级别:G1,轻度不良反应;G2,中度不良反应;G3,重度不良反应;G4,危及生命的不良反应;G5,与不良反应相关的死亡。
1.4 统计学方法
采用SPSS 22.0软件进行统计学分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数及率(%)表示,组间比较采用χ2检验;以P﹤0.05为差异有统计学意义。
2 结果
2.1 治疗前后肿瘤靶病灶最大径缩小值的比较
治疗前后观察组患者靶病灶最大径缩小值为(33.45±11.16)mm,大于对照组的(27.54±9.15)mm,差异有统计学意义(t=2.055,P=0.043)。
2.2 临床疗效的比较
观察组患者ORR和DCR分别为36.8%(25/68)、76.5%(52/68),分别高于对照组的16.7%(5/30)、53.3%(16/30),差异均有统计学意义(χ2=3.958、5.246,P﹤0.05)。(表1)
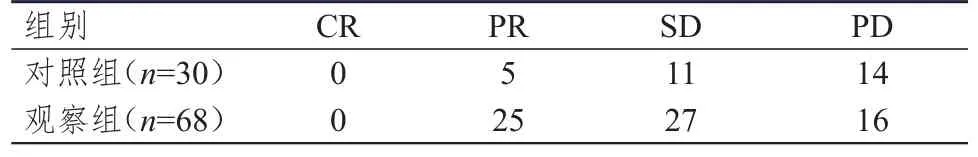
表1 两组患者的临床疗效
2.3 不良反应发生情况的比较
观察组患者发生G1~G2级不良反应41例(60.3%),G3级不良反应8例(11.8%)。治疗中患者对不良反应均能耐受,不影响后续治疗。(表2)
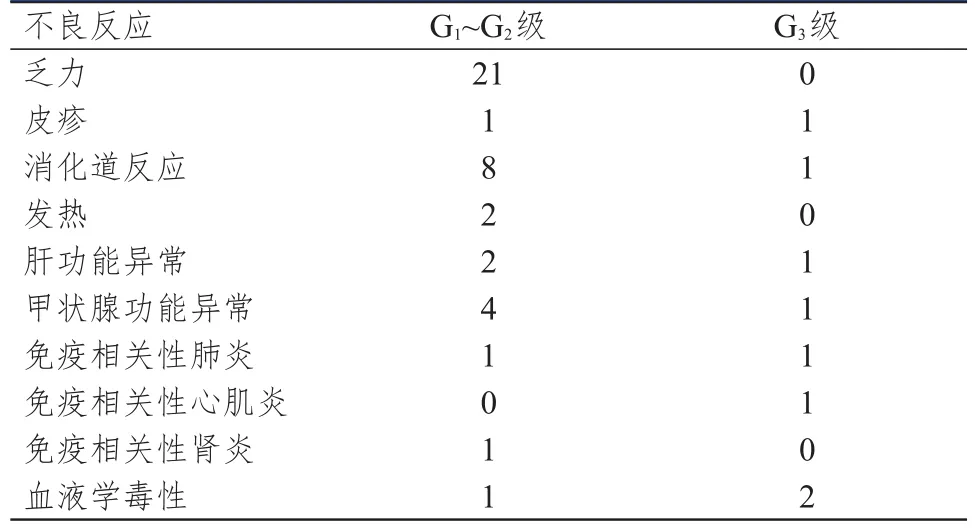
表2 68例观察组患者不良反应发生情况
3 讨论
肿瘤免疫治疗的机制是通过激发或调动机体的免疫系统,恢复机体正常的抗肿瘤免疫反应,从而控制和杀伤肿瘤细胞。近年肿瘤免疫治疗在黑色素瘤、霍奇金淋巴瘤、非小细胞肺癌、结直肠癌及泌尿生殖系统肿瘤等的治疗中展现出良好的抗肿瘤活性,在临床取得了重大突破,且大多数不良反应较轻,耐受性良好,有效的患者可以获得长期生存[5]。但对患者来说,价格过于昂贵。信迪利单抗注射液是第二款国产PD-1抑制剂,于2018年12月24日上市,是一种全人源化免疫球蛋白G4(immunoglobulin G4,IgG4)单克隆抗体[6]。目前信迪利单抗注射液临床多用于食管癌、非小细胞肺癌等多种实体肿瘤的治疗。
肺癌是目前病死率最高的肿瘤之一,多项研究显示,在肺癌治疗中,免疫治疗已经成为一线治疗方案,CheckMate 057是针对ⅢB和Ⅳ期既往经含铂双药化疗进展的非鳞状细胞非小细胞肺癌患者的主要研究。该研究入组582例患者,随机接受Nivolumab和多西他赛治疗,两组患者总生存期分别为12.2个月和9.4个月,ORR分别为19%和12%[7]。KEYNOTE-407研究证实,卡铂+紫杉醇或白蛋白紫杉醇联合Pembrolizumab一线治疗晚期肺鳞状细胞癌可带来显著的生存获益,Pembrolizumab联合治疗组患者中位总生存期为15.9个月,安慰剂对照组患者中位总生存期为11.3个月,且疗效与PD-L1表达水平无关[8]。一项6个队列、开放标签、多中心的Ⅰb期研究(NCT02937116),评价信迪利单抗联合吉西他滨/铂类治疗初期、局部晚期(Ⅲb期)、复发性或转移性(Ⅳ期)鳞状细胞非小细胞肺癌的有效性,研究发现,17例患者的ORR为64.7%[9]。本研究中,观察组36例肺癌患者中1例肺鳞状细胞癌患者术后经白蛋白紫杉醇联合信迪利单抗注射液治疗6个周期后达到CR,且总生存期大于20个月,其余肺癌患者治疗中PR 12例,SD 15例,PD 8例,临床疗效较对照组显著。
既往一项关于晚期食管癌患者接受Pembrolizumab治疗的临床Ⅰ期试验表明,ORR为30.4%,稳定率为13.0%,12个月无进展生存率为21.7%[10]。一项关于难治性食管癌采用Nivolumab治疗的临床Ⅱ期试验表明,治疗后ORR为17%,不良反应发生率为2%,无治疗相关死亡发生[11]。一项24例肛管鳞状细胞癌患者采用Pembrolizumab治疗的研究发现,DCR为58%,有16例患者出现恶心、腹泻等药物相关不良反应,未发生药物相关死亡[12]。一项关于晚期肝细胞肝癌患者采用Nivolumab治疗的临床Ⅰ/Ⅱ期试验则表明,治疗后CR率为5%,PR率为18%,SD率为46%[13]。Nivolumab于2017年8月被美国食品药品管理局批准用于DNA错配修复缺陷/微卫星高度不稳定转移性结直肠癌患者的治疗。本研究入组消化系统肿瘤患者共24例,观察组中PR 8例,SD 9例,PD 6例,对于晚期消化系统肿瘤的治疗,免疫治疗联合化疗较单纯化疗或靶向治疗有更好的临床疗效。
一项将PD-L1单抗Atezolizumb用于铂类化疗失败后的局部进展或转移性尿路上皮癌的临床研究显示,全组患者ORR为15%,其中CR率为5%[14]。本研究8例尿路上皮癌患者接受化疗联合信迪利单抗注射液治疗,其中CR 0例,PR 3例,SD 3例,PD 2例,本研究观察组患者ORR及DCR均高于对照组,总体疗效较好。
PD-1抑制剂在取得显著疗效的同时也会引起免疫相关不良反应。一项关于Nivolumab一线治疗后进展的肾癌随机Ⅱ期临床试验中,最常见的治疗相关不良事件是疲劳(35%),11%的患者出现3~4级不良反应[16]。ORIENT-1研究结果表明,信迪利单抗单药的安全性与Pembrolizumab、Nivolumab相似,未见预期外的不良反应发生[17]。本研究中60.3%发生G1~G2级不良反应,G3级不良反应发生率为11.8%,其中21例出现乏力,均为G1~G2级;9例出现消化系统症状,主要表现为纳差、恶心、腹泻,其中1例出现G3级恶心症状;5例出现甲状腺功能异常,其中1例为G3级甲状腺功能减退;3例出现转氨酶升高,1例为G3级转氨酶升高;3例出现血液学毒性,其中2例为G3级血小板减少;不良反应经对症治疗均取得控制,总体不良反应可控。
综上所述,信迪利单抗注射液联合治疗用于多线治疗后无标准治疗的晚期恶性肿瘤患者,疗效尚可,不良反应可耐受,患者经济压力小。本研究样本量小,信迪利单抗注射液免疫治疗的疗效与不良反应仍需大规模的临床试验进行验证。

