弱干旱下H2O2稳态调控大豆抗旱性的信号作用研究
陶雨佳,李蕾,任宗梁,卢城,宫青涛,邢兴华,江海东*
(1.南京农业大学农学院/农业部作物生理生态与生产管理重点实验室/江苏省现代作物生产协同创新中心,江苏 南京210095;2.江苏徐淮地区徐州农业科学研究所,江苏 徐州,221131)
干旱胁迫是重要的非生物胁迫因子,不但影响植物的生长代谢,而且严重时能导致作物产量下降50%[1,2]。大豆作为重要的油料作物,其生长需水量高,根系不发达,受干旱影响极为明显,对产量与品质都造成了严重损害[3]。因此,提高大豆抗旱性,对降低干旱造成的产量损失具有重要意义。
干旱胁迫会加速活性氧(ROS)的生成引起“氧化爆发”,导致蛋白质、DNA、脂质和其它细胞组分的损伤,从而影响正常的细胞功能,造成代谢功能障碍以致植物死亡[4]。一般认为ROS 只是有毒的有氧代谢副产物,可以通过酶和非酶系统的共同作用清除[5,6]。而越来越多的研究表明,ROS 作为重要的信号分子参与植物生长、发育,响应非生物和生物应激刺激,以及程序性细胞死亡等过程[7~9]。ROS 是否会起到破坏、保护或信号传导的作用取决于ROS的产生和清除在适当的位置和时间之间的微妙平衡[10]。与其他活性氧相比H2O2稳定性最高,因此作为信号分子研究最多[11~14]。但是近年来对大豆抗旱性的研究中多采用中度或重度干旱处理,或虽然进行了抗性锻炼,也只是研究作物对中重度干旱胁迫响应及其机理。在这种情况下,H2O2的信号作用与毒害作用混合在一起,不能清楚地阐明H2O2信号的作用机制。逆境条件下会导致植物体内细胞和组织功能的紊乱。在这样的生存条件下,维持细胞内氧化还原稳态是极其重要的[15]。在实验室前期研究中发现弱干旱下抗旱大豆品种科丰1号的大豆叶片中会积累H2O2,并持续一段时间,而在敏感品种南农99-6 中则不积累,这暗示着科丰1 号在弱干旱下形成了一种提高抗旱性的H2O2稳态[16,17]。因此模拟自然界中干旱发生进程,研究前期弱干旱下H2O2的含量变化对大豆干旱胁迫的调控作用,有助于我们深入了解H2O2在植物应对逆境的信号网络中的作用,并进而通过调节氧化还原水平来提高大豆抗旱性,为大豆抗旱栽培提供理论依据。
1 材料与方法
1.1 材料
供试大豆(Glycine mɑx)品种为科丰1 号,由南京农业大学国家大豆改良中心提供。
1.2 方法
在南京农业大学牌楼试验基地正常土培供试大豆长至三叶期,将大豆幼苗洗脱伤害后在26℃(12 h 光照/12 h 黑暗)光照培养箱中用Hoagland 营养液水培缓苗3 d。再通过聚乙二醇(PEG-6000)模拟干旱胁迫处理。本实验室前期研究发现0.5%和5%PEG 溶液对科丰1 号分别造成弱、强干旱胁迫,因此本实验设置4 个处理,3 次重复,分别为:(1)CK:Hoagland 营养液正常水培;(2)弱-强胁迫(WS)处理:0.5%PEG 溶液培养1 d 后转入5%PEG 溶液培养;(3)强胁迫(S)处理:正常水培1 d后转入5%PEG溶液培养;(4)弱胁迫(W)处理:0.5%PEG 溶液培养2 d。用Hoagland 营养液分别配制浓度为0.5%和5%的PEG-6000 处理液。处理共2 d,各处理分别于处理后第0、3、12、24和48 h取样。
1.3 测定项目与方法
1.3.1 叶片相对含水量测定 叶片相对含水量=[(鲜质量-干质量)/(饱和质量-干质量)]×100%[18]。
1.3.2 生理生化指标测定 丙二醛(MDA)含量测定采用赵世杰等[19]的改进方法;过氧化氢(H2O2)含量测定采用试剂盒(南京建成生物工程研究所提供);超氧阴离子自由基(O2-)产生速率测定方法采用羟胺法[20];SOD 活性测定采用NBT 法[21];POD 活性采用愈创木酚法[21];CAT 活性测定采用紫外吸收法[21];抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)粗酶提取液及测定参照施海涛[22]的方法;单脱氢抗坏血酸还原酶(MDHAR)和脱氢抗坏血酸还原酶(DHAR)提取和测定参考Krivosheeva 等[23]的方法;谷胱甘肽过氧化物酶活性(GPX)活性测定参考Barbara 等[24]的方法;抗坏血酸(ASA)及还原型谷胱甘肽(GSH)的含量参照Renu 等[25]及Wang 等[26]的方法。
1. 4 数据处理
所有数据均采用3 次重复的平均值,采用Excel 2019 进行数据统计,采用SPSS 17.0 对试验数据进行差异显著性分析,运用Sigmaplot 12.5软件绘图。
2 结果与分析
2.1 不同干旱处理对大豆叶片形态的影响
如图1 所示,正常培养下,大豆叶片呈正常状态。24 h 时的W 处理(图1C)中大豆叶片相较于CK处理,叶片边缘略微发黄,未造成显著伤害。48 h时的W 和WS 处理(图1D 和E)中的大豆叶片出现明显卷曲,失绿现象,两处理受干旱胁迫伤害程度无明显差异。此时,48 h 时的S 处理(图1F)中大豆叶片显著卷曲,失绿严重,干旱胁迫伤害程度显著高于W和WS处理。

图1 不同干旱处理下大豆叶片形态Fig.1 Soybean leaf morphology under 4 drought treatments
2.2 不同干旱处理对大豆叶片相对含水量的影响
如图2 所示,弱干旱胁迫(0.5%PEG 溶液)处理3 h 内,大豆叶片相对含水量对比CK 显著降低(P<0.05,下同),之后又迅速回升,24 h时略高于CK,差异不显著。强干旱胁迫(5%PEG 溶液)处理后,随着干旱时间的持续,WS 处理中的叶片相对含水量进一步降低显著低于CK,但要高于S和W处理。
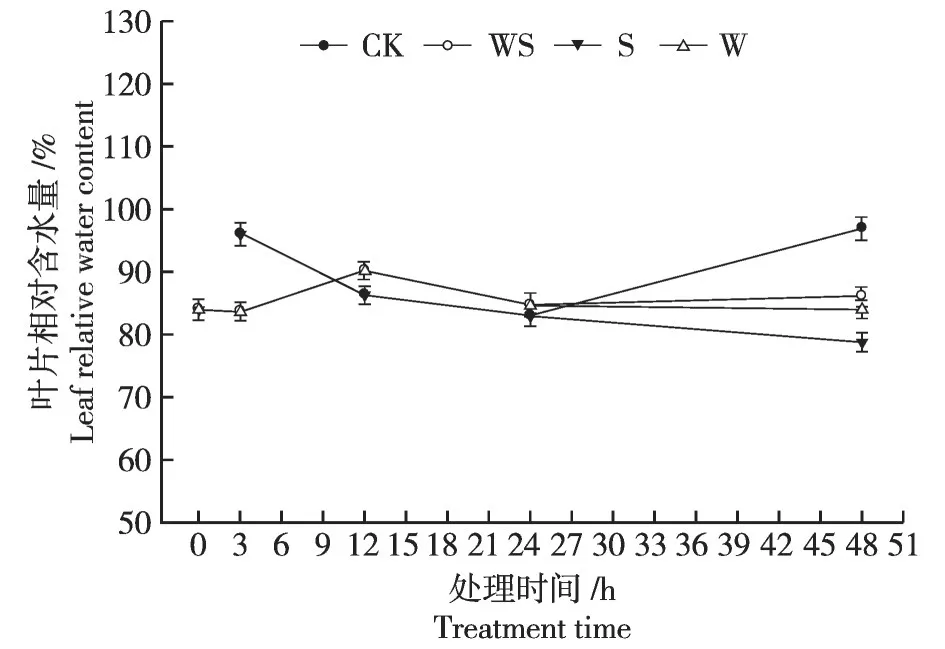
图2 不同干旱处理下大豆叶片相对含水量Fig.2 Relative water content in soybean leaves under 4 drought treatments
2.3 不同干旱处理对大豆叶片抗氧化系统的影响
2.3.1 对叶片MDA 含量的影响 如图3 所示,弱干旱胁迫处理3 h 内,大豆叶片中MDA 含量迅速降低,显著低于CK,虽然之后开始上升但在24 h 时仍低于CK。WS处理中1 d强干旱胁迫处理后MDA 含量虽然相对CK显著上升,但W和S处理均大幅度升高,48 h时MDA含量显著高于WS处理。
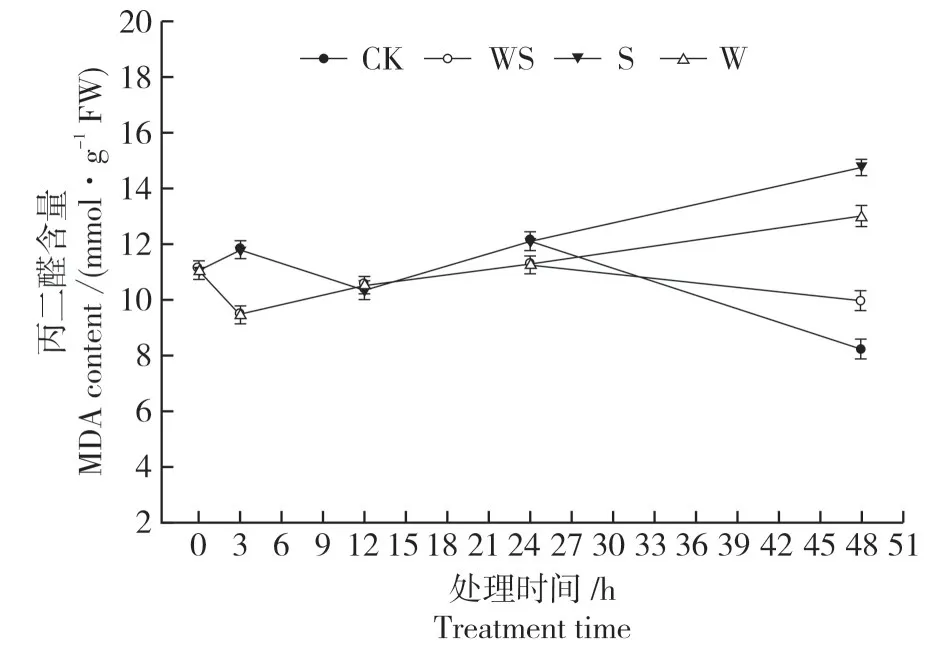
图3 不同干旱处理下大豆叶片MDA含量Fig.3 MDA content in soybean leaves under 4 drought treatments
2.3.2 对叶片活性氧水平的影响 如图4A 所示,正常培养下,大豆叶片中O2-产生速率没有发生明显波动。弱干旱胁迫处理后,相较于CK 轻微促进了叶片中O2-的产生速率。WS处理中强干旱胁迫处理后,叶片中O2-的产生速率继续平缓上升。S 和W 处理中叶片中O2-的产生速率迅速增加,48 h时显著高于WS处理。
如图4B 中所示,正常培养下,大豆叶片中H2O2含量呈现先下降后上升的趋势。弱干旱胁迫处理3 h内,大豆叶片中的H2O2含量迅速上升并在3 h时达到峰值,随后开始下降但含量明显高于CK。WS 处理中强干旱胁迫处理后H2O2含量再次增加但与CK差异不显著。此时W 和S 处理中H2O2含量呈急剧上升的趋势,48 h时含量显著高于WS处理。
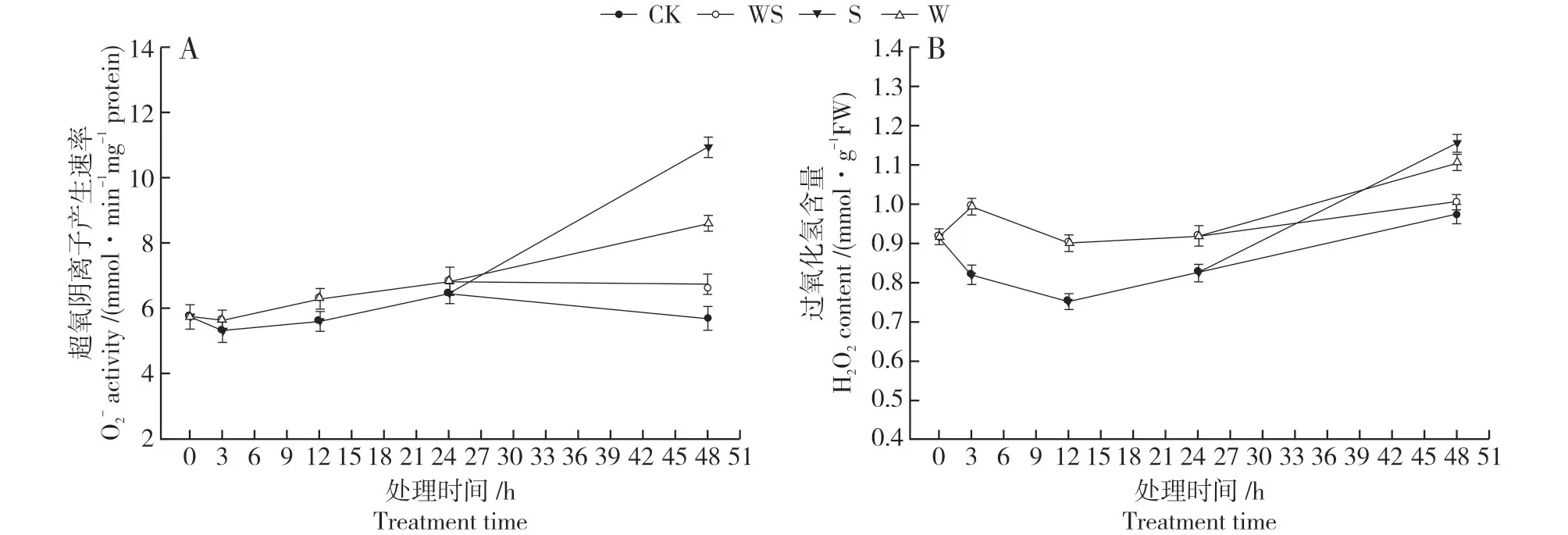
图4 不同干旱处理下大豆叶片O2-产生速率及H2O2含量Fig.4 O2-production rate and H2O2 content in soybean leaves under 4 drought treatments
2.3.3 对叶片SOD、POD 和CAT 活性的影响 如图5A所示,弱干旱胁迫处理后,对比CK促进了大豆叶片中SOD 酶活性大幅度增加。强干旱胁迫处理后,随着干旱程度的加深,WS 处理中的SOD 活性继续平缓上升。此时S 和W 处理叶片中SOD 活性虽然对比CK明显增加,但48 h时显著低于WS处理。
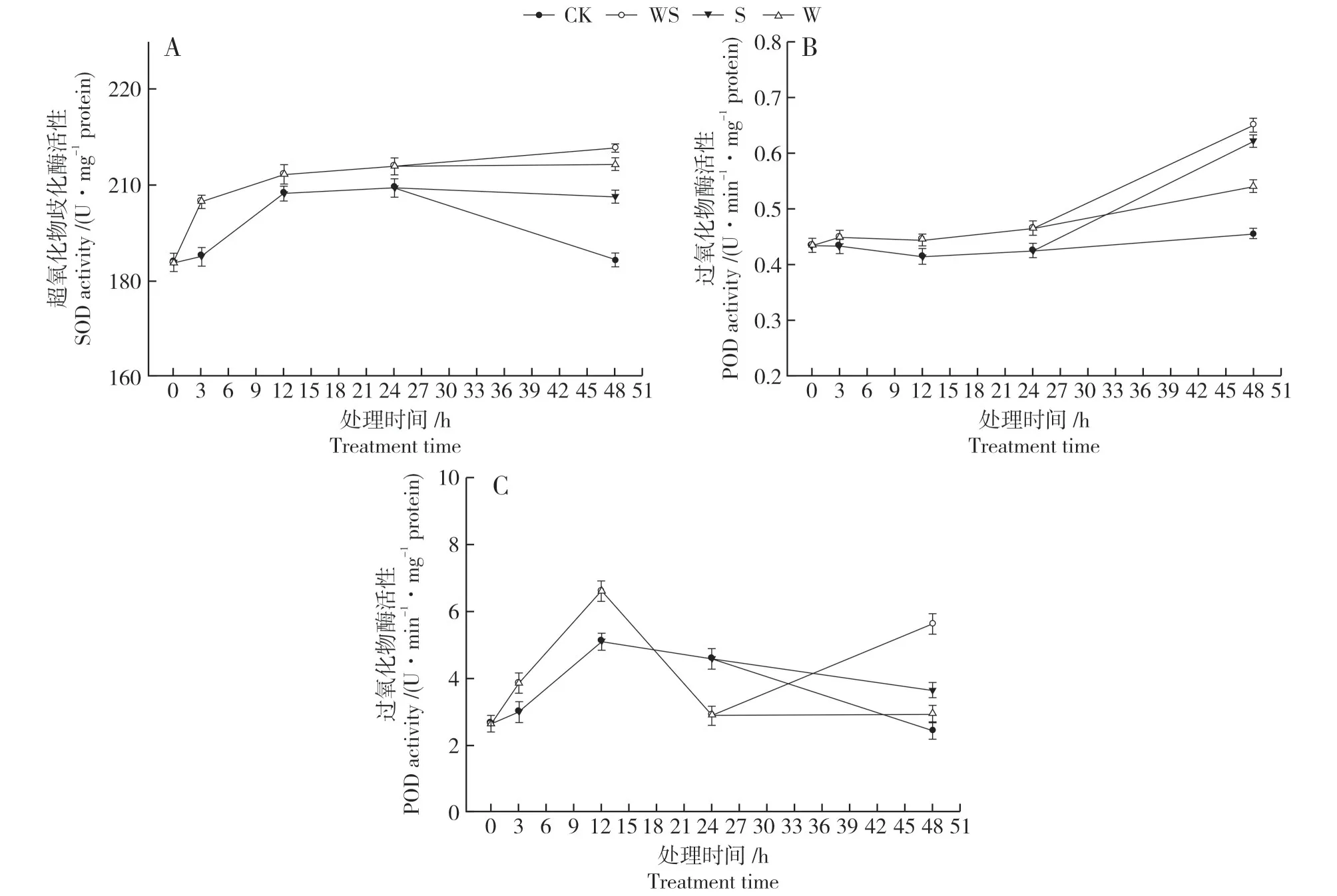
图5 不同干旱处理下大豆叶片SOD、POD和CAT活性Fig.5 SOD,POD and CAT activities in soybean leaves under 4 drought treatments
如图5B 所示,正常培养下,大豆叶片中的POD活性维持在一定水平。弱干旱胁迫处理后,大豆叶片中的POD 活性略有升高。强干旱胁迫处理后,WS 处理中的POD 活性迅速上升,与CK 差异极显著。虽然S 和W 处理中POD 活性均有增加,但在48 h时低于WS处理。
如图5C 所示,弱干旱胁迫处理后,大豆叶片中的CAT 活性急剧升高后又迅速降低。强干旱胁迫处理后,WS 处理对比CK 叶片中CAT 活性再次大幅度增加,此时S处理中CAT活性迅速降低,W 处理中CAT 活性 略微增加,48 h 时WS 处理中CAT 活性高于S和W处理,差异极显著。
2.3.4 对叶片抗坏血酸和谷胱甘肽含量的影响如图6A 所示,正常培养下,大豆叶片中的AsA 含量没有明显变化。弱干旱胁迫处理后,促进了大豆叶片中AsA含量的显著增加。强干旱胁迫处理后,WS处理中AsA 含量大幅度提高,与CK 差异显著。随着处理时间的持续,S 和W 处理也有不同程度的增加,但增加幅度均低于WS处理。
如图6B 所示,正常培养下,大豆叶片中的GSH含量无明显波动。弱干旱胁迫时促进了大豆叶片中GSH 含量的显著升高。强干旱胁迫处理后,WS处理中GSH 含量上升幅度不大,但W 和S 处理都快速上升,48 h时GSH含量显著高于WS处理。
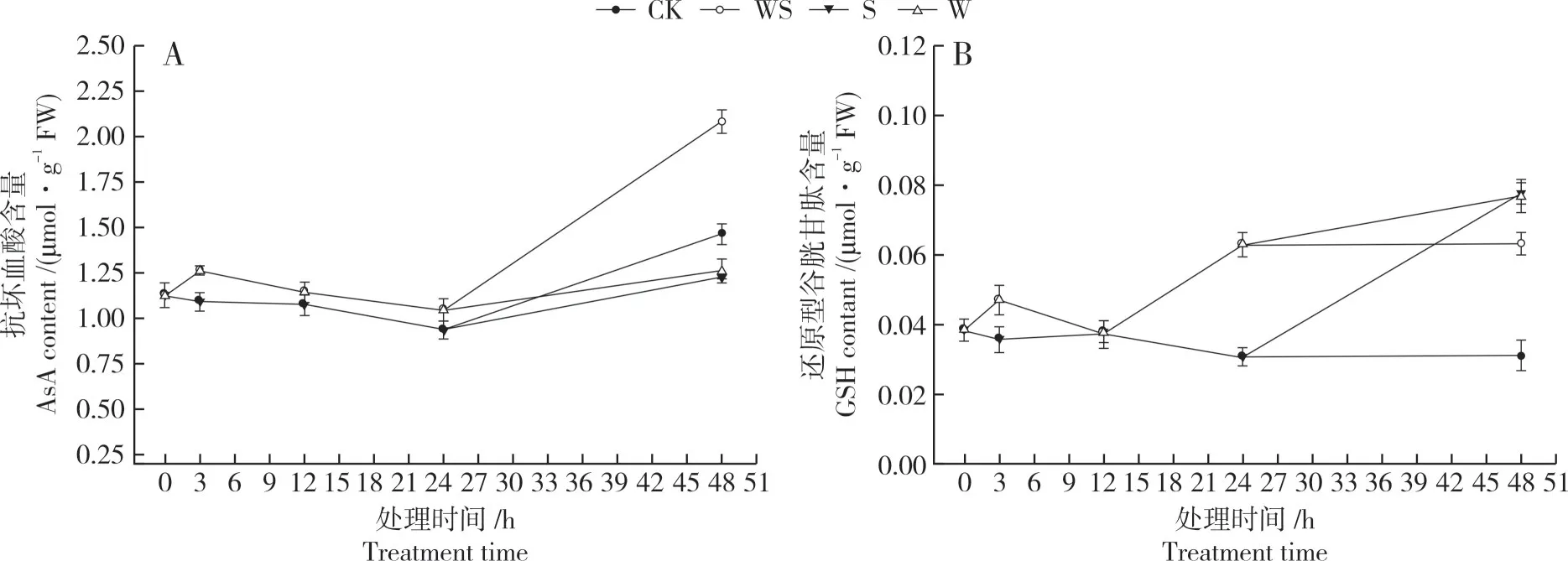
图6 不同干旱处理下大豆叶片AsA和GSH含量Fig.6 AsA and GSH contents in soybean leaves under 4 drought treatments
2.3.5 对大豆叶片APX 和GPX 活性的影响 如图7A 所示,正常培养下,大豆叶片中的APX 活性呈上升趋势。整个处理中随胁迫程度的加深,WS 处理中APX 活性对比CK 持续性增加。后期处理中,S和W 处理中的APX 活性虽然也升高了但显著低于WS处理。
如图7B 所示,正常培养下,大豆叶片中的GPX活性呈先上升后下降的趋势。弱干旱胁迫处理后,大豆叶片中的GPX 活性迅速上升后下降,强干旱胁迫处理后,WS 处理相对于CK 再次大幅度增加且极显著高于S和W处理。

图7 不同干旱处理下大豆叶片APX和GPX活性Fig.7 APX and GPX activities in soybean leaves under 4 drought treatments
2.3.6 对大豆叶片MDHAR、DHAR 和GR 活性的影响 如图8A 所示,弱干旱胁迫处理后,大豆叶片中MDHAR 活性相对于CK 迅速增加,随后开始降低。在强干旱胁迫处理后,WS、S 和W 处理中MDHAR 活性都快速上升与CK 产生显著差异,在48 h时WS处理中MDHAR活性略高于S和W处理。
如图8B 所示,弱干旱胁迫处理后,显著提高了大豆叶片中DHAR 活性并维持一段时间后再开始降低。强干旱胁迫处理后,WS 处理中的DHAR 活性再次升高,与CK差异极显著。此时S和W处理都有不同程度的降低,但均略高于CK 而显著低于WS处理。
如图8C 所示,弱干旱胁迫处理后,相较于CK,大豆叶片中GR 活性显著上升并持续了一段时间。强干旱胁迫处理后,WS 处理中GR 活性再次大幅度升高,对比CK 差异极显著。此时S 和W 处理中GR活性虽有增加但显著低于WS处理。

图8 不同干旱处理下大豆叶片MDHAR、DHAR和GR活性Fig.8 Activities of MDHAR,DHAR and GR in soybean leaves under 4 drought treatments
3 讨论与结论
作物会随着干旱时间和程度的加深产生越来越多的活性氧,活性氧的积累会导致膜脂过氧化,破坏细胞结构,影响作物正常生长与发育等[27]。在恶劣环境条件下维持水分状况是保证植物正常生长的普遍现象,相对含水量是植物最重要的干旱胁迫指标,可作为耐旱性的指标[28]。在本研究中,大豆幼苗在强干旱(S)处理24 h 后,O2-产生速率和H2O2含量增加,活性氧水平升高,导致MDA含量升高,细胞受到伤害,相对含水量下降,叶片显著卷曲失绿。而在弱干旱(W 和WS)处理24 h 后,O2-产生速率、H2O2含量、MDA 含量和叶片萎蔫程度都低于S 处理,表明受伤害程度与胁迫强度成正比,这与前人结果一致[29]。但是与CK 处理相比,O2-产生速率、H2O2含量虽显著高于CK,MDA 含量却显著低于CK,相对含水量略高于CK,但差异不显著,表明此时植株未受伤害或伤害较小。而随着时间的延续,W 处理在48h 出现较大伤害,但叶片卷曲失绿程度仍低于S处理,而WS处理在强胁迫下伤害程度与W处理差别不大,远低于S处理。
活性氧的伤害水平除了与氧化损伤标记(脂质过氧化)做比较,还必须与抗氧化剂标记(即抗氧化酶和抗氧化物质)相结合,才能较好地衡量氧化胁迫[30]。抗氧化酶在控制ROS过度积累和维持细胞氧化还原平衡方面起着重要作用[31],Noctor 等认为称之为“ROS 处理酶”或者“ROS 相关酶”更为准确[32]。抗坏血酸是丰富而稳定的抗氧化剂,具有适当的氧化还原电位,并维持一个普遍的还原状态,通过整合代谢信息和环境刺激来调节细胞信号网络中的反应[33],是氧化还原中枢的关键角色,在氧化还原稳态和信号传导中也发挥重要作用[34]。在本试验WS处理中,弱干旱胁迫3 h 时出现H2O2峰值,增加幅度持续至12 h,基本保持稳定(20%左右)。与此相应,此时间段内MDA 含量低于CK,抗氧化酶(SOD、POD、CAT、APX、GPX)酶活性、AsA 含量、DHAR 和GR 酶活性相对CK 处理保持增长,且增加幅度变化较小。非酶类和酶类H2O2清除剂调节了H2O2水平[35],两者共同作用下与H2O2形成了一种缓冲体系,形成并维持了H2O2稳态,起着信号作用,使得强干旱处理24 h 后,WS 处理植株中各种抗氧化酶活性显著高于S 处理,O2-产生速率、H2O2含量和MDA 含量显著低于S处理,明显提高了植株相对含水量,说明WS处理增强了大豆的抗旱性。
但H2O2稳态的持续有其时效性。在本实验中,弱干旱胁迫24 h 时,H2O2含量增幅减小,虽然SOD、POD、APX 活性和AsA 以及GSH 含量仍高于CK,但此时部分酶活性如CAT、MDHAR、DHAR、GR 和GPX 活性开始降低,均低于CK,说明在相同胁迫强度下H2O2稳态不能长时间保持,其信号作用会逐步减弱并消失。因此比较W处理在24h和48 h时的抗氧化系统可以发现,48 h 时SOD、CAT、APX、GR 酶活性和GSH 含量无明显增加,POD 酶活性和AsA 含量小幅度上升,GPX 和DHAR 酶活性逐渐下降,表明抗氧化能力下降,氧化伤害增加。而WS 处理表现优于W 处理,说明新的外界刺激会进一步加强H2O2稳态。
综上所述,在弱干旱胁迫条件下内源H2O2产生积累,并与抗氧化剂形成缓冲体系,在抗氧化酶的共同作用下形成持续的稳态,从而形成信号提高强干旱下大豆的抗氧化能力,增强了大豆的抗旱性。但这种信号作用具有时效性,在没有新的外界刺激的情况下会逐渐减弱。

