芸薹属二倍体种的基因组结构及细胞遗传学研究进展
邵玉娇,曾攀,李再云*
(1.湖北第二师范学院化学与生命科学学院,湖北 武汉,430205;2.作物遗传改良国家重点实验室/华中农业大学植物科学技术学院,湖北 武汉,430070)
十字花科或芸薹科(Brɑssicɑceɑefamily)的3600多个种被划归321 个属,这些属再被指定至49 个族(Tribes)。系统演化研究表明在族的水平上芸薹科可划分为三大系谱(Lineages I-III),模式植物拟南芥(Arɑbidopsis thɑliɑnɑ)所在的亚麻荠族(Cɑmelineɑe)属于Lineage I,而芸薹族(Brɑssiceɑe)属于Lineage II[1];且Lineage I、II 衍生于大约2 千多万年前的同一个祖先。该科植物的染色体组基数为x = 4~13,但较多物种具有x = 8,这可能为共同的祖先染色体组[2]。随着基因组测序物种的增加,可通过比较基因组学研究基因组的进化历史并重建祖先染色体组。特别是芸薹族在进化过程中还经历了祖先染色体组/基因组的三倍化事件(WGT,whole genome triplication),由此古老的六倍体(paleohexaploid)基因组演化出染色体数目不同的3个芸薹属栽培二倍体种;传统细胞遗传学的研究也提出二倍体为古多倍体的假说。至今,3 个芸薹属栽培二倍体种的基因组已测序,进一步验证并解析三倍化事件,并重建芸薹属3个二倍体种的祖先染色体结构。本文综合分析细胞遗传学及基因组学在芸薹属基因组结构及进化方面的进展。
1 芸薹科的祖先核型重建
拟南芥是第一个测序的植物基因组,被选择的部分原因是其与农业重要的芸薹属作物的系统关系[3]。 Parkin 等[4]根 据AFLP(amplified fragment length polymorphism)作图首先确定白菜与拟南芥共同的21 个基因组区段。基于多至数百个的拟南芥BAC 克隆遗传图谱及比较染色体作图(comparative chromosome painting,CCP),Schranz 等[5]鉴定出不同物种中保守的24 个基因组区段(A~X),并认为现在的基因组进化于8条染色体组成的芸薹科祖先核型(AncestralBrɑssicɑceɑeKaryotype,ABK)。随后,利用琴叶拟南芥(A. lyrɑte,2n=16), 荠菜(Cɑpsellɑ rubellɑ,2n=16),盐芥(Thellungiellɑ pɑrvulɑ, 2n=14)和白菜(Brɑssicɑ rɑpɑ,2n=20)等的基因组序列[6~9],对此基于24 个基因组区段的祖先核型进行了改进[10]。ABK 进化形成两个原始核型:8 条染色体的ACK 核型(ancestral Camelineae Karyotype,x = 8)、7 条染色体的PCK 核型(Proto-Calepineae Karyotype,x = 7)。在进化过程中通过这些染色体区段的重排(染色体融合、倒位、易位),衍生出染色体基数减少的核型[11]。如ACK经历了2次相互易位、3次染色体融合和至少3 次倒位,使拟南芥的染色体数减至x = 5。而ABK 经过3 次易位和2 次倒位进化出7 条染色体组成的PCK 核型,此核型经过三倍化形成白菜的基因组。Schranz 等[5]在白菜中检测出预测的72 (3 ×24)个基因组区段的61 个,而Cheng 等[12]最近找出105个基因组区段或亚区段。由于利用24个基因组区段进行基因组成对比较的分辨率低,Murat等[13]基于多个物种基因组信息建立了高分辨率的芸薹科祖先核型,该核型的8 条染色体包含20 000 余个排序及定向的原基因(protogenes),衍生的PCK 核型的7条染色体包含21 000余个排序的原基因。
2 芸薹属二倍体祖先基因组的建立
由于现存的芸薹属二倍体种在进化中经历了两次异源多倍化或六倍化事件,基因组经历了复杂的结构变异,只有借助基因组测序才能解析该事件对基因组结构的影响。目前3个二倍体种的基因组均已测序[9,14,15],序列分析显示它们基因组中三倍化的PCK 核型染色体经历了基因含量的不同程度的分选(fractionation),形成称为LF(least fractionated)、MF1(medium fractionated)、MF2(most fractionated blocks)的3 个基因组区块(genomic compartments),它们在基因保留及表达水平上表现出LF>MF1>MF2的亚基因组显性(subgenome dominance)。三个亚基因组之间在基因组结构改变与基因保留方面的显性关系是在两步进化过程中形成的,第一次杂交在MF1与MF2间,以MF1为基因丢失较少的显性亚基因组,第二次在MF1-MF2 与LF 间,以LF 为基因丢失最少的超显性亚基因组,以MF2 为基因丢失最多的亚基因组[9,13,15]。二倍体基因组间的同一染色体区段在基因留存量上有差异。三倍化的直系同源区段的系统发育分析证实3个二倍体共有全基因组三倍化[15]。PCK 核型三倍化后经历了染色体的融合与断裂,使染色体数目从n=21 降低至3 个二倍体的n=8、9、10,相应的21 个着丝粒只部分得以保留,如白菜第1、3、4、5、6、7 和10 条染色体的着丝粒来自PCK 核型的第2、2、7、1、5、3 和6 条染色体的着丝粒,而第2、8、9 条染色体的来自PCK 5-6、1-7、2-6 两条不同染色体着丝粒的融合,其余的通过倒位及易位丢失[13]。
根据3 个二倍体的基因组测序结果及比较分析[9,14,15],Perumal 等[15]建立了三倍化后芸薹属特异的祖先基因组,它具有9 条原始染色体,由178 区段组成,基因组大小为321 Mb(图1)。根据系谱内恒定的变化速率的分子钟假说,该祖先应是白菜(B.rɑpɑ)和甘蓝(B. olerɑceɑ)的最近的共同祖先,而与黑芥(B. nigrɑ)关系较远;白菜/甘蓝与黑芥大约在11.5 My(million years)前分开,而白菜与甘蓝只在大约6.8 My 前分开。白菜和甘蓝的染色体与祖先染色体具有广泛的同源性,故白菜和甘蓝的染色体间的同源性区段也较多,特别是1 与2 号染色体间的区段基本上完全同源。而黑芥染色体的形成经历了更多的重组,与白菜和甘蓝染色体间的同源性较低。
就每个基因组内染色体的构成而言,白菜的A1与A2 染色体基本上保留1 与2 号原始染色体的组成、A4 染色体则保留6 号原始染色体的组成、A8 染色体则保留4 号原始染色体的组成。其余6 条染色体则至少由来自2 条原始染色体的区段连接而成,A3、A6、A9、A10 染色体均含有来自9 号原始染色体的一个大区段,该区段占A9、A10 染色体的几乎一半,A3染色体的一大半及A9染色体的一小半来自3号原始染色体,这4 条染色体间可进行部分同源配对形成二价体或多价体;A5、A7 染色体基本上由来自5 和8 号原始染色体的区段组成,差不多各占一半,它们之间部分同源性最高、最有可能配对形成二价体(图1)[15]。
甘蓝的C1 与C2 染色体也基本上保留1 与2 号原始染色体的组成、C9 染色体则保留9 号原始染色体的组成。其余6 条染色体中的5 条包含来自2 条原始染色体的区段,C7 染色体的一半也来自9 号原始染色体而另一半来自5 号原始染色体的区段,C5与C6 染色体由来自7 和8 号原始染色体区段构成,C5染色体中各占一半,C6染色体中8号原始染色体占多半。C3 和C8 染色体的区段来自3 与4 号原始染色体,C3 染色体的大部分由3 号原始染色体提供,C8染色体的多半来自4号原始染色体。C4染色体的区段来自5、6、9 号原始染色体,其中6 号原始染色体的占一半,9 号原始染色体的只占很少部分,余下的来自5 号原始染色体,与C7 染色体的一半相同。故部分同源配对可发生在C5 与C6 间、C4 和C7和C9间、C3和C8间(图1)。
黑芥没有保留完整的原始染色体,基因组中的每一条染色体都由来自至少三条原始染色体的区段组成;就来自相同原始染色体的区段而言,B2 与B8 染色体在末端有较大的区段来自3 号原始染色体,B3与B7染色体在末端有较大的区段来自4号原始染色体,在这两对染色体间最有可能发生部分同源配对(图1)。
就基因组间的同源性而言,A1 与C1、A2 与C2间的同源性最高,各自来源于同一条原始染色体。其余3个基因组的染色体间具有大小不同的同源区段,A 与C 间的区段较大,二者与B 基因组间的同源区段较小。可预期包含A、C 组的杂种的基因组间配对频率高于A、B组与B、C组杂种的频率(图1)。

图1 根据比较基因组学建立的具有9条染色体的芸薹属祖先基因组及衍生的三个二倍体种的染色体组成Fig.1 Brassica ancestral genome with nine chromosomes and the chromosome components of three diploids through comparative genomic analysis
3 芸薹属细胞遗传学与二倍体的基因组结构
芸薹属细胞遗传学开始于1916年,因这一年日本研究人员N. Takamine 报道了白菜型油菜的染色体数(见印度科学院院士Shyam Prakash教授于2009年8月在韩国釜山举行的纪念著名芸薹属细胞遗传学家禹长春(Nagaharu U)逝世50周年学术研讨会的综述文章)[16]。日本科学家Toshitario Morinaga 采用木原均(Hitoshi Kihara)在小麦中使用的著名的染色体组分析(Genome analysis)方法[16],开创了芸薹属栽培种的染色体组分析,以解析它们之间的细胞遗传学关系;他在1928-1934 年间进行6 个栽培种之间各种组合的杂交并观察染色体的配对行为,提出芸薹属栽培种包含3个基本的二倍体种,即黑芥(n=8,B)、甘蓝(n=9,C)和白菜型油菜(n=10,A),及3 个高染色体数的四倍体种,即埃塞俄比亚芥(n=17,BC)、芥菜型油菜(n=18,AB)和甘蓝型油菜(n=19,AC),它们起源于自然界的趋同异倍性进化(convergent alloploid evolution)。在同一时期,日籍朝鲜科学家禹长春开展了系统的芸薹属细胞遗传学研究,建立6 个栽培种之间起源的细胞遗传学,即著名的禹氏三角(U-triangle),并且通过推测的亲本白菜型油菜与甘蓝的杂交实验合成甘蓝型油菜而验证3个高染色体数栽培种的异源多倍性起源[17]。德国科学家G. Röbbelen[18]对减数分裂粗线期染色体形态进行研究,提出了3 个二倍体种的原始核型及染色体组成,认为它们具有6条基本染色体,不同染色体具有1-3个拷贝,故认为3个二倍体种为x=6的次级平衡多倍体(secondarily balanced polyploids),这暗示染色体组内存在部分同源性(homoeology)。
通过观察3 个二倍体种单倍体的染色体配对,可直观显示染色体间的部分同源性程度,推测染色体基数(x),因一个基因组内的同源配对(autosyndesis)反映的是由区段重组产生的染色体间的节段同源性,或有关染色体的共同起源[19]。Prakash、Armstrong 和Keller 通过研究黑芥、白菜及甘蓝单倍体的染色体配对情况,发现它们最大的配对构型分别为2II+4I,3I+2II+1III 及4I+1II+1III,支持三个二倍体基因组的x=6的推论[20~22]。
利用可区分A与C组染色体的BAC荧光原位杂交方法,Nicolas 等[23]在甘蓝型油菜品种Darmor-bzh单倍体中观察到最高有2对A基因组内的A-A 同配二价体(autosyndetic bivalents)和2 对C 基因组内的C-C同配二价体。在三个四倍体种间杂交产生的三基因组杂种(AABC,BBAC 和CCAB)中,Mason 等(2010)[24]观察到在A、B、C 单倍体基因组内最多有3对A-A、2 对B-B 和2 对C-C 同配二价体,虽然这些基因组来自天然异源四倍体且经历进化过程。在天然及人工合成甘蓝型油菜和黑芥杂交、埃塞俄比亚芥和白菜型油菜杂交的三基因组杂种(AC.B,A.C. B 和BC. A)内,最多有2 对B-B 同配二价体出现[25],虽然B 基因组来源于埃塞俄比亚芥或黑芥。特别的是,崔成等(2012)[26]采用基因组原位杂交(GISH)和BAC荧光原位杂交方法,分析三个二倍体种的成对正反交所获得的二基因组二倍体和三倍体杂种(A.B 和BB.A,A.C 和CC.A,B.C 和CC.B)、三基因组三倍体种杂种(A.C.B 和C.A.B),发现A或C单倍体基因组中最多有2或3对同配二价体,但单倍体B 基因组中仅有2 对。这些不同来源的B 基因组一致形成2 对同配二价体,为芸薹属基因组起源于x=6的基本核型的理论提供了染色体证据。另外,来自二倍体和异源四倍体的每一个基因组内的同配程度相似,表明基因组结构在异源多倍化中大体得以保持,而B 基因组比A 和C 基因组更稳定,受基因组和细胞质类型影响较小。
这些细胞学观察揭示的基因组内的同源性,与上述基于芸薹属祖先染色体建立的二倍体染色体结构所预期的基本相符。
4 芸薹属基因组间部分同源关系
种间杂种内基因组间的染色体配对水平可度量基因组间的部分同源性高低。传统细胞学研究的结论是,A 和C 基因组之间的配对水平高于B和C及A 和B 基因组间的配对,说明A 和C 基因组之间的同源性更高及亲缘关系更近,而B 和C 及A 和B基因组间的同源性较低及亲缘关系较远(见Prakash的综述文章)[27]。崔成等[26]通过3个二倍体种的成对杂交合成的3 个杂种(A.C、A.B、B.C)中,出现的最多异源配对二价体数分别为8、5、5,A 与C组间的配对二价体数基本上达到最高数。这些基因组间的配对差异应主要归因于它们间的染色体结构差异,因芸薹属中还未发现小麦中抑制部分同源配对的遗传调控系统。这也为3个二倍体种的最新基因组结构提供了细胞遗传学证据。有意思的一个现象是,天然甘蓝型油菜单倍体的配对频率显著低于白菜型油菜与甘蓝杂交产生的杂种的配对,这可能是由于在进化中发生的染色体结构重组加大了甘蓝型油菜中染色体间的差异;引起染色体重组的主要途径可能为基因组测序在甘蓝型油菜中所检测出的高频率的部分同源交换(homeologous exchanges,HEs)[28],它一方面改变了A 与C 两个亚基因组的结构,另一方面还在基因组进化、基因表达调控和表型变异等方面发挥重要作用[29]。
一整套的包含一个亲本完整基因组和另一个亲本单条染色体的单体附加系(Monosomic alien addition lines),为研究近缘物种间,尤其是异源多倍体植物亚基因组间同源性关系的独特遗传材料。至今为止,报道了两套白菜型油菜-甘蓝单体附加系,并且利用染色体特异性的分子标记识别了每条附加的甘蓝染色体。Heneen 等[30]创建了在白菜型油菜黄籽沙逊(Yellow sarson,Brɑssicɑ rɑpɑvar.triloculɑris)背景下附加甘蓝变种芥兰(B. olerɑceɑvar. ɑlboglɑbrɑ)每条染色体的全套单体附加系。朱斌等[31]利用从天然甘蓝型油菜重建的白菜型油菜祖先种与亲本甘蓝型油菜杂交及连续回交,创建出将C 亚基因组单条染色体附加到A亚基因组的全套单体附加系,这些附加系的A 亚基因组和附加的C 组染色体共同经历了数千年的进化。两套附加系花粉母细胞减数分裂中染色体的配对频率整理于表1(Heneen 等/朱斌等),分别为C1:59.1%/68.9%、C2:62.5%/69.8%、C3:51.3%/75.0%、C4:44.3%/81.7%、C5:90.2%(附加的C5 为一条染色体臂)/74.3%、C6:68.1%/78.4%、C7:82.5%/79.6%、C8:39.7%/78.1%、C9:39.0%/87.1%,平 均 频 率 为55.8%(除去C5 的数值)/77.0%,变化范围在39.0(C9)%-82.51%(C7)(未包括C5 的数据)/68.9%(C1)-87.1%(C9)。Heneen 等的附加C7 的附加系的单价体频率较高(82.5%),可能是由于C7 染色体似不完整。可见两套附加系内不同C 组染色体与A基因组异源配对频率差异明显,进一步证明各条C组染色体与A 基因组间的部分同源关系存在差异。而且,朱斌等的附加系中附加的C 组染色体以单价体出现的频率远高于Heneen等的结果,这也揭示出天然甘蓝型油菜中A 与C亚基因组经过在同一细胞核内的数千年共进化后染色体结构发生分化而降低了同源性;另外,附加C1与C2的附加系中最高的异源配对频率也说明它们和A1与A2间最高的部分同源性,而附加C9的附加系中最低的异源配对频率则反映与A基因组间降低的部分同源性。有些意外的是附加C4 的附加系,也表现次低的异源配对频率。
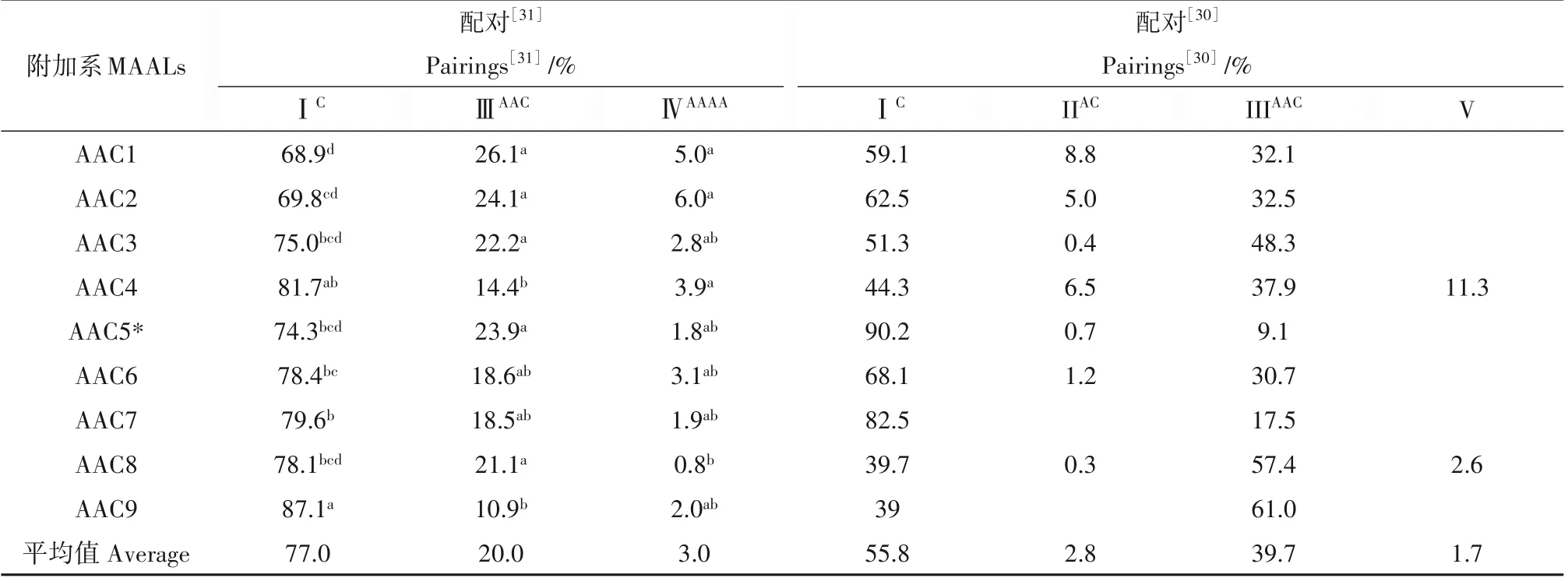
表1 Heneen等[30]与朱斌等[31]创建的两套白菜-甘蓝单体附加系的染色体配对构型Table 1 Chromosome pairings in two sets of B.rapa-oleracea monosomic alien additional lines(MAALs)developed by Heneen et al. [30]and Zhu et al.[31]
Heneen 等的附加系的配对频率与A 组染色体间的部分同源性不相符,因附加C8(39.7%)与C9(39.0%)附加系的单价体频率最低,即它们的异源配对频率最高,而附加其他几条染色体(C1-C4,C6,C8)的附加系的单价体频率明显较高(44.3%~62.5%),异源配对频率反而较低。这可能是黄籽沙逊与芥兰自身的基因组结构所致,因在包含各种类型的白菜及白菜型油菜的系统关系树中黄籽沙逊是6 类中的一类,且与白菜最后的共同祖先最早分化;而芥兰在包含各种类型的甘蓝的系统关系树上也是7 类中的一类[32]。天然甘蓝型油菜的真正亲本难以确定,且两个祖先基因组已在进化中发生了一定程度的结构变化,故与现在的二倍体黄籽沙逊与芥兰在结构上及配对行为上有差异。
上述两套附加系的细胞学观察所反映出的染色体结构差异,还表现在染色体配对构型的不同;Heneen 等的附加系中附加的甘蓝染色体具有多样的配对方式,与一条A 组染色体配对形成一个异型二价体、与一对A组染色体形成三价体、与二对A组染色体形成五价体;多数附加的C 组染色体表现出一种以上的部分同源配对,与一个以上的A 组二价体配对,也显示与多个A 组染色体区段及多条A 组染色体间的同源关系,如上述的染色体结构所预期的。朱斌等的附加系中附加的甘蓝染色体只与一对A 组染色体形成三价体;在所有附加系的少量花粉母细胞内,出现一个由A 基因组的4 条染色体形成的四价体,细胞的配对方式为8IIAA+1IC+1IVAAAA,而这一同配四价体并没有在重建的祖先种白菜型油菜中观察到,这可能是由于未配对的附加染色体促进了A 基因组的配对,从而使交换频率保持在一定水平,如倒位杂合体倒位区段内有活力重组子频率的下降由同一对染色体上其他区段或其他对染色体上重组频率的上升而补偿,从而使群体的重组值接近最佳值;这种现象在Heneen等的附加系中没有出现,这也暗示在天然甘蓝型油菜中进化出某种调控减数分裂重组的机制,特别是与基因组的互作有关。
谭晨等[33]培育出除B2染色体外的7个甘蓝变种芥兰-黑芥单体附加系,花粉母细胞减数分裂中附加黑芥染色体与芥兰染色体的配对频率较低、单价体频率为82.3%(B5)~90.8%(B6)、平均86.2%,且附加的黑芥染色体也只与一对C组染色体形成三价体;虽然附加B5 和B1 的附加系拥有最高的异源配对频率,分别为17.71%和16.67%,而附加B6 的拥有最低的频率(9.17%),但是它们之间不存在显著性的差异。芥兰-黑芥单体附加系的单价体频率高于上述的两套白菜型油菜-甘蓝附加系,这也证实芸薹属B 基因组与A/C 基因组间的部分同源性比A与C 基因组间的更低,还表明黑芥的每条染色体与芥兰染色体间有较大程度的结构差异而阻止配对。
崔成等[26]在合成的甘蓝型油菜中观察到两个A-A-C-C 的异源配对环状四价体,周建男等[34]在人工合成的芸薹属异源六倍体(AABBCC)中也发现高频率的A-A-C-C 的环状或链状异源配对四价体,且环状四价体中A 组与C组染色体的排列有相邻的A-A-C-C 与相间的A-C-A-C 两种方式,这些配对极有可能发生在同源性最高的A1与C1、A2与C2染色体间。相应的是,熊志勇等[35]在合成甘蓝型油菜中观察到的染色体补偿与替换也涉及这两对染色体,如4A1:1C1,0A1:4C1等。这些结果也揭示两个基因组个别染色体间的高度同源性及功能补偿。
需要指出的是,从代表甘蓝型油菜主要类型及遗传变异的29 个品种产生的单倍体中观察到部分同源配对的广泛变异,二价体数在3~8个,单价体数目有两倍的差异,可明确分成高配对与低配对两组,这两组与两种质体单倍型对应[36]。通过高配对与低配对品种的杂交及遗传分析,在C9染色体上定位到可能抑制甘蓝型油菜单倍体中部分同源重组的 主 要QTL 位 点PrBn(pairing regulator inB. nɑ-pus)、C1 和C6 上的两个微效QTL 位点[37]。这些单倍体中的配对变异可由PrBn位点两个等位基因的分离所解释[36]。但是,以定位PrBn位点的两个亲本为父本与同一个白菜型油菜杂交产生的三倍体(AAC)展现相似的配对行为[38],表明该基因对三倍体的减数分裂行为没影响、在半合(hemizygous)状态无效。反之,这两个三倍体的一对A 亚基因组染色体上的交换频率有显著差异[39];与高配对亲本的三倍体与其单倍体相比,C 亚基因组内的同源配对及A-C 异源配对均下降,故C基因组上的PrBn位点在AAC背景下未能增加或影响自身染色体的配对[40]。Heneen等的附加C9染色体的白菜型油菜-甘蓝附加系也具有最高频率的异源配对三价体,暗示在甘蓝C9上没有类似PrBn的抑制基因,或在新合成的甘蓝型油菜中还未形成配对的调控系统,如小麦的Ph1基因也是通过异源多倍化产生的[41]。故芸薹属中是否存在调控染色体配对的遗传系统还有待进一步研究;杂种及多倍体中染色体部分同源配对主要与起源(细胞质)及基因组结构有关[26,36]。
5 展望与建议
芸薹属作物因其农业的重要性及基因组的特有多倍化演变方式,成为细胞遗传学及基因组学研究的模式系统,经过一个世纪的研究特别是基因组测序技术的应用,使我们对它们的基因组结构及进化有了更深刻的认识与理解,也给遗传育种提供新的启示与指导。
芸薹科特别是芸薹属的祖先核型为物种间的共线性关系提供了基本的框架,对于基因挖掘及解析基因组进化具有指导性。药用植物菘蓝(菘蓝的根即板蓝根)(Isɑtis indigoticɑFort., 2n=14)所在的菘蓝族(Isɑtideɑe),也起源于Lineage II,具有tPCK核型(translocation Proto-Calepineae Karyotype),由PCK 的第二和第七染色体间的整个染色体臂的易位而产生。基因组测序表明[42],菘蓝的基因组大小为~300Mb,每一个基因组区段与拟南芥有很好的共线性,与tPCK 核型一致;菘蓝的每一个基因组区段可在拟南芥找到一个、白菜中找到3个匹配的区段,提示菘蓝在拟南芥的α-WGD(whole genome duplication)后没有经历独立的WGD事件。相应的,康雷等[43]在全套甘蓝型油菜-菘蓝单体附加系的减数分裂中,观察到一些菘蓝染色体可与甘蓝型油菜染色体异源配对,印证了芸薹族与菘蓝族较近的系谱关系;还将一个附加系中菘蓝染色体上的细胞质雄性不育的恢复基因导入甘蓝型油菜而培育相应的恢复系,从而实现外源基因的渗入[44]。
萝卜属(Rɑphɑnus)的农业重要性仅次于芸薹属,与芸薹属一样划归芸薹族。萝卜基因组测序获得的基因组大小为528.6 Mb[45],与白菜的529 Mb 几乎一样。认为萝卜与白菜起源于基因组三倍化后的同一个祖先种,且与白菜分开后萝卜在5.1~8.4 My 又发生了一次全基因组重复事件[45]。在萝卜的基因组中检测到ACK 核型24 个区段中的23 个,一半为三倍化;萝卜与芸薹属3 个二倍体种的基因组间存在广泛的部分同源性[46]。尽管萝卜与白菜基因组序列比较发现一定数量的共线性区段,但两个物种连锁群间的共线性关系非常复杂,显示在基因组三倍化后在各自的进化中多次发生染色体重排[9,47,48]。鉴于萝卜与芸薹属物种间基因组结构已发生较大的分化,才为人工合成新物种萝卜甘蓝(RRCC)(Rɑphɑnobrɑssicɑ)奠定了细胞学基础,萝卜与甘蓝的染色体在减数分裂中同源配对为主,而没有或较少发生部分同源配对,使新形成的异源四倍体得以稳定存在[49]。合成的萝卜白菜(xBrɑssicorɑphɑnus,RRAA)也可能由于同样的原因而成为新的蔬菜[50]。
虽然进化产生了芸薹属异源四倍体种,但自然界没有发现倍性更高的芸薹属种存在。通过芸薹属6个栽培种间的几种杂交途径人工合成的芸薹属三基因组异源六倍体(2n=54,AABBCC),表现一定程度的细胞学不稳定性,会产生整倍体与非整倍体后代,非整倍体植株丢失一些染色体,且偏向性地丢失来自A 及C 组的染色体,C 组染色体最易丢失,C 组染色体几个世代后可全部丢失[32,51]。其原因为,这些异源六倍体除表现同源染色体配对形成27 个二价体外,还有相当频率的A 与C 组染色体间的部分同源配对,形成异配二价体、三价体、四价体,而B组染色体仍正常配对,这也反映A 与C 组间更高的同源性。如在远缘杂交诱导下发生的甘蓝型油菜中C 组染色体的偏向性丢失,这种C 组染色体的更不稳定性可能与其染色体结构及遗传组成有关,其染色体的减少对配子的活力影响比A组染色体减少的小,故后代中C组染色体的变化范围比A组的大。
从以上合成芸薹属异源六倍体中A 与C基因组间高度的同源性导致的细胞学不稳定性得到启示,在人工合成包含3 个基因组及以上的异源多倍体时,尽量避免亲缘关系很近的亲本。从遗传研究与种质资源创建的角度考虑,可进行芥菜型油菜及埃塞俄比亚芥与萝卜的杂交,合成两种异源六倍体(AABBRR,BBCCRR),所含3 个基因组间没有同源性特别高的两个基因组,预期减数分裂配对较正常。特别是将各种芥菜与萝卜杂交,有可能培育出新的蔬菜。

