恢复期血浆治疗重症新型冠状病毒肺炎患者的Meta分析
杨 程, 冯春露, 刘 敏, 庹 琳, 耿晓霞, 杨兴祥, 3
(1. 电子科技大学医学院, 四川 成都, 610054; 2. 四川省人民医院 感染科, 四川 成都, 610072; 3. 成都医学院, 四川 成都, 610500)
恢复期血浆是患者在疾病感染中机体激发体液免疫而产生针对病原的特异性抗体,康复后采集该患者的血浆所获得的血浆制剂,属于人工获得的被动免疫疗法[1-3]。有假说[4]提出恢复期血浆中的抗体可以通过干扰棘突蛋白与血管收缩素转化酶2(ACE2)受体的结合、激活补体和病毒溶解、与病毒颗粒结合从而促进抗原呈递细胞的摄取并激活细胞介导的免疫反应等途径发挥治疗效果,但其机制尚未完全明确。恢复期血浆输注原则于1880年确立[5], 1890年首次用于治疗白喉感染, 1918—1920年针对西班牙流感首次尝试了恢复期血浆治疗,并将恢复期血浆视为病毒感染的潜在治疗方法之一。此后,恢复期血浆也用于麻疹、百日咳、流感、严重急性呼吸感染病毒(SARS-CoV)、埃博拉病毒(EBOV)等治疗[6], 被认为是一些流行病的紧急干预措施。本研究采用Meta分析评估恢复期血浆对新型冠状病毒肺炎(COVID-19)的疗效与安全性,现报告如下。
1 资料与方法
本系统评价遵循《系统评价和 Meta 分析的首选报告项目(PRISMA)》中的准则完成。
1.1 纳入与排除标准
1.1.1 研究类型: 随机对照实验。
1.1.2 研究对象标准[7]: ① 年龄≥18岁者。② 基于聚合酶链反应(PCR)检测的阳性COVID-19病例。③ 休息和呼吸环境空气时血氧饱和度(SaO2)≤94%; 出现气促,呼吸频率≥30次/min; 氧合指数≤300 mmHg; 至少符合上述任意1条者。
1.1.3 排除标准: ① 研究人群为非重症COVID-19患者; ② 研究类型为观察性研究、基础研究、病例报告、系统评价、医学新闻、科普文章、非医学类论文、综述、信件、评论或设计分析,未报道试验结果; ③ 研究中未设置对照组。
1.1.4 干预措施: 恢复期血浆组采用任何剂量的恢复期血浆,允许联合使用常规治疗或标准治疗; 对照组使用常规治疗或标准治疗。
1.1.5 结局指标: 有效性指标包括28 d或30 d的病死率、出院率; 安全性指标主要是指不良事件发生率。
1.2 文献检索
采取“主题词+自由词”的方式对数据库PubMed、EMBASE、Web of Science、Cochrane Library、中国知网(CNKI)、中国生物医学文献数据库进行检索,检索时限截至2021年12月1日。主要检索词包括COVID-19、2019-nCoV、SARS-CoV-2、2019 novel coronavirus、convalescent plasma等。
1.3 文献筛选与资料提取
首先,由2名研究人员独立阅读并筛选文献标题及摘要,排除明显不符合纳入标准的文献; 其次,阅读全文并严格按照纳入标准和排除标准对初筛后的文献进行进一步筛选; 最后,由2名研究者独立萃取纳入文献的数据,若有异议则讨论解决,若仍不能解决,则由第三方裁定。使用EndNote软件进行文献筛选并提取资料。提取的数据有: ① 基本情况,包括篇名、作者、研究地区、研究日期; ② 具体干预方法,包括恢复期血浆剂量、使用频次、单独或联合用药; ③ 结局指标,包括28 d或30 d全因死亡率、出院率,不良事件发生率,使用恢复期血浆后3 d的核酸转阴率。
1.4 纳入研究的偏倚风险评价
依据Cochrane系统评价手册对纳入研究进行偏倚风险评估。评价条目有: 随机分配方法、分配方案隐藏、对研究对象及治疗方案实施者采用盲法、对研究结果测量者采用盲法、结果数据完整性、选择性报告研究结果、其他偏倚风险。
1.5 统计学分析
采用RevMan 5.3软件对资料进行分析处理。计数资料以相对危险度(RR)及其95%置信区间(CI)为效应量。采用χ2检验对研究结果进行异质性检验,当P≥0.10、Ι2≤50%时,采用固定效应模型进行Meta分析; 反之,则采用随机效应模型进行Meta分析。
2 结 果
2.1 文献检索结果
共检索617篇文献,其中PubMed 166篇, Cochrane Library 70篇, EMBASE 63篇, Web of Science 61篇, CNKI 186篇,中国生物医学文献数据库70篇,补充文献1篇; 剔除重复文献; 阅读文献题目及摘要后初筛获得文献25篇,阅读全文,剔除结局不符、纳入人群不符、干预措施不符等文献16篇; 最终获得9篇文献[8-16], 共3 461例患者。
2.2 纳入研究的基本特征
本系统评价共纳入9项研究[8-16], 均为随机对照实验,其中1项研究[11]并未找到纳入研究对象具体标准,但文中提到患者均满足“年龄≥18岁”“被确诊为SARS-CoV-2感染”“中度或重度患者”等标准; 参考世界卫生组织(WHO)定义的成人重症患者标准,即“室内条件氧饱和度<90%”“成人呼吸频率>30次/min”“严重呼吸窘迫的体征”,满足上述任何1项即可诊断,故考虑该项研究符合本Meta分析纳入标准,予以纳入。本研究纳入文献的基本特征见表1。
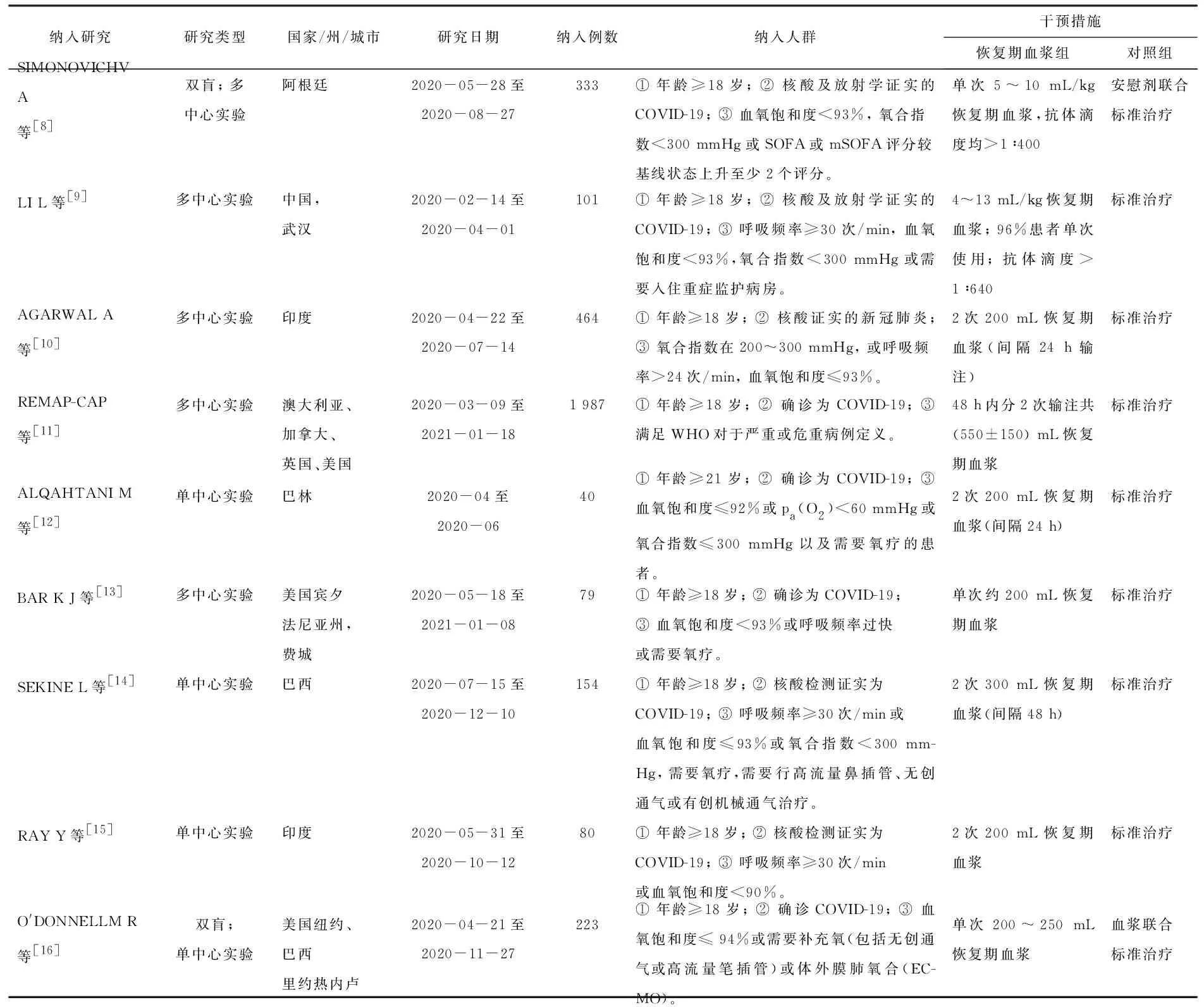
表1 纳入研究的基本特征
2.3 纳入研究的偏倚风险评价
所有研究均在方法学提及“随机对照”, 2项研究[8, 16]采用双盲; 纳入的研究偏倚风险见表2。

表2 纳入研究的偏倚风险评价结果
2.4 结果分析
2.4.1 28 d或30 d全因死亡率: 在 9项研究[8-16]中, 1 917例接受恢复期血浆患者在28 d或30 d中死亡467例(24.36%); 1 544例未接受恢复期血浆的对照组患者中有412例死亡(26.68%)。异质性检验发现,各项研究间存在中度异质性(Ι2=34,P=0.14), 提示恢复期血浆与对照组相比,差异无统计学意义(RR=0.94, 95%CI: 0.84~1.05,P=0.27), 见图1。考虑此结果中REMAP-CAP等[11]实验病例数占纳入研究总例数的57.41%, 对总体结果影响较大。若排除这项研究,则其他8项研究[8-10, 12-16]包含839例接受恢复期血浆患者,这些患者在28 d或30 d中死亡115例(13.70%); 635例未接受恢复期血浆的对照组患者中有112例死亡(17.64%); Meta分析提示各项研究间存在中等异质性(I2=25,P=0.17), 提示恢复期血浆组与对照组的差异无统计学意义(RR=0.81, 95%CI: 0.63~1.02,P=0.08), 见图2。
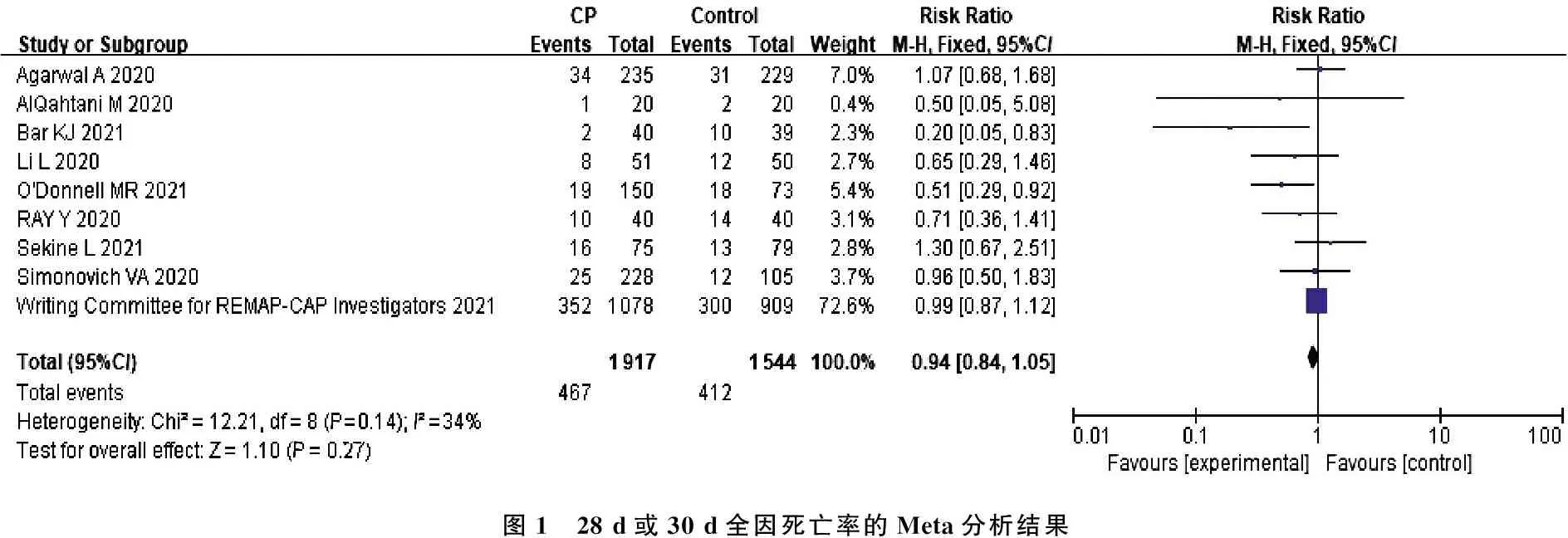
图1 28 d或30 d全因死亡率的Meta分析结果
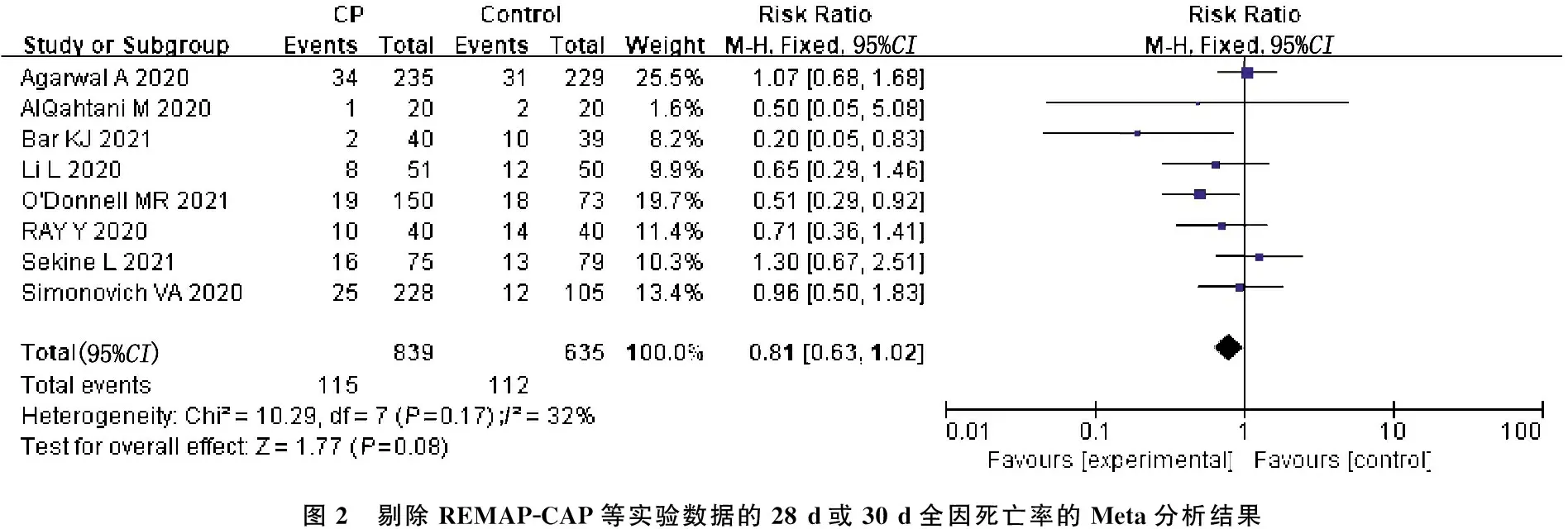
图2 剔除REMAP-CAP等实验数据的28 d或30 d全因死亡率的Meta分析结果
2.4.2 28 d或30 d出院率: 9项研究中,有3项研究[8-9, 16]报道了28 d或30 d出院率; 429例接受恢复期血浆患者在28 d或30 d有305例出院(71.10%); 228例未接受恢复期血浆的对照组患者中有146例出院(64.04%); Meta分析提示各项研究间存在中等异质性(I2=32%,P=0.23), 恢复期血浆组与对照组的差异无统计学意义(RR=1.06, 95%CI: 0.95~1.19,P=0.28), 见图3。

图3 28 d或30 d出院率的Meta分析结果
2.4.3 不良事件发生率: 6项研究[8-9, 11-13, 17]统计了血浆组和对照组不良事件的发生率; 1 763例接受恢复期血浆患者中有112例发生不良事件(6.35%); 1 470例未接受恢复期血浆的对照组患者中有70例发生不良事件(4.76%)。Meta分析提示各项研究间存在中度异质性(I2=58%,P=0.04), 故使用随机效应模型,提示恢复期血浆组与对照组不良事件发生率的差异无统计学意义(RR=1.16, 95%CI为0.71~1.88,P=0.55), 见图4。
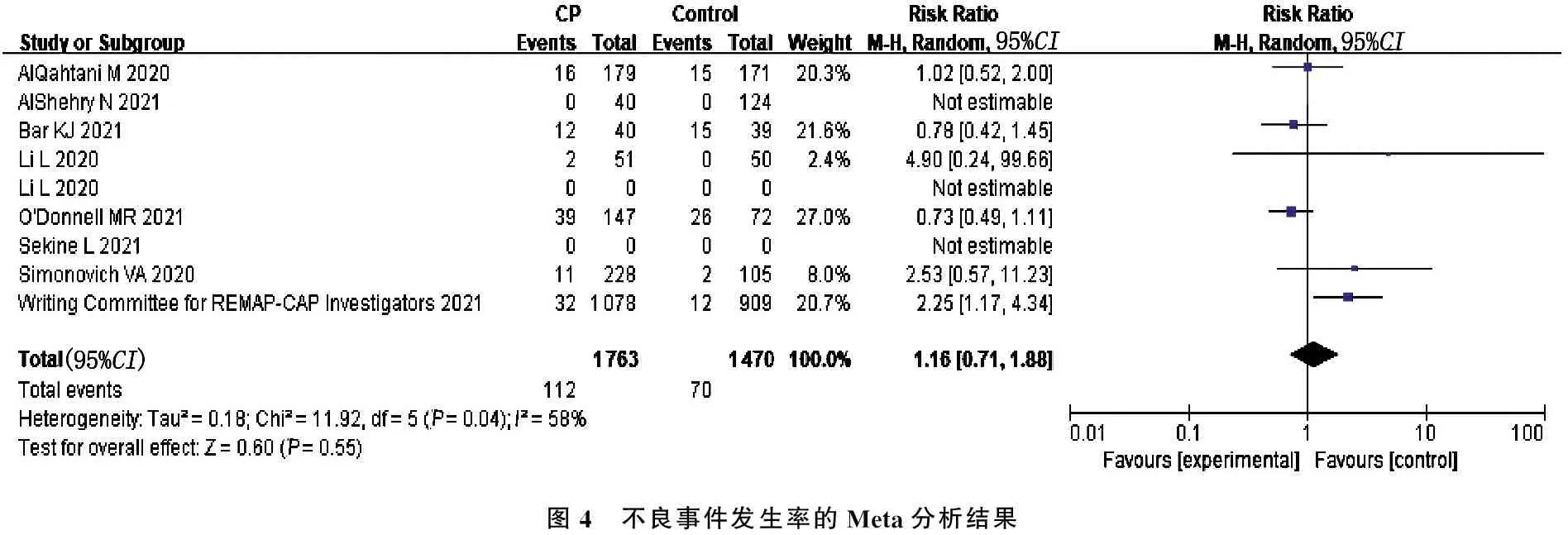
图4 不良事件发生率的Meta分析结果
2.4.4 其他事件: LI L等[9]研究中恢复期血浆组和对照组的3 d核酸转阴率分别为87.2%(41/47)、37.5%(15/40); AGARWAL A等[10]研究中恢复期血浆组和对照组的3 d核酸转阴率分别为43%(79/184)、37%(67/183); 由于研究数量少,未使用Meta分析。
2.5 发表偏倚
在RevMan 5.3 统计软件中绘制9篇文献的漏斗图,漏斗图不对称,可能存在发表偏倚。见图5。
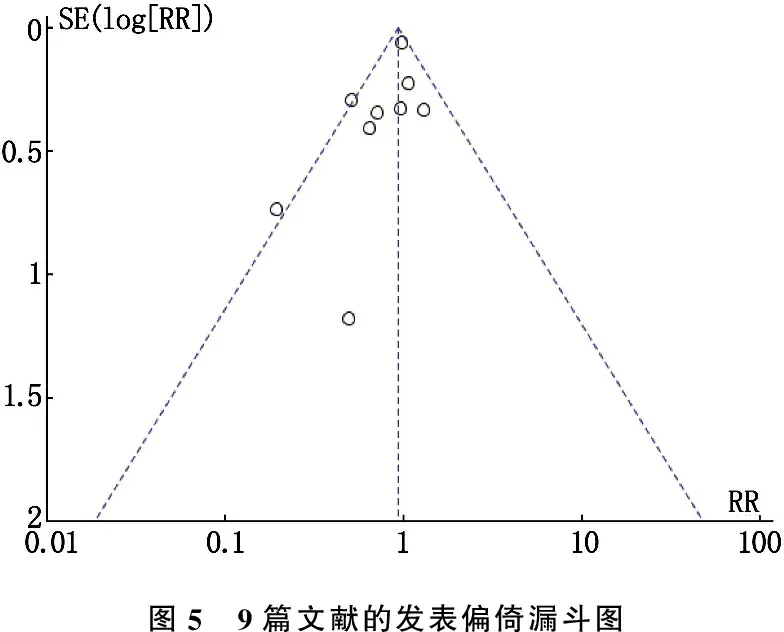
图5 9篇文献的发表偏倚漏斗图
2.6 证据质量评级
本研究参考证据质量分级和推荐强度系统(GRADE系统)评价证据等级,结果显示,恢复期血浆对于改善COVID-19患者28 d或30 d全因死亡率、出院率、不良事件发生率的证据质量均非常低。
3 讨 论
恢复期血浆被视为一种应急措施而多次应用于流行病等治疗,但有效性和安全性一直存在争议[18]。本研究Meta分析最终纳入9项[8-16]随机对照实验,纳入重型COVID-19患者3 461例,其中2项研究[13, 16]单次使用200~250 mL恢复期血浆, 5项研究[10-12, 14-15]使用了2次400~700 mL的恢复期血浆, 2项研究[8-9]根据体质量单次使用,未报道具体剂量。9项研究[8-16]中均存在不同程度的偏倚,其中4项研究[8, 11-12, 16]偏倚风险较高, 5项研究[9-10, 13-15]偏倚风险高,高风险原因为未使用盲法、有失访、提前终止试验等。本研究Meta分析结果显示,恢复期血浆治疗重型COVID-19患者28 d或30 d全因死亡率、出院率较对照组并无显著差异。分析原因为恢复期血浆的疗效或与使用时机、抗体滴度、剂量、使用人群不同相关。JOYNER M J等[18]研究显示,与输注低抗体水平血浆单位的患者相比,输注高抗体水平血浆单位的患者7 d及30 d死亡率降低; LIBSTER R等[19]研究也提示,免疫球蛋白G(IgG)滴度为1∶3 200或更高的血浆能有效降低严重呼吸道疾病的发生风险,提示使用抗体高滴度的恢复期血浆或能有效提高重症COVID-19患者短期内的出院率。本研究Meta分析并未统一剂量及抗体滴度,但若使用高抗体水平的恢复期血浆或能更有利于提高恢复期血浆疗效。
本研究Meta分析纳入人群均为重症患者,但针对重症患者何时使用恢复期血浆并未得出有效结论。SALAZAR E等[20]研究表明,入院后72 h内接受恢复期血浆治疗能降低患者的死亡率。一项多中心研究[18]也显示,确诊后72 h内接受恢复期血浆治疗的住院患者的7 d死亡率低于超过72 h接受恢复期血浆治疗的患者,提示尽早使用恢复期血浆或能有效降低患者死亡率及病情进展率。本研究Meta分析显示,恢复期血浆组较对照组不良事件发生率无显著差异。在一项纳入5 000例重症或危重症COVID-19成人患者使用恢复期血浆的研究[21]中,输血后4 h所有严重不良事件的发生率<1%。此后扩大研究,纳入20 000例重症或危重症COVID-19患者[18], 报告了1 247例严重不良事件; 在这些严重不良事件中,绝大多数均被认为与血浆输注无关,表明恢复期血浆的安全性较好。DUAN K等[22]研究也提示恢复期血浆对核酸转阴或有获益,但此结果仍缺乏更多高质量研究的支持。
本研究Meta分析也具有一定的局限性: ① 所有纳入的研究并未统一恢复期血浆剂量,也并未全部规范测量所使用的恢复期血浆的抗体滴度; ② 关于不良事件的统计,并未区分一般或严重不良事件,同时由于对照组中有使用安慰剂或其他标准治疗作为对照,故尚不能完全明确不良事件是否为恢复期血浆导致; ③ 由于纳入研究的结局指标存在差异,无法对病毒转阴率、临床症状缓解率、住院时长等指标进行进一步的Meta分析,缺乏客观评价恢复期血浆疗效的依据; ④ 鉴于各国、各地区、各医院对于标准治疗、支持性护理的类型以及插管和入院的阈值不同,应谨慎解释研究结果; ⑤ 排除了观察性研究、回顾性病例分析; ⑥ 只检索了英文文献和中文文献,以日文、法文等其他语言发表的文献被排除在外,可能存在偏倚。
综上所述,本研究Meta分析总结了恢复期血浆用于重症COVID-19患者的临床实验结果,表明恢复期血浆虽具有较好安全性,但对短期死亡率及出院率无明显改善。

