重建人类表皮模型医疗器械体外皮肤刺激试验中白细胞介素-1α和白细胞介素-8的表达变化
刘 佳, 范春光, 孙立魁, 赵增琳
(山东省医疗器械和药品包装检验研究院/国家药品监督管理局材料器械安全性评价重点实验室/山东省医疗器械生物学评价重点实验室, 山东 济南, 250101)
表面接触医疗器械使用过程中与人体皮肤接触,其材料本身和(或)其可沥滤物可能会导致皮肤产生刺激反应。因此,相关产品上市前须对其进行皮肤刺激评价。根据ISO10993系列方法,评价方法有3种,分别为人体试验、体内动物试验和体外试验,其中常用的是家兔皮肤刺激试验。体外重建人类表皮模型(RhE)皮肤刺激试验是针对家兔皮肤刺激试验研发的替代模型[1]。RhE模型是采用人正常角蛋白细胞体外培养形成的包括基底层、棘层、颗粒层和有功能的角质层在内的三维皮肤模型[1]。RhE模型体外皮肤刺激试验是将试验样品置于模型表面孵育一定时间后清除,再检测模型中细胞的活性,与阴性对照相比得到相对活性(活度),根据组织活度预测试验样品的刺激性。该模型被广泛用于化学品和化妆品皮肤刺激试验[2], 前期实验室通过研究[3]证明该体外皮肤刺激模型也可应用在医疗器械体外皮肤刺激试验中。
白细胞介素(IL)-1α作为促炎细胞激动素,能够诱导表皮层角质形成细胞炎症级联反应[4]。此外,被动释放的IL-1α能够进一步诱导细胞因子 IL-6和IL-8的表达[5]。IL-8对中性粒细胞和淋巴细胞具有强烈的趋化作用[6]。研究[7]表明, RhE皮肤刺激模型培养基中IL-1α和IL-8的表达增加,其可以作为皮肤刺激反应的分子标记物。本研究针对国产化的SkinEthicTMRHE模型在医疗器械体外皮肤刺激试验方面进行研究,选取2种典型的表面接触医疗器械产品,采用SkinEthicTMRhE模型试验检测其皮肤刺激性,并探讨模型中相关蛋白,寻找出该模型合适的分子标记物。
1 材料与方法
1.1 试验材料
1.1.1 试验样品: 分别选取水胶体敷料(记为T1)和物理抗菌洗液(记为T2)作为试验样品。此外,本研究还选取了2个浓度典型的皮肤刺激阳性物质乳酸作为效力检测样品。
1.1.2 模型信息: SkinEthicTMRHE模型(上海斯安肤诺生物科技有限公司)。
1.1.3 主要试剂: 组织培养基(上海斯安肤诺生物科技有限公司)、杜氏磷酸盐缓冲溶液(DPBS, 1×, gibco)、氯化钠注射液(辰欣药业股份有限公司)、芝麻油(ACROS)、20%十二烷基硫酸钠(SDS)溶液(sigma)、噻唑蓝(MTT, sigma)、异丙醇(沪试)、人IL-1α 酶联免疫吸附法(ELISA)试剂盒(R&D)、人IL-8 ELISA试剂盒(R&D)。
1.2 方法
1.2.1 试验样品浸提液制备: 试验组T1, 取水胶体敷料按照3.0 cm2/mL的比例加入极性浸提介质(氯化钠注射液),于(37.0±1.0) ℃、60转/min震荡条件下,浸提(72.0±2.0) h制备极性浸提液,记为T1-1; 另取敷料按照相同比例,加入芝麻油,同条件制备非极性浸提液T1-2。试验组T2, 物理抗菌洗液原液不作处理,记为T2。试验组T3, 1.5%和4%的乳酸/氯化钠注射液溶液,分别记为T3-1和T3-2。介质对照, 对照按照样品制备方法同样处理,分别制备,氯化钠注射液对照记为VC-1; 同芝麻油介质对照VC-2。阴性对照, DPBS不作处理作为阴性对照,记为NC。阳性对照, 氯化钠注射液配制的1%的SDS极性阳性对照,记为PC-1; 芝麻油制备1%的SDS非极性阳性对照,记为PC-2。
1.2.2 体外RhE模型培养: 将预孵育后小室转移至预先加入1 mL培养基的6孔板中,吸取100 μL试验液或对照液置于每个模型表皮表面(重复3孔),培养箱中孵育(24.0±2.0) h。孵育后,使用无菌DPBS冲洗小室内组织,去除残留样品,对模型进行MTT检测。使用酶标仪选择570 nm波长滤光片读取光密度(OD)值。
1.3 数据计算及试验接受准则
计算6个空白对照孔OD值均值。其余各孔OD值均扣除空白均值得修正值。计算每块组织经修正的OD值均值。将NC组均值设为100%活度。每块组织修正OD值均值除以NC组OD值均值得到每块组织活度。再计算各组组织活度均值即为各组组织活度。阴性对照和介质对照组3块组织OD均值≥0.8~<2.8, 且3块组织活度的标准差(SD)≤20%; 介质对照组活度为80%~120%, 且阳性对照组活度<40%; 3块组织活度的标准差(SD)≤20%。试验样品组3块组织活度的标准差(SD)≤20%。
结果判定: 试验组活度≤50%, 即表示刺激反应阳性(I)。采用浸提液进行试验时,其中一种介质浸提液显示阳性结果(活度≤50%且SD≤20%)则认为此医疗器械/材料有刺激性(I)。
ELISA检测 IL1α、IL-8含量: 孵育24 h后,收集小室下的培养基,按照试剂盒规定的操作步骤测定IL-1α和IL-8的含量,计算蛋白含量。
1.4 统计学分析
使用SPSS 21.0软件对数据进行统计学分析。数据以平均值表示,行t检验;P< 0.05为差异有统计学意义。
2 结 果
2.1 体外RhE试验
研究结果显示,使用RhE模型进行体外刺激试验中,试验样品水胶体敷料和物理抗菌洗液皮肤刺激指数为均0, 为无刺激反应; 1%乳酸皮肤刺激指数为0, 为无刺激反应; 4%乳酸皮肤刺激指数为I, 显示为有刺激反应,见图1。组织病理学显示,阳性对照组上皮细胞变性坏死。4%乳酸组上皮细胞萎缩,角质层脱落。其他组上皮组织织未见明显异常,见图2。
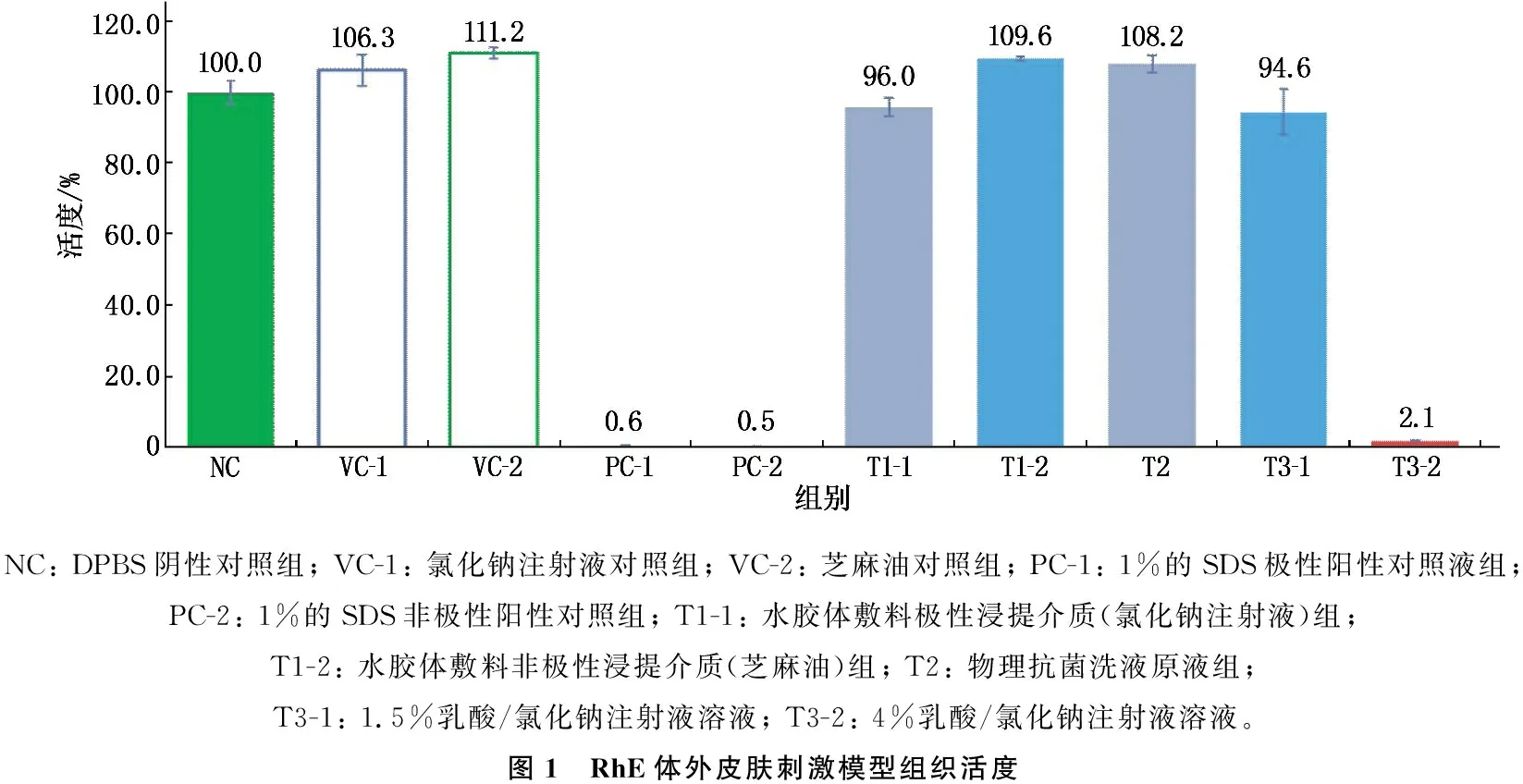
NC: DPBS阴性对照组; VC-1: 氯化钠注射液对照组; VC-2: 芝麻油对照组; PC-1: 1%的SDS极性阳性对照液组; PC-2: 1%的SDS非极性阳性对照组; T1-1: 水胶体敷料极性浸提介质(氯化钠注射液)组; T1-2: 水胶体敷料非极性浸提介质(芝麻油)组; T2: 物理抗菌洗液原液组; T3-1: 1.5%乳酸/氯化钠注射液溶液; T3-2: 4%乳酸/氯化钠注射液溶液。图1 RhE体外皮肤刺激模型组织活度
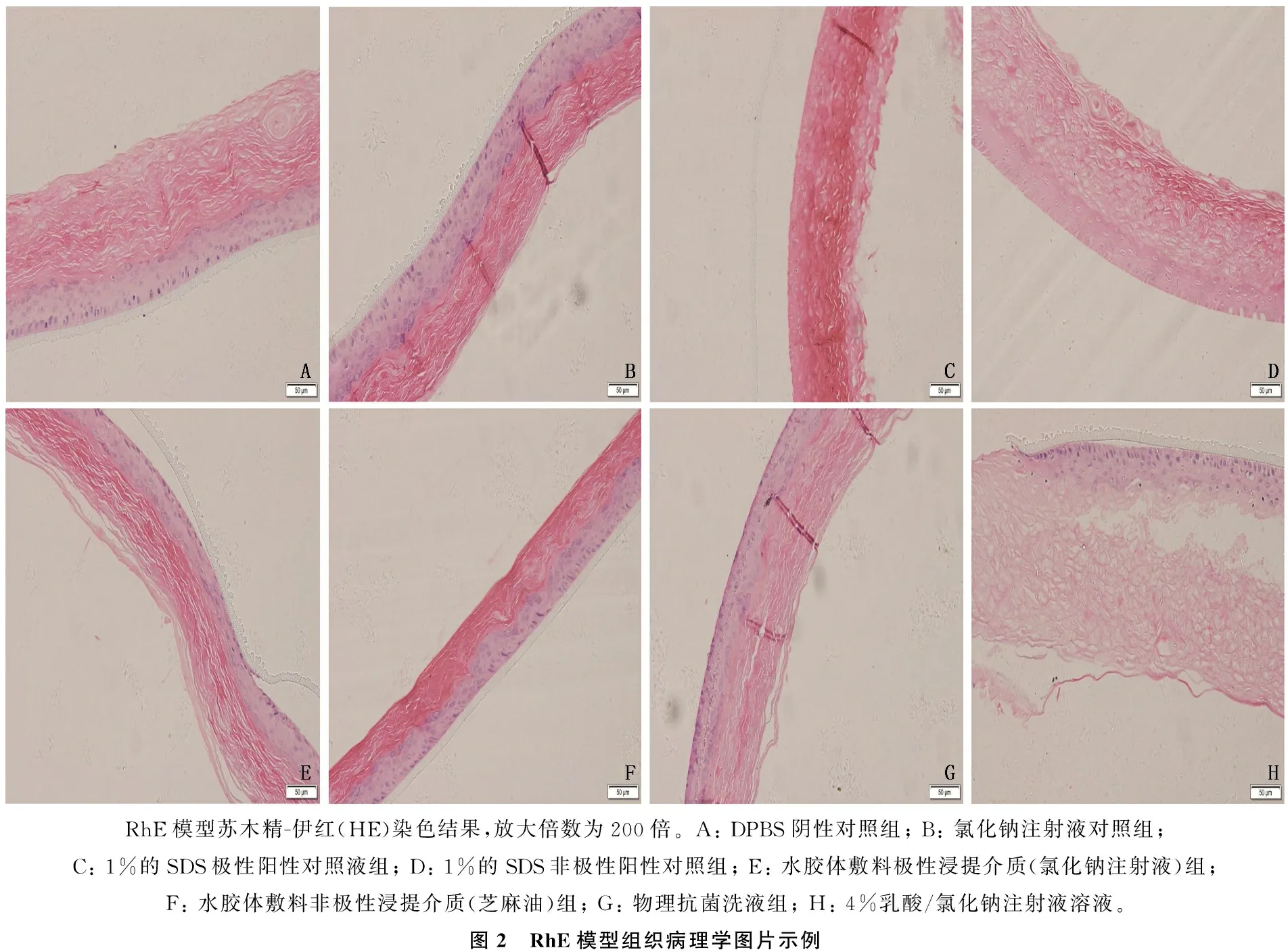
RhE模型苏木精-伊红(HE)染色结果,放大倍数为200倍。A: DPBS阴性对照组; B: 氯化钠注射液对照组; C: 1%的SDS极性阳性对照液组; D: 1%的SDS非极性阳性对照组; E: 水胶体敷料极性浸提介质(氯化钠注射液)组; F: 水胶体敷料非极性浸提介质(芝麻油)组; G: 物理抗菌洗液组; H: 4%乳酸/氯化钠注射液溶液。图2 RhE模型组织病理学图片示例
2.2 体外RhE模型体外皮肤刺激试验培养基中IL-1α表达结果
ELISA结果显示,阳性对照组培养基中IL-1α表达均高于相应介质对照组,差异有统计学意义(P<0.001); 水胶体敷料极性(氯化钠注射液)浸提实验组IL-1α表达与氯化钠注射液对照组比较,差异有统计学意义(P<0.05); 水胶体敷料非极性(芝麻油)浸提实验组IL-1α表达与芝麻油对照组比较,差异无统计学意义(P>0.05)。物理抗菌洗液原液组IL-1α表达与氯化钠注射液对照组比较,差异有统计学意义(P<0.01)。1.5%、4.0%乳酸组与氯化钠注射液对照组比较,差异有统计学意义(P<0.01或P<0.05), IL-1α与皮肤刺激指数呈正相关,见图3。
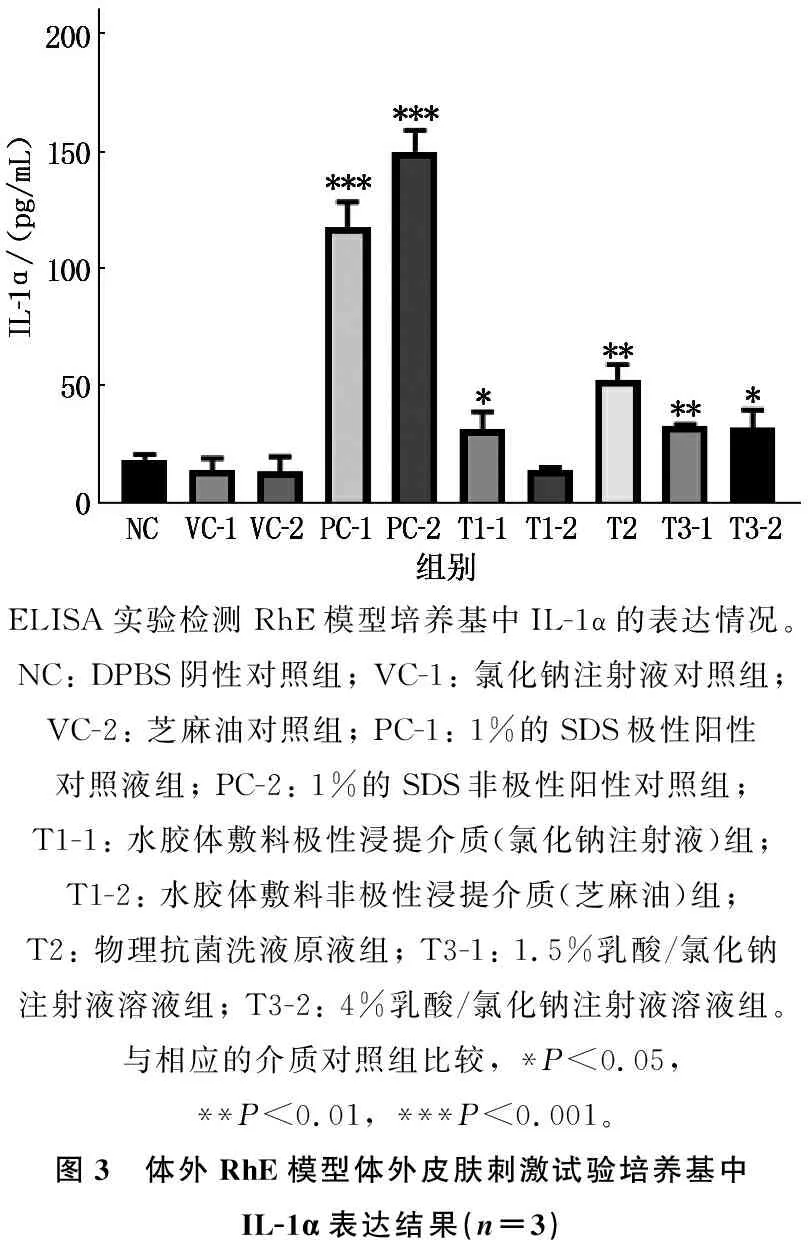
ELISA实验检测RhE模型培养基中IL-1α的表达情况。NC: DPBS阴性对照组; VC-1: 氯化钠注射液对照组; VC-2: 芝麻油对照组; PC-1: 1%的SDS极性阳性对照液组; PC-2: 1%的SDS非极性阳性对照组; T1-1: 水胶体敷料极性浸提介质(氯化钠注射液)组; T1-2: 水胶体敷料非极性浸提介质(芝麻油)组; T2: 物理抗菌洗液原液组; T3-1: 1.5%乳酸/氯化钠注射液溶液组; T3-2: 4%乳酸/氯化钠注射液溶液组。与相应的介质对照组比较, *P<0.05, **P<0.01, ***P<0.001。图3 体外RhE模型体外皮肤刺激试验培养基中IL-1α表达结果(n=3)
2.3 体外RhE试验培养基中IL-8表达结果
ELISA结果显示,阳性对照组培养基中IL-8表达均低于相应介质对照组,差异有统计学意义(P<0.01或P<0.001); 水胶体敷料极性、非极性浸提实验组IL-8表达与阴性对照组比较,差异无统计学意义(P>0.05)。物理抗菌洗液原液组IL-8表达与阴性对照组比较,差异无统计学意义(P>0.05)。1.5%、4.0%乳酸实验组IL-8表达低于氯化钠注射液对照组,差异有统计学意义(P<0.05或P<0.01), 见图4。
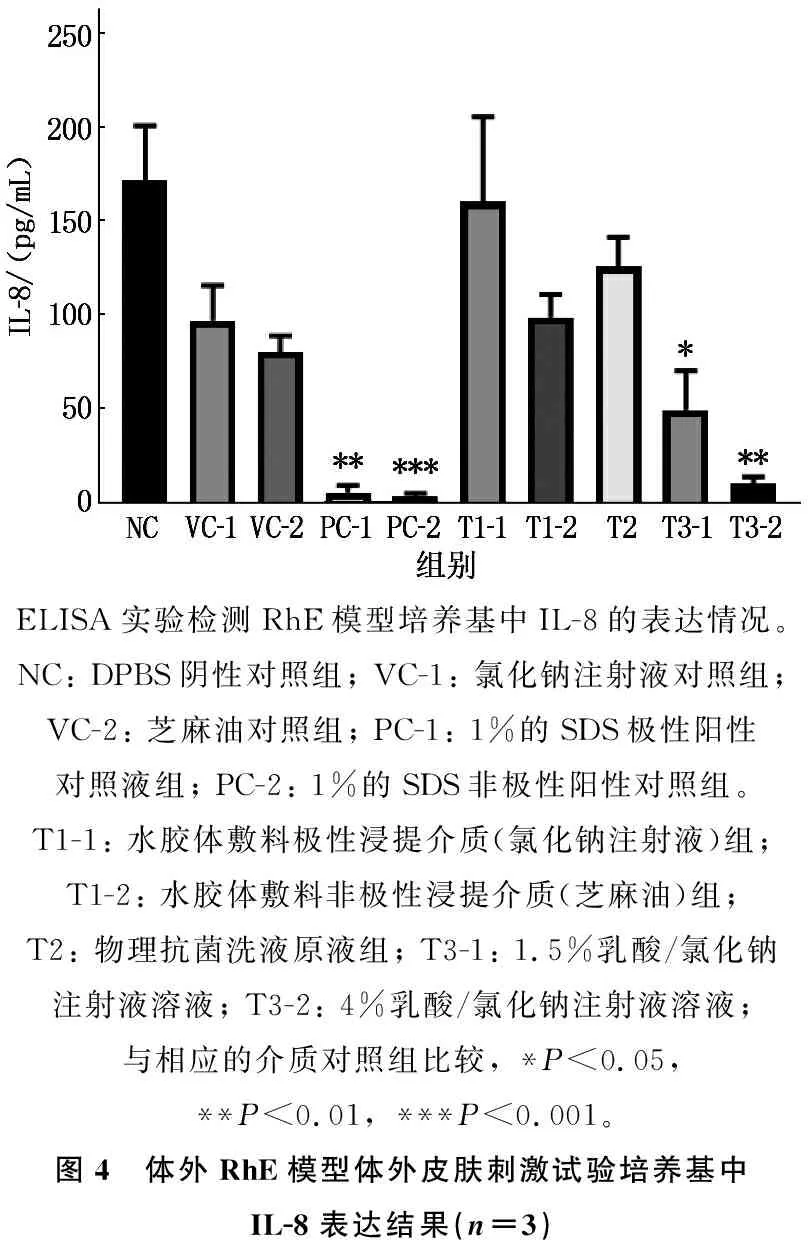
ELISA实验检测RhE模型培养基中IL-8的表达情况。NC: DPBS阴性对照组; VC-1: 氯化钠注射液对照组; VC-2: 芝麻油对照组; PC-1: 1%的SDS极性阳性对照液组; PC-2: 1%的SDS非极性阳性对照组。T1-1: 水胶体敷料极性浸提介质(氯化钠注射液)组; T1-2: 水胶体敷料非极性浸提介质(芝麻油)组; T2: 物理抗菌洗液原液组; T3-1: 1.5%乳酸/氯化钠注射液溶液; T3-2: 4%乳酸/氯化钠注射液溶液; 与相应的介质对照组比较, *P<0.05, **P<0.01, ***P<0.001。图4 体外RhE模型体外皮肤刺激试验培养基中IL-8表达结果(n=3)
3 讨 论
针对医疗器械浸提液体外刺激试验进行的国际实验室间比对研究[8-9]验证了RHE模型能够有效地评价医疗器械皮肤刺激反应。本实验室针对RHE模型也进行了大量研究,证明该模型能够应用于医疗器械皮肤刺激替代试验。既往研究[10-11]表明,在使用体外皮肤刺激模型研究空气污染物刺激性实验中, IL-1α和IL-8表达均增加,其可以作为敏感的分子标记物,提示相关的皮肤刺激性。但也有研究认为,对皮肤刺激性物质和致敏性物质刺激RHE模型后, IL-1α和IL-8表达情况有所不同。当局部用致敏物质孵育时,细胞内外 IL-1α水平非常低,但会引起明显的细胞毒性,其IL-8的释放量最大。但只存在皮肤刺激物下,作者观察到反向的细胞因子释放谱,并认为IL-8、IL-1α和MTT在皮肤刺激试验中都是必要的,可以用来区分物质的刺激性和致敏性[12]。在本研究中,对试验液孵育24 h后培养基中的IL-8表达含量进行测定,结果发现IL-8在组织活度低的培养基中含量很低,在组织活度高的培养基中的含量基本一致。由于本研究模型主要检测皮肤刺激物对SkinEthicTMRHE模型的刺激作用,而文献检索也表明IL-8的表达与致敏性相关性更高。分析结果认为, IL-8与皮肤刺激性关系不大,但可能与该模型检测致敏性物质有关。本研究结果表明,体外皮肤刺激模型培养基中IL-1α的表达含量随试验样品刺激性的增加而增加。与本实验室前期MTT法中测得的吸光度情况相比,体现出更高的敏感性。同时,实验室前期家兔刺激试验结果也显示, IL-1α表达能够更为敏感地监测出皮肤刺激反应。另一方面,对于临界值不好判断的结果,应该结合MTT结果和体内实验,防止出现假阳性或假阴性结果。
综上所述,医疗器械体外皮肤刺激试验中, RhE模型体外皮肤刺激试验中,培养基中IL-1α表达量与刺激指数呈正相关,和IL-8与皮肤刺激指数呈负相关。IL-1α可作为RhE模型体外皮肤刺激试验的分子标记物,提高医疗器械刺激试验体外替代模型的准确性。

