血清sICAM1、TNFR1、miRNA155检测对早期1型糖尿病肾病诊断的价值研究*
熊 敏,潘勇军,苗新宇
(南方科技大学医院重症医学科,广东 深圳 518000)
糖尿病(diabetes mellitus,DM)是临床常见代谢性疾病,主要表现为高血糖,其中1型糖尿病(type 1 diabetes mellitus,T1DM)患者约占DM总人数5%~10%,是青少年常见内分泌疾病之一,近年来调查显示,成人T1DM患者人数甚至更多,全球发病率呈上升趋势[1]。糖尿病肾病(diabetic kidney disease,DKD)是DM常见并发症,以尿中出现白蛋白为主要特征,DM中有20%~40%患者发展为DKD,是DM预后不良的重要原因之一[2]。DKD已逐渐成为终末期肾病(end-stage renel disease,ESRD)最主要原发病,导致肾功能发生不可逆损伤,严重危害患者生命健康。DKD早期起病隐匿,而肾穿刺活检属有创检查,患者难以接受,因此,通过血清相关指标进行早期诊断,并采取积极措施进行干预,有助于延缓疾病进展,改善患者预后。可溶性细胞间黏附因子1(soluble intercellular adhesion molecule 1,sICAM1)参与炎症反应及免疫调节,与DKD发生发展关系密切[3]。肿瘤坏死因子受体1(tumor necrosis factor receptor 1,TNFR1)是肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)家族成员,肾组织受刺激后可大量表达,对判断肾损伤具有潜在价值[4]。微小RNA(microRNA,miRNA)-155参与调控炎症反应,在急性肾损伤及梗阻性肾病中表达上调,与肾损伤有关[5-6]。目前关于DKD早期诊断相关研究多集中于2型糖尿病(type 2 diabetes mellitus,T2DM),而对T1DM患者研究较少。本研究通过检测T1MD患者血清sICAM1、TNFR1、miRNA155水平,探讨三者检测对DKD早期诊断的意义,以期为临床诊治提供参考。
1 资料与方法
1.1 纳入及排除标准
纳入标准:①符合世界卫生组织关于DM诊断标准[7];②根据发病年龄、胰岛素水平等诊断为T1DM。排除标准:①T2DM或其他继发性DM患者;②急慢性感染患者;③存在心、肺、肝等器官严重损伤;④合并其他肾脏疾病;⑤合并血液系统疾病患者;⑥严重精神疾病患者;⑦合并恶性肿瘤及其他可能影响糖代谢疾病患者;⑧妊娠及哺乳期妇女;⑨使用肾毒性或影响肝肾代谢药物;⑩合并甲状腺机能减退/亢进等内分泌疾病。患者均知情同意,研究经院伦理委员会批准。
以尿白蛋白排泄率(urinary albumin excretion rate,UAER)为早期DKD诊断指标[8],收集患者24h尿液,测定UAER,根据UAER水平进行分组,UAER<20μg/min为DM组,UAER 20~200μg/min为早期DKD组。
1.2 一般资料
选取2019年1月至2021年3月我院内分泌科、肾内科收治的T1DM患者101例,其中男58例,女43例,年龄21~51岁,平均(31.79±5.48)岁。
1.3 方法
1.3.1 临床资料调查
收集患者年龄、性别、病程、吸烟史、饮酒史、治疗史(降糖、降压、降脂)等基本资料,计算身体质量指数(body mass index,BMI),入院后禁食12h,采集清晨空腹静脉血,测定空腹血糖(fasting blood glucose,FBG)、糖化血红蛋白A1c(glycated hemoglobin A1c,HbA1c),收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、血肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)、尿酸(uric acid,UA)、总胆固醇(total cholesterol,TC)、高密度脂蛋白(high density lipoprotein,HDL)、甘油三酯(triglyceride,TG)、低密度脂蛋白(low density lipoprotein,LDL)、估算肾小球滤过率(estimated glomerular filtration rate,eGFR)、超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、空腹胰岛素(fasting insulin,FINS)、24h尿蛋白等临床指标。
1.3.2 血清sICAM1、TNFR1、miRNA155水平检测
所有患者抽取清晨空腹静脉血5mL,3 000r/min 4℃条件下离心5min,留取上清,-80℃保存。取血清样品,sICAM1、TNFR1采用酶联免疫吸附法,根据试剂盒(上海润裕生物科技有限公司)说明书,使用680全自动酶标仪(美国Bio-Rad公司)在450nm处读取吸光度(A)值,以标准品浓度为横坐标,A值为纵坐标绘制标准曲线,计算待测样本中sICAM1、TNFR1水平。
miRNA155采用qRT-PCR法检测,取血清样品,加入TRzol试剂,提取总RNA,检测总RNA纯度和浓度,选择A260/A280为1.8~2.0的RNA样品,使用逆转录试剂盒(美国Thermo Fisher Scientific公司)将总RNA逆转录为cDNA,配制反应体系,包括:2μL cDNA,1μL上下游引物,10μL SYBR Green Master Mix,ddH2O补充至总体积25μL。使用CFX96 PCR仪(美国Bio-Rad公司)检测血清样本中miRNA155表达水平。扩增条件:95℃预变性10min,95℃ 20s,55℃ 10s,72℃ 30s,40个循环。以U6为内参,miRNA155相对表达水平采用2-△△CT法计算。所用引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。
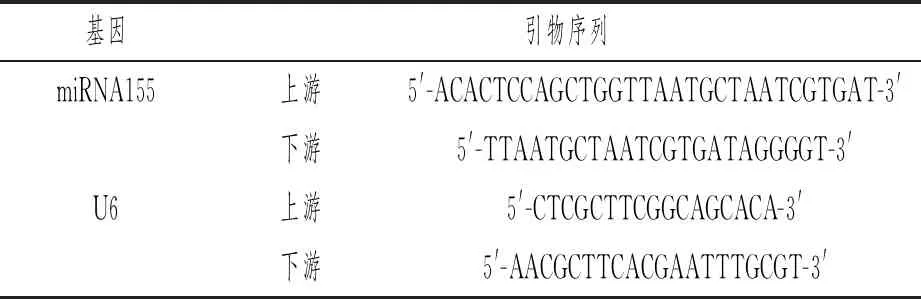
表1 miRNA155引物序列
1.4 统计学方法
2 结 果
2.1 可能导致DKD的影响因素分析
101例T1DM患者发生DKD 37例,发生率为36.63%。两组患者年龄、性别构成比、病程、BMI、FBG、HbA1c、SBP、DBP、UA、TC、HDL、TG、LDL、吸烟、饮酒、ALT、AST、降糖治疗、降压治疗、降脂治疗构成比及FLNS、24h尿蛋白等临床资料比较,差异无统计学意义(P>0.05)。早期DKD组Scr、BUN、hs-CRP、sICAM1、TNFR1、miRNA155高于DM组,eGFR低于DM组(P<0.05)。见表2。

表2 影响T1DM患者发生DKD的单因素分析
2.2 Logistic回归分析
以T1DM患者发生DKD的影响因素为自变量(X),以是否发生DKD为因变量(Y),分别进行赋值,赋值方法见表3。

表3 变量赋值方法
将X和Y纳入Logistic回归模型,进行多因素分析。结果显示,hsCRP(OR=2.140,P=0.023)、eGFR(OR=0.425,P=0.009)、sICAM1(OR=4.187,P=0.001)、TNFR1(OR=4.697,P<0.001)、miRNA155(OR=3.832,P<0.001)均是导致T1DM患者发生DKD的影响因素。见表4。
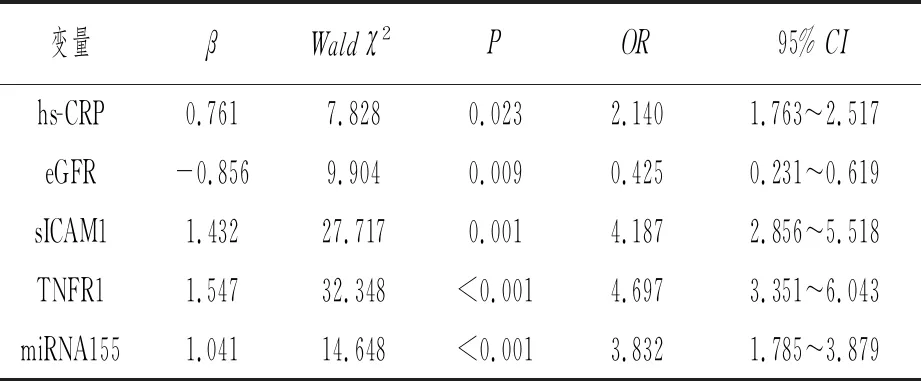
表4 T1DM患者发生DKD的Logistic回归分析
2.3 血清sICAM1、TNFR1、miRNA155对早期DKD的诊断价值
ROC结果显示,血清sICAM1、TNFR1、miRNA155用于诊断早期DKD的最佳截断点分别为303.16ng/mL、873.21pg/mL、4.65,单独及联合诊断早期DKD的AUC分别为0.762、0.749、0.756、0.835。见表5、图1。
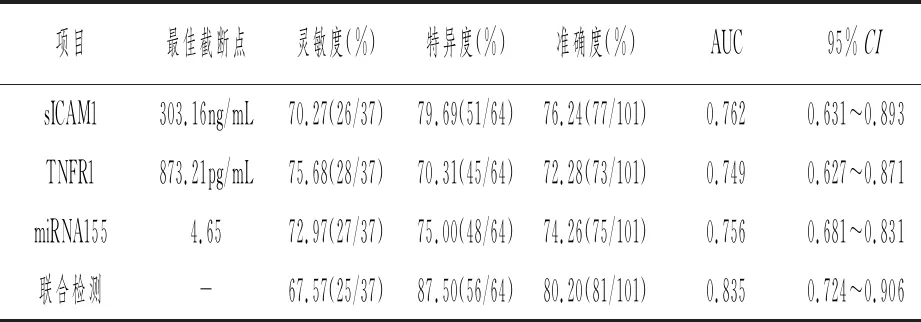
表5 血清sICAM1、TNFR1、miRNA155对早期DKD的诊断价值
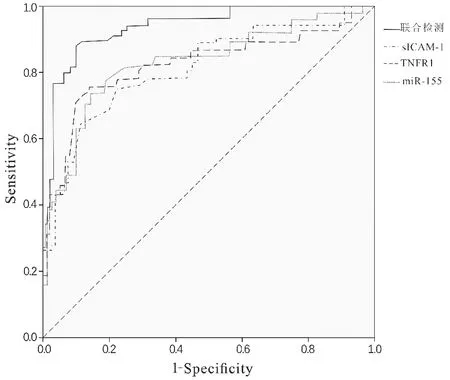
图1 血清sICAM1、TNFR1、miRNA155对早期DKD的诊断价值
3 讨 论
T1DM是一种代谢紊乱综合征,与遗传、免疫功能、环境因素等有关,长期血糖控制不佳,患者处于高血糖状态,导致脂肪和蛋白质代谢紊乱,增加肾脏负担,促进肾小球肥大和硬化,引起肾功能下降,血流动力学发生改变,最终发展为DKD[9-10]。DKD早期病理改变为可逆性,及时治疗可延缓病情进展,甚至能够逆转损伤,一旦进入终末期,肾实质性损害将无逆转可能。临床上常用微量白蛋白尿及肾功能指标诊断DKD早期病变,但早期UAER受饮食、血糖及运动等因素影响较大,且部分患者肾功能出现明显下降,而微量白蛋白仍在正常范围,Scr及BUN等指标很难反应早期肾脏病变,因此,需寻找更为敏感的早期诊断指标。
炎症反应在DKD发病机制中发挥重要作用,由代谢过剩引发的慢性低度炎症状态,是导致DM并发症发生的主要机制之一,体外实验及动物实验均表明,慢性低度炎症状态与DKD发生、发展密切相关[11-12]。sICAM1是一种免疫球蛋白,广泛分布于单核细胞、内皮细胞等内,通过与受体结合形成复合物,释放各种物质,在细胞与细胞以及细胞外基质之间产生黏附作用,促进血管增生,引发DKD、糖尿病视网膜病变等DM并发症[13]。TNF-α是主要促炎因子,通过受体TNFR1、TNFR2介导炎症反应,对DKD的发生发挥病因学作用。TNFR1在机体各种细胞广泛表达,与肾损伤关系密切,血清TNFR1浓度较高的T2DM患者发生ESRD风险明显增加[14]。miRNA155参与调节炎症反应,与DKD关系密切,Beltrami等[15]研究显示,miRNA155在DKD患者中的表达是单纯DM患者的1.8倍。本研究结果显示,DKD组患者血清sICAM1、TNFR1、miRNA155较DM组明显升高,提示sICAM1、TNFR1、miRNA155均与T1DM患者肾损伤有关。另外,本研究结果还显示,DKD组hs-CRP水平升高,eGFR降低,提示hs-CRP、eGFR也是影响T1DM患者发生DKD的因素。hs-CRP是临床炎症标志物,其水平升高表明患者存在炎症反应,且在肾损伤早期已发生异常表达。部分DM患者微量尿白蛋白处于正常范围时,eGFR已发生明显下降,eGFR下降可反应肾功能损伤程度和DKD进展程度。本研究经Logistic回归分析,结果显示sICAM1、TNFR1、miRNA155、hs-CRP、eGFR均为DKD的影响因素,参与DKD发生发展过程。
本研究ROC结果显示,血清sICAM1、TNFR1、miRNA155预测DKD的最佳截断点分别为:303.16ng/mL、873.21pg/mL、4.65,三者单独及联合检测用于诊断早期DKD的AUC分别为:0.762、0.749、0.756、0.835,提示三者均对DKD发生具有较高预测价值,且三者联合检测价值更高。sICAM1参与内皮细胞及炎性细胞黏附作用,主要与肾小球血管内皮细胞炎症反应有关,可反应炎症情况和功能障碍,在多种炎症性疾病中表达异常[16]。TNFR1参与TNF-α介导的炎症反应,在T1DM患者早期损伤中,TNFR1与肾小球滤过率呈负相关,对早期肾损伤具有良好预测作用[17]。miRNA155参与肾间质纤维化过程,在肥胖相关性肾病及急性肾损伤等多种肾功能障碍疾病中表达异常[18]。血清sICAM1、TNFR1、miRNA155均可在一定程度上反应肾功能损伤程度,但存在特异性不足等局限性,本研究将3种指标联合检测后AUC可达0.835,因此,临床对T1DM患者进行血清sICAM1、TNFR1、miRNA155检测,有助于早期诊断DKD,及早采取干预措施,延缓疾病进展,改善预后。
综上所述,血清sICAM1、TNFR1、miRNA155均是T1DM患者发生DKD的影响因素,采用三者联合检测对DKD早期诊断价值更高,有望成为临床早期诊断DKD的可靠指标。另外,本研究尚存在研究时间相对较短及样本量较小等不足,今后仍需扩大样本量,进一步验证结论可信度。

