ZNF750在结直肠癌细胞增殖中的作用和分子机制研究*
司马学琴,孙元鹏
(湖北科技学院医学部基础医学院,湖北 咸宁 437100)
结直肠癌是一种常见的消化系统恶性肿瘤,严重影响患者的健康。在世界范围内,中国虽然处于结直肠癌的低发区,但是,近年来随着饮食结构及生活方式的改变,结直肠癌发病率呈逐年上升的趋势[1]。
结直肠癌的发生、发展是一个多基因、多步骤、多阶段的复杂而连锁的过程,涉及多个分子的相互作用以及不同基因在DNA和RNA水平上一过性或永久性的变化[2]。
锌指蛋白750(zinc finger protein 750,ZNF750)是锌指蛋白C2H2样锌指蛋白亚群的一员,其编码基因位于染色体17q25.3,编码蛋白质长度为723个氨基酸,其中5-58位氨基酸为C2H2样结构域,可结合特异性DNA位点CCNNAGGC,702-723位氨基酸为其核定位信号,这两个结构域是其发挥转录调控功能所必需的[3]。目前,对ZNF750基因的功能和机制研究较少,ZNF750在结直肠癌发生、发展及转移中的作用及分子机制亦尚未明确。因此,本研究重点探讨ZNF750基因在结直肠癌增殖中的可能作用及分子机制,旨在阐明ZNF750在结直肠癌发生发展中的主要生物学功能,为结直肠癌的早期诊断、干预和治疗及预后奠定理论基础。
1 材料与方法
1.1 材料与试剂
人结直肠癌细胞株SW620和LoVo购于中国科学院细胞典藏培养中心,ZNF750小分子干扰RNA由吉玛基因公司合成。Gibco胎牛血清、1640培养基、Lipofectamine2000(Invitrogen,Carlsbad,CA,USA)瞬时转染试剂盒、cDNA逆转录试剂盒(MBI Fermentas公司)、荧光定量(qRT-PCR)试剂盒(MBI Fermentas公司)和碧云天MTT检测试剂盒购于广州威佳科技有限公司。
1.2 方法
1.2.1 细胞培养
人结直肠癌细胞株SW620、LoVo在1640培养基中辅以5%胎牛血清培养,置于细胞培养箱内。
1.2.2 细胞转染
选取对数生长期的SW620和LoVo细胞,按照说明书,用Lipofectamine2000试剂、ZNF750 siRNA和Negative control转染,分为ZNF750-SW620敲低组和NC-SW620对照组,ZNF750-LoVo敲低组和NC-LoVo对照组。
1.2.3 干扰RNA和引物的设计
见表1、表2。

表1 干扰RNA和阴性对照序列

表2 所选基因引物序列
1.2.4 实验组和对照组细胞的RNA提取和逆转录反应
转染48h后,选取生长良好的SW620和LoVo实验组和对照组细胞,倒掉培养基后,用PBS缓冲液冲洗2次,加入1mL Trizol试剂,把裂解物移入DEPC处理过的1.5mL离心管,加入0.2mL氯仿,翻转离心管,充分混合,在冰上静置10min后,在高速离心机中,4℃ 12 000rpm离心15min,把上层液体析出至另一干净离心管中,加入0.2mL异丙醇,将新的离心管在高速离心机4℃ 12 000rpm离心10min后,析出上清液,把管底的白色沉淀用DEPC水配置的75%乙醇和100%乙醇各洗涤1次,室温自然干燥后,加入20μL DEPC水溶解,用分光光度计测量提取的RNA纯度和浓度。按照逆转录试剂盒说明进行操作,1μg的总RNA加入逆转录试剂盒中的相应试剂,混匀后在PCR扩增仪中42℃ 60min、95℃ 5min、4℃ 5min后取出,置于-20℃冷冻保存。
1.2.5 荧光定量PCR(qRT-PCR)检测ZNF750 siRNA干扰效率
按照荧光定量试剂盒说明书,把反转录合成的cDNA,分别按剂量加入SYBR Green染料和ZNF750上下游引物(表2),以及SYBR Green染料和内参GAPDH上下游引物(表2),匀速离心混合后,置于ABI7 000PCR仪器中分别扩增基因ZNF750和内参基因GAPDH,用采集到的荧光定量值(Ct值)进行相对定量分析,检测SW620和LoVo细胞实验组和对照组中ZNF750的相对表达量,基因相对表达量采用2-ΔΔCt值表示,每组数值需要测定3个复孔,检测siRNA对ZNF750的干扰效率。
1.2.6 MTT检测细胞增殖活性
选取处于对数生长期的细胞,PBS缓冲液冲洗2遍后,加入胰蛋白酶液消化,使细胞充分解离,把ZNF750敲低的SW620和LoVo细胞和对照组细胞大约以每孔1 000个/细胞的密度分别接种于96孔板中,每组设置3个复孔,加入培养基,置于37℃、5% CO2培养箱内培养。24、48、72h后取出,然后向每孔内加入配置好的20μL MTT溶液,在培养箱中继续孵育4h,取出后再用PBS缓冲液冲洗,最后加入20μL的DMSO溶液,使用酶标仪在450nm波长处测定吸光值(OD值)。
1.2.7 平板克隆形成实验
选取处于对数期增长的细胞,PBS缓冲液冲洗,用胰蛋白酶液消化,使细胞充分分散,接种200个细胞到6孔板中,每种细胞接种3孔,然后轻轻晃动培养板,使细胞均匀平铺在培养板中,在细胞培养箱中孵育2周。当培养板中的细胞出现肉眼可见的细胞克隆时,停止培养,倒掉培养基,用缓冲液PBS轻轻冲洗3次,在空气中干燥后,再倒入1mL甲醇固定15min,然后又置于空气中干燥,待干燥完全后,用Giemsa染液染色15min,最后用蒸馏水缓缓洗净残留染液,干燥后在光镜下计算克隆数。
1.2.8 荧光定量PCR(qRT-PCR)检测实验组和对照组细胞KLF4的表达
采用荧光定量PCR分别测定ZNF750-SW620敲低组和NC-SW620对照组,ZNF750-LoVo敲低组和NC-LoVo对照组,KLF4基因和内参基因GAPDH的荧光定量值(Ct值),检测SW620和LoVo细胞实验组和对照组中KLF4的相对表达量,基因相对表达量采用2-ΔΔCt值表示,每组数值需要测定3个复孔,分析ZNF750沉默后,KLF4表达是否会有差异。
1.3 统计学方法
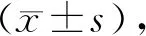
2 结 果
2.1 荧光定量PCR检测ZNF750siRNA干扰效率
荧光定量PCR结果显示:瞬时转染ZNF750 siRNA后,ZNF750-SW620敲低组和NC-SW620对照组相比,ZNF750的mRNA表达水平明显下降,差异具有统计学意义(P<0.05);瞬时转染ZNF750 siRNA后,ZNF750-LoVo敲低组和NC-LoVo对照组相比,ZNF750的mRNA表达水平明显下降,差异具有统计学意义(P<0.05);说明SW620和LoVo细胞ZNF750基因敲低成功,可以进一步开展后续实验,详见表3。
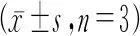
表3 ZNF750 siRNA转染结直肠癌细胞株ZNF750mRNA的相对表达量
2.2 ZNF750沉默对结直肠癌细胞株SW620和LoVo增殖能力的影响
运用MTT法检测ZNF750沉默后,结直肠癌细胞SW620和LoVo增殖能力的变化。选取ZNF750敲低成功的SW620和LoVo细胞继续培养,MTT检测24、48和72h的OD值发现,实验组较对照组细胞增殖活性明显增强,差异具有显著性(P<0.01),结果见表4和表5。表明敲低ZNF750的表达会增强结直肠癌细胞的体外增殖能力。
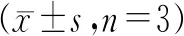
表4 ZNF750敲低对SW620细胞增殖活性的影响
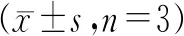
表5 ZNF750敲低对LoVo细胞增殖活性的影响
2.3 ZNF750沉默对结直肠癌细胞株SW620和LoVo平板克隆形成能力的影响
平板克隆形成实验结果显示:ZNF750-SW620敲低组单个细胞增殖能力高于NC-SW620对照组,差异具有统计学意义(P<0.01),结果见图2;ZNF750-LoVo敲低组单个细胞增殖能力也高于NC-LoVo对照组,差异具有统计学意义(P<0.01),结果见图3。
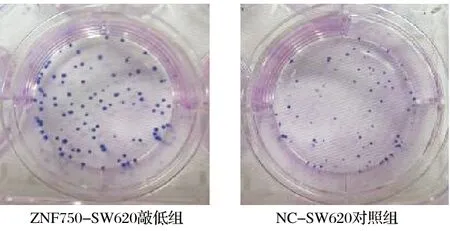

与对照组相比,**P<0.01
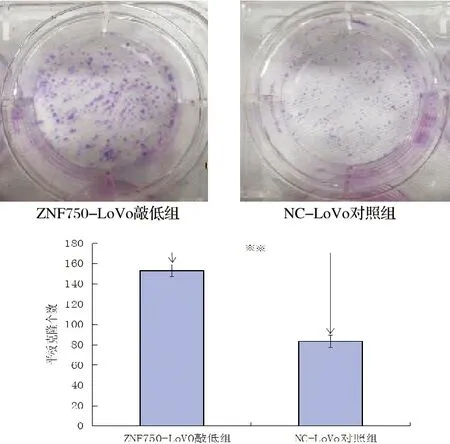
与对照组相比,**P<0.01
2.4 ZNF750沉默后对结直肠癌细胞KLF4基因表达水平的影响
荧光定量PCR结果显示:结直肠癌细胞SW620中ZNF750敲低成功后,KLF4的mRNA表达水平较对照组明显下降,差异具有统计学意义(P<0.05),结果见表6;结直肠癌细胞LoVo中ZNF750敲低成功后,KLF4的mRNA表达水平也较对照组明显下降,差异具有统计学意义(P<0.05),结果见表6。表明在结直肠癌细胞中,ZNF750的沉默会使KLF4的mRNA表达水平相应下降,ZNF750可能间接调控KLF4的表达。
表6 ZNF750 siRNA转染结直肠癌细胞株KLF4 mRNA的相对表达量
3 讨 论
ZNF750在大部分上皮组织如胎盘、胸腺、肺、前列腺、皮肤、角质形成细胞中有表达,在间质细胞如外周血白细胞、T细胞、成纤维细胞中没有表达,说明ZNF750可能是上皮组织特异性表达的基因[4]。有研究[5]表明ZNF750在原发性食管癌中发挥肿瘤抑制基因的作用,ZNF750基因的突变与失活导致食管鳞癌的发生和转移,ZNF750低表达与喉鳞状细胞癌TNM分期、淋巴结转移及预后有关。也有文献[6-7]报道ZNF750基因在结直肠癌组织中的表达水平明显低于周围正常组织,而且ZNF750低表达和不良预后相关。基于以上研究报道,我们运用小分子RNA沉默ZNF750在结直肠癌细胞中的表达,进一步探讨ZNF750对结直肠癌增殖过程的影响,以及其是否调控核转录因子KLF4的表达参与结直肠癌的发生发展。
通过本实验我们发现ZNF750对结直肠癌的增殖能力有显著抑制作用,而且还参与调控KLF4的表达。有研究[8]表明,ZNF750在口腔鳞状细胞癌中通过调控KLF4基因转录参与口腔鳞癌的发生发展。这一研究结果与我们在结直肠癌的初步实验相佐证,后续我们将运用Oncomine数据库做生物信息学研究,进一步研究ZNF750通过哪种信号通路如何调控KLF4在结直肠癌中的表达,探索ZNF750在结直肠癌发生发展中的机制。

