超声造影对C-TIRADS中甲状腺4~5类结节良恶性的鉴别价值*
卢景新,陈俊君,何志忠,袁智帆,李霞,陈沛芬,邝永培
(南方医科大学附属东莞医院 超声科,广东 东莞 523059)
甲状腺结节患病率约20%~35%,女性高于男性,其中7%~15%为甲状腺乳头状癌[1-2]。超声检查是甲状腺疾病筛查常用方法,为统一对甲状腺结节的认识和处理意见,我国制定了中国超声甲状腺影像报告和数据系统(China ultrasound thyroid imaging report and data system,C-TIRADS)[3],C-TIRADS分类主要依赖二维灰阶图像进行判断,未参考甲状腺血流成像(color doppler flow imaging,CDFI)特性,但提出超声造影和弹性成像可作为有效补充手段,医生和患者对4~5类结节关注度最高,对于甲状腺结节是否需手术切除,取决于结节的良恶性[4]。超声造影在甲状腺结节中的应用已在临床推广,其恶性结节的增强模式和特点已得到认可,但良恶性结节的灌注仍存在较大重叠区域[5]。为进一步研究超声造影对甲状腺良恶性结节的鉴别价值,本研究选取甲状腺超声检查患者为研究对象进行前瞻性分析,但考虑到不同甲状腺疾病的血供本身存在差异,如正常甲状腺、亚急性甲状腺炎等不同疾病条件下,甲状腺组织血流特点不尽相同,在此基础疾病上出现的甲状腺结节,也可能与基础疾病的血供特点密切相关。因此,本研究分析甲状腺结节与周边甲状腺组织造影时的峰值强度,计算其比值,以减少甲状腺基础血供对结节的影响,现报道如下。
1 对象与方法
1.1 研究对象
选取2019年1月—2020年3月超声科行甲状腺超声检查的128例患者,要求符合:(1)C-TIRADS分类为4~5类,且C-TIRADS分类由2名主治医师共同判定获得一致结果,无法获得一致结果时、由1名高级职称医师参与判定者[6];(2)已行手术切除或细针穿刺(fine needle aspiration,FNA)活检获得病理结果者;(3)对可疑良性、没有病理结果的患者随访12个月以上者;(4)行超声造影检查者;(5)甲状腺结节实性部分>50%者等。排除标准:(1)出现淋巴结转移者;(2)合并多个结节,经手术切除且无法确认超声识别的结节是否进行病理检测者;(3)超声造影图像受呼吸或吞咽影响,超声造影结果无法分析或分析结果不可靠者;(4)FNA细胞学检查为1级,无法获得良恶性判断者等。共纳入128例患者的135个甲状腺结节,患者及结节一般情况见表1。本研究经医院医学研究伦理委员会审核批准(KYKT2021-009)。
1.2 检查方法
1.2.1甲状腺常规超声检查 患者取仰卧位进行甲状腺超声检查,采用佳能Aplio i900超声诊断仪观察结节并测量结节大小,根据结节可疑恶性超声特征(实性、微钙化、极低回声、边缘模糊、边缘不规则或甲状腺外侵犯、垂直位)的个数计算分值(0分或1分),如果存在彗星尾伪像(良性特征),则将总分值减去1,根据最终分值(各项总分)进行C-TIRADS分类,1分为4 A类,2分为4 B类,3~4分为4 C类,5分为5类[7]。未行手术的患者每6个月随访1次,结节增大定义为实性结节或囊实性结节的实性部分至少2个径线增加20%以上,以1年时间为限,结节增大则进行细针穿刺抽吸(fine needle aspiration,FNA)或手术切除。
1.2.2甲状腺超声造影 使用佳能Aplio i900超声诊断仪,选用PLI-1205BX高频线阵探头,探头频率12.00~18.00 MHz,造影频率5.50~6.00 MHz,造影剂为Bracco公司的SonoVue,造影时机械指数(mechanical index,MI)为0.06~0.08;经肘静脉团注造影剂1.2 mL,观察造影剂在结节内的灌注情况,存储图像并后处理分析。
1.2.3甲状腺FNA活检 结合患者意愿并签署知情同意书后进行FNA活检,由超声明确结节部位后,选择合适的穿刺路线,反复抽吸提取样本10次,拔出针头,保存样本进行液基细胞学检查。
1.3 观察指标
1.3.1甲状腺结节的大小及良恶性 根据手术、FNA检查结果记录甲状腺结节的大小及良恶性,同时分析FNA诊断甲状腺恶性结节的诊断价值;参照Bethesda标准诊断甲状腺结节良恶性[8]。
1.3.2甲状腺良恶性结节超声造影特征 根据1.2.2项下结果,记录甲状腺C-TIRADS 4~5类良恶性结节超声造影特征,包括结节强化方式(偏心性、向心性及弥漫性)、强化程度(高增强、低增强及等增强)、周围有无环状增强等。
1.3.3甲状腺结节良恶性的诊断结果 根据1.2.2项下结果,记录甲状腺C-TIRADS 4~5类结节良恶性的强化模式(均匀强化、不均匀强化),并定量分析结节实性部分的峰值强度(peak intensity of solid part of nodule,PIM)、周边甲状腺组织峰值强度(peak intensity of peripheral thyroid tissue,PIT)以及两者的比值(PIM/PIT)。
1.4 统计学分析
2 结果
2.1 一般情况及良、恶性诊断
128例患者有甲状腺C-TIRADS 4~5类结节135个,4类结节112个、5类结节23个,男性43例有45个结节,年龄25~64岁,女性85例有90个结节,年龄22~71岁;结节大小为4~32 mm,平均(13.0±7.7)mm;92个结节进行FNA,其中45个结节为恶性、37个结节为良性、10个结节FNA结果与手术结果不符;FNA诊断甲状腺恶性结节的准确性为89.13%(82/92),诊断恶性结节的敏感性为90.00%(45/50),特异性为88.10%(37/42)。见表1。

表1 甲状腺C-TIRADS 4~5类结节不同诊断方法的良恶性结果Tab.1 Benign and malignant results of different diagnostic methods for C-TIRADS 4-5 categories of thyroid nodules
2.2 超声造影特征
甲状腺良恶性结节的强化方式、强化程度及无环状增强等方面比较,差异均有统计学意义(P<0.05)。见表2。
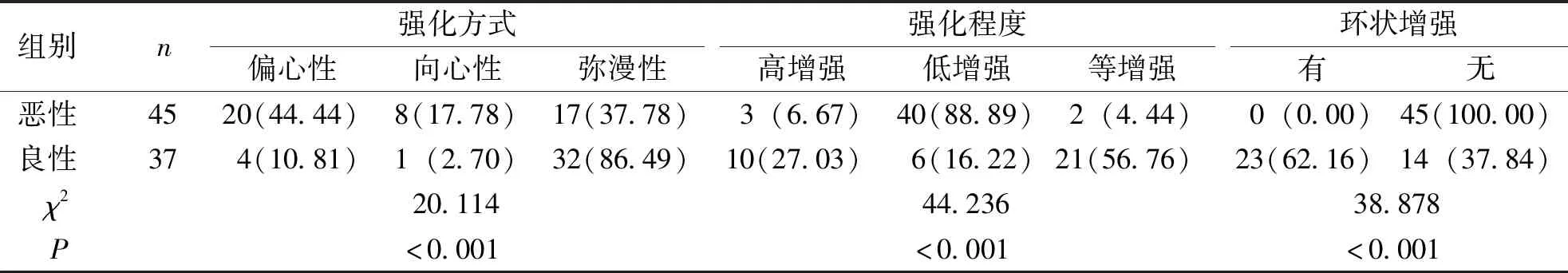
表2 良恶性甲状腺C-TIRADS 4~5类结节的超声造影特征[n(%)]Tab.2 Contrast-enhanced ultrasound features of benign and malignant C-TIRADS 4-5 categories of thyroid nodules[n(%)]
2.3 超声造影对良、恶性甲状腺结节的诊断
甲状腺良恶性结节强化模式比较,差异无统计学意义(P>0.05);甲状腺恶性结节的PIM和PIM/PIT明显低于良性结节,差异均有高度统计学意义(P<0.001)。见表3和图1。
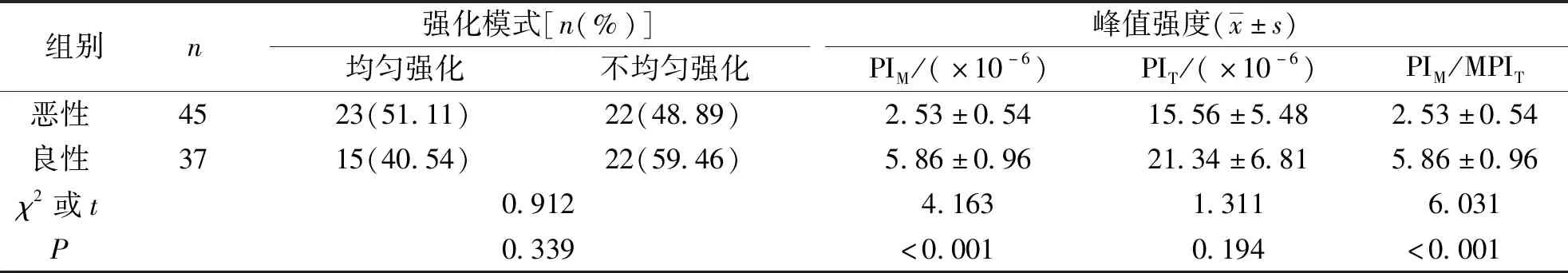
表3 超声造影对良恶性甲状腺C-TIRADS 4~5类结节的诊断Tab.3 Contrast-enhanced ultrasound diagnosis of benign and malignant C-TIRADS 4-5 categories of thyroid nodules
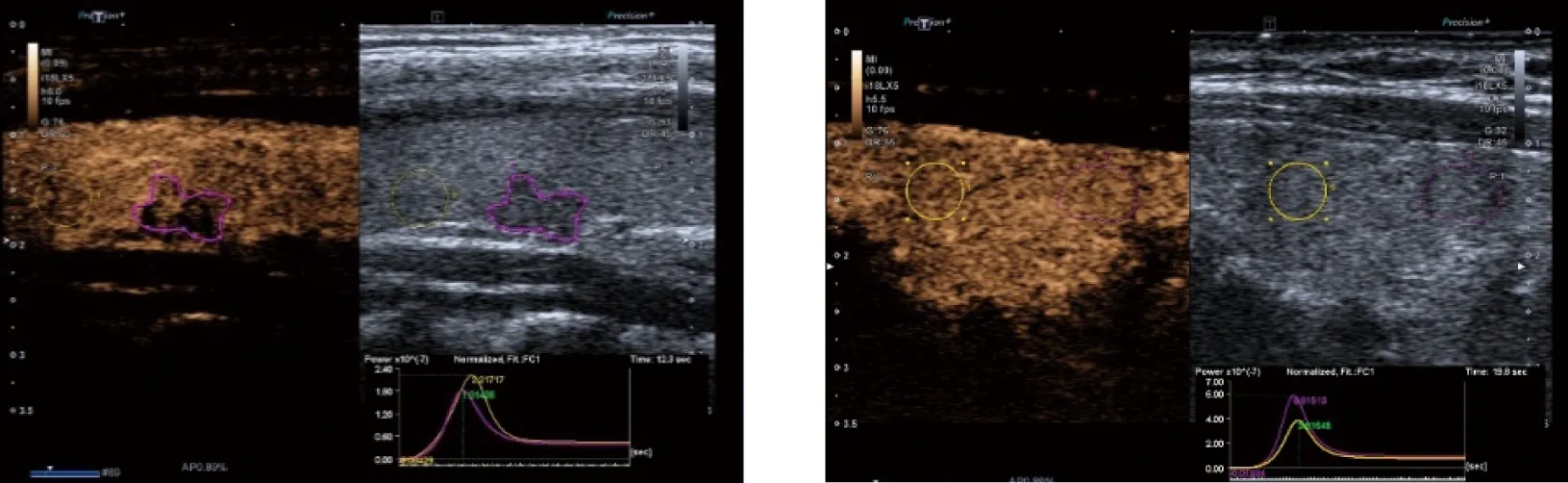
恶性结节 良性结节注:紫色表示结节的图像范围及超声造影时间强度曲线,黄色表示周边甲状腺组织的图像范围及超声造影时间强度曲线。图1 良恶性甲状腺C-TIRADS 4~5类结节与周边组织的时间强度关系Fig.1 The relationship between the time intensity of C-TIRADS 4-5 categories and surrounding tissues in benign and malignant thyroid nodules
2.4 ROC曲线
以甲状腺C-TIRADS 4~5类PIM、PIT及PIM/PIT绘制ROC曲线,AUC分别为0.784(P=0.001)、0.872(P<0.001),后者诊断效能优于前者;甲状腺C-TIRADS 4~5类结节峰值强度以0.784为临界点鉴别结节良恶性时,其敏感性为62.50%、特异性为87.00%;PIM/PIT以0.872为临界点鉴别甲状腺结节良恶性时,其敏感性为79.20%、特异性为91.30%;PIM/PIT诊断甲状腺结节良恶性的敏感性、特异性均高于甲状腺结节峰值强度(P<0.05);PIM/PIT≥0.872时考虑为良性结节,PIM/PIT<0.872时考虑为恶性结节。见图2。
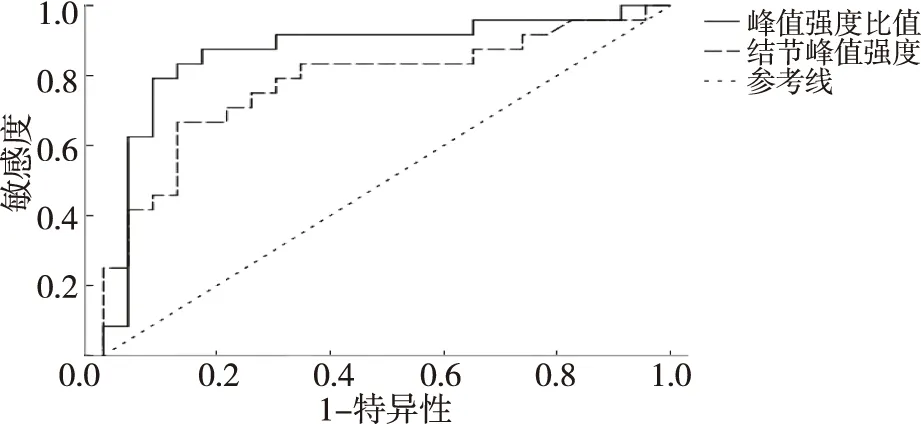
图2 甲状腺C-TIRADS 4~5类结节峰值强度及PIM/PIT的ROC曲线Fig.2 Peak intensity of C-TIRADS 4-5 categories of thyroid nodules and ROC curve of PIM/PIT
3 讨论
超声造影判断甲状腺结节良恶性的研究近年来非常受关注,在前期研究结果的推动下,超声造影已被2020版C-TIRADS指南中列入了B级别推荐[9]。有研究认为,低增强、不均匀性增强及早消退是甲状腺结节恶性征像的灌注特点,但凭借这些灌注特点区分甲状腺良恶性结节仍存在一定的重叠区域[10]。甲状腺乳头状癌在甲状腺癌中数量最多,约占80%~90%,虽然其预后良好,但超声造影的增强显像特点并不唯一[11]。既往研究认为,良性结节以等增强占比最多(72.11%),恶性结节低增强占比最多(75.8%);但也有研究显示甲状腺癌等增强占比最多(49.5%),低增强占比29.3%,略高于高增强占比(21.2%)[12-14]。有研究比较良性结节和恶性结节的增强强度、均匀增强和早期消退指标,结果表明二者差异均无统计学意义(P>0.05)[15],考虑原因与到强化强度的判断受检查者主观判断因素的影响有关,本研究在排除主观因素的影响后进行研究,取得了较好的结果。
超声造影定量分析可以通过分析软件获得客观数据,同时根据超声造影对患者病情情况进行分析,本研究中发现甲状腺恶性超结节强化方式不一,且多为低增强;良性结节则以弥漫性强化、等增强为主,与童瑾等[16]研究所得一致。分析原因可能为:甲状腺恶性结节新生血管形成较快,而微小血管内癌栓形成后,可致静脉回流受阻而引起低增强,同时甲状腺恶性结节内部多伴有纤维化、玻璃样变性,可促进动静脉瘘的形成,使内部血管网不平衡,导致节强化方式不一[17-18]。此外,研究显示,超声造影时,良恶性结节的峰值强度、达峰时间均有差异,但平均渡越时间则无差异[19]。曹月光等[20]将甲状腺结节分为内部和边缘区域进行勾勒,获得不同部位的时间-强度曲线,结果显示无论是良性结节还是恶性结节,内部区域的峰值强度均低于边缘区域,其中恶性结节的内部区域峰值强度低于良性结节;达峰时间恶性结节慢于良性结节,内部区域慢于边缘区域。甲状腺良恶性结节组织病理结构、血流动力学表现不一致,结节内部时间一强度曲线相对不一致,对甲状腺良恶性鉴别起着一定作用[21]。本研究中恶性结节的PIM、PIM/PIT低于良性结节,且PIM/PIT以0.872为临界点鉴别甲状腺结节良恶性时,其敏感性为79.20%,特异性为91.30%,进一步说明PIM/PIT能更好地鉴别甲状腺结节良恶性,PIM/PIT≥0.872时考虑为良性结节,PIM/PIT<0.872时考虑为恶性结节。分析原因为:甲状腺癌的造影特征呈低增强、慢消退特性,恶性结节周边组织易遭受到破坏,结节内正常血供受阻甚至中断,可导致PIM、PIM/PIT呈降低趋势[22-24]。施燕芸等[25]通过对甲状腺结节超声造影定量分析,进一步证实甲状腺乳头状癌同样呈缓慢增强。
综上,本研究表明PIM/PIT能更好地鉴别甲状腺结节良恶性,PIM/PIT≥0.872时考虑为良性结节,PIM/PIT<0.872时考虑为恶性结节。但本研究亦存在一定的不足,如样本量较少、无超声造影和彩色多普勒血流显像(color doppler flow imaging,CDFI)结合的临床诊断价值,值得临床进一步进行多中心、大样本量的研究与推广应用。

