氧化三甲胺促进动脉粥样硬化的研究进展
李轶男 裴汉军
(内蒙古科技大学包头医学院第一附属医院心内科,内蒙古 包头 014010)
氧化三甲胺(trimethylamine N-oxide,TMAO)是胆碱、卵磷脂和肉碱的代谢产物,可由三甲胺(trimethylamine,TMA)转变而来。肠道中的膳食胆碱和左旋肉碱在多种酶的作用下产生TMA,后者在肠道上皮细胞被吸收并输送到肝脏,在肝脏中被黄素单加氧酶3(flavin-containing monooxygenase 3,FMO3)进一步氧化,形成TMAO,之后生成的TMAO一部分作为渗透压调节剂被转运到组织中积累,其余绝大部分以尿液的形式排出体外[1]。近年来TMAO被认为是动脉粥样硬化(atherosclerosis,AS)形成和发展的重要因素,并且有望在改善冠心病患者危险分层及预后方面发挥作用。现就TMAO促AS机制、TMAO在临床研究中的作用及干预TMAO产生的治疗方案展开综述,旨在为防治AS及改善冠心病患者临床预后提供新靶点。
1 TMAO促AS的机制
TMAO作为一种代谢产物,其促AS的机制可概括为以下五点,如图1所示:(A)调节巨噬细胞表面的受体促使其对氧化型低密度脂蛋白的摄取增多、排出减少,促进泡沫细胞的形成;(B)激活三磷酸肌醇通路,增加血小板反应性;(C)减少一氧化氮(nitric oxide,NO)产生及生物利用度,引起内皮细胞功能障碍;(D)下调CYP7A1的表达,减少肝内胆汁酸合成;(E)促进炎症反应。
1.1 促进泡沫细胞的形成
巨噬细胞吞噬胆固醇形成的内源性泡沫细胞是AS早期病变的主要标志。其中CD36和A1类清道夫受体(class A1 scavenger receptor,SR-A1)是巨噬细胞表面的受体,它们可识别并介导巨噬细胞对氧化型低密度脂蛋白摄取[2]。胆固醇酰基转移酶-1和中性胆固醇酯水解酶调节胆固醇的酯化作用。ATP结合盒转运体A1、G1和清道夫受体BI则在巨噬细胞胆固醇输出中起关键作用。当胆固醇摄取和酯化作用增加和/或胆固醇输出减少时,脂质超负荷的巨噬细胞将转化为泡沫细胞,即AS斑块中的典型细胞[3]。TMAO则可激活巨噬细胞SR-A1和CD36受体的表达,刺激对氧化型低密度脂蛋白的摄取来促进泡沫细胞的形成[4]。同样的,Mohammadi等[5]也发现TMAO既可上调SR-A1的表达,又能下调ATP结合盒转运体A1,促进泡沫细胞的形成。
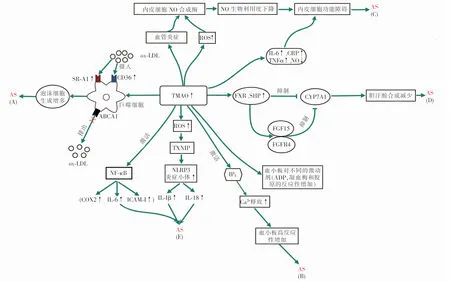
注:ABCA1,ATP结合盒转运体A1;ROS,活性氧;FGF15,成纤维细胞生长因子15;FGFR4,成纤维细胞生长因子受体4;CRP,C反应蛋白;TNF-α,肿瘤坏死因子-α;SHP,小异二聚体伴侣;IP3,三磷酸肌醇;TXNIP,硫氧还蛋白互作蛋白;NLRP3,NOD样受体蛋白3;ox-LDL,氧化型低密度脂蛋白;COX2,环氧合酶2;ICAM-1,细胞间黏附分子-1;FXR,法尼酯X受体;CYP7A1,胆固醇7α-羟化酶;NF-κB,核因子κB;IL,白介素;ADP,腺苷二磷酸。图1 TMAO促AS机制
1.2 增加血小板的反应性
血小板活化作为AS形成过程中的重要因素,参与血栓的形成和AS斑块的破裂,故促进血小板活化,血小板反应性的增加,会加重AS[6]。Zhu等[7]研究发现口服胆碱补充剂,受试者血浆TMAO水平增加,同时伴随着血小板对腺苷二磷酸(adenosine diphosphate,ADP)的聚集反应相应增强。还有研究[8]发现TMAO可直接增加血小板对多种不同激动剂(ADP、凝血酶和胶原)的反应性,促进血小板与它们之间的黏附性,而且在ADP和凝血酶作为激动剂的前提下,TMAO会激活血小板中三磷酸肌醇信号通路,促使细胞内储存的Ca2+依赖性释放来提高血小板高反应性。
1.3 促使血管内皮细胞功能障碍
内皮细胞功能障碍是公认的心血管危险因素,是AS发展的早期事件。许多临床和基础研究显示内皮祖细胞在恢复内皮损伤和维持内皮功能中起着至关重要的作用。当血管发生损伤时,骨髓来源的内皮祖细胞可动员到外周循环,并在损伤的内皮部位分化为内皮细胞[9],而且内皮祖细胞的数量和冠心病的危险因素负相关[10]。研究发现TMAO可通过增加体外培养的内皮祖细胞内炎症和活性氧的产生,直接导致循环内皮祖细胞功能损伤,并最终导致内皮功能障碍,同时TMAO还可减少内皮祖细胞内NO的表达,使NO介导的内皮功能受损[11]。而NO的产生或可用性降低也是内皮功能障碍的重要原因,Li等[1]发现在老年大鼠中,高水平的TMAO可通过增加血管炎症和氧化应激减弱内皮细胞一氧化氮合酶来源的NO的生物利用度,从而导致与衰老相关的血管内皮功能障碍;且NO介导的处于静止状态的内皮细胞在受到氧化还原信号的刺激时会转化为激活状态[12],导致炎症、血管收缩和重塑,促进AS的发展。
1.4 影响胆汁酸代谢
高胆固醇是AS的主要危险因素之一,胆固醇合成胆汁酸是清除体内多余胆固醇的主要途径,有助于AS的消退[13]。胆汁酸已被证明是核受体法尼酯X受体(farnesoid X receptor,FXR)的内源性配体,FXR调节参与胆汁酸合成、转运、结合和排泄等基因的活性[14]。胆汁酸激活FXR通过反馈机制下调胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)的表达可限制肝内胆汁酸的合成[15]。Ding等[16]发现TMAO仅可改变胆汁酸的分布,激活核FXR及小异二聚体伴侣受体,下调CYP7A1的表达抑制胆汁酸合成,增加主动脉壁内泡沫细胞的积聚和斑块面积,加速小鼠主动脉损伤的形成。还有研究[17]发现与正常喂养的小鼠相比,补充膳食TMAO的小鼠表现出肝胆汁酸转运蛋白活性的下降和总胆汁酸池大小的减少。白藜芦醇则可降低TMAO的水平,并通过肠肝FXR-成纤维细胞生长因子15轴诱导肝胆汁酸的合成来影响胆固醇代谢,减弱TMAO所致的AS[18]。由此可见TMAO引起的胆汁酸合成减少在促AS中发挥重要作用。
1.5 引起炎症反应
AS是一种慢性炎症疾病,核因子κB(nuclear factor-κB,NF-κB)通路在许多与AS相关的促炎基因的表达中起调节作用。TMAO可通过激活NF-κB通路诱导包括环氧化酶2、E选择素、白介素(interleukin,IL)-6和细胞间黏附分子-1在内的几种促AS的炎症基因的表达[17]。Sun等[19]发现在人脐静脉内皮细胞中,TMAO可触发氧化应激,激活硫氧还蛋白互作蛋白-NOD样受体蛋白3(TXNIP-NLRP3)炎症小体,释放促炎细胞因子IL-1β和IL-18,且使内皮一氧化氮合酶和NO的产生受到抑制;而促炎细胞因子IL-1β和IL-18的成熟和分泌引起的炎症反应,则在促进脂质斑块的发展和破坏AS斑块的稳定中起着重要的作用[20]。此外,TMAO还可激活人冠状动脉内皮细胞的NF-κB信号通路来增加组织因子的表达和活性,促进AS血栓形成[21]。
2 TMAO在临床研究中的应用价值
2.1 预测冠心病患者冠状动脉粥样硬化斑块负荷
高SYNTAX和Gensini评分以及多支血管病变被认为是冠状动脉粥样硬化负荷的临床标志物,与冠心病患者预后不良相关。Waleed等[22]在一项前瞻性队列研究中发现血浆TMAO水平与非ST段抬高型心肌梗死(non-ST-segment elevation myocardial infarction,NSTEMI)患者的高AS负荷相关,高TMAO水平的NSTEMI患者的SYNTAX和Gensini评分增高,且在NSTEMI患者中多支血管病变的患者血浆TMAO水平比单支血管病变患者TMAO水平高。此外,TMAO水平在稳定型心绞痛患者及ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者中也显示出与高AS负荷相关[23-24],TMAO水平越高预示着更高的SYNTAX评分及冠状动脉多支血管病变的存在,因此TMAO水平可作为AS负荷的独立预测因子。
2.2 作为评估冠状动脉斑块易破裂性的生物标志物
斑块破裂和侵蚀是发生STEMI的主要原因,斑块破裂或侵蚀不仅发生在完整的脂质或纤维化斑块中,而且也可发生在急性事件后先前已愈合的斑块中。Li等[25]研究发现STEMI患者血浆TMAO水平与罪犯斑块的愈合相关。斑块愈合患者的TMAO水平显著高于未愈合斑块患者,已愈合的罪犯斑块的STEMI患者比罪犯斑块未愈合的STEMI患者更易出现斑块的易损性,包括斑块破裂和薄纤维帽粥样斑块(thin-cap fibroatheroma,TCFA)。此外TMAO水平与非罪犯斑块的易破裂性(又称易损性)也存在相关性。与低水平TMAO的冠心病患者相比,TMAO水平较高的冠心病患者非罪犯斑块更加脆弱,表现为增高的TCFA和微血管发生率[26],而TCFA与微血管的形成正是易损斑块典型的形态学特征。以上研究表明TMAO可作为识别STEMI患者已愈合罪犯斑块破裂及冠心病患者非罪犯斑块破裂的生物标志物,检测TMAO水平对改善冠心病患者预后和临床管理至关重要。
3 以TMAO为靶点的防治AS的策略
3.1 减少TMA的生成,从而减少向TMAO转化
ZDY01是具有TMA代谢能力的产气肠杆菌,ZDY01可降低具有TMA裂解酶活性的梭菌属和不动杆菌属的相对丰度,减少胆碱或肉碱形成TMA[27-28]。Qiu等[29]用ZDY01处理胆碱喂养的小鼠,发现小鼠血清TMAO水平显著降低。
3,3-二甲基-1-丁醇(3,3-dimethyl-1-butanol,DMB)是一种胆碱结构类似物,在一些食品(如一些香醋、红葡萄酒,以及一些冷榨特级初榨橄榄油和葡萄籽油)中可检测到。有研究发现它可抑制部分TMA裂解酶,减少TMA的生成。虽然DMB疗法对循环胆固醇、胆碱和其他致AS的危险因素无显著影响,但它抑制了胆碱饮食依赖的巨噬细胞胆固醇酯积累(泡沫细胞形成)和主动脉根部AS斑块的形成。此外DMB还促进了一些与血浆TMA和TMAO水平以及主动脉斑块范围相关的微生物类群比例的降低[30]。
已知产甲烷古细菌(methanogenic archaea,MA)的某些成员可在培养中使用甲基化胺(如TMA)作为生长底物,因此为使用MA肠道定植降低血浆TMAO提供了可能。Ramezani等[31]研究发现,将某些MA肠道定植到小鼠体内,可降低血浆TMAO浓度,尤其是在喂食高胆碱/TMA的Apoe-/-小鼠中降低血浆TMAO水平最有效,并显示出减轻AS的趋势。与此同时,该研究还发现使用抗生素抑制肠道内源性微生物,可增加MA的定植。然而由于抗生素带来的种种副作用,在人类身上使用抗生素增加MA的定植,降低TMAO水平显然不可取。将来应进一步明确MA降低血浆TMAO水平的具体机制,然后再推广应用到人类。
ZDY01和DMB都是通过抑制微生物TMA裂解酶来减少微生物TMA产生,MA则是通过消耗TMA生成甲烷,三者最终都使TMA的含量降低,进而减少TMA向TMAO的转化。
3.2 补充某些中草药及化合物
小檗碱(berberine,BBR)是从黄连和小檗等草本植物中提取的异喹啉生物碱,在中国传统上用于治疗细菌性腹泻,现在许多现代药理学研究证明BBR对心血管疾病和代谢紊乱具有良好的治疗作用[32],有研究发现BBR通过降低主要TMA合成途径的关键基因cutC和cntA的功能基因水平,降低胆碱向TMA的转化,最终使血清TMAO水平降低,从而减弱AS的发展,此外该研究还指出BBR对来自人类粪便的肠道微生物群的TMA形成的抑制作用与胆碱喂养的小鼠抑制作用相当[33],这一发现,将BBR降低TMAO水平的机制应用到人类提供了可能。
Annunziata等[34]使用了一种含有麦芽糊精微胶囊化的葡萄渣多酚提取物,注册为Taurisolo®,对健康受试者进行了一项随机、安慰剂对照、交叉临床试验。在研究中,证明了基于葡萄渣多酚提取物的新型营养制剂在降低健康受试者血清TMAO水平方面的效果。此外白藜芦醇作为最有代表性的Taurisolo多酚,被发现它可降低TMAO的水平,调节肠道菌群的重塑[19]
大蒜素是一种公认的抗菌植物化学物质,可从新鲜的大蒜中提取,易从饮食中获得。Wu等[35]研究发现,在肠道富含肉碱的环境中,补充大蒜素可完全抑制小鼠肠道微生物群产生TMAO的代谢能力。这意味着肉碱饮食诱导的肠道微生物群的功能改变可通过添加另一种具有抗微生物潜力食物来源的物质(大蒜素)来预防。但大蒜素及其代谢物的抗菌谱非常广泛,究竟大蒜素是影响哪种微生物的改变从而引起TMAO含量的改变,还需进一步探究。
3.3 调控饮食结构
Koeth等[36]发现红肉中的营养物质左旋肉碱在肠道微生物群的作用下生成TMAO,可促进AS,在该研究中杂食受试者通过微生物群依赖机制摄入左旋肉碱后,产生的TMAO明显多于素食主义者。此外在存在心血管疾病危险因素的人群中,补充特级初榨橄榄油或坚果等地中海饮食可降低主要心血管事件的发生率[37],一项研究[38]发现无论男性或女性,坚持地中海饮食都与低循环水平的TMAO有关。因此在饮食结构中适当地向地中海饮食结构倾斜,减少过多红肉的摄入,补充富含多酚类的水果、蔬菜,可延缓AS的进展。
4 结语
AS是一种危害人类健康的慢性心血管疾病,也是老年人最常见的死亡原因之一。本综述引入了胆碱等物质的代谢产物TMAO,总结了TMAO促AS的机制及其在临床研究中的应用价值,TMAO可作为预测冠心病患者AS斑块负荷及斑块破裂的标志物,因此以TMAO为治疗目标或能使AS患者获益。但上述临床研究均为单中心、小样本的研究,且未对TMAO预测愈合斑块形成的有效性及易损性进行验证,未来需更大样本量进一步验证,明确TMAO与斑块相互作用的关系。