管花肉苁蓉醇提物抗小鼠运动性疲劳的效果
祖木热提汗·买买提 , 陈 卓 , 马义诚 , 加依娜古丽·吐尔逊拜 , 张晓红 , 赵红琼 , 郝智慧 , 姚 刚
(1. 新疆农业大学动物医学院 , 新疆 乌鲁木齐 830052 ; 2. 中国农业大学动物医学院 , 北京 海淀 100193)
运动性疲劳(Exercise fatigue or exercise-induced fatigue)是由运动引起的肌肉最大收缩或者最大输出功率暂时性下降以及机体多方面生理功能的复杂变化过程[1]。采用动物模型研究运动性疲劳能够更加客观反映出机体的生理生化变化机理,有利于评价机体的损伤变化[2]。Bedford等[3]1979年设计了一种基于耗氧量变化的大鼠10阶段有氧跑台运动状况测定程序和相应的测定装置。运动过程中心率(Heart rate,HR)、血压(Blood pressure,BP)、血尿素氮(Blood urea nitrogen,UREA)、血糖(Blood glucose,GLU)、乳酸(Lactose,LAC)、丙二醛(Malondialdehyde,MDA)、肌酸激酶(Creatine kinase,CK)、乳酸脱氢酶(Lactate dehydrogenase,LDH)、肝糖原(Hepatic glycogen,HG)和肌糖原(Muscle glycogen,MG)等指标的变化常作为运动性疲劳产生的生物医学指征[4-6]。朱浩[7]采用大鼠跑台运动方法建立运动性疲劳模型,发现力竭大鼠CK、LAC和UREA显著上升,LDH、MG和HG含量显著下降。殷娟娟[8]研究证明,小鼠力竭运动后骨骼肌Bcl-2/Bax的蛋白比值显著降低。管花肉苁蓉[Cistanchetubulosa(Schenk) Wight,CtW]属列当科(Orobanchaceae)肉苁蓉属(Cistanche)多年寄生性草本植物,又名苁蓉、大芸等。主要分布于我国内蒙古、青海、陕西、甘肃、宁夏、新疆南部地区以及国外一些地区[9-10]。管花肉苁蓉化学成分主要包括苷类、萜类、生物碱类、糖类、微量元素和氨基酸等[11],其中苯乙醇苷类具有抗氧化、抗病毒、增强免疫力、改善记忆力、抗衰老等多种药理作用[12]。丁琼[13]采用游泳运动小鼠模型测定了景天三七提取物灌胃后小鼠抗疲劳作用,发现景天三七提取物可发挥显著抗疲劳作用。管花肉苁蓉与景天三七具有相似的化学组成,但管花肉苁蓉提取物是否也具有抗运动性疲劳效果尚未见报道。因此,本试验拟采用小鼠跑台运动方法制备运动性疲劳小鼠模型,进行管花肉苁蓉醇提物抗小鼠运动性疲劳的研究,以期为管花肉苁蓉抗疲劳制剂的研发奠定试验动物药效学基础。
1 材料与方法
1.1 药品和试剂 管花肉苁蓉,购自新疆和田地区于田县中医药店;大孔树脂,购自北京索莱宝科技有限公司;无水乙醇,购自天津永晟精细化工有限公司;肝糖原、肌糖原测定试剂盒,均购自南京建成生物研究所;乳酸(LAC)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、尿素氮(UREA)、血糖(GLU)生化试剂片,均购自美国爱德士有限公司。
1.2 仪器 中药粉粹机,浙江省温岭市大鹏机械有限公司产品;旋转蒸发皿,上海亚荣生化仪器厂产品;动物跑步机,城都泰盟软件有限公司产品;紫外可见分光光度计,上海菁华科技仪器有限公司产品;血液生化分析仪,北京益仁恒业科技有限公司产品。
1.3 试验方法
1.3.1 实验动物 4~5周龄雄性健康昆明小鼠60只,体重为18~22 g,购自新疆医科大学实验动物中心 [生产许可证号:SCXK(新)2018—0001,使用许可证号:SYXK(新)2018—0003]。小鼠每天饲喂商品颗粒饲料(购自新疆医科大学实验动物中心)1次,自由采食和饮水(净化水)。实验室饲养环境安静、清洁,光照、通风良好,无异味。垫料定期更换,保持干燥。饲养环境及动物试验已经通过新疆农业大学实验动物福利伦理委员会审核批准(批准号为2019015)。
1.3.2 管花肉苁蓉醇提物的制备 采用中药粉碎机(转速2 800次/min)将管花肉苁蓉粉碎呈粉状。参照任璐等[14]的提取方法,精确称取500 g管花肉苁蓉粉,加入75%的乙醇溶液5 L(1∶10)浸泡24 h。12层纱布过滤弃药渣,利用大孔树脂过滤。滤液通过旋转蒸发仪浓缩至500 mL得到液体状醇提物(每毫升含生药1 g)。
1.3.3 小鼠适应性运动训练与试验分组 采用动物跑步机参照刘晓莉等[15]的方法设计训练计划(表1),坡度为0°,转速为10 m/min和 14 m/min,运动训练时间为15 min,每天1次,经3 d适应性训练,随机分为5个组:不运动组(Non exercise control,NE)、运动组(Exercise control,EC),每组10只;管花肉苁蓉醇提物低剂量组(E+CtW-L)、中剂量组(E+CtW-I)和高剂量组(E+CtW-H),每组12只。具体处理方法如表2所示。

表1 小鼠跑步机适应性训练计划
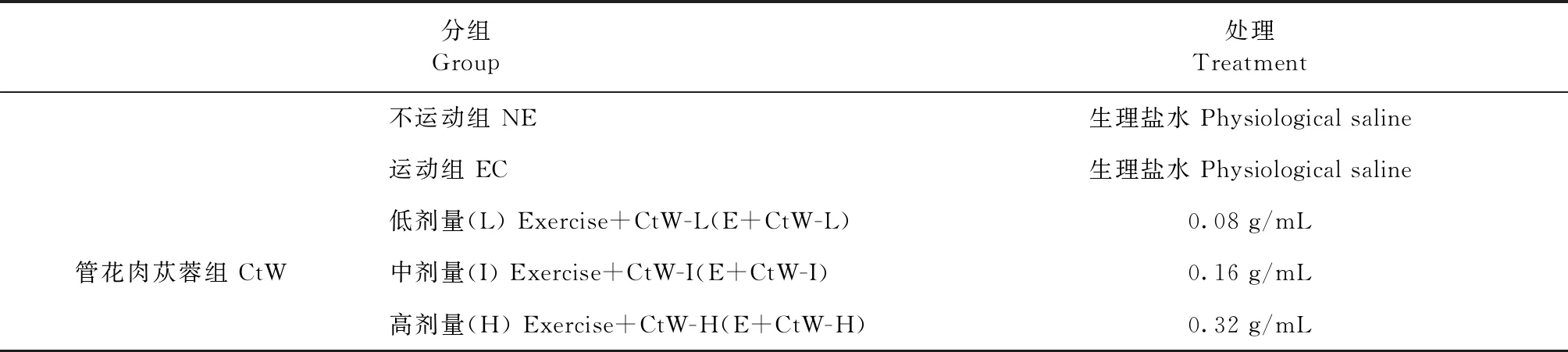
表2 管花肉苁蓉醇提物灌胃小鼠剂量分组与处理
1.3.4 小鼠运动跑台运动性疲劳模型的建立 经过适应性训练的小鼠,参照Bedford等[3]方法采用小鼠跑步机设计10阶段运动性疲劳训练计划(表3),制备小鼠运动性疲劳模型。主要观测运动时后肢蹬地力量、腹部与跑道的接触程度、维持运动强度能力、对刺激的应答反应能力和力竭状态的出现等。
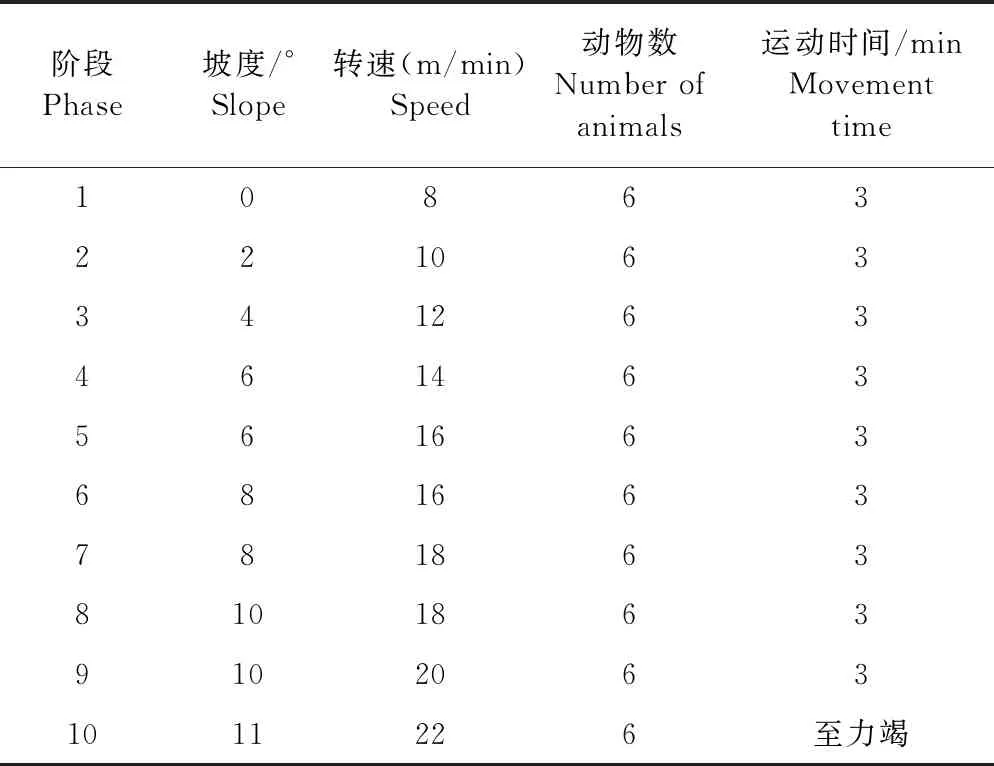
表3 10阶段运动训练参数
1.3.5 指标测定 (1)体重测定:每天小鼠灌胃之前使用电子天平测量小鼠体重并记录。(2)器官相对重量测定:试验结束处死小鼠,采集心、肝、脾、肺、肾、胃和肠等器官测定湿重,按公式:器官相对重量/%=器官湿重/小鼠体重×100%,计算器官相对重量。(3)运动性疲劳相关指标测定:采用爱德士全自动生化分析仪测定血清GLU、LAC、UREA、 LDH、CK含量,MG、HG含量按试剂盒说明书操作测定。(4)肺组织显微结构观察:采集运动前和运动后小鼠肺脏,用10%甲醛固定,H.E.染色,制作石蜡组织切片于光学显微镜下观察。
1.3.6 管花肉苁蓉醇提物抗小鼠运动性疲劳效果测定 (1)给药方式:管花肉苁蓉醇提物根据实验动物学、中药药理学教材[16-17]药物4倍稀释法,计算低、中、高剂量的浓度。灌胃剂量为0.2 mL/(10 g·bw),每天早晨10:30对CtW各剂量组小鼠灌胃1次,连续灌胃14 d。 EC组灌胃等体积的生理盐水。灌胃结束后开始补饲料,试验期间各组小鼠的饲养条件一致。具体分组和试验处理见表2。(2)运动方式:同表3。以实验动物疲劳模型所获的疲劳阶段为依据,CtW低、中、高剂量组的50%动物终止运动,其余的50%动物继续运动至力竭状态后再进行上述指标测定。
1.4 统计学方法 各项运动相关指标和血清生理生化测定数据均用平均数±标准误(Mean±SE)表示,器官相对重量以百分比表示。利用GraphPad Prism 8软件进行统计学分析。NE组与EC组之间进行非配对t检验,管花肉苁蓉醇提物各剂量组与EC组之间进行单因素方差分析(One-way ANOWA)。P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果
2.1 小鼠运动性疲劳模型建立
2.1.1 小鼠运动性疲劳体征变化 当小鼠运动至第9阶段,坡度为10°,跑台转速为20 m/min时,小鼠出现拒绝跑步,腹部和跑台密切接触,电刺激数增加到2.8 c/phase,小鼠反应迟钝,仍滞留在电磁感应区,此阶段初步视为出现疲劳症状(图1)。
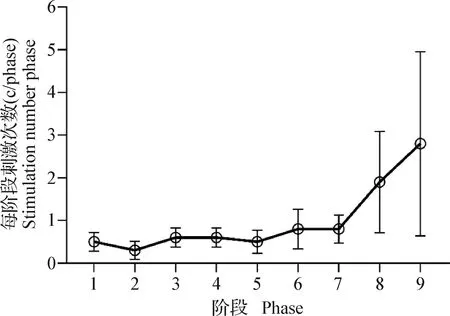
图1 小鼠运动至疲劳状态电刺激次数变化
2.1.2 运动性疲劳对小鼠体重和器官相对重量的影响 结果如图2所示,EC组小鼠体重[(29.15±0.64)g]与NE组小鼠体重[(32.39±1.39)g]相比显著下降(P<0.05)。EC组肝脏相对重量(4.63%±0.09%)和肾脏相对重量(1.11%±0.18%)均比NE 组(5.28%±0.23%和1.59%±0.62%)显著降低(P<0.05)。而其他所测定的器官相对重量变化差异不显著(P>0.05)。
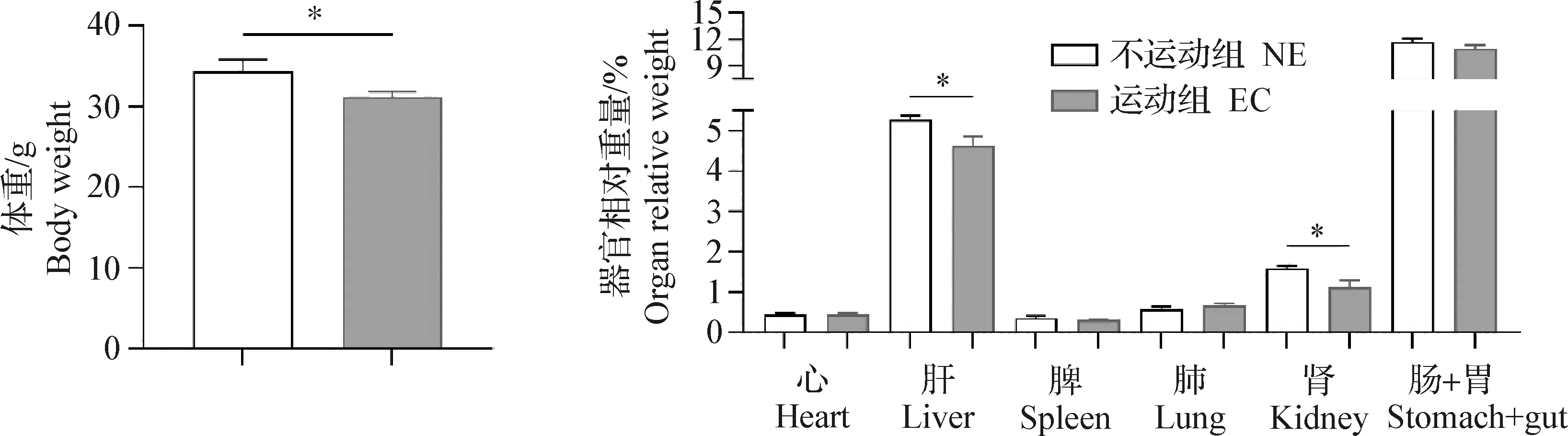
图2 不运动组和运动组小鼠体重、器官相对重量比较
2.1.3 运动性疲劳对小鼠血清生化指标及肌糖原和肝糖原含量的影响 结果如图3所示,第9阶段EC组小鼠GLU [(2.80±0.47)mmol/L]、LDH[(1 373 ±85.83)U/L]、MG[(1.80±0.11)mg/g]和HG[(6.92±0.21) mg/g]含量均极显著低于NE组[GLU:(8.73±1.07) mmol/L,LDH:(2 709±87.51)U/L,MG:(4.05±0.24) mg/g, HG:(24.65±2.42) mg/g](P<0.01)。而EC组的UREA[(15.71±1.69) mmol/L]和CK[(739.3±2.31)U/L]含量均极显著高于NE组[(6.70±0.54)mmol/L和(337.8±0.41)U/L](P<0.01)。EC组小鼠LAC含量与NE组相比也呈升高趋势(P=0.099)。
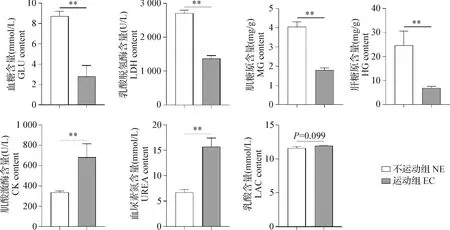
图3 运动性疲劳对小鼠血清生化指标及MG、HG含量的影响
2.1.4 运动性疲劳对肺组织形态学影响 与NE组小鼠相比,EC组小鼠局部肺泡扩张,肺泡壁断裂,肺泡相互融合(图4B 1),肺泡间质增宽(图4B 2),肺间质内可见淋巴细胞浸润(图4B 3),但肺泡内未有炎性渗出。
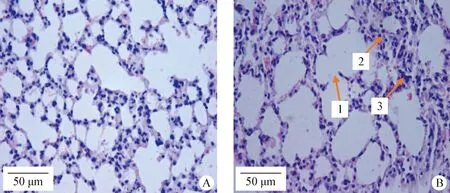
图4 肺脏组织切片图(H.E.染色,40×)
2.2 管花肉苁蓉抗小鼠运动性疲劳的效果
2.2.1 管花肉苁蓉对第9阶段运动小鼠器官相对重量的影响 结果如表4所示,各CtW组与EC组相比,体重无差异(P>0.05)。与运动组相比,E+CtW-I组小鼠肺脏和肾脏器官相对重量均显著增加(P<0.05),其他脏器无显著变化(P>0.05)。
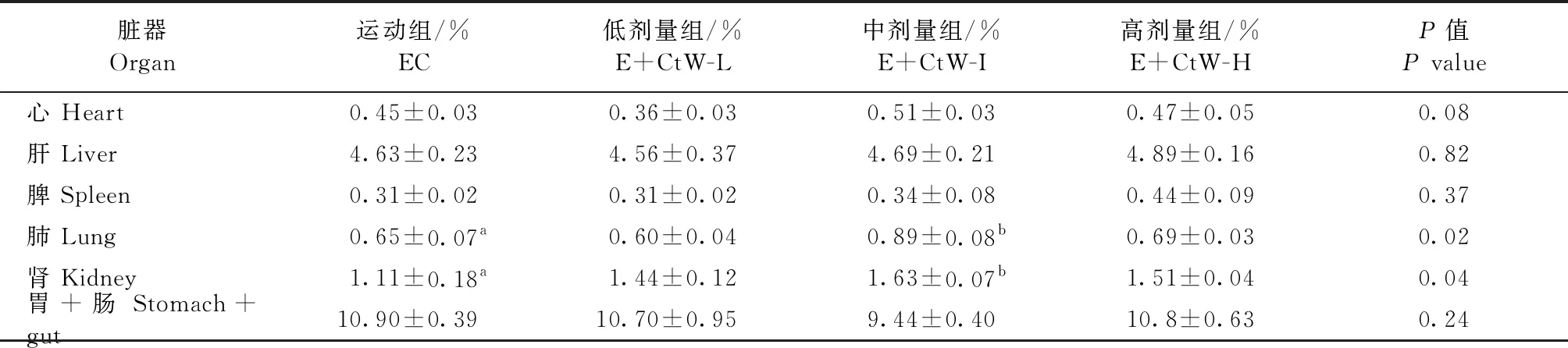
表4 第9阶段管花肉苁蓉对小鼠脏器器官相对重量的影响
2.2.2 管花肉苁蓉对第9阶段运动小鼠运动参数及运动性疲劳相关指标的影响 由封三图5可知,各CtW组与EC组相比,运动时间、运动历程和刺激次数等参数无显著差异(P>0.05)。由封三图6可知,与NE组相比,EC组小鼠的GLU、MG和HG含量极显著降低(P<0.001),LDH含量也呈现显著下降趋势(P=0.054),而UREA含量极显著升高(P<0.001),CK含量也呈显著上升趋势(P=0.068),LAC含量无差异(P>0.05)。整体显示,第9阶段EC组大鼠出现疲劳状态。而各CtW组与EC组相比,E+CtW-L组GLU含量极显著高于EC组(P<0.001),UREA含量显著低于EC组(P<0.05),CK含量也呈显著下降趋势(P=0.052)。 各CtW组的LDH均极显著高于EC组(P<0.01),E+CtW-I组和E+CtW-H组的MG含量极显著高于EC组(P<0.001),而E+CtW-L组和E+CtW-I组的HG含量也显著高于EC组(P<0.05)。结果表明各CtW组小鼠尚未出现运动性疲劳状态。
2.2.3 管花肉苁蓉对第10阶段运动小鼠脏器相对重量的影响 由表5可知,在第10阶段各CtW组与EC组相比,器官相对重量无显著变化(P>0.05)。

表5 第10阶段管花肉苁蓉对小鼠脏器器官相对重量的影响
2.2.4 管花肉苁蓉对第10阶段运动小鼠运动参数及运动性疲劳相关指标的影响 由封三图7可知,与EC组相比,E+CtW-L组的运动时间和距离显著延长(P<0.05),而E+CtW-I组和E+CtW-H组的运动时间和距离极显著延长(P<0.01)。各CtW组电刺激次数与EC组相比,差异不显著(P>0.05)。由图8可知,各CtW组的GLU含量与EC组相比无显著差异,但均极显著低于NE组(P<0.01)。E+CtW-H组的UREA含量与EC组比较无显著差异(P>0.05),但E+CtW-L组和E+CtW-I组的UREA含量显著低于EC组(P<0.05)。E+CtW-H组的LAC含量显著低于EC组(P<0.05)。各CtW组的LDH含量均显著高于EC组(P<0.01),各CtW组的CK含量均显著低于EC组(P<0.05),E+CtW-I组的MG和HG含量也极显著高于EC组(P<0.01)。

图8 第10阶段小鼠运动性疲劳相关指标
3 讨论
3.1 小鼠运动性疲劳模型的建立 运动性疲劳模型大多以大鼠或小鼠作为试验对象,采用跑台上运动、游泳运动建立[18]。本试验采用Bedford等[3]建立的经典10阶段运动方案。参照杨堤[19]研究的UREA、 LAC、CK、LDH以及MG、HG等疲劳指标进行评价。本试验结果显示,EC组UREA和CK含量极显著高于NE组,而GLU、LDH、MG和HG含量极显著低于NE组,这些结果与Takeda等[20]的研究结果一致。观察力竭小鼠肺泡,结果发现EC组出现局部肺组织肺泡扩张、肺泡塌陷。与张童君[21]建立的疲劳模型中大鼠肺脏形态变化的研究结果一致。证明本试验的10阶段运动性疲劳模型建立成功。
3.2 管花肉苁蓉抗运动性疲劳效果 寻找更加安全有效的抗疲劳物质己经成为全球研究热点。本试验结果显示,连续灌胃管花肉苁蓉醇提物14 d,各剂量小鼠日常生活行为无任何异常,但E+CtW-I组肺脏和肾脏器官相对重量显著增加,其他脏器无显著变化。这个现象可能提示管花肉苁蓉醇提物对肺脏和肾脏没有保护功能。覃茂鑫等[22]研究显示,给小鼠注射大蒜素可极显著提高游泳时间,降低CK、UREA和LAC水平。此研究结果与本试验结果一致,说明管花肉苁蓉醇提物可降低血清CK、UREA和LAC的含量,补充体内所需要的营养和能源物质,具有抗运动性疲劳的作用。
3.3 管花肉苁蓉延缓运动性疲劳效果 运动时间延长是抗运动性疲劳的直观外在体现,因此用力竭时间的长短作为本试验的一个指标。郑尚莉[23]研究给小鼠灌胃蓝莓浓缩汁,发现其可显著延长小鼠力竭游泳时间。张磊[24]研究发现,给小鼠灌胃枫糖可延缓小鼠负重游泳时间,降低血清CK和UREA含量,显著升高MG、HG和LDH含量。本试验使用管花肉苁蓉醇提物对小鼠灌胃,明显延长了小鼠在一定运动强度下持续运动时间和运动历程,并降低了CK和UREA含量,增加了HG、MG和LDH含量,该结果与上述研究结果基本一致。综上,管花肉苁蓉醇提物能够延缓小鼠运动性疲劳的发生,具有抗小鼠运动性疲劳、提高运动耐力、延缓力竭状态出现的作用。

