蛇足石杉内生真菌Cladosporium tenuissimum MT-35的代谢产物研究
石璠钰,杨洪芸,莫 婷,齐博文,王雯静,张蓓蓓,刘 晓,史社坡*
1北京中医药大学中药学院中药现代研究中心,北京100029;2宁夏回族医药研究所,银川750021
蛇足石杉(Huperziaserrata(Thunb.ex Murray)Trev.)是石杉科石杉属植物,又名千层塔,以全草入药,具有清热解毒、生肌止血、散瘀消肿的功效,可用于治疗跌打损伤、毒蛇咬伤、瘀血肿痛等[1]。据文献报道,蛇足石杉的根、茎、叶中均存在丰富的内生菌,这些内生菌在体外培养时,可以产生结构丰富多样的代谢产物[2,3];部分内生真菌在体外发酵培养时还可以产生石杉碱甲[4,5]。课题组前期研究发现,从蛇足石杉中分离鉴定出多株内生真菌,进一步对其发酵产物进行研究,分离鉴定了一系列结构新颖的杂萜、聚酮类代谢产物,部分化合物在体外具有显著的抗炎和乙酰胆碱酯酶抑制活性[6-9]。C.tenuissimumMT-35是课题组前期从蛇足石杉中分离纯化的一株内生真菌,其发酵产物具有一定的乙酰胆碱酯酶抑制活性。因此,课题组对该株内生真菌的代谢产物进行分离纯化,结合体外活性筛选,期望能够获得具有乙酰胆碱酯酶抑制活性的代谢产物。
1 材料与方法
1.1 仪器与试剂
Autopol IV全自动旋光仪(美国Rudolf);高效液相离子阱飞行时间质谱分析系统:UFLC SIL-20AC自动进样器,CTO-20AC 柱温箱,SPD M20A紫外检测器,LC-20ADXR 泵,IT-TOF-MS 配备ESI离子源(日本Shimadzu);Varian 500核磁共振仪(美国Varian);Waters 2998半制备型高效液相色谱仪(美国Waters);ODS半制备柱(SunFireTMC18,10 × 150 mm,5 μm);ODS柱色谱填料(Li-Chroprep RP-C18,40~63 μm,德国Merck);柱色谱用硅胶(200~300目)及薄层色谱用GF254硅胶预制板均为青岛海洋化工厂生产;MCO-18AIC(UV)CO2培养箱(日本 Sanyo);MCO-18AIC细胞培养箱(日本Sanyo);AE2000倒置荧光显微镜(中国Motic);M1000多功能酶标仪(瑞士 Tecan);脂多糖(LPS)(美国Sigma);胎牛血清(美国Hyclone);DMEM培养基(购自日本Corning公司,批号:8121625,详细组成可见参考说明书)。
蛇足石杉(Huperiaserrata(Thunb.ex Murray)Trev.)于2015年7月采自福建省南平市(标本编号:201507)。本研究所用菌株由课题组自蛇足石杉中分离纯化,经形态特征及ITS-rDNA鉴定基因组测序(GenBank中序列号为OM131669)为枝孢菌属极细枝孢菌Cladosporiumtenuissimum,菌种保存于北京中医药大学中药现代研究中心(菌种编号:CladosporiumtenuissimumMT-35)。
1.2 实验方法
1.2.1 提取与分离
C.tenuissimuMT-35于无菌环境下接种于0.5 L × 40瓶糙米培养基中,25 ℃室温培养40天后,用醋酸乙酯超声提取3次。提取液合并滤过,减压浓缩得浸膏120 g。经正相硅胶柱色谱,石油醚-乙酸乙酯(20∶1→1∶1)、二氯甲烷-甲醇(20∶1→0∶1)梯度洗脱,合并得到8个流分Fr.1~8。Fr.2经反相硅胶柱色谱分离,甲醇-水(3∶7→1∶0),并结合半制备HPLC(流动相∶乙腈-水 38∶62,tR= 13 min)分离纯化得化合物8(30 mg);Fr.4经反相硅胶柱色谱,甲醇-水(3∶7→1∶0)梯度洗脱,结合半制备HPLC(流动相∶乙腈-水 22∶78,tR= 18 min)分离纯化得化合物7(15 mg);Fr.6经反相硅胶柱色谱,甲醇-水(3∶7→1∶0)梯度洗脱,结合半制备HPLC分离纯化得化合物1(2.5 mg;流动相∶乙腈-水 20∶80,tR= 18 min)、2(5.2 mg;流动相∶乙腈-水 20∶80,tR= 38 min)、3(3.3 mg;流动相∶乙腈-水 23∶77,tR= 9 min)、4(4.2 mg;流动相∶乙腈-水 30∶70,tR= 12 min)、9(4.2 mg;流动相∶乙腈-水 85∶15,tR= 18 min);Fr.8经反相硅胶柱色谱,甲醇-水(3∶7→1∶0)梯度洗脱,结合半制备HPLC分离纯化得化合物5(5.1 mg;流动相∶甲醇-水 20∶80,tR= 17 min)、10(4.5 mg;流动相∶甲醇-水 50∶50,tR= 25 min)、6(2.4 mg;流动相∶甲醇-水 30∶70,tR= 20 min)。
1.2.2 抗乙酰胆碱酯酶活性筛选
采用改良的Ellman法测定各单体化合物的乙酰胆碱酯酶抑制活性[2,10]。在96孔板中每孔加入100 μL的PBS缓冲液(pH 8.0),20 μL乙酰胆碱酯酶(50 U/L,溶于PBS中),20 μL样品溶液(终浓度为100、20、4 mg/L,溶于含2% 的DMSO的PBS溶液中),20 μL浓度为1.2 mmol/L的碘代硫代乙酰胆碱作为酶反应底物。在37 ℃条件下恒温孵化30 min后加入20 μL 4%的十二烷基硫酸钠(SDS)终止反应,并加入20 μL 0.6 mmol/L的5,5′-二硫代双(2-硝基苯甲酸,DTNB),立即测定反应体系在405 nm波长下的吸光度。单体化合物的百分抑制率通过公式I=[1-(A样品-A背景)/A空白]× 100%计算获得,其中A样品为加药组,A背景为没有加入酶的对照组,A空白为未加样品。通过计算不同样品浓度对乙酰胆碱酯酶的抑制率来计算不同单体化合物的IC50值。以上每组实验均重复3次,石杉碱甲作为阳性对照。
1.2.3 抗炎活性筛选
比较不同化合物抑制脂多糖(lipopolysaccharide,LPS)诱导RAW 264.7细胞释放NO能力,对其抗炎活性进行评价[7,11]。取对数期的RAW 264.7细胞,0.25%胰酶消化后,用含10%胎牛血清(FBS)的DMEM培养基终止消化,低速离心,重悬于新鲜培养基中。将细胞用DMEM培养基稀释至4×105个/mL,以每孔40 000个细胞接种于96孔板中,CO2培养箱37 ℃孵育24 h。用二甲基亚砜(DMSO)配制浓度为25 mmol/L单体化合物母液,经培养基稀释后加入96孔培养板至终浓度分别为100、20、4 μmol/L,孵育1 h,再加入终质量浓度为1 μg/mL的LPS,继续孵育24 h。从96孔板各孔中吸取100 μL上清至酶标板内,每孔加入50 μL Griess R1,室温避光放置5 min,再加入50 μL Griess R2,室温避光放置5 min。在540 nm条件下测定吸光度。计算各化合物对NO释放的抑制率,并得出半数抑制浓度(IC50)。
2 结果
2.1 结构鉴定
化合物1白色无定型粉末;ESI-MS:m/z192[M+H]+,分子式为C10H9NO3。1H NMR(500 MHz,CD3OD)δ:7.93(1H,d,J=8.5 Hz,H-5),7.48(1H,t,J=7.5 Hz,H-7),7.31(1H,d,J=8.5 Hz,H-8),7.24(1H,t,J=7.5 Hz,H-6),3.84(3H,s,3-OCH3);13C NMR(125 MHz,CDCl3)δ:163.1(C-2),131.8(C-3),154.7(C-4),124.0(C-5),123.3(C-6),130.9(C-7),116.3(C-8),136.7(C-9),117.4(C-10),60.6(3-OCH3)。化合物1结构已有文献[12]报道,但其完整的NMR数据在文献中没有报道。因此,在对化合物的二维NMR图谱(HMBC和HSQC图谱)进行分析的基础,本文中对化合物1的NMR数据进行了详细归属,鉴定其结构为4-hydroxy-3-methoxy-2(1H)-quinolinone。
化合物2淡黄色粉末;ESI-MS:m/z225[M+H]+,分子式为C11H12O5。1H NMR(500 MHz,DMSO-d6)δ:12.62(1H,br s,9-COOH),6.89(1H,s,H-5),6.50(lH,s,H-8),4.01(3H,s,H-12),2.36(3H,s,H-11),1.83(3H,s,H-10);13C NMR(125 MHz,DMSO-d6)δ:162.8(C-2),103.2(C-3),165.2(C-4),97.5(C-5),156.8(C-6),141.9(C-7),120.0(C-8),166.9(C-9),8.7(C-10),13.1(C-11),57.0(C-12)。以上数据与文献[13]报道基本一致,故鉴定化合物2为acropyrone。
化合物3淡黄色粉末;ESI-MS:m/z243[M+H]+,分子式为C12H10N4O2。1H NMR(500 MHz,DMSO-d6)δ:11.70(1H,s,NH),7.91(1H,s,H-6),7.71(lH,s,H-9),2.49(3H,s,H-11),2.46(3H,s,H-12);13C NMR(125 MHz,DMSO-d6)δ:150.1(C-2),160.6(C-4),128.6(C-6),144.5(C-7),138.7(C-8),125.8(C-9),19.5(C-11),20.1(C-12),130.1(C-4a),138.3(C-5a),141.6(C-9a),146.5(C-10a)。以上数据与文献[14]报道基本一致,故鉴定化合物3为lumichrome。
化合物4白色粉末;ESI-MS:m/z189[M+H]+,分子式为C10H8N2O2。1H NMR(500 MHz,CD3OD)δ:8.73(1H,s,H-2),8.30(lH,dd,J=7.0,2.0 Hz,H-4),7.48(1H,dd,J=6.5,1.5 Hz,H-7),7.26(2H,m,H-5,6);13C NMR(125 MHz,CD3OD)δ:139.5(C-2),113.1(C-3),122.9(C-4),123.9(C-5),124.7(C-6),114.0(C-7),183.1(C-8),168.2(C-9),127.9(C-3a),138.0(C-7a)。以上数据与文献[15]报道基本一致,故鉴定化合物4为(1H-indol-3-yl)oxoacetamide。
化合物5淡黄色粉末;ESI-MS:m/z154[M+H]+,分子式为C7H7NO3。1H NMR(500 MHz,CD3OD)δ:8.45(1H,d,J=2.5 Hz,H-5),7.96(1H,dd,J=9.5,2.5 Hz,H-3),6.53(1H,d,J=9.5 Hz,H-2),3.61(3H,s,N-CH3);13C NMR(125 MHz,CD3OD)δ:167.2(C-1),119.3(C-2),141.1(C-3),112.5(C-4),145.7(C-5),165.3(4-COOH),38.6(N-CH3)。以上数据与文献[16]报道基本一致,故鉴定化合物5为1,6-dihydro-1-methyl-6-oxo-3-pyridinecarboxylic acid。
化合物6白色粉末;ESI-MS:m/z113[M+H]+,分子式为C4H4N2O2。1H NMR(500 MHz,DMSO-d6)δ:7.39(1H,d,J=7.5 Hz,H-5),5.44(1H,dd,J=7.5,1.5 Hz,H-6);13C NMR(125 MHz,DMSO-d6)δ:151.5(C-2),164.3(C-4),100.2(C-5),142.2(C-6)。以上数据与文献报道基本一致[17],故鉴定化合物6为尿嘧啶。

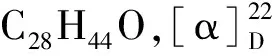
化合物9黄色油状物;ESI-MS:m/z280[M+H]+,分子式为C18H33NO。1H NMR(500 MHz,CD3OD)δ:5.34(4H,m,H-9,10,12,13),2.78(2H,t,J=7.5 Hz,H-11),2.20(2H,t,J=7.5 Hz,H-2),2.06(2H,q,J=6.5 Hz,H-14),0.91(3H,t,J=7.0 Hz,H-18);13C NMR(125 MHz,CD3OD)δ:179.3(C-1),36.5(C-2),26.5(C-3),30.2,30.3,30.4(C-4~C-6),28.2(C-7),26.9(C-8),129.1(C-9),130.9(C-10),30.7(C-11),129.1(C-12),130.9(C-13),30.5(C-14),28.2(C-15),32.6(C-16),23.6(C-17),14.4(C-18)。以上数据与文献[19]报道基本一致,故鉴定化合物9为9(Z),12(Z)-十八碳二烯酰胺。
化合物10棕色无定型粉末;ESI-MS:m/z387[M+H]+,分子式为C20H18O8。1H NMR(500 MHz,CD3OD)δ:7.58(1H,s,H-7′),7.44(1H,d,J=1.5 Hz,H-2),7.30(1H,s,H-2′),7.28(1H,d,J=15.5 Hz,H-7),7.07(1H,d,J=8.0 Hz,H-6),7.05(1H,d,J=8.0 Hz,H-6′),6.80(1H,d,J=8.0 Hz,H-5′),6.73(1H,d,J=8.0 Hz,H-5),6.38(1H,d,J=15.5 Hz,H-8),3.97(3H,s,3′-OCH3),3.70(3H,s,3-OCH3);13C NMR(125 MHz,CD3OD)δ:125.9(C-1),113.6(C-2),148.8(C-3),149.6(C-4),116.1(C-5),126.4(C-6),128.4(C-7),145.8(C-8),164.5(C-9),130.2(C-1′),112.4(C-2′),150.5(C-3′),149.1(C-4′),114.8(C-5′),123.2(C-6′),145.8(C-7′),118.0(C-8′),167.3(C-9′),56.0(3-OCH3),56.6(3′-OCH3)。以上数据与文献[20]报道基本一致,故鉴定化合物10为8-O-4-dehydrodiferulic acid。
化合物1~10结构见图1。

图1 化合物1~10的化学结构式
2.2 抗乙酰胆碱酯酶活性筛选
所述单体的抗乙酰胆碱活性筛选结果显示,化合物3对乙酰胆碱酯酶具有一定的抑制活性,IC50为77.9±11.1 μmol/L(阳性对照石杉碱甲IC50为0.6±0.1 μmol/L)其余化合物在浓度为100 μmol/L时,对乙酰胆碱酯酶无明显抑制活性。
2.3 抗炎活性筛选
所述单体的抗炎活性筛选结果显示,化合物3、7、8、9对脂多糖诱导的小鼠单核巨噬细胞释放一氧化氮具有抑制活性,IC50值分别为36.8±1.0、3.9±0.2、36.6±0.0、53.2±1.4 μmol/L(阳性对照吲哚美辛IC50为39.0±13.8 μmol/L),其余化合物在浓度为100 μmol/L时,对RAW 264.7细胞NO释放无明显抑制活性。
3 讨论与结论
微生物在体外发酵培养时可以产生结构新颖多样的代谢产物[6],通过对微生物代谢产物的分离鉴定并结合活性筛选,有望发现具有开发潜力的活性分子。C.tenuissimum是课题组前期从蛇足石杉中分离得到的一株内生真菌,文献报道该菌在乔松(Pinuswallichiana)、美登木(Maytenushookeri)等植物中也曾分离报道,Naseer、Dai等[21,22]对其在马铃薯-葡萄糖琼脂培养基中发酵的代谢产物进行研究,分离得到多个大环内酯类聚酮,其中部分化合物具有抗菌活性。在本研究中,从C.tenuissimum的糙米发酵产物中共分离鉴定了10个代谢产物,包括6个含氮类化合物,2个甾体类化合物,2个聚酮类化合物,部分化合物具有抗乙酰胆碱酯酶和抗炎的生物活性。其中化合物1的结构虽已有报道[11],但其核磁数据尚无文献参考,本文利用二维核磁共振(2D NMR)等方法,对其碳氢数据进行了准确归属。上述研究结果对进一步了解极细枝孢菌C.tenuissimum代谢产物的结构类型和活性天然产物的发现有一定的参考意义。但是,在对该菌株的系统分离研究中,发现该株内生真菌在本文报道的条件下进行发酵培养,其代谢产物非常有限,没有分离到文献中报道的大环内酯类成分,可能是由于培养条件不同或者内生菌的植物宿主不同,导致其代谢产物不同。在后续研究中,可以尝试改变发酵培养条件或者尝试不同真菌共培养的方法,结合液相色谱-质谱联用(LC-MS)分析导向,筛选出合适的培养条件后,再开展LC-MS导向性分离,尽量避免低层次的重复性分离。另一方面,随着目前基因组测序技术的快速发展,基于基因挖掘技术进行新颖结构活性天然产物的发现策略,成为研究的前沿热点[23]。通过激活特定基因簇的表达,或者将相关的基因簇在其他异源体系中进行表达,有望发现大量常规条件下无法获得的新颖产物。

