基于IL-6/STAT3信号通路研究冬凌草甲素对乳腺癌细胞的作用及机制
黎乃维,王 飞,尧子钊,王剑石
基于IL-6/STAT3信号通路研究冬凌草甲素对乳腺癌细胞的作用及机制
黎乃维,王 飞*,尧子钊,王剑石
南昌大学抚州医学院,江西 抚州 344000
基于白细胞介素-6(interleukin-6,IL-6)/信号传导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)信号通路研究冬凌草甲素对乳腺癌细胞增殖、自噬和凋亡的影响,并进一步探究冬凌草甲素对乳腺癌细胞增殖和凋亡相关蛋白表达的影响。通过MTT法检测冬凌草甲素对MDA-MB-231、MDA-MB-453、MDA-MB-468乳腺癌细胞增殖的影响;采用GFP-LC3荧光斑点检测冬凌草甲素对MDA-MB-468细胞自噬的影响;采用DAPI染色法观察冬凌草甲素对MDA-MB-468细胞生长抑制的影响;采用流式细胞仪测定冬凌草甲素对MDA-MB-468细胞凋亡的影响;利用稳定转染STAT3-luciferase报告基因质粒的HepG2-STAT1/3-Luc细胞,检测冬凌草甲素对IL-6/STAT3信号通路的作用;采用Western blotting检测冬凌草甲素对STAT3磷酸化的影响以及对细胞增殖及凋亡相关蛋白表达的影响。冬凌草甲素抑制乳腺癌细胞增殖,诱导乳腺癌细胞自噬和凋亡作用,呈剂量相关性;冬凌草甲素对IL-6/STAT3信号通路和STAT3磷酸化均有明显的抑制作用;冬凌草甲素能够上调乳腺癌细胞p53、剪切型多聚腺苷二磷酸核糖聚合酶(cleaved poly ADP-ribose polymerase,cleaved PARP)、剪切型半胱氨酸天冬氨酸蛋白酶-3(cleaved cystein-asparate protease-3,cleaved Caspase-3)以及Caspase-9蛋白表达。冬凌草甲素通过抑制STAT3磷酸化而抑制IL-6/STAT3信号通路的激活,并能上调p53、cleaved PARP、cleaved Caspase-3及cleaved Caspase-9蛋白表达,进而抑制乳腺癌细胞增殖,诱导乳腺癌细胞的自噬和凋亡。
冬凌草甲素;乳腺癌;细胞增殖;自噬;凋亡;白细胞介素-6/信号传导及转录激活蛋白3信号通路
乳腺癌为我国女性发病率最高的癌症,居相关死亡原因第5位,严重威胁女性健康。乳腺癌为异质性疾病,病理类型可分为非浸润、早期浸润癌和浸润癌,分子分型临床上可分为4类:Luminal A型(HR+,HER2−)、Luminal B型(HR+,HER2+)、HER2+型(HR−,HER2+)和三阴型(HR−,HER2−),其中Luminal A型和三阴型均为HER2阴性乳腺癌,占晚期乳腺癌的80%,这意味着接近80%的乳腺癌患者不适合HER2靶向治疗。针对这部分患者的治疗方案,目前主要以化疗和内分泌治疗为主,但治疗效果并不理想[1-6]。
冬凌草为唇形科植物碎米桠(Hemsley) H. Hara的干燥地上部分,具有清热解毒、健胃活血、消炎止痛、抗肿瘤等作用。冬凌草的主要有效成分为冬凌草甲素,能够通过阻断细胞周期、诱导细胞凋亡、诱导自噬、下调端粒酶活性、逆转多药耐药等多种方式发挥抗肿瘤作用,是一种潜在的抗癌候选新药[7-20]。研究发现,冬凌草甲素可以通过抑制核因子-κB(nuclear factor-κB,NF-κB)或者激活有丝分裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK),从而抑制肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)等促炎性细胞因子的释放[21-22]。信号传导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)是多种生长因子或细胞因子信号通路激活的关键点,STAT3通路的激活可以诱导肿瘤细胞的增殖,而其抑制可以促进肿瘤细胞的凋亡。多种细胞因子可以通过细胞膜上相应的酪氨酸激酶相关受体来激活STAT3信号通路完成信号传导。在大多数人类癌症中可见通过酪氨酸第705位点磷酸化实现的STAT3过度激活。研究显示,在他莫昔芬耐药的乳腺癌MCF7细胞中STAT3酪氨酸第705位点磷酸化水平升高[23]。因此,本研究考察冬凌草甲素对乳腺癌细胞增殖、自噬、凋亡以及IL-6/STAT3信号通路的影响,为冬凌草甲素治疗乳腺癌的应用提供实验依据。
1 材料
1.1 细胞
人乳腺癌MDA-MB-231、MDA-MB-453、MDA-MB-468细胞株由中国科学院上海细胞库所提供。
1.2 药品与试剂
冬凌草甲素(批号PHL89745,质量分数≥98%)购自美国Merck公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、RPMI 1640培养基、α-MEM培养基、胎牛血清购自美国Gibco公司;DAPI染液购自Boster公司;荧光素酶检测试剂盒购自美国Promega公司;流式检测试剂盒购自Yeasen公司;IL-6购自上海博升生物科技有限公司;STAT3抗体(批号AF1492)、p-STAT3抗体(批号AF5941)、β-actin抗体(批号AP0060-100)购自美国CST公司;Western blotting所用抗体均购于美国Sigma公司;p53抗体(批号P6874)、剪切型多聚腺苷二磷酸核糖聚合酶(cleaved poly ADP-ribose polymerase,cleaved PARP)抗体(批号SAB2108195)、PARP抗体(批号P7065)、细胞色素C(cytochrome C,CytC)抗体、剪切型半胱氨酸天冬氨酸蛋白酶-9(cleaved cystein-asparate protease-9,cleaved Caspase-9)抗体(批号C8726)、cleaved Caspase-3抗体(批号SAB1305630)、B淋巴细胞瘤2(B-cell lymphoma 2,Bcl-2)抗体(批号SRP0186)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号SAB4502546)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号G5262)购自美国Sigma公司;GFP-LC3脂质体复合物(批号C3011)购自山西碧云天生物科技有限公司。
1.3 仪器
倒置显微镜(德国Leica公司);CO2培养箱(美国Thermo公司);酶标仪(瑞士Tecan公司);超净工作台(苏州净化设备厂);TGL-16G型离心机(上海安亭科学仪器厂);DYY-6c型电泳仪(北京六一仪器厂);Facscallbar流式细胞仪(美国Becton Dickinson公司)。
2 方法
2.1 细胞培养
MDA-MB-231、MDA-MB-453、MDA-MB-468细胞用含10%胎牛血清和1%双抗的RPMI 1640培养基,于37 ℃、5% CO2培养箱中培养。
稳定转染STAT3-luciferase报告基因质粒的细胞(HepG2-STAT1/3-Luc)用含10%胎牛血清的α-MEM培养基,于37 ℃、5% CO2培养箱中培养。
2.2 MTT法检测冬凌草甲素对乳腺癌细胞增殖的影响
MDA-MB-231、MDA-MB-453、MDA-MB-468细胞分别以5×104个/mL接种于96孔板,100 μL/孔,培养24 h。分别加入1、5、10 μmol/L的冬凌草甲素处理细胞(冬凌草甲素溶于DMSO配制成10 mol/L的溶液,以含10%胎牛血清的RPMI 1640培养基稀释至所需浓度,使DMSO终质量分数<0.1%),每组设置3个平行孔,同时设置对照组(加入不含药物的培养基)。培养48 h后再加入含0.5 mg/mL MTT的培养基,孵育4 h后,加入DMSO,用酶标仪测定吸光度()值。
2.3 DAPI染色检测细胞状态
取处于对数生长期的MDA-MB-468细胞,以2×104个/mL接种于6孔板中的爬片,分别加入冬凌草甲素(1、5、10 μmol/L)处理24 h后,以预冷的70%乙醇固定,加入1 μg/mL DAPI染液染色2~3 min,弃去染料,PBS漂洗1次,使用荧光显微镜观察细胞的状态。
2.4 荧光斑点检测细胞自噬水平
取处于对数生长期的MDA-MB-468细胞,以2×104个/mL接种于6孔板,2 mL/孔,培养24 h。加入GFP-LC3脂质体复合物,继续孵育24 h,观察细胞与脂质体融合状态,当细胞与脂质体融合度达到60%~80%,吸出脂质体混合物,分别给予冬凌草甲素(1、5、10 μmol/L)处理细胞,同时设置对照组(加入不含药物的培养基),培养48 h后于倒置荧光显微镜下观察细胞内荧光斑点的数目。
2.5 细胞凋亡检测
取处于对数生长期的MDA-MB-468细胞,以2×104个/mL接种于6孔板,2 mL/孔,培养24 h。分别给予冬凌草甲素(1、5、10 μmol/L)处理细胞24 h后,收集细胞,吸取100 μL稀释至1×106/mL的细胞悬液,加入400 μL结合缓冲液、5 μL Annexin V/FITC和10 μL碘化丙啶(PI),混匀后室温避光孵育15 min,采用流式细胞仪上样检测。
2.6 Luciferase活性测定
取处于对数生长期的HepG2-STAT1/3-Luc细胞,以2×105个/mL接种于96孔板,100 μL/孔,培养48 h。分别加入100 μL冬凌草甲素(1、5、10 μmol/L)处理1 h后,每孔加入10 μL IL-6(50 ng/mL)孵育5.5 h,加入30 μL细胞裂解液,振荡使细胞充分裂解,采用酶标仪测定荧光强度。
2.7 Western blotting检测IL-6/STAT3信号通路、增殖和凋亡相关蛋白表达
2.7.1 HepG2-STAT1/3-Luc细胞中IL-6/STAT3信号通路相关蛋白表达,取处于对数生长期的HepG2-STAT1/3-Luc细胞,以3000个/mL接种于6孔板,2 mL/孔,培养24 h。分别给予冬凌草甲素(1、5、10 μmol/L)处理细胞24 h后,每孔加入10 μL IL-6(50 ng/mL)孵育1 h,收集细胞。使用蛋白提取试剂盒提取总蛋白,加入5×上样缓冲液,沸水浴煮沸5 min。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入脱脂牛奶室温封闭1 h,分别加入一抗,4 ℃孵育过夜;PBST洗涤3次,每次10 min,加入相应二抗室温孵育2 h,PBST洗膜后,用ECL发光试剂显影。
2.7.2 MDA-MB-468细胞中增殖和凋亡相关蛋白表达 取处于对数生长期的MDA-MB-468细胞,以2×105个/mL接种于6孔板,2 mL/孔,培养24 h。分别给予冬凌草甲素(1、5、10 μmol/L)处理细胞24 h后,收集细胞。按“2.7.1”项下方法检测增殖和凋亡相关蛋白表达。
2.8 统计学方法
3 结果
3.1 冬凌草甲素抑制乳腺癌细胞的增殖
如图1所示,冬凌草甲素能抑制MDA-MB-453、MDA-MB-231、MDA-MB-468乳腺癌细胞的增殖,且呈剂量相关性。
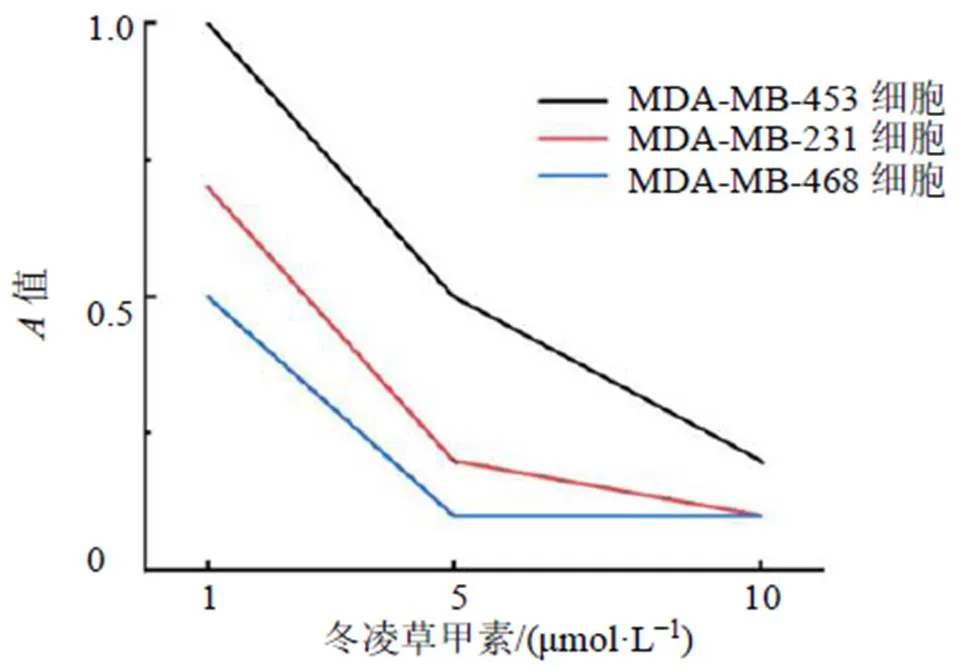
图1 冬凌草甲素抑制乳腺癌细胞增殖(, n = 3)
3.2 冬凌草甲素影响乳腺癌细胞的形态
如图2所示,对照组未见细胞明显凋亡,细胞核呈椭圆形;冬凌草甲素组MDA-MB-468细胞数量明显减少,冬凌草甲素(10 μmol/L)组大量细胞体积略缩小,细胞间连接消失,空隙变大,并从培养皿中脱离,细胞核呈凋亡核形态,即核体积减小,在高倍镜下可观察到细胞凋亡的形态。表明冬凌草甲素可以诱导细胞凋亡。
3.3 冬凌草甲素诱导乳腺癌细胞的自噬
如图3所示,冬凌草甲素组细胞内自噬标志蛋白LC3荧光斑点数量及荧光强度明显增加,表明冬凌草甲素能够诱导细胞自噬,且呈剂量相关性。
3.4 冬凌草甲素诱导乳腺癌细胞凋亡
如图4所示,乳腺癌MDA-MB-468细胞给予冬凌草甲素处理24 h后,早期凋亡和晚期凋亡细胞比例均升高,且呈剂量相关性,表明冬凌草甲素能够诱导乳腺癌细胞凋亡。
3.5 冬凌草甲素抑制IL-6/STAT3信号通路激活
如图5-A所示,给予IL-6刺激后,HepG2-STAT1/3-Luc细胞荧光强度明显升高(<0.05);给予冬凌草甲素后,HepG2-STAT1/3-Luc细胞荧光强度明显降低(<0.05),且呈剂量相关性,表明冬凌草甲素能够抑制IL-6/STAT3通路的激活,从而抑制炎性小体的激活。如图5-B所示,给予IL-6刺激后,HepG2-STAT1/3-Luc细胞p-STAT3蛋白表达水平明显升高(<0.05);给予冬凌草甲素后,HepG2-STAT1/3-Luc细胞p-STAT3蛋白表达水平明显降低(<0.05),呈剂量相关性。表明冬凌草甲素通过抑制STAT3的磷酸化而抑制IL-6/STAT3通路的激活,进而诱导乳腺癌细胞自噬,抑制乳腺癌细胞增殖。

图2 冬凌草甲素诱导乳腺癌细胞凋亡形态变化(×400)
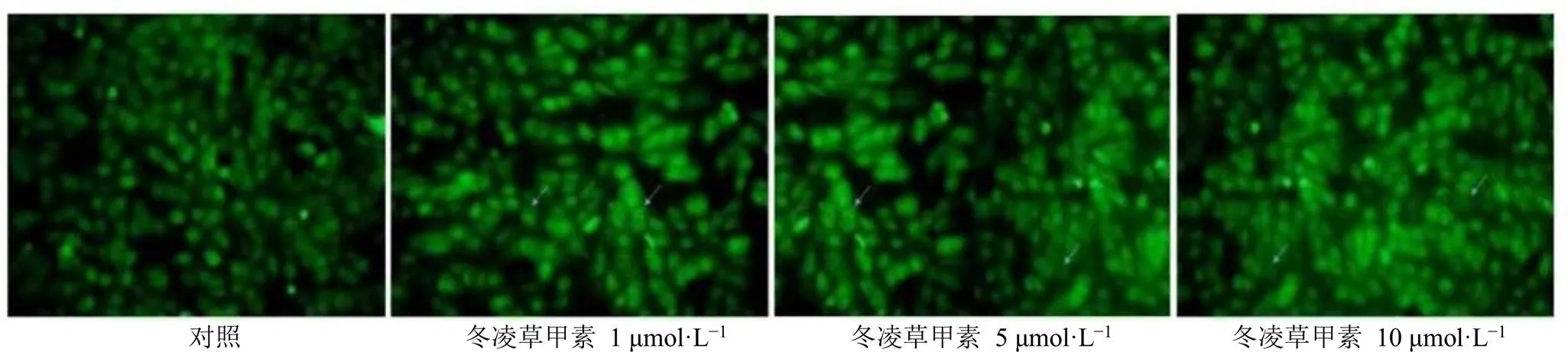
图3 冬凌草甲素诱导乳腺癌细胞自噬 (×400)
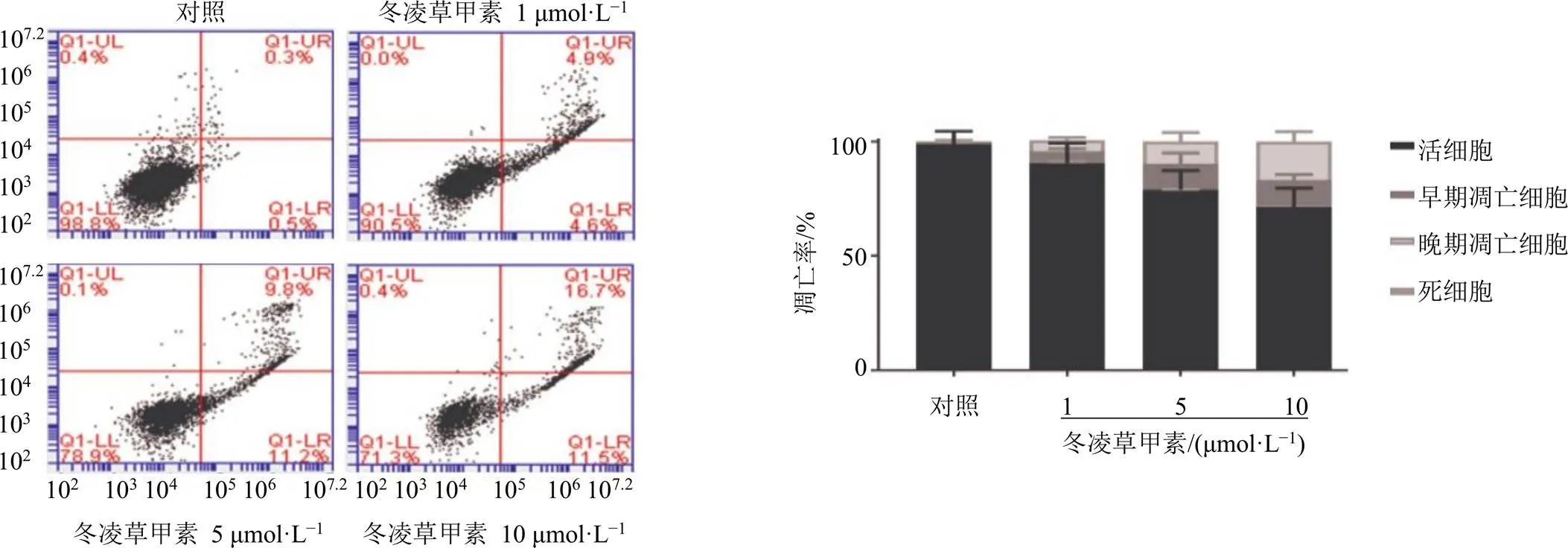
图4 冬凌草甲素诱导乳腺癌细胞凋亡(, n = 3)
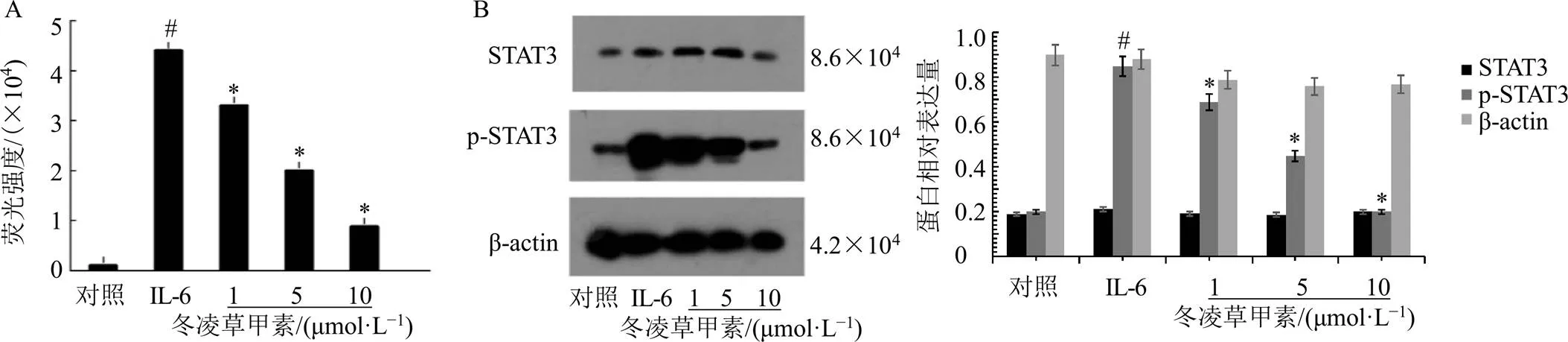
与对照组比较:#P<0.05;与IL-6组比较:*P<0.05,下图同
3.6 冬凌草甲素影响乳腺癌细胞增殖和凋亡有关蛋白表达
如图6所示,冬凌草甲素能够显著上调p53、cleaved PARP、CytC、cleaved Caspase-9、cleaved Caspase-3和Bax蛋白表达水平(<0.05),下调PARP、Bcl-2蛋白表达水平(<0.05),且呈剂量相关性。提示冬凌草甲素能够通过启动内源和外源性途径诱导乳腺癌细胞凋亡。
4 讨论
冬凌草是20世纪70年代发现的抗癌抗菌消炎中草药,中国科学院昆明植物研究所孙汉董院士从冬凌草中提取出抗癌、抗菌、消炎的活性成分冬凌草甲素。经临床试验证实,冬凌草及其提取物冬凌草甲素对多种肿瘤有效,尤其是对于我国北方地区发病率较高的食管癌和胃腺癌最为敏感。同时,冬凌草与化疗药联合使用能够提高化疗药的抗肿瘤作用,并降低其不良反应。冬凌草甲素具有明确的抗肿瘤作用,其在部分瘤种中的抗肿瘤作用机制已初步阐明。研究表明,冬凌草甲素可以促进非小细胞肺癌Bax表达而抑制Bcl-2表达,从而促进肺癌细胞凋亡;冬凌草甲素不仅调控胰腺癌细胞Bax/Bcl-2表达,而且促进CytC从线粒体释放,从而诱导线粒体凋亡途径[23-24]。但冬凌草甲素对乳腺癌细胞的作用和机制尚未有深入研究。
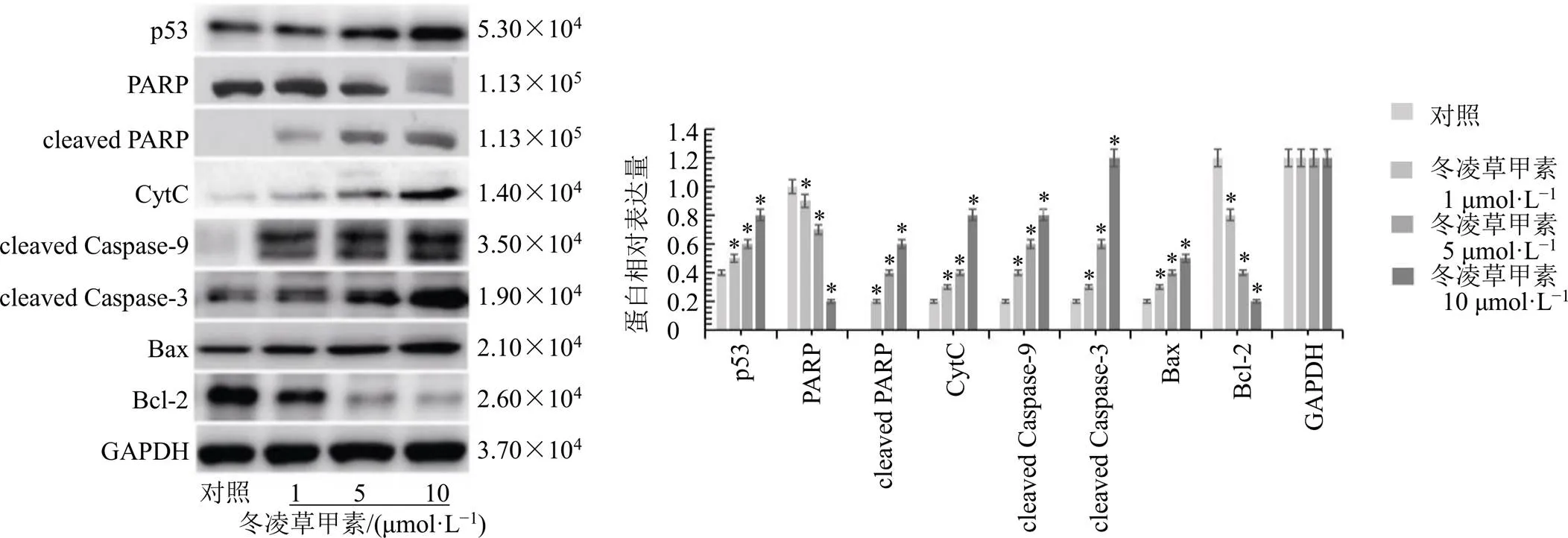
图6 冬凌草甲素对乳腺癌细胞增殖和凋亡相关蛋白表达的影响(, n = 3)
STAT3信号通路是多种细胞因子和生长因子在细胞内传递信号的共同途径,广泛参与细胞增殖、分化、凋亡以及炎症和自噬等过程,可以通过负调节因子、与其他信号通路作用、共价修饰等多种途径进行调节,在很多恶性肿瘤中过度表达和活化,与乳腺癌细胞增殖有着密切的关系。抑制STAT3的表达或活化能够抑制肿瘤细胞生长,促进肿瘤细胞凋亡[23-27]。在多数人类癌症中,肿瘤细胞可通过酪氨酸第705位点的磷酸化实现STAT3过渡激活,此外,IL-6也可通过细胞膜上相应的酪氨酸激酶相关受体来激活STAT3信号通路,最终诱导肿瘤细胞的增殖。抑制IL-6/STAT3信号通路的激活,可促进肿瘤细胞的凋亡[28-29]。本研究发现,冬凌草甲素能够抑制IL-6/STAT3通路和STAT3磷酸化,综合GFP-LC3荧光斑点实验结果,发现冬凌草甲素可能通过抑制STAT3的磷酸化而抑制IL-6/STAT3信号通路的激活,从而抑制乳腺癌细胞的增殖,并诱导了乳腺癌细胞自噬和凋亡。
细胞凋亡途径可分为内源性和外源性途径,最终都通过Caspase-3活化启动凋亡进程,外源性途径以Caspase-9的活化等为代表,而内源性途径则以线粒体膜上CytC的释放为代表。p53基因是人类肿瘤相关性最高的基因,p53基因广泛分布于核仁、线粒体等结构中,参与细胞周期调控、细胞凋亡及维持基因组稳定等过程。已有研究表明p53基因可同时诱导内源性和外源性凋亡的发生,p53基因上调后,细胞损伤后的监控增强,有DNA损伤的细胞无法进入复制周期,继而走向凋亡[30-34]。本研究发现,冬凌草甲素能够上调p53表达,导致细胞监控加强,从而使肿瘤细胞不能进入复制周期;同时研究还发现,随着冬凌草甲素浓度升高,细胞凋亡相关蛋白(cleaved Caspase-3、cleaved Caspase-9、CytC)表达水平逐渐升高,最终共同导致了乳腺癌细胞的凋亡。结合DAPI染色法观察乳腺癌细胞核形态学特征结果,冬凌草甲素可通过提高多种凋亡蛋白活性,最终导致乳腺癌细胞凋亡。
综上所述,本研究发现冬凌草甲素能够通过抑制STAT3信号通路,上调p53蛋白、PARP、Caspase-3活化形式以及Caspase-9活化形式表达等,从而诱导乳腺癌细胞自噬和凋亡,并抑制乳腺癌细胞增殖。
利益冲突 所有作者均声明不存在利益冲突
[1] Fan L, Strasser-Weippl K, Li J J,. Breast cancer in China [J]., 2014, 15(7): e279-e289.
[2] 李贺, 郑荣寿, 张思维, 等. 2014年中国女性乳腺癌发病与死亡分析 [J]. 中华肿瘤杂志, 2018, 40(3): 166-171.
[3] Siegel R L, Miller K D, Jemal A. Cancer statistics, 2017 [J]., 2017, 67(1): 7-30.
[4] Allemani C, Matsuda T, Carlo V D,. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): Analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries [J]., 2018, 391(10125): 1023-1075.
[5] Provenzano E, Ulaner G A, Chin S F. Molecular classification of breast cancer [J]., 2018, 13(3): 325-338.
[6] Shi Y Q, Jin J, Ji W F,. Therapeutic landscape in mutational triple negative breast cancer [J]., 2018, 17(1): 99.
[7] 李春雨, 王琪, 申珅, 等. 冬凌草甲素对人黑色素瘤A375细胞侵袭和转移的影响及机制研究 [J]. 中草药, 2018, 49(3): 658-662.
[8] 俞文英, 马建琦, 方杰, 等. 冬凌草甲素聚乙二醇功能化氧化石墨烯纳米粒的制备及抗结肠癌实验研究 [J]. 中草药, 2017, 48(19): 3954-3960.
[9] 赫玮, 左勇. 冬凌草甲素上调PLK1对Jurkat细胞细胞周期的影响 [J]. 上海交通大学学报: 医学版, 2021, 41(5): 603-611.
[10] 王景, 刘晶, 魏旭静, 等. 冬凌草甲素对子宫内膜癌HEC-1B细胞增殖、迁移和侵袭及lncRNA CCAT1表达的影响 [J]. 吉林大学学报: 医学版, 2021, 47(2): 384-389.
[11] 谢谭芳, 朱小勇, 黄天衍. 壳聚糖氧化石墨烯负载冬凌草甲素对A549细胞增殖及凋亡的影响 [J]. 中国药房, 2021, 32(13): 1589-1595.
[12] 贺守第, 王健雄, 马港圆, 等. 冬凌草甲素通过NF-kapppaB信号通路对LPS刺激树突状细胞的影响 [J]. 南昌大学学报: 医学版, 2021, 61(2): 13-17.
[13] 刘晖, 赵春英, 郑洁, 等. 冬凌草甲素通过上调p53抑制三阴性乳腺癌细胞增殖并诱导凋亡的机制 [J]. 实用癌症杂志, 2021, 36(6): 891-894.
[14] 杨鹏, 赵美兰, 杨宇慎, 等. 冬凌草甲素与奥沙利铂联合应用抑制结肠癌肝转移的实验研究 [J]. 吉林中医药, 2021, 41(6): 784-787.
[15] 王佐, 王璐, 陈忠正, 等. 冬凌草甲素诱导小鼠肝癌细胞醌还原酶活性及其机理研究 [J]. 食品科学, 2017, 38(7): 193-200.
[16] 黄清波. 冬凌草甲素对甲状腺癌细胞放射敏感性的影响及机制 [J]. 中国老年学杂志, 2020, 40(1): 185-190.
[17] 刘建群, 高俊博, 刘小红. 热分析法研究冬凌草甲素的热稳定性和分解动力学[J]. 林产化学与工业, 2015, 35(6): 119-125.
[18] 杨宏静, 方应权, 沈庆坤, 等. 冬凌草甲素衍生物的合成及其抗肿瘤活性研究 [J]. 化学试剂, 2021, 43(2): 147-151.
[19] 刘艺, 郭金兴. 冬凌草甲素抑制人卵巢癌细胞恶性行为及机制研究 [J]. 现代预防医学, 2021, 48(1): 139-143.
[20] 刘荣兴, 胡培, 马妍, 等. 冬凌草甲素抑制HCT116细胞增殖与p38 MAPK信号通路相关性研究[J]. 药物评价研究, 2018, 41(2): 200-205.
[21] Huang J, Wu L J, Tashiro S,. A comparison of the signal pathways between the TNF alpha- and oridonin-induced murine L929 fibrosarcoma cell death [J]., 2005, 59(6): 261-270.
[22] Xu Y, Xue Y, Wang Y,. Multiple-modulation effects of oridonin on the production of proinflammatory cytokines and neurotrophic factors in LPS-activated microglia [J]., 2009, 9(3): 360-365.
[23] 崔莎莎. 疏肝益肾方对乳腺癌微环境中外泌体串扰介导他莫昔芬耐药性的研究 [D]. 北京: 中国中医科学院, 2021.
[24] 何国浓, 贺志良, 王邦才, 等. 冬凌草甲素靶向Sema4D抑制人非小细胞肺癌A549细胞增殖的机制研究 [J]. 中华中医药杂志, 2021, 36(7): 3842-3846.
[25] 邱雯莉. 载冬凌草甲素靶向GPC1多模态分子探针在胰腺癌诊疗一体化中的研究 [D]. 南京: 南京中医药大学, 2019.
[26] 张锦锦, 唐慧. JAK/STAT3信号通路调控肿瘤及其相关生物功能的研究进展 [J]. 基础医学与临床, 2017, 37(10): 1456-1460.
[27] 尹建国, 张社兵, 彭道泉. 载脂蛋白AⅠ通过JAK2/STAT3信号通路抑制肿瘤坏死因子α的转录表达 [J]. 中国动脉硬化杂志, 2017, 25(6): 566-570.
[28] 杨毅, 袁杰, 牛瑞芳. STAT3的多重调控方式在肿瘤中的研究进展 [J]. 中国肿瘤临床, 2016, 43(8): 352-357.
[29] 邢济麟. SIRT4通过抑制IL-6/STAT3信号通路增强雌激素受体阳性乳腺癌对他莫昔芬的敏感性 [D]. 沈阳: 中国医科大学, 2020.
[30] Li P, Zhou L B, Zhao T,. Caspase-9: Structure, mechanisms and clinical application [J]., 2017, 8(14): 23996-24008.
[31] An H K, Chung K M, Park H,. CASP9 (caspase 9) is essential for autophagosome maturation through regulation of mitochondrial homeostasis [J]., 2020, 16(9): 1598-1617.
[32] Amaral J D, Xavier J M, Steer C J,. The role of p53 in apoptosis [J]., 2010, 9(45): 145-152.
[33] Kanapathipillai M. Treating p53 mutant aggregation-associated cancer [J]., 2018, 10(6): E154.
[34] Stein Y, Rotter V, Aloni-Grinstein R. Gain-of-function mutant p53: All the roads lead to tumorigenesis [J]., 2019, 20(24): 6197.
Effect and mechanism of oridonin on breast cancer cells based on IL-6/STAT3 signaling pathway
LI Nai-wei, WANG Fei, RAO Zi-zhao, WANG Jian-shi
Fuzhou Medical College, Nanchang University, Fuzhou 344000, China
To study the effect of oridonin on proliferation and autophagy of breast cancer cells based on interleukin-6 (IL-6)/signal transducer and activator of transcription 3 (STAT3) signaling pathway, and further explore the effect of oridonin on proliferation and apoptosis-related protein expressions of breast cancer cells.Effect of oridonin on proliferation of MDA-MB-231, MDA-MB-453 and MDA-MB-468 breast cancer cells was detected by MTT method; Effect of oridonin on autophagy of MDA-MB-468 cells was detected by GFP-LC3 fluorescent spotsin; Effect of oridonin on nuclear morphology of MDA-MB-468 cells was observed by DAPI staining; Effect of oridonin on apoptosis of MDA-MB-468 cells was determined by flow cytometry; Effect of oridonin on IL-6/STAT3 signaling pathway was detected by HepG2-STAT1/3-Luc cells stably transfected with STAT3-luciferase reporter gene plasmid; Effect of oridonin on phosphorylation of STAT3 and cell proliferation and apoptosis-related protein expressions was detected by Western blotting.Oridonin inhibited the proliferation of breast cancer cells, induced autophagy and apoptosis of breast cancer cells in a dose-dependent manner; Oridonin significantly inhibited IL-6/STAT3 signaling pathway and STAT3 phosphorylation; Oridonin up-regulated p53, cleaved poly ADP-ribose polymerase (cleaved PARP), cleaved caspase-aspartic protease-3 (cleaved Caspase-3) and Caspase-9 protein expressions in breast cancer cells.Oridonin may inhibit the activation of IL-6/STAT3 signaling pathway by inhibiting the phosphorylation of STAT3, and up-regulate protein expressions of p53, cleaved PARP, cleaved Caspase-3 and cleaved Caspase-9, thereby inhibiting the proliferation of breast cancer cells, inducing autophagy and apoptosis in breast cancer cells.
oridonin; breast cancer; cell proliferation; autophagy; apoptosis; interleukin-6/signal transducer and activator of transcription 3 signaling pathway
R285.5
A
0253 - 2670(2022)13 - 4046 - 07
10.7501/j.issn.0253-2670.2022.13.018
2022-02-17
江西省卫生健康委科技计划项目(SKJP220210301);抚州市科技计划项目(109025488028)
黎乃维(1982—),女,博士研究生,主要从事药物研究。 E-mail: 18992685@qq.com
王 飞(1980—),副教授。Tel: (0794)8251669 E-mail: 28010495@qq.com
[责任编辑 李亚楠]

