基于UHPLC-Q-TOF-MS技术研究炮制对白术芍药散中化学成分的影响
刘 晓,孙戡平,秦昆明,金俊杰,杨 超,蔡宝昌, *
基于UHPLC-Q-TOF-MS技术研究炮制对白术芍药散中化学成分的影响
刘 晓1,孙戡平1,秦昆明2, 3,金俊杰2, 3,杨 超1,蔡宝昌1, 2, 3*
1. 南京中医药大学药学院,江苏 南京 210023 2. 南京海昌中药集团有限公司,江苏 南京 210061 3. 南京海源中药饮片有限公司,江苏 南京 210061
采用UHPLC-Q-TOF-MS技术结合多元数据统计分析方法,针对白术芍药散水煎液中的化学组成进行分析,同时与药材未经炮制即配伍入药的情况进行比较,探讨中药炮制过程对白术芍药散中化学成分的影响。采用正、负离子扫描模式检测,利用Peakview 1.2软件鉴别样品中化学成分,结合MarkerView 1.2.1软件对炮制前后样品进行主成分分析并寻找两者的特征差异性成分。正、负离子检测模式下共匹配出化学成分183种,通过检验发现差异性化学成分34种,差异性成分的主要来源为陈皮和防风。药材经过炮制配伍入药对于白术芍药散的化学组成具有显著性影响,古籍中所载白术芍药散应采用炮制品进行组方用药具有实际的客观原因与深刻的科学内涵。
白术芍药散;炮制;UHPLC-Q-TOF-MS;主成分分析;水煎液;陈皮;防风
白术芍药散(又名痛泻要方),始载于古籍《丹溪心法》,由白术(麸炒)、白芍(麸炒)、陈皮(清炒)、防风共4味中药组成,为中医治疗肝郁脾虚、腹痛泄泻的代表方剂,具有健脾舒肝、止痛止泻之功,现代临床多用于治疗结肠炎、肠易激综合征等[1]。白术自古被奉为“健食消谷第一要药”“安脾胃之神品”[2],为方中君药,具有健脾益气、燥湿利水之功效;白芍为臣药,可滋脾柔肝、益阴养血、缓急止痛,与白术相配后泻肝补脾;陈皮为使药,可理气而燥湿、健脾和胃以助运化;防风为使药,其味辛能散肝风、能胜湿,其性升浮,可升阳而止泻。此4味药相辅相成,为医家从古至今临床治疗肠道病征之要药[3]。
目前,白术芍药散在临床使用过程中存在饮片品类滥用的现象,尤其以生饮片代替炮制品进行组方的现象最为常见[4-5]。众多研究表明,中药炮制过程会使饮片的物理状态与其中的化学成分发生变化[6-7],进一步影响饮片配伍后所得复方的化学成分构成。饮片品类的滥用,将会在一定程度上改变方剂的化学成分,从而影响其药效,不利于临床规范用药。
白术芍药散中化学成分的种类复杂,包括白术挥发油类成分、芍药黄酮类成分、陈皮挥发油类成分、防风挥发油类及香豆素类成分等,因此选择合适的分析技术成为实验的关键。UHPLC-Q-TOF-MS技术是目前中药成分分析最为前沿的技术之一,具有灵敏度高、选择性好、分辨率高的特点[8]。不同于一般分析技术对于对照品的依赖性较大,Q-TOF技术提供的高分辨精确质核比准确度高,经校准后配合以子离子碎片信息,可有效提供化合物的结构信息,在中药化学多成分分析及药效物质基础研究方面运用广泛[9-11]。前期,已有研究通过此技术对白术芍药散醇提液中化学成分进行分析[12],但考虑到临床使用白术芍药散的实际剂型为汤剂,故本实验以复方水提液为研究对象,最大程度模拟药物的临床使用情况,通过多元数据分析方法对比生品组及制品组样品中化学成分的差异,从物质基础角度客观阐明古籍采用炮制品饮片组方的现代科学内涵。
1 仪器与材料
1.1 仪器与设备
超高效液相色谱仪(Shimadzu 30AD,日本);Sciex Triple TOF 5600+系统(AB Sciex,美国);数据采集软件:Analyst TF 1.6 software(AB Sciex,美国);数据处理软件系统:Peakview 1.2软件(AB Sciex,美国)和Markerview 1.2.1软件(AB Sciex,美国);KQ5200DB型数控超声波清洗器(昆山市超声仪器有限公司);SPE固相萃取小柱(WATO43395 Waters Sep-pak C18);BP121S分度值电子分析天平(梅特勒托雷多公司);十万分之一电子天平(济南爱来宝医疗科技有限公司)。
1.2 材料与试剂
白术、白芍、陈皮、防风饮片各6批经南京中医药大学陈建伟教授鉴定,符合《中国药典》要求,白术为菊科植物白术Koidz. 的干燥根茎炮制得到的合格饮片;白芍为毛茛科植物芍药Pall.的干燥根炮制得到的合格饮片;陈皮为芸香科植物橘Blanco的干燥成熟果皮炮制得到的合格饮片;防风为伞形科植物防风(Turcz.) Schischk.的干燥根炮制得到的合格饮片。来源信息见表1。甲醇为质谱纯(德国E. Merck);水为Milliporeill-Q自行制备。对照品芍药苷(批号X12A8C33672)、芍药内酯苷(批号Y21A9H59553)、白术内酯I(批号P29N8F49265)、白术内酯II(批号ZM0311BC13)、白术内酯III(批号R29M9F57437)、川陈皮素(批号P05M8535478)、橙皮苷(批号M02J9S64781)、升麻素(批号YH09H72162)、5--甲基阿米醇苷(批号H25A8K42328)、没食子酸(批号Y19M8C36143)、芸香柚皮苷(批号P11N8C48150)、1,2,3,4,6--五没食子酰基葡萄糖(批号P28M9F54631),均购于上海源叶生物有限公司,质量分数均>98%。
表1 实验用饮片来源信息
Table 1 Source information of herbal pieces
编号白术(批号)白芍(批号)陈皮(批号)防风(批号) 1南京海源中药饮片公司(180501)南京海源中药饮片公司(180101)南京海源中药饮片公司(180620)南京海源中药饮片公司(180901) 2安徽美誉中药饮片有限公司(111708201)南京海源中药饮片公司(180903)安徽众益堂中药材销售有限公司(20181013)南京海源饮片公司(180124) 3康美药业股份有限公司(180150141)广东汇群中药饮片有限公司(20161202)康美药业股份有限公司(180403751)康美药业股份有限公司(180550771) 4四川御鼎堂中药饮片有限公司(180301)普宁泽群中药饮片有限公司(180801)安国市瑞琪中药材有限公司(20180707)河北凯达药业有限公司(20180307) 5安徽万生中药饮片有限公司(170902)广东天诚中药饮片有限公司(180101)安国市瑞琪中药材有限公司(20171201)广东天诚中药饮片有限公司(180601) 6安徽尚德中药饮片有限公司(170901)广州华惟堂药业有限公司(180910)广州华惟堂药业有限公司(180910)康美药业股份有限公司(180405411)
1.3 饮片炮制
蜜炙麸皮:炼蜜用少许开水化开,洒入麸皮中,拌匀后闷润约30 min,倒入锅中用微火炒干至不粘手即可(每100千克麸皮,用炼蜜25 kg)。
麸炒白术、麸炒白芍:取蜜炙麸皮炒至微微冒烟,放入生饮片,中火均匀拌炒至饮片表面焦黄,有焦香气逸出,取出筛去麦麸,放凉即可(每100千克生饮片加10 kg蜜炙麸皮)。
清炒陈皮:取生陈皮饮片用文火均匀至陈皮质脆,色泽加深,略有焦斑,有香气逸出,取出放凉即可。
1.4 方剂配伍
未炮制组:随机选取“1.2”项中白术6 g、白芍4 g、陈皮3 g、防风4 g,组成方剂8份,编号为生品组1~8。
炮制组:随机选取“1.3”项中麸炒白术6 g、麸炒白芍4 g、清炒陈皮3 g、防风4 g(与生品组相对应,保持为同一批药材来源),组成方剂8份,编号为制品组1~8。
2 方法与结果
2.1 液相及质谱条件
液相条件:采用ZORBAX Extend-C18反相色谱柱(100 mm×2.1 mm,1.8 μm);流动相为水(A)-乙腈(B),梯度洗脱:0~4 min,5%~15% B;4~10 min,15%~25% B;10~15 min,25%~60% B;15~22 min,60~80% B;22~25 min,80%~100% B;25~27 min,100% B;27~30 min,100%~5%B;30~32 min,5% B;体积流量0.3 mL/min;柱温35 ℃,进样体积3 μL。质谱条件:ESI离子源,正、负离子模式扫描。雾化气体为氮气,TEM为550 ℃,DP为60 V/−60 V,CE为35 eV/−35 eV,ISVF为4500 V/−4500 V,Gas1为379.5 kPa,Gas2为379.5 kPa,Curtain Gas为241.5 kPa。一级质谱母离子扫描范围为/100~2000,二级质谱子离子扫描范围为/50~1000,并开启动态背景扣除。
2.2 对照品溶液的制备
精密称取芍药苷,芍药内酯苷,白术内酯I、II、III,川陈皮素,橙皮苷,升麻素,5--甲基阿米醇苷,没食子酸,芸香柚皮苷,1,2,3,4,6--五没食子酰基葡萄糖对照品各5 mg于1 mL量瓶中,加甲醇溶解并定容,得混合对照品储备液,再稀释至各成分质量浓度为5 μg/mL备用。
2.3 供试品溶液的制备
按“1.4”项下所得样品中加入12倍量水浸泡30 min,100 ℃回流提取1 h,滤出提取溶液,再加入12倍量水,回流提取1 h,合并提取液,定容至500 mL,混匀。定容溶液中取15 mL水浴蒸干,加入2 mL水复溶,转移至2 mL离心管中。溶液12 000 r/min离心5 min,取上清液,过SPE小柱稀释备用,洗脱梯度为1 mL 5%乙腈,2 mL 15%乙腈,2 mL 30%乙腈,2 mL 45%乙腈,1.5 mL 60%乙腈,0.5 mL 75%乙腈,0.5 mL 90%乙腈。
2.4 数据库的建立
借助于知网、SciFinder和PubMed等文献数据库检索白术、白芍、陈皮、防风及其炮制品相关文献,尽可能全面地建立包含白术芍药散中所含化合物的化学名称、相对分子质量、分子式和分子结构等信息数据库,并借助ChemicalBook、ChemSpider等数据库下载所得化合物的mol文件,计算化合物在正离子模式下[M+H]+、[M+NH4]+和负离子模式下[M-H]−、[M+COOH]−等离子形态的精确质荷比。
2.5 成分鉴定和分析
将所得数据导入PeakView 1.2软件,通过对照品保留时间对比和一级质量数匹配定位化学成分,所有化学成分的鉴别分析均是依据一级质量数、同位素匹配和二级结构式与质量碎片匹配而进行。将各化合物总离子流图中提取到的一级质量数、同位素进行对比,误差<5×10−6为可接受标准,通过二级碎片与其化学结构所对应的碎片间的匹配程度以及相关文献数据对比进行化学成分确认,匹配度达到85%以上的化学成分被鉴别确认,借助Markerview1.2软件对多批制品及生品组样品测试结果进行主成分分析和组间检验分析,得到得分图及载荷图。
生品组与制品组样品在正、负离子模式下的总离子流图如图1所示,正、负离子2种模式下共鉴别出183种化合物(表2),以芍药苷为例来说明鉴别过程,峰50的[M+H]+准分子离子峰为480.163,对应分子式为C23H28O11,主要二级碎片为/449.146、327.104、165.055、121.030,发现二级碎片质量数所对应的结构碎片与芍药苷相当,推测该化合物为芍药苷,将芍药苷的mol文件所预测的碎片与二级碎片进行匹配,与已有报道相同[13],且裂解行为与芍药苷对照品相同,最终确认该化合物为芍药苷。其他化合物均采用类似方法鉴定,当出现同分异构体时可通过对照品出峰时间及化合物极性差异进行推测,共鉴定出的183种成分,主要为黄酮类、萜类和酚酸类成分。
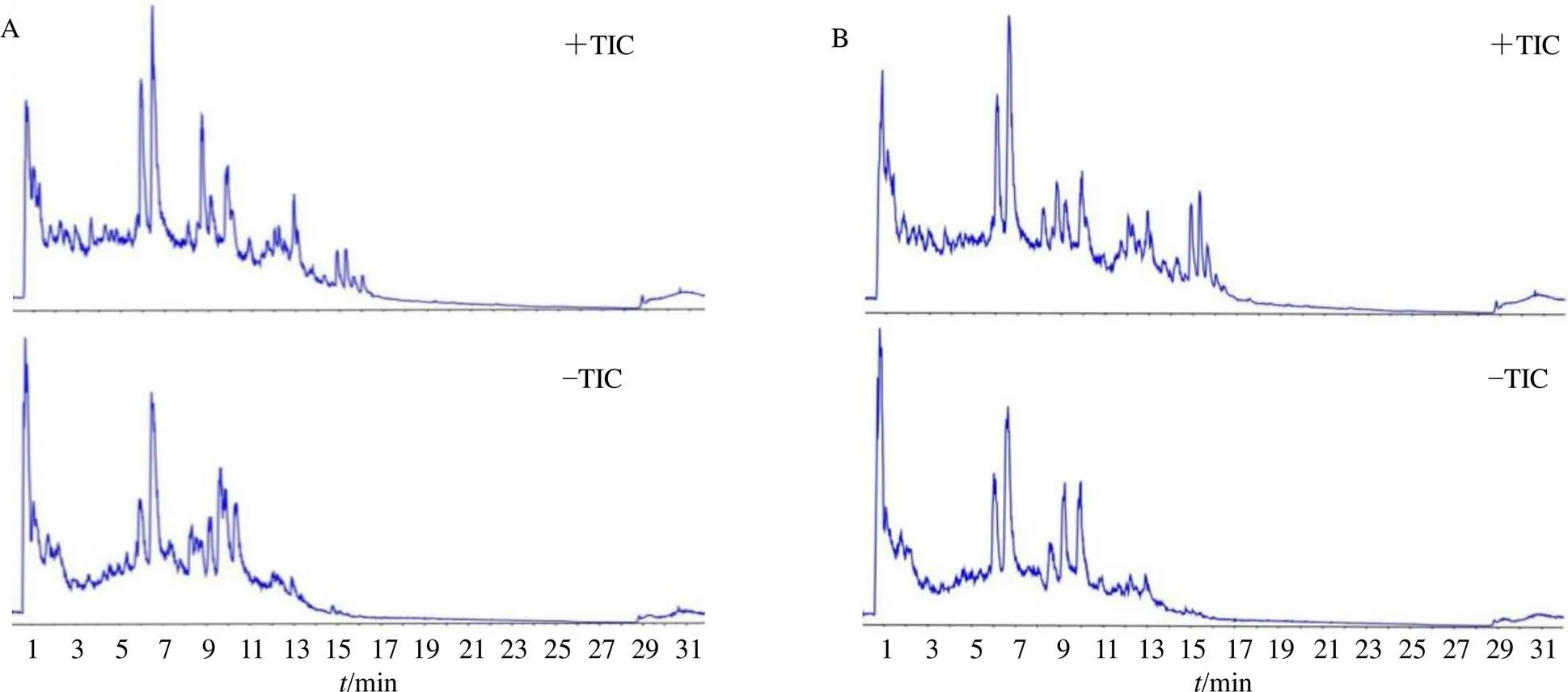
图1 正(+TIC)、负(−TIC) 离子检测模式下制品组(A) 和生品组(B)样品典型质量色谱图
表2 UHPLC-Q-TOF-MS检测出制品组、生品组样品中共有化学成分信息
Table 2 Information of common components detected in processed and unprocessed samples by UHPLC-Q-TOF-MS
序号化合物tR/min化学式来源序号化合物tR/min化学式来源 14,15-环氧类固醇0.02C15H20O4白术23丁二酸0.86C4H6O4白术 28,9-环氧类固醇0.02C15H18O3白术24辛弗林0.92C9H13NO2防风 3地奥司明0.02C28H32O15白芍25异亮氨酸1.01C6H13NO2白术 4牡丹皮苷J0.03C23H28O11陈皮26葡糖胆素1.24C13H16O10陈皮 5儿茶素异构体0.04C15H14O6陈皮272-(甲氨基)苯甲酸甲酯1.70C9H11NO2白芍 6阿魏酸0.05C10H10O4白术28芍药酮1.88C10H14O4白芍 7紫花前胡苷0.05C20H24O9防风295-羟甲基糠醛2.36C6H6O3白术 8(S)-柚皮素0.06C15H12O5陈皮30咖啡酸2.40C9H8O4白术 9辛弗林异构体0.11C9H13NO2白芍31腺苷2.47C10H13O4N5防风 10香叶木苷0.14C28H32O15白芍326-O-b-D-吡喃葡萄糖酰内酯3.03C16H26O9陈皮 112-氨基-5-胍基-戊酸0.62C6H14N4O2白术33芍药内酯D3.07C10H16O4白芍 12柠檬酸0.63C6H8O7陈皮34牡丹皮苷F3.42C16H24O8陈皮 133,4′-二羟基-3′-甲氧基苯丙酮0.66C16H22O10白术35苍术苷A3.64C21H36O10白术 14谷氨酸0.66C5H9NO4白术36对羟基苯甲酸4.39C7H6O3陈皮 15D-甘露糖0.67C6H12O6白芍37氧化芍药苷4.60C23H28O12白芍 16奎尼酸0.67C7H12O6白芍38儿茶素4.96C15H14O6陈皮 17L-阿拉伯糖酸0.68C5H10O6白术39淫羊藿次苷F25.22C18H26O10白术 18D-甘露糖醇0.69C6H14O6白术40(6S,9S)-长寿花糖苷5.35C19H30O8白芍 19蔗糖0.73C12H22O11防风41芍药苷B5.52C16H22O9白芍 20缬氨酸0.78C5H11NO2白术421′-O-苯甲酰蔗糖5.78C19H26O12陈皮 21异茴芹灵0.79C13H11O5防风43木犀草素-7-O-芸香苷5.80C27H30O15白芍 22D-脯氨酸0.80C5H9NO2白术44波状苷A5.80C16H18O9防风
续表2

序号化合物tR/min化学式来源序号化合物tR/min化学式来源 456′-O-b-D-吡喃葡萄糖基芍药苷5.81C29H38O16白芍85柚皮素-7-O-b-D-吡喃葡萄糖苷9.14C21H22O10陈皮 46苯甲酸5.95C7H6O2陈皮86柚皮素9.15C15H12O5陈皮 47芍药内酯苷5.98C23H28O11白芍87柚皮苷9.15C27H32O14陈皮 483-O-乙酰基亥茅酚5.99C17H18O6防风887-羟基-3,5,6,8,3′,4′-六甲氧基黄酮9.15C21H22O9白芍 49芍药内苷C5.99C17H18O6白芍89natsudaidain-3-O-b-D-glucoside9.15C27H32O14白芍 50芍药苷5.99C23H28O11白芍90chysoeriol-6,8-di-C-glucoside9.21C28H32O16白芍 51白芍苷R15.99C23H28O11白芍91山柰苷9.21C27H30O14陈皮 52芍药内苷B5.99C10H12O4白芍921,2,3,4,6-O-五没食子酰葡萄糖9.48C41H32O26陈皮 53芍药苷元酮5.99C17H18O6白芍93橙皮苷9.83C28H34O15陈皮 54维采宁-26.05C28H32O16白芍94新橙皮苷9.83C28H34O15陈皮 55芍药内酯酮6.06C10H16O2白芍95橙皮素9.86C16H14O6陈皮 566′-O-b-D-吡喃葡糖苷6.13C29H38O16陈皮964-O-没食子酰白芍苷9.87C30H32O15白芍 57异杞柳苷6.13C21H22O10陈皮97橙皮素-7-b-D-葡萄糖苷9.87C22H24O11陈皮 58香叶木素-6,8-di-C-葡萄糖苷6.33C28H32O16白芍98阿亚黄素9.88C18H16O7白芍 59升麻苷6.51C22H28O11防风99牡丹皮苷D10.15C24H30O12陈皮 60芍药新苷6.58C23H26O10白芍100邻苯二甲酸二丙酯10.15C14H18O4陈皮 614-乙烯基-2-甲氧基苯酚6.58C9H10O2白芍1011-O-b-D-吡喃葡萄糖基-8-10.17C23H28O10白芍 6263反式-4-甲氧基肉桂酸松柏醛6.596.59C10H10O3C10H10O3白术白芍 102O-苯甲酰基芍药香酮4-O-没食子酰白花苷异构体 10.33 C30H32O15 防风 64珊瑚菜内酯6.60C17H16O5防风1036,7-二甲氧基香豆素10.52C11H10O4白术 65N-甲基-L-苯丙氨酸6.63C10H13NO2白芍1045-甲氧基-7-(3,3-二甲基烯丙氧基)香豆素10.78C15H16O4防风 66水杨酸甲酯6.80C8H8O3陈皮105白术内酯III10.79C15H16O4白术 67水杨苷芍药苷7.07C23H28O12白芍106芍药新苷10.88C23H26O10白芍 68双歧杆菌酸7.10C16H16O7防风107O-葡糖基苯胺异构体10.93C21H26O10防风 69丁香酸7.13C9H10O5陈皮108芸香柚皮苷10.93C27H32O14陈皮 70紫云英苷7.17C21H20O11陈皮1093-O-甲基芍药苷11.22C24H30O11白芍 71东莨菪内酯7.76C10H8O4白术1104-O-甲基白花苷11.22C24H30O11陈皮 72圣草次苷7.82C27H32O15白芍111白芍苷11.22C24H30O11白芍 73芦丁7.99C27H30O16白芍112枸橘苷11.24C28H34O14白芍 744′,5,7-三羟基黄酮醇-3,7-二- O-葡萄糖苷7.99C27H30O16白术1131145-O-甲维阿斯米醇诺达克宁11.4611.54C16H18O5C14H14O4防风防风 75槲皮素8.01C15H10O7白芍115苯甲酰氧芍药苷11.69C30H32O13白芍 76异槲皮苷8.01C21H20O12白芍116牡丹皮苷C11.69C30H32O13陈皮 77嗪皮啶8.04C11H10O5陈皮117pinen-10-ylvicianoside11.71C21H34O10白芍 78升麻素8.15C16H18O6防风118十四烷基柠檬酸11.99C20H36O7白术 79没食子酰芍药苷8.57C30H32O15白芍119亥茅酚苷12.04C21H26O10防风 806′-O-没食子酰芍药苷8.57C30H32O15白芍120牡丹皮苷H12.24C30H32O14陈皮 81柯伊利素-7-O-葡萄糖苷8.59C22H22O11白芍121citusin III12.49C36H53N7O9白芍 82diosmetin-8-C-葡萄糖苷8.59C22H22O11白芍1225,7-二羟基-6,8,3′,4′-四甲氧基黄酮12.56C19H18O8白芍 835-O-甲基维斯阿米醇苷8.74C22H28O10防风123黄花菜木脂素A12.71C20H18O8防风 841-O-b-D-吡喃葡萄糖基-芍药酮8.74C22H28O10白芍124姜黄烯12.73C15H22白术
续表2
运用Markerview 1.2软件进行检验和主成分分析(principal component analysis,PCA),得到正、负离子模式下样品分析的得分图(图2)。从图2可以看出,制品组与生品组样品在正离子检测模式下明显聚为2类,说明在正离子模式下能够检测出炮制对于复方化学成分组成存在显著影响;载荷图(图3)中每个点代表1个贡献成分,且对组间分类影响越大的离子距离原点越远,靠近中心的点所代表的成分在组间无显著性差异,成分结构可以根据标注出的质核比信息与保留时间数据判断。在差异性成分分析中,<0.05的成分被认为差异性成分,其中值>0表示成分在制品组中有所减少;值<0表示成分在制品组中有所增加。在鉴定出的183种成分中共发现34种差异性成分(表3),其中,柚皮素、芦丁、3--乙酰基亥茅酚、香叶木素-6,8-二- C-葡萄糖苷的变化趋势与已有文献报道一致[10]。

图2 正、负离子模式下制品组与生品组样品PCA分析
从实验结果可以看出差异性成分主要来源于陈皮和防风,且多为正离子模式下匹配出的成分,从图3中亦可看出,在负离子模式下制品组与生品组成分并没有明显分类,这一结论与差异性成分多在正离子检测模式下被检出的实验现象相一致。
3 讨论
本实验利用UHPLC-Q-TOF-MS技术及多元数据统计方法,检测并明确了制品组与生品组中的34种主要差异成分及其变化趋势。对结果进行分析,推测炮制前后样品化学成分组成发生变化的原因为:炮制使黄酮类成分的溶出度增加,如芸香柚皮素、柚皮苷等[14];另一方面,高温使其原型成分转化、降解,使之含量增加,如柚皮素、橙皮素等苷类成分易受高温影响降解,这可能是苷类成分含量降低的原因,如橙皮苷等。防风未经炮制进行组方但成分明显发生变化的原因可能是防风中的部分成分与其他中药中成分结合作用反应生成新的物质,如升麻苷,防风中的酸性多糖在适合条件下发生Smith降解生成升麻素,使升麻素含量大幅增加[15]。
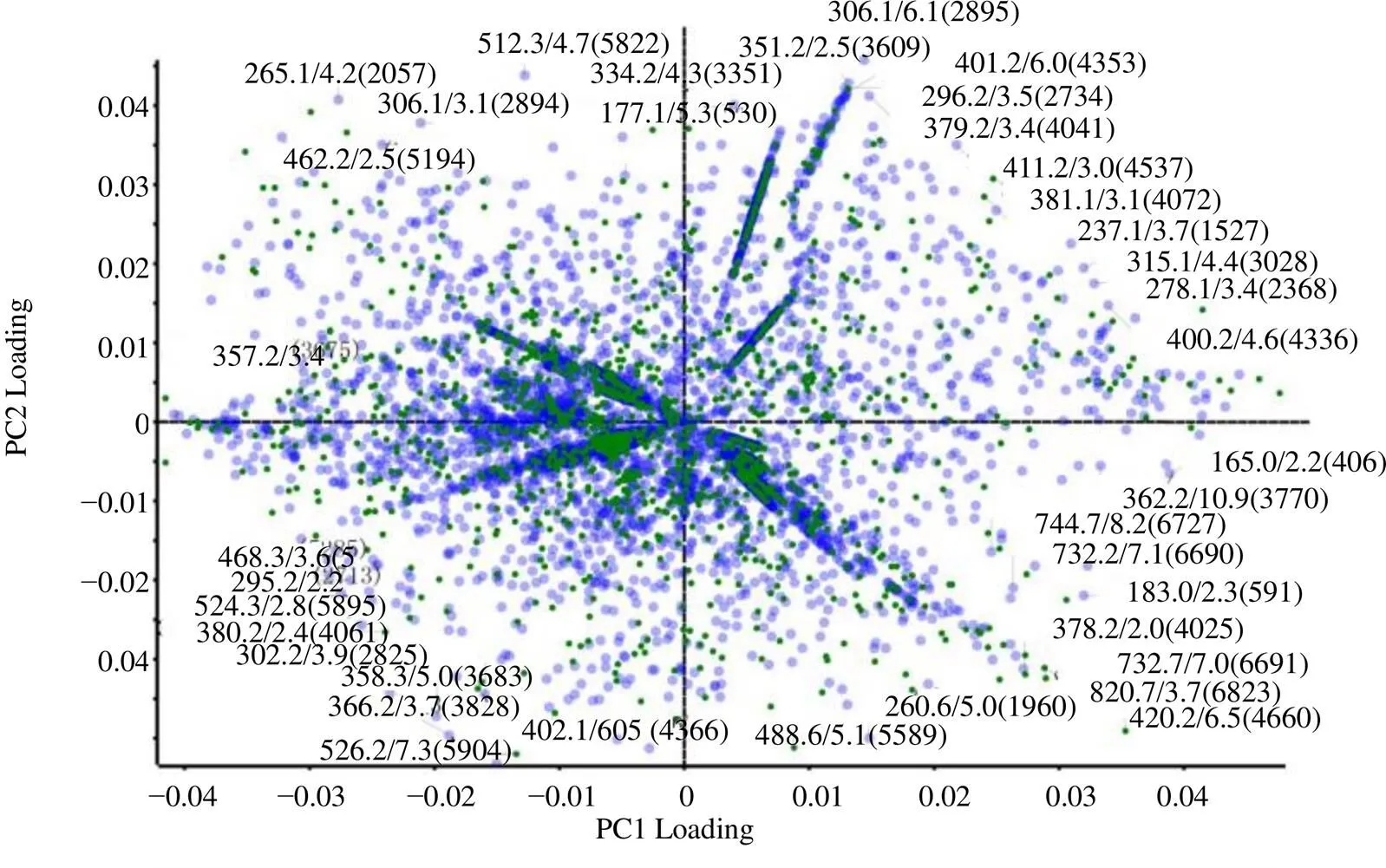
图3 正离子检测模式下制品组及生品组样品间差异性成分分析结果载荷图
据报道,升麻素相对于升麻苷有着更强的消炎作用[16],陈皮中丰富的黄酮类成分有着抗炎镇痛、抗菌抗癌、调节免疫、抗氧化等多种药理作[17]。方中差异性成分升麻素、橙皮素、柚皮素、芸香柚皮苷等成分含量的增加将会客观上影响复方的临床功效,极有可能是古籍中记载炮制品入药的依据。
表3 t检验分析得到组间差异性成分信息(n= 8)
Table 3 Information of distinctive components between groups obtained by ttest (n= 8)
编号化合物tR/mint值P值变化趋势 8(S)-柚皮素**0.06−2.9980.008 51+ 10香叶木苷*0.142.2810.036 56− 31腺苷*2.47−2.2250.040 74+ 326-O-b-D-吡喃葡萄糖酰内酯**3.033.11630.006 65− 36对羟基苯甲酸*4.39−2.1560.046 63+ 44波状苷A*5.80−2.2240.040 83+ 483-O-乙酰基亥茅酚*5.992.5420.021 73− 58香叶木素-6,8-di-C-葡萄糖苷**6.333.0620.007 44− 59升麻苷*6.51−2.5270.022 40+ 60芍药新苷*6.582.8180.012 37− 64珊瑚菜内酯***6.605.2820.000 07− 66水杨酸甲酯**6.803.6140.002 33− 68双歧杆菌酸*7.102.2010.042 73− 70紫云英苷*7.172.3060.034 82− 73芦丁*7.992.1230.049 68− 78升麻素*8.152.1380.048 26− 81柯伊利素-7-O-葡萄糖苷*8.59−2.1350.048 59+ 841-O-b-D-吡喃葡萄糖基-芍药酮*8.742.4300.027 21− 91山柰苷*9.212.1310.048 98− 95橙皮素*9.86−2.4870.024 32+ 99牡丹皮苷D*10.152.3830.029 94− 100邻苯二甲酸二丙酯*10.15−2.3860.029 74+ 1011-O-b-D-吡喃葡萄糖基-8-O-苯甲酰基芍药香酮**10.174.0110.001 01− 106芍药新苷***10.884.5290.000 34− 108芸香柚皮苷**10.93−2.9980.008 51+ 1104-O-甲基白花苷*11.222.4450.030 77− 1135-O-甲维阿斯米醇*11.462.5240.026 43− 118十四烷基柠檬酸*11.992.8850.010 78− 1284-O-甲基-苯甲酰基芍药苷**13.103.1510.006 18− 1455,6,7,3′,4′-五甲氧基黄酮*14.242.5340.022 11− 1633,5,6,7,8,3′,4′-七甲氧基黄酮*15.292.3840.029 87− 166别欧前胡素***15.615.6260.000 04− 170栎精-3,7,3′,4′-四甲醚*15.712.5410.021 78− 181邻苯二甲酸二丁酯**20.193.0620.007 44−
*<0.05,**<0.01,***<0.001;“−”代表制品组与生品组比较含量减少,“+”代表制品组与生品组比较含量增加
*<0.05,**<0.01,***<0.001;“−” indicated a decreasing trend compared with unprocessed samples, “+”indicated a increasing trend compared with unprocessed samples
本实验以水煎液为研究对象,直观、准确地模拟药物临床使用情况,探究炮制对经典名方白术芍药散化学物质基础的影响,用现代科学诠释古籍中运用炮制品的合理性。然而,由于从事人员的忽视及专业知识不足,饮片品种滥用、乱用情况仍然存在,纠正此乱象对于保证中药临床使用的安全、有效具有现实意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 章宸, 刘斌, 郑虎占, 等. 痛泻要方药理作用和临床应用研究概况 [J]. 中国实验方剂学杂志, 2010, 16(7): 223-226.
[2] 李志花, 文颖娟, 许爱英. 白术在方剂中的配伍应用 [J]. 陕西中医学院学报, 2012, 35(4): 77-79.
[3] 刘静, 傅杰, 丁舸. 痛泻要方核心药组论证 [J]. 中医杂志, 2012, 53(2): 172-174.
[4] 钱雷, 时贞平, 郭英球. 推拿配合白术芍药散治疗腹泻型肠易激综合征53例 [J]. 中医药导报, 2010, 16(10): 63-64.
[5] 朱秋双, 赵玉珍, 张明远, 等. 白术芍药散抗腹泻药效实验研究 [J]. 黑龙江医药科学, 2007, 30(1): 14-15.
[6] 任娟, 刘晓, 李伟东, 等. 基于UHPLC-Q-TOF-MS/MS的白芍炒制前后化学成分研究[J]. 世界中医药, 2019, 14(2): 268-273.
[7] 谭利平, 竹林, 黄峥峥, 等. 差异性炮制方法对丹参药材中丹酚酸B的变化研究[J]. 世界中医药, 2020, 15(7): 1008-1011.
[8] 任伟光, 武拉斌, 降雪, 等. 豨莶草及其酒炙品UPLC-Q- TOF/MS分析 [J]. 中草药, 2014, 45(2): 181-187.
[9] 冯红, 潘桂湘. 高分辨质谱在中药化学成分分析中的应用 [J]. 辽宁中医药大学学报, 2012, 14(8): 40-42.
[10] 李郭帅, 马阳, 耿婷, 等. UPLC-Q-TOF-MS/MS分析复方南星止痛膏化学成分 [J]. 中国中药杂志, 2019, 44(2): 298-307.
[11] 周丹丹, 邹秦文, 林瑞超. 基于超高效液相色谱-四级杆-静电场轨道阱质谱的胃复春片化学成分研究[J]. 世界中医药, 2020, 15(13): 1841-1848.
[12] Xu Y Y, Cai H, Cao G,. Profiling and analysis of multiple constituents in Baizhu Shaoyao San before and after processing by stir-frying using UHPLC/Q- TOF-MS/MS coupled with multivariate statistical analysis [J]., 2018, 1083: 110-123.
[13] Wu J, Shen H, Xu J,. Detection of sulfur-fumigated Paeoniae Albain complex preparations by high performance liquid chromatography tandem mass spectrometry [J]., 2012, 17(8): 8938-8954.
[14] 周国洪, 唐力英, 寇真真, 等. 炮制对王不留行中刺桐碱及黄酮苷类成分含量及溶出率的影响 [J]. 中国实验方剂学杂志, 2016, 22(22): 18-21.
[15] 王松柏, 秦雪梅, 刘焕蓉, 等. 防风多糖化学成分的研究 [J]. 化学研究, 2008, 19(2): 66-68.
[16] 王晓钰, 于曦, 刘海亮, 等. 升麻素对小鼠Th2型变应性接触性皮炎的影响及致敏初期启动因子的作用[A].// 中国药理学会抗炎免疫药理专业委员会第十一届全国学术会议论文集 [C]. 苏州: 中国药理学会抗炎免疫药理专业委员会, 2014.
[17] 曹纬国, 刘志勤, 邵云, 等. 黄酮类化合物药理作用的研究进展 [J]. 西北植物学报, 2003, 23(12): 2241-2247.
Influence evaluation of processing on chemical composition of Baizhu Shaoyao Powder based on UHPLC-Q-TOF-MS technique
LIU Xiao1, SUN Kan-ping1, QIN Kun-ming2, 3, JIN Jun-jie2, 3, YANG Chao1, CAI Bao-chang1, 2, 3
1. School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China 2. Nanjing Haichang Chinese Medicine Corporation, Nanjing 210061, China 3. Nanjing Haiyuan Prepared Slices of Chinese Crude Drugs Co. Ltd.,Nanjing 210061, China
UHPLC-Q-TOF-MS technology coupled with multivariate statistical analysis strategies was used to analyze the chemical composition of water decoction of Baizhu Shaoyao Powder (白术芍药散, BZSYP). Simultaneously, water decoction of this prescription composed with unprosessed herbal drugs was also tested for a purpose of comparison.Both positive and negative ion scanning modes were applied for qualitative analysis with applications of Peakview 1.2 software to identify chemical components and MarkerView 1.2.1 software to search principal components for differences.A total of 183 chemical constituents were matched. A total of 34 differential chemical constituents were found by-test, which contributed most of the differences and came fromand.The processing of herbal drugs indeed showed a significant influence on the chemical composition of BZSYP, and it is of realistic and objective reasons that BZSYP should be composed with processed herbal drugs just as recorded in the ancient literature.
Baizhu Saoyao Powder; processing; UHPLC-Q-TOF-MS; principal components analysis; water decoction;;
R284.1
A
0253 - 2670(2022)13 - 3920 - 09
10.7501/j.issn.0253-2670.2022.13.005
2021-10-21
国家自然科学基金资助项目(81873004);南京市科技计划项目(201812021)
刘 晓(1981—)女,辽宁抚顺人,博士,副研究员,主要从事中药炮制机制与功效物质基础研究。Tel: 15261873181
蔡宝昌(1952—),男,江苏南京人,博士,教授,主要从事中药饮片炮制工艺规范化研究。E-mail: bccai@126.com
[责任编辑 王文倩]

