广藿香PcHAD基因克隆及其参与广藿香醇生物合成功能分析
吴带娣,黄慧玲,单耀楷,邹 璇,龚丽珍,詹若挺, 3,陈立凯, 3*
• 药材与资源 •
广藿香基因克隆及其参与广藿香醇生物合成功能分析
吴带娣1, 2,黄慧玲1, 2,单耀楷1, 2,邹 璇1, 2,龚丽珍1, 2,詹若挺1, 2, 3,陈立凯1, 2, 3*
1. 广州中医药大学中药学院,广东 广州 510006 2. 岭南中药资源教育部重点实验室(广州中医药大学),广东 广州 510006 3. 岭南现代农业科学与技术广东省实验室茂名分中心,广东 茂名 525000
从广藿香中克隆HAD(haloacid dehalogenase)超级家族蛋白水解酶基因,验证其编码蛋白与广藿香醇合酶(patchoulol synthase,PcPTS)蛋白互作,探究其参与调控广藿香醇生物合成的作用。从广藿香转录组数据中,筛选出一条具有完整编码区并且包含HAD-like结构域的基因序列(),并对该基因进行克隆和生物信息学分析。利用qRT-PCR对的表达模式进行分析。利用酵母双杂交实验进一步验证PcHAD与广藿香PcPTS蛋白的互作情况。通过瞬时过表达,分析其对广藿香醇甲羟戊酸合成途径(mevalonate pathway,MVA)相关基因的表达以及对广藿香醇含量的影响。从广藿香中克隆得到HAD-like基因,其开放阅读框为1149 bp,编码蛋白长度为382个氨基酸,蛋白相对分子质量为43 000,且为不稳定的亲水性蛋白,亚细胞定位结果表明该蛋白定位于叶绿体。酵母双杂交实验结果表明PcHAD完整蛋白能与PcPTS完整蛋白互作,且PcHADN与PcPTSN互作。与对照组相比,瞬时过表达广藿香叶中的广藿香醇含量提高了30%,MVA途径基因包含、和在内表达量均显著上调。从广藿香中克隆得到1个与广藿香醇合酶PcPTS互作的基因,该基因在瞬时过表达后上调和MVA途径多个基因的表达量,且能够显著提高广藿香醇的含量,表明该基因可能在广藿香醇生物合成中发挥正向调控作用,为进一步揭示广藿香中HAD-PTS复合体的功能提供科学依据。
广藿香;广藿香醇;HAD;蛋白互作;合成调控;功能分析
广藿香(Blanco) Benth为唇形科刺蕊草属植物,其干燥地上部分为药用部分。广藿香作为芳香化湿药的代表之一,具有芳香化浊、开胃止呕、发表解暑的功效[1]。广藿香不仅是中成药的主要原料,也是抗病毒口服液、藿香正气水、藿香鼻炎胶囊等中成药的重要组成部分。广藿香油是广藿香提取的挥发性成分,是广藿香诸多药效的主要成分。广藿香油除了作为药用,还广泛用于轻化工业,可作为配制各种杀虫剂、定香剂和化妆护肤品等的重要原料[2-4],市场需求大,具有广阔的应用前景。虽然广藿香已在亚洲热带和亚热带地区广泛种植,如印度、马来西亚、中国和越南,但从广藿香植物中提取的广藿香油含量低(干质量比为0.54%~5.20%)且不稳定,难以满足全球市场对广藿香药材的巨大需求[5-6]。因此需要系统研究其合成积累机制,采用新的技术手段调控广藿香油含量,而利用自身代谢途径是提高广藿香油产量的有效途径。
广藿香醇(patchoulol)是广藿香油的主要成分,是1种三环倍半萜类的次生代谢化合物,是我国历版药典中用于评价广藿香药材及广藿香油质量的指标成分。在广藿香中广藿香醇主要是在甲羟戊酸途径(mevalonate pathway,MVA)进行合成,其合成主要分为3个阶段,第1个阶段是异戊烯基二磷酸酯(isopentenyl diphosphate,IPP)和二甲基烯丙基二磷酸(dimethylallyl pyrophosphate,DMAPP)的合成;在前体IPP的合成中,6种酶参与反应,包括乙酰乙酰辅酶A硫解酶(acetoacetyl-CoA thiolase,AACT)、羟基-3-甲基戊二酰辅酶A合酶(hydroxymethylglutaryl-CoA synthase,HMGS)、3-羟基-3-甲基戊二酰辅酶A还原酶(hydroxymethylglutaryl-CoA reductase,HMGR)、甲羟戊酸激酶(mevalonate kinase,MVK)、磷酸甲羟戊酸激酶(phosphomevalonate kinase,PMK)和甲羟戊酸二磷酸脱羧酶(mevalonate pyrophosphate decarboxylase,MPD),IPP和DMAPP在异戊烯基异构酶的作用下可以相互转换;第2阶段,广藿香醇直接前体的生成,法尼基焦磷酸合酶(farnesyl diphosphate synthase,FPPS)缩合IPP和DMAPP以形成法尼基焦磷酸;第3阶段,广藿香醇合酶(patchoulol synthase,PcPTS)催化法尼基焦磷酸生成广藿香醇[7-8]。根据广藿香醇的生物合成途径可知,PcPTS能直接催化法呢基焦磷酸生成倍半萜类终产物广藿香醇,是调控广藿香醇生物合成的关键,因此PcPTS功能受到了不少研究者的关注。6-丙酮酰四氢蝶呤合酶基因的克隆[9]、表达规律[10]和酶活功能[11]等已有不少报道。另外关于调控广藿香醇合酶的转录因子的研究已也取得新进展,如陈秀珍等[12]找到了调控的6个转录因子PatDREB、PatERF061和PatSWC4等,并对其功能进行了分析。黄伟展等[13]成功构建pRI101-PTS过表达载体,获得了遗传过表达广藿香植株,这些研究为探讨广藿香醇生物合成的分子调控研究奠定了基础。
绝大多数蛋白质通过配体或者以复合体的形式参与调节细胞活动,在转录、翻译、信号传递等方面发挥了关键作用,因此研究蛋白互作对理解分子调控网络至关重要。酵母双杂交是研究植物蛋白间互作非常有用的系统,是筛选和发现新互作蛋白的一项首选技术[14]。在高通量筛选和严格筛选压力的基础上,许多研究通过双杂交方法获得了候选猎物蛋白,如小麦[15]、拟南芥[16]、水稻[17]等。也有许多研究通过双杂验证2个蛋白之间的互作并明确互作结构域,如小麦[18]、番茄[19]、水稻[20]等。目前对PcPTS在萜类化合物合成途径中涉及到的蛋白尚不清楚。因此,为了进一步解析广藿香醇生物合成的分子机制,课题组前期构建了广藿香cDNA酵母文库,以PcPTS为诱饵,筛选到候选互作蛋白HAD-like蛋白PcHAD。本实验对基因进行克隆和生物信息学分析、亚细胞定位分析以及组织表达模式分析。通过酵母双杂交技术验证PcHAD蛋白与PcPTS蛋白互作,进一步利用瞬时过表达和RT-qPCR分析PcHAD蛋白对广藿香醇生物合成的调控作用。本研究揭示PcHAD参与调控广藿香醇的生物合成的分子机制,为药用植物次生代谢合成调控提供新的思路。
1 材料、试剂及仪器
1.1 材料
本研究材料广藿香采集于广州中医药大学时珍山,经广州中医药大学詹若挺研究员鉴定为唇形科刺蕊草属植物广藿香(Blanco) Benth.。繁育广藿香植物在岭南中药资源教育部重点实验室光照培养箱培养。
1.2 试剂
pLB零背景快速克隆试剂盒购自天根生化科技(北京)有限公司植物。总RNA提取试剂盒购自于上海美吉生物医药科技有限公司。反转录试剂盒、DNA胶回收试剂盒、实时荧光定量PCR试剂盒、PCR酶2×Phanta Master Mix,2×Taq Plus Master Mix II(Dye Plus)、均购自南京诺唯赞生物科技有限公司。DH5α Chemically Competent Cell,GV3101(pSoup-p19),Y2HGold Chemically Competent Cell均购自上海唯地生物科技有限公司。金担子素A(aureobasidin A,AbA)、5-溴-4-氯-3-吲哚-α--吡喃半乳糖苷(X-α-Gal)均购自上海翊圣生物科技有限公司。引物合成和基因测序由广州天一辉远基因科技有限公司完成。
1.3 仪器
电泳仪(北京六一生物科技有限公司);凝胶成像仪分析系统(广州博鹭腾仪器仪表有限公司);CFX960荧光定量PCR仪(美国Bio-Rad公司);PCR仪(杭州博日科技有限公司);激光共聚焦显微镜(蔡司ZEISS);Q Exactive mass spectrometer质谱仪(Thermo fisher公司)。
2 方法
2.1 PcHAD基因的克隆
课题组前期进行酵母双杂文库筛选得到候选互作蛋白并利用Uniprot数据库对候选互作蛋白进行注释分析,发现包含1个含HAD-like结构域的蛋白。为了进一步验证广藿香中的含HAD-like结构域的蛋白与PcPTS的蛋白互作关系,本试验利用其GenBank蛋白序列号下载蛋白氨基酸序列,利用本地Blast方法与广藿香全长转录组数据库(NCBI:PRJNA528262)进行blastp比对,选取比对分数最高(567),e值为0并具有完整编码框的基因。根据获得的候选基因序列,设计引物(表1)扩增完整编码区。
表1 基因克隆及载体构建引物序列
Table 1 Primers used for gene cloning and vector construction
基因名引物序列 (5’→3’)用途 PcHADF: ATGGTGGATTCAATTGCTGC基因克隆 R: TCACCAGAATCCATCATCATAAA PcHADF: CATGGAGGCCAGTGAATTCATGGTGGATTCAATTGCTGCAACPGADT7载体 R: GCTCGAGCTCGATGGATCCTCACCAGAATCCATCATCATAAACACCTACT PcHADNF: CATGGAGGCCAGTGAATTCATGGTGGATTCAATTGCTGCAACPGADT7载体 R: CAGCTCGAGCTCGATGGATCCACCTAACCACCCACAACCCAT PcHADCF: GCCATGGAGGCCAGTGAATTCGCTGTATTTGAGTGGGAAGGTGTPGADT7载体 R: GCTCGAGCTCGATGGATCCTCACCAGAATCCATCATCATAAACACCTACT PcPTSF: TCAGAGGAGGACCTGCATATGATGGAGTTGTATGCCCAAAGTGTTPGBKT7载体 R: GCTAGTTATGCGGCCGCTTAATATGGAACAGGGTGAAGGTACAACT PcPTSNF: TCAGAGGAGGACCTGCATATGATGGAGTTGTATGCCCAAAGTGTTPGBKT7载体 R: GGTTATGCTAGTTATGCGGCCGCGTGATGAGATGCGTATTGCTCGTAG PcPTSCF: CAGAGGAGGACCTGCATATGAAAGGCTTGCTCAAACTTGCTPGBKT7载体 R: TATGCTAGTTATGCGGCCGCAACAGGGTGAAGGTACAACTGC PcHADF: AGGACAGCCCAGATCACTAGTATGGTGGATTCAATTGCTGCA亚细胞定位载体 R: GCCCTTGCTCACCATGGATCCCCAGAATCCATCATCATAAACACC PcHADF: TTCGTGTTCTTGTCATTAATTAAATGGTGGATTCAATTGCTGCA过表达载体 R: TCAAGTTGCAGGACCGCGGCCGCTCACCAGAATCCATCATCATAAACA
提取广藿香叶片的总RNA,并反转录获得cDNA作模板,利用Vazyme高保真酶对基因进行PCR扩增。反应程序为:95 ℃、3 min;95 ℃变性15 s,56 ℃复性15 s,72 ℃延伸,33个循环;72 ℃,5 min。PCR产物利用琼脂糖凝胶电泳检测,确定扩增所得片段与预期大小一致之后,将目的基因片段纯化回收并连接到克隆载体,转化大肠杆菌DH5α,经菌落PCR鉴定后挑取阳性菌液,由广州天一辉远基因科技有限公司完成测序。
2.2 生物信息学分析
首先使用SnapGene软件将获得测序序列与原序列进行对比初步确认所获序列的正确性,然后使用生物信息分析软件和在线工具进行分析。用ORFfinder预测其编码的蛋白,利用ExPASy-ProtParam tool在工具预测编码蛋白质的理化性质,分别用SOPMA和SWISSMODEL对PcHAD蛋白的二级结构和三级结构进行预测和分析;采用Uniprot上的BLAST软件进行序列对比分析,下载序列相似性比较高的氨基酸序列利用DNA MAN进行同源对比分析。
2.3 亚细胞定位分析
采用无缝克隆的方法将去除密码子的片段克隆至载体pAN580绿色荧光蛋白(GFP)标签的N端。通过制备拟南芥原生质体,利用聚乙二醇(polyethlene glycol,PEG)介导的方法转化拟南芥原生质体[21],在激发光为470 nm的条件下使用激光共聚焦显微镜观察GFP荧光信号,分析目标蛋白的亚细胞定位情况。
2.4 表达模式分析
分别提取广藿香不同组织部位的总RNA,反转录合成cDNA,使用NCBI设计基因特异性引物(表2),进行qRT-PCR实验。以为内参,基因相对表达量以2-ΔΔCt进行计算。每个样品包含3个生物学重复和2个技术重复,利用统计学软件SPSS 20对数据进行显著性分析。
2.5 酵母双杂验证
扩增带有coRI和amHI酶切位点的和片段,分别连接至酵母表达载体pGADT7,构建重组质粒。将含有deI和otI酶切位点的和片段分别插入pGBKT7载体,获得重组质粒。将pGBKT7-PTS按照说明书方法转化Y2HGold感受态细胞,在SD/-Trp缺陷培养基生长2 d得到阳性克隆,将单克隆用100 µL ddH2O混匀,按10倍梯度再稀释3个浓度,分别点涂于SD/-Trp、SD/-Trp+X-α-Gal、SD/-Trp+X-α-Gal+AbA缺陷培养基上观察菌斑生长情况。随后分别将诱饵质粒和捕获质粒质粒共转化Y2HGold感受态细胞,待长出阳性菌落后,挑取单克隆稀释3个10倍梯度浓度点涂于SD/-Trp-Leu(DDO)、SD/-Trp-Leu-Ade-His(QDO)、SD/-Trp-Leu- Ade-His+X-α-Gal(QDO/X)、SD/-Trp-Leu-Ade- His+X-α-Gal+AbA(QDO/X/A)缺陷培养基上,30 ℃倒置培养3 d,待显菌斑。
表2 qRT-PCR引物序列
Table 2 Primer used for qRT-PCR
基因名引物序列(5’→3’)用途 Pc18SF: TCGCCGTTCGGACCAAATAA内参基因 R: CGATGGTTCACGGGATTCTGC PcHADF: CCAGAGACTTTCGGCATGGTqRT-PCR R: CCACCCACAACCCATCCTTT PcPTSF: TGGGTGCTGCTTCTCGTCCTCqRT-PCR R: TGCGTTGTGGACTTGTTTCG PcFPPSF: TGCCACTTCACCGTCGTATTqRT-PCR R: TTTCAGGCTCACCGAAGCAA PcIPPIF: AAATACGTGAATCGTGACGAGqRT-PCR R: CTTGTTTCAAAGTCCCATTC PcMVDF: AGACACCCACCAACAAGCGqRT-PCR R: CTCCTTTCCGTTGAGCCACA PcPMKF: TCGAAAGGCACCTCAAGACCqRT-PCR R: AAGCATAGCATCTCTGGCCC PcMVKF: ATGAGGTCGCTTCCATCATCqRT-PCR R: TTTCGATTGTAGCATGGCTG PcHMGRF: CACCGTCTTCTTCACGCTCTqRT-PCR R: GCGGGGAATAATGAGCGACT PcHMGSF: ACGGAGCAAGCAAAGGGAAAqRT-PCR R: TTCCAACTTCAAGGCGACCA PcAACTF: TGTGCCTCTGGAATGAAAGCAqRT-PCR R: CAGCATTCCATCAACCAGCG
2.6 在广藿香叶片中瞬时过表达PcHAD基因
采用无缝克隆的方法将克隆至pJL-TRBO载体的acⅠ和otI之间,构建烟草花叶病毒RNA介导的(Tabacco Mosaic Virus RNA-Based)植物过表达载体。以空载pJL-TRBO作为阴性对照,将构建好的pJL-HAD质粒和空载质粒转化GV3101(pSoup-p19)菌株,通过农杆菌注射法侵染广藿香叶片。注射后第3天,取侵染后的叶片进行基因表达变化(引物见表2)及挥发性成分含量的检测。每组实验进行3次重复。
2.7 广藿香挥发性成分提取与检测
取瞬时过表达后广藿香叶片在液氮下研磨成细粉,然后用正己烷提取,用气相色谱-质谱联用(GC-MS)测定广藿香挥发性成分含量[22]。
3 结果与分析
3.1 广藿香PcHAD基因的克隆和生物信息学分析
提取广藿香叶片总RNA,以反转录得到的cDNA为模板,以获得的HAD序列为模板设计引物,进行PCR扩增,获得了长度约为1100 bp的条带,测序结果表明其为1149 bp(图1-A)。利用Uniprot数据库BLAST对比分析,结果显示该序列与黄花蒿L.和紫花风铃木L.含HAD-like结构蛋白的氨基酸序列一致性性分别为80.3%和74.9%。下载一致性较高的氨基酸序列利用DNA MAN进行同源对比分析(图1-C),结果显示它们均含有1个HAD-like结构域,故将其命名为
预测编码1个包含382 aa的蛋白,相对分子质量为43 000,理论等电点(pI)为8.15,不稳定指数为46.09。编码的氨基酸序列中具有多个明显的亲水区域,大部分氨基酸属于亲水氨基酸,其合成的蛋白属于不稳定的亲水性蛋白(图1-B)。PcHAD蛋白质二级结构由4种形式组成,其中无规则卷曲(random coil)所占比例最高,为43.19%,α-螺旋(alpha helix)和延伸链(exstened strand)分别为39.53%、12.04%,β-转角占5.24%(图1-D)。以c3iruA为模体对PcHAD蛋白进行三维结构模型构建(图1-E),模型覆盖范围为132~336 aa,相似性为21%。

A-PcHAD的PCR扩增结果 B-PcHAD的亲疏水性预测 C-PcHAD与其他植物HAD-like蛋白的多序列比对分析 D-PcHAD的二级结构预测 E- PcHAD的三维结构预测
3.2 广藿香PcHAD的亚细胞定位分析
将空载pAN580和构建好的PcHAD-EGFP融合表达载体通过PEG介导的方法转化到拟南芥原生质体中,通过激光共聚焦显微镜观察到阳性对照(EGFP)在整个细胞中表达,而PcHAD-EGFP在叶绿体中呈现绿色荧光。以上结果表明PcHAD蛋白定位在叶绿体中(图2)。

EGFP-pAN580空载 GFP-绿色荧光蛋白 Chlorophyll-叶绿体自发荧光 Bright field-明场 Merge-叶绿体自发荧光、绿色荧光蛋白和明场叠加
3.3 PcHAD基因表达模式分析
利用qRT-PCR技术分析基因在广藿香叶、茎、根不同组织的表达水平。结果显示,以根为对照,在叶、茎和根中都有表达,在叶片中的表达量最高,且显著高于茎和根,表明该基因具有组织表达差异性(图3)。

*表示差异在P<0.05水平上显著
3.4 PcHAD与PcPTS的互作分析
将捕获质粒与BD-PTS共转至Y2HGold感受态细胞中,进行酵母双杂点对点验证。经检测BD-PTS无自激活活性(图4-C)。阳性对照、pGBKT7-PTS和pGADT7-HAD能在SD/-Leu/-Trp/-His/-Ade/AbA筛选平板上生长且变蓝色,而阴性对照(BD-PTS+ pGADT7)不能正常生长且变蓝色,表明PcHAD完整蛋白能与PcPTS完整蛋白结合(图4-D)。
通过Pfam网站预测结构域,发现PcHAD的HAD2_like结构域分布在134~314个氨基酸,PcPTS的Terpene_synth结构域为25~197个氨基酸,Terpene_synth_C为229~495个氨基酸。为进一步分析PcHAD与PcPTS的互作域,将PcHAD和PcPTS根据结构域进行截短(图4-D),PcHAD截短为PcHADN(1~133 aa)和PcHADC(134~382 aa,该段被预测包含HAD2-like结构域)。PcPTS截短为PcPTSN(25~225 aa)和PcPTSC(226~550 aa)2个片段,然后将PcHAD的截短蛋白分别和pGADT7连接PcPTS的截短蛋白分别和pGBKT7连接,利用酵母双杂点对点验证PcHAD截短蛋白和PcPTS截短蛋白的互作。结果表明,PcHADN与PcPTSN互作,而PcHADC与PcPTSN不互作(图4-D)

M-Marker A: 1-AD-HAD 2-AD-HADN 3-AD-HADC的菌落PCR电泳检测 B: 1-BK-PTSN 2-BK-PTS的菌落PCR C-诱饵载体的自激活检测 D-酵母双杂交结果
3.5 PcHAD瞬时过表达后对广藿香醇的合成及MVA途径相关基因表达影响分析
提取瞬时侵染后的广藿香叶片总RNA,反转录成cDNA,利用qRT-PCR分析基因的表达情况。结果表明,瞬时过表达的叶片,与CK组相比,的表达量增加约2倍,说明成功获得了瞬时过表达的广藿香株系(图5-C)。GC-MS结果显示广藿香醇的对照品保留时间为17.25 min,广藿香醇含量统计结果表明,过表达广藿香叶片的广藿香醇含量为1.580 mg/g,显著高于对照(1.212 mg/g),提高了30.3 %(图5-A、B)。
为了进一步揭示基因的功能,本研究选取了广藿香醇主要的生物合成途径即MVA途径中的9个基因,对其在瞬时过表达基因的广藿香叶片的表达进行了分析。结果如图5-C所示,发现及MVA途径的2个关键基因表达量均显著上调。
通过截短蛋白的酵母双杂交实验明确了其互作域,PcHADN与PcPTSN互作,因此,PcHAD与PcPTS蛋白的相互作用应该是由PcHAD的N端截短蛋白或是PcPTS的N端截短蛋白决定的。但PcHADN无相关结构域,推测Terpene_synth这个元件可能在PcHAD与PcPTS的结合中发挥重要作用,但是具体的作用机制还不清楚,需要进一步研究。
为了明确HAD蛋白调控广藿香醇合成的功能,构建了pJL-HAD的过表达载体进行瞬时过表达实验,发现过表达后广藿香醇的含量显著上升。另外,RT-qPCR结果表明在瞬时过表达叶片中广藿香醇合酶基因及MVA途径的和基因的表达均显著上调。据报道,类异戊二烯核心通路中的基因一旦过表达或受到抑制,将改变代谢通量,促进通路中的反馈或前馈信号,从而调节基因的上、下游表达[26]。课题组前期过表达MYB_related转录因子,该基因通过上调MVA通路中的基因表达,促进了广藿香醇的生物合成和积累[12]。因此,基因可能通过上调及MVA途径的和基因的表达促进广藿香醇的合成和积累。本研究成功克隆了,进一步验证了其编码蛋白与PcPTS蛋白的互作关系,并对其功能进行了初步分析,探究了过表达后对广藿香醇合成途径基因和广藿香醇含量的影响,为进一步揭示PcPTS及其互作蛋白在广藿香萜类生物合成调控中的作用奠定基础。后续将通过转基因等实验进一步揭示PcHAD的功能,深入了解其调节广藿香醇生物合成的分子机制。
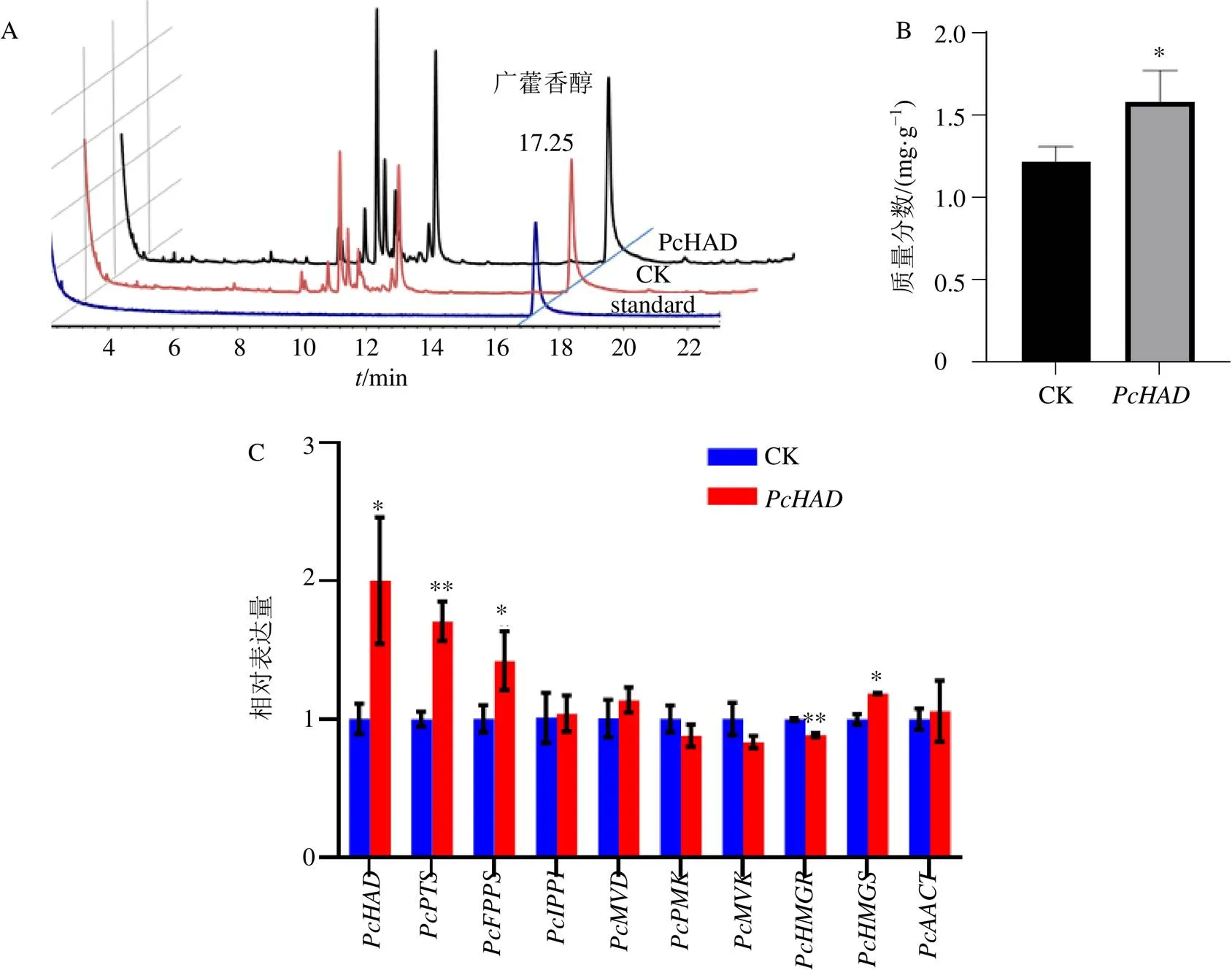
A-GC-MS色谱图 B-广藿香醇含量分析柱状图 C-及广藿香醇合成途径相关基因表达情况 CK-空载对照以18 S为内参,以空载样品为对照,采用2-△△Ct法进行相对定量计算。每组试验设3个生物学重复,Student’s t-test,与CK组比较:*<0.05、**<0.01
A-GC-MS chromatogram B-content of patchouli alcohol in leaf of transient overexpression plant C-expression levels ofand genes involved in cytosolic mevalonate (MVA) pathway in leaves of transient overexpression plant CK-control check. The relative expression level was calculated according to the expression of PcHAD at CK sample. 2-△△Ctmethod was used for relative quantitative calculation. Data are means ± SD of three independent biological replicates.Student’s-test:*< 0.05,**< 0.01 va CK group
图5瞬时转化广藿香叶片广藿香醇含量检测及RT-qPCR鉴定广藿香醇合成途径相关基因表达情况
Fig. 5 Detection of patchouli alcohol content and expression profiles ofand genes involved in cytosolic mevalonate (MVA) pathway in leaves of transient overpression plant
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 46.
[2] 曾庆钱, 蔡岳文, 严振, 等. 广藿香精油的杀虫作用及其活性成分分析 [J]. 植物资源与环境学报, 2006, 15(3): 21-25.
[3] 王玥, 郭苗苗, 施雁勤, 等. 广藿香精油抗炎祛痘功效研究 [J]. 日用化学工业, 2017, 47(5): 272-276.
[4] Deguerry F, Pastore L, Wu S Q,. The diverse sesquiterpene profile of patchouli,, is correlated with a limited number of sesquiterpene synthases [J]., 2006, 454(2): 123-136.
[5] Swamy M K, Sinniah U R. Patchouli (Benth.): Botany, agrotechnology and biotechnological aspects [J]., 2016, 87: 161-176.
[6] van Beek T A, Joulain D. The essential oil of patchouli,: A review [J]., 2018, 33(1): 6-51.
[7] Newman J D, Chappell J. Isoprenoid biosynthesis in plants: Carbon partitioning within the cytoplasmic pathway [J]., 1999, 34(2): 95-106.
[8] Yang L, Yang C Q, Li C Y,. Recent advances in biosynthesis of bioactive compounds in traditional Chinese medicinal plants [J].(), 2016, 61: 3-17.
[9] Deguerry F, Pastore L, Wu S Q,. The diverse sesquiterpene profile of patchouli,, is correlated with a limited number of sesquiterpene synthases [J]., 2006, 454(2): 123-136.
[10] 刘璐, 吴友根, 于靖, 等. 广藿香中PTS基因不同时间点的表达分析 [J]. 热带生物学报, 2016, 7(1): 89-91.
[11] Frister T, Hartwig S, Alemdar S,. Characterisation of a recombinant patchoulol synthase variant for biocatalytic production of terpenes [J]., 2015, 176(8): 2185-2201.
[12] 陈秀珍. 广藿香醇生物合成途径中转录因子对PatPTS的调控机制研究 [D]. 广州: 广州中医药大学, 2020.
[13] 黄伟展, 胡贞贞, 卢昌华, 等. 广藿香PTS基因的克隆及CPEC法构建其过表达载体pRI101-PTS [J]. 广东药科大学学报, 2019, 35(2): 186-192.
[14] 徐重益. 植物中验证蛋白相互作用的Pull-down和Co-IP技术 [J]. 植物学报, 2020, 55(1): 62-68.
[15] Jiang W H, Liu T X, Nan W Z,. Two transcription factors TaPpm1 and TaPpb1 co-regulate anthocyanin biosynthesis in purple pericarps of wheat [J]., 2018, 69(10): 2555-2567.
[16] 訾亮, 洪灏, 翟金玲, 等. 拟南芥NiNJA基因酵母双杂诱饵载体构建及互作蛋白的筛选 [J]. 热带生物学报, 2013, 4(1): 31-35.
[17] 孔兰, 王锋, 蔡正正, 等. 酵母双杂交筛选水稻OsJAG互作蛋白 [J]. 基因组学与应用生物学, 2019, 38(10): 4572-4579.
[18] 刘丽. 小麦两个蛋白激酶MAPK1、W55a基因的表达特性及功能鉴定 [D]. 杨凌: 西北农林科技大学, 2008.
[19] 何洁. 番茄SlMPK1的互作蛋白筛选及初步功能分析 [D]. 扬州: 扬州大学, 2016.
[20] 王亚楠. 水稻OsVDAC3及其互作蛋白亚细胞定位和功能初步分析 [D]. 武汉: 中南民族大学, 2019.
[21] Yoo S D, Cho Y H, Sheen J.mesophyll protoplasts: A versatile cell system for transient gene expression analysis [J]., 2007, 2(7): 1565-1572.
[22] Chen X Z, Li J R, Wang X B,. Full-length transcriptome sequencing and methyl jasmonate-induced expression profile analysis of genes related to patchoulol biosynthesis and regulation in[J]., 2019, 19(1): 266.
[23] Burroughs A M, Allen K N, Dunaway-Mariano D,. Evolutionary genomics of the HAD superfamily: Understanding the structural adaptations and catalytic diversity in a superfamily of phosphoesterases and allied enzymes [J]., 2006, 361(5): 1003-1034.
[24] Chin T, Okuda Y, Ikeuchi M. Improved sorbitol production and growth in cyanobacteria using promiscuous haloacid dehalogenase-like hydrolase [J]., 2019, 306S: 100002.
[25] Burroughs A M, Allen K N, Dunaway-Mariano D,. Evolutionary genomics of the HAD superfamily: Understanding the structural adaptations and catalytic diversity in a superfamily of phosphoesterases and allied enzymes [J]., 2006, 361(5): 1003-1034.
[26] THOLL D.[M]. Cham: Springer International Publishing, 2015: 63-106.
Cloning ofgene fromand functional analysis of its involvement in biosynthesis of patchouli alcohol
WU Dai-di1, 2, HUANG Hui-ling1, 2, SHAN Yao-kai1, 2, ZOU Xuan1, 2, GONG Li-zhen1, 2, ZHAN Ruo-ting1, 2, 3, CHEN Li-kai1, 2, 3
1. School of Chinese Materia Medica, Guangzhou University of Chinese Medicine, Guangzhou 510006, China 2. Key Laboratory of Chinese Medicinal Resource from Lingnan, Ministry of Education, Guangzhou University of Chinese Medicine, Guangzhou 510006, China 3. Maoming Branch, Guangdong Laboratory for Lingnan Modern Agricultural Science and Technology, Maoming 525000, China
gene of HAD (haloacid dehalogenase) superfamily protease was cloned from Guanghuoxiang (), and its coding protein interaction with patchoulol synthase (PTS) protein was verified to explore its role in regulating the biosynthesis of patchouli alcohol.In this study, agene sequence () with complete coding region and HAD-like domain was screened fromtranscriptome data for cloning and bioinformatics analysis. The tissue expression pattern ofwas analyzed by RT-qPCR. The yeast two-hybrid experiment was used to verify the interaction between PcHAD and PcPTS protein. Transient overexpression ofwas used to analyze the effect ofon the expression of genes related to the MVA pathway and the content of patchouli alcohol.The HAD-like genewas cloned from. Its open reading frame was 1149 bp, encoding 382 amino acids, and the molecular weight of the protein was 43 000. It was an unstable hydrophilic protein and subcellularly localized in the chloroplast. In the yeast two-hybrid assay, the PcHAD protein can not only interact with the PcPTS protein, but also with PcPTSN. After transient overexpression of, the content of patchouli alcohol was increased by 30% compared with the control group, and the expression of genes on the MVA pathway including,andwere significantly up-regulated.In this study,gene that interacts with patchoulol synthase PcPTS was cloned from. Transient overexpression ofcan increased the content of patchouli alcohol and the expression levels ofand genes involved in the MVA pathway, suggesting that this gene may play a positive role in the biosynthesis of patchouli alcohol. These results provided scientific basis for further research on the function of HAD-PTS complex in
(Blanco) Benth.; patchouli alcohol; HAD; protein-protein interactions; synthesis regulation; function analysis
R286.12
A
0253 - 2670(2022)13 - 4100 - 09
10.7501/j.issn.0253-2670.2022.13.023
2021-11-03
国家自然科学基金资助项目(81803657);广东省自然科学基金资助项目(2019A1515011542);广东省重点领域研发计划(2020B020221001)
吴带娣(1995—),女,硕士研究生,研究方向为药用植物萜类活性成分遗传调控。E-mail: 1753931835@qq.com
陈立凯(1986—),男,博士,副研究员,博导,主要从事中药资源利用与药效成分的遗传调控。E-mail: chenlk@gzucm.edu.cn
[责任编辑 时圣明]

