生物炭对烟草幼苗氯化钠胁迫的缓解效应
刘晓涵,刘晓晖,郑好,荆永锋,周文辉,余海涛,钱华,叶协锋
生物炭对烟草幼苗氯化钠胁迫的缓解效应
刘晓涵1,2,刘晓晖3,郑好4,荆永锋5,周文辉5,余海涛5,钱华5,叶协锋1*
1 河南农业大学烟草学院,国家烟草栽培生理生化研究基地,烟草行业烟草栽培重点实验室,郑州 450002;2 广东省韶关烟叶复烤有限公司,韶关 512000;3 深圳烟草工业有限责任公司,深圳 518000;4 武汉乐道物流有限公司,武汉 430000;5湖南中烟工业有限责任公司,长沙 410000
【】研究外源添加生物炭对烟苗NaCl胁迫的缓解作用。【】以烤烟品种K326为供试材料,通过盆栽试验,施用150 mmol/L NaCl溶液进行盐胁迫,设置0、10、20和30 g/kg生物炭添加量,以不加盐和生物炭为对照(CK),通过检测烟株生物量、水分含量、抗逆生理指标及矿质元素含量等,明确生物炭对烤烟盐胁迫的缓解作用。【】盐胁迫导致烟株发育迟缓,叶片含水率降低,自由水与束缚水比值降低,添加20~30 g/kg生物炭可显著提高烟株干鲜重,提高叶片的相对含水率,提高自由水与束缚水的比值。在同一时期,盐胁迫下添加20 g/kg生物炭可显著提高叶片叶绿素a、叶绿素b含量和叶绿素总量;而添加30 g/kg生物炭显著降低了丙二醛(MDA)和H2O2含量;同时,盐胁迫增加了叶片超氧化物歧化酶(SOD)和过氧化物酶(POD)活性,加入生物炭后SOD和POD酶活性显著降低。与CK相比,盐胁迫下烟株地上部Ca2+、K+和Mg2+含量分别下降34.36%、15.04%和11.37%,Na+含量增加542.90%,而在移栽后75 d,添加30 g/kg生物炭烟株地上部Ca2+含量增加34.05%,Na+含量降低54.99%。【】外源添加生物炭可以改善盐胁迫下烟草叶片水分状况、促进根系发育和烟株生物量积累,缓解由盐胁迫导致的活性氧增多引起的膜脂过氧化反应,调节烟株地上部的离子平衡,本研究中以添加20~30 g/kg生物炭对150 mmol/L NaCl胁迫下烟草生长的缓解效果较好。
NaCl;烟草;生物炭;盐胁迫
随着现代农业的发展,由人类活动导致的土壤盐渍化现象正在逐步加重,据FAO数据显示,超过3.97亿公顷土地的农业生产受到盐渍化影响[1],作物产量远低于其遗传潜力[2-3]。研究表明,高浓度的盐分会影响植物的生理稳态,干扰植物的光合能力、渗透平衡、离子吸收、蛋白和核酸合成、酶活性、有机溶质积累和激素平衡[4-5]。更甚者,盐分会抑制根系伸长,扰乱植物的吸水能力,进而影响生态系统养分循环[6-7]。数据统计显示,盐渍化土壤每公顷平均损失3.47 t土壤有机碳,这不仅影响土壤肥力,也对全球气候也产生一定影响[8]。因此对盐渍土壤的研究越来越受重视,2018年与盐渍化有关的文章较2004年增加了4倍[9]。
生物炭是指废弃的有机物经厌氧热解后形成的难溶性、高度芳香化、非常稳定、富含碳素的固态物质,生物炭通过提高植物的养分利用率、改善土壤物理和生物学特性来促进植物生长[10],进而提高作物在盐胁迫条件下的产量[11]。Akhtar等[12]研究表明,生物炭可以吸附土壤中Na+、增加马铃薯木质部的K+含量,进而缓解盐胁迫,提高马铃薯块茎产量。大量研究表明,生物炭一方面通过吸附作用缓解盐渍化引起的危害[11,13],另一方面通过减轻氧化应激,保护植物免受盐胁迫[14]。迄今为止,有关生物炭在烟草幼苗耐盐方面的作用尚未见报道。因此,本研究旨在探讨盐胁迫下生物炭对烟草生长发育及抗逆指标等的影响,以期为生物炭在调控盐渍化土壤的应用提供参考。
1 材料与方法
1.1 试验材料
试验于2019年5—9月在河南农业大学国家烟草栽培生理生化研究基地进行,供试品种为烤烟K326(玉溪中烟种子有限公司);盆栽土壤为丹麦品氏托普泥炭土(pH 5.5~6.0,全氮0.881%,全磷0.046%,全钾0.325%);试验用盆为塑料盆(上口直径为17.5 cm,下口直径为12.5 cm,高度为16.0 cm);生物炭用烟秆炭(pH 8.97,全碳67.65%,全氮1.44%,全磷1.00%,全钾8.19%,阳离子交换量85.65 cmol·kg-1,BET比表面积6.072 m2·g-1,平均孔径为2.769 nm,贵州金叶丰农业科技有限公司);烟草专用复合肥N:P2O5:K2O=8:12:20(许昌科宏工贸有限公司)。
1.2 试验方法
1.2.1 烟苗培养与试验设计
通过0~250 mmol/L NaCl胁迫预试验,摸索出半致死浓度(引起烟草幼苗根长下降50%的NaCl浓度)为150 mmol/L,作为NaCl胁迫浓度展开后续试验。试验在人工培养架上进行,控制条件为光照时长14 h/d,温度23℃±3℃,相对湿度为60%~70%。采用漂浮育苗,培养至苗龄45 d,挑选长势一致的烟苗用于试验(叶片数4~5片,移栽日期为6月5日)。试验设置CK(不加盐和生物炭处理)、T1(150 mmol/L NaCl)、T2(10 g/kg生物炭+150 mmol/L NaCl)、T3(20 g/kg生物炭+150 mmol/L NaCl)、T4(30 g/kg生物炭+150 mmol/L NaCl)共5个处理,每个处理培育45株烟苗。在移栽前将生物炭(过20目筛)、肥料(每盆施纯氮2 g,即烟草专用复合肥25 g)和NaCl(溶水)按处理要求与泥炭土混匀后装入盆中(每个盆单独混匀)。每个盆中装泥炭土350 g(以干基计重,泥炭土平均含水率为53.24%,换算为湿基重量为650 g),自烟苗移入盆当天计时为第0 d。各处理每周浇水1~2次,浇水量保持一致。
1.2.2 农艺性状的测定
选取5株有代表性的烟株标记定株,分别于移栽后30 d、45 d、60 d和75 d测量记录烟株的最大叶长、最大叶宽和叶片数(大于2 cm)。
1.2.3 叶片水分含量的测定
水分含量的测定采用快速称重法[15]。分别于移栽后30 d、45 d、60 d和75 d,每个处理取3株长势一致的烟株,取生长点下第3片完全展开功能叶,称取质量(m1),然后浸泡于4℃蒸馏水中,放置于黑暗环境5 h,取出,擦干叶片表面水分后,称其质量(m2)。随后,将此叶片转入4℃ 65%蔗糖溶液中,黑暗处放置5 h后,取出叶片,用蒸馏水洗净、擦干,立即称其质量(m3)。最后将叶片于75℃下烘干,称其质量(m4),每组处理重复3次。水分含量计算公式如下:
自由水含量(%)=(m1-m3)/m1×100
总含水量(%)=(m1-m4)/m1×100
束缚水含量(%)=总含水量/%-自由水含量/%
相对含水量(%)=(m1-m4)/(m2-m4)×100
水分饱和亏(%)=(m2-m1)×100/(m2-m4)
1.2.4 烟株鲜干重的测定
各处理于移栽后30 d、45 d、60 d和75 d,分别取3株长势一致的烟株,用自来水洗净后再用去离子水冲洗数遍,晾干后称鲜重,在105℃下杀青15 min,于85℃烘干至恒重,称量干重。
1.2.5 根系特征的测定
在移栽后30 d、45 d、60 d和75 d,各处理分别取3株长势一致的烟株,冲洗根系以去除粘附的基质及其他表面杂物,尽可能保持完整性,利用扫描仪(Epson Perfection V800 Photo)扫描根系图像,再用Win RHIZO 2007根系分析软件(Regent Instruments Inc8,Canada)分析根系形态学参数。
1.2.6 叶绿素含量的测定
移栽后30 d、45 d、60 d和75 d,各处理分别取3株长势一致的烟株,取生长点下第3、4片叶(自大于2 cm的叶片开始计数)剪碎混匀后测定叶绿素含量。叶绿素测定采用酒精提取研磨法[16]。
1.2.7 生理指标的测定
移栽后30 d、45 d、60 d和75 d,各处理分别取3株长势一致的烟株,取所有叶片冻存,过氧化物酶(POD)、超氧化物歧化酶(SOD)活性和H2O2、丙二醛(MDA)、还原型谷胱甘肽(GSH)含量均使用试剂盒测定(苏州科铭生物技术公司)。
1.2.8 地上部K、Na、Ca、Mg含量的测定
将1.2.4的地上部样品磨碎,过20目筛,采用GB5009.15—2014中干法灰化法提取K、Na、Ca、Mg,并通过ICP-OES电感耦合等离子原子发射光谱仪测定其含量。
1.3 数据分析
采用Excel 2017进行数据处理,SPSS22.0进行分析及差异显著性检验。
2 结果与分析
2.1 生物炭对烟草植物学性状和干鲜重的影响
如表1所示,随着生育期的延长,最大叶长均呈增加趋势。移栽后30 d,T1处理与其他4个处理差异显著,其中CK最大叶长最大,为13.50 cm,T1处理最大叶长最小,为8.83 cm,添加生物炭的处理最大叶长均大于T1处理,且与CK差异不显著;移栽后45 d,各处理最大叶长表现为:CK>T4>T3>T2>T1;移栽后75 d,T1处理的最大叶长最小,仅为CK的61.02%。最大叶宽表现为移栽75 d,T4处理最大,与其他处理差异显著。
随着生育期延长,各处理叶片数持续增加。移栽后30 d,T1处理仅有6片叶,其余处理均为8片;移栽45~60 d,NaCl逐渐表现出对叶片发育的抑制作用,CK和T4处理与其他3个处理差异显著,表现为:CK>T4>T3>T1>T2;移栽后75 d,生物炭表现出缓解效果,其中T3处理有效叶数达到17.33片。
表1 不同用量生物炭对盐胁迫下烟草植物学性状的影响

Tab.1 Effects of different doses of biochar on tobacco botanical traits under salt stress
注:同列数据后标有不同小写字母者表示组间差异达到显著水平(),下同
Note: the data in the same column marked with different lowercase letters means that the difference between groups has reached a significant level (), the same as below
由图1可以看出,烟株的干重和鲜重变化趋势相同。移栽后30 d,CK的干鲜重最大,分别为0.97 g和19.81 g;移栽后60 d,烟株干鲜重表现为CK>T4> T3>T1>T2;移栽后75 d,T4处理烟株干鲜重与CK相比无明显差异。综合来看,添加生物炭对盐胁迫下烟株叶片生长和干物质积累有较好的促进作用,可缓解盐胁迫对烟草生长造成的抑制作用。

图1 不同用量生物炭对盐胁迫下烟株干鲜重的影响
2.2 生物炭对盐胁迫下烟叶水分含量的影响
生物炭对盐胁迫下烟叶水分影响如表2所示。各处理总含水量差异不显著,T1处理的总含水量最小,T3处理的总含水量最大。相对含水量的数值波动幅度比总含水量大,但整体趋势一致,各处理差异不显著。水分饱和亏能表现出植物组织间的水分亏缺程度[17],水分饱和亏越高表明植株需水越多。移栽后30 d,T4处理与CK、T1和T2处理差异显著,移栽后60 d和75 d,添加NaCl的处理间差异不显著,与CK差异显著。自由水/束缚水整体表现为CK与T3处理无显著差异(45 d除外);移栽后75 d,各处理表现为CK>T3>T2>T4>T1。以上结果表明,150 mmol/L NaCl会影响烟草叶片内的水分调控,盐胁迫下烟株更为缺水;添加生物炭可缓解烟草叶片的缺水状况,但为了抵御盐胁迫烟株表现出更强烈的需水要求,需水量较正常处理有所增加。
表2 不同用量生物炭对盐胁迫下烟叶含水率的影响

Tab.2 Effects of different amounts of biochar on tobacco moisture content under salt stress
续表2

处理时间(Treatment time)/d处理Treatment总含水量(total water content)/%相对含水量(Relative water content)/%水分饱和亏(Water saturation deficit )/%自由水/束缚水Free water/bound water 45CK86.84±0.43a84.06±0.73 a15.94±0.73 a0.82±0.30 a T185.89±0.80 a80.68±1.39 a18.85±1.39 a0.21±0.10 c T286.79±1.36 a81.15±2.38 a18.31±2.38 a0.49±0.14 b T388.25±6.53 a83.93±0.88 a19.03±0.88 a0.65±0.08 b T486.36±1.49 a82.21±1.97 a17.79±1.97 a0.63±0.15 c 60CK86.87±1.16 a85.72±6.36 a14.96±6.35 b0.73±0.14 a T184.20±0.63 a82.61±0.65 a16.39±0.65 a0.22±0.06 c T285.90±0.63 a84.04±1.28 a16.13±1.28 a0.51±0.11 b T386.68±1.55 a87.96±2.23 a18.07±2.23 a0.58±0.02 ab T484.46±0.89 a83.18±2.38 a16.82±2.38 a0.60±0.24 c 75CK86.51±0.58 a85.77±1.59 a14.23±1.59 b0.65±0.01 a T184.15±0.99 a81.76±1.07 a17.24±1.07 a0.29±0.04 c T285.80±2.40 a83.28±1.82 a15.72±1.82 a0.41±0.04 b T388.07±0.93 a85.27±2.11 a17.73±2.11 a0.69±0.06 a T484.72±0.27 a81.66±1.55 a16.34±1.55 a0.54±0.01 b
2.3 生物炭对烟株根系发育的影响
图2为移栽75 d时各处理烟草根系状况,T1处理烟株根系发育最弱,生物炭可以有效缓解盐胁迫对根系的抑制,且生物炭用量越多,根系发育越好。

图2 不同用量生物炭对盐胁迫下烟草根系的影响
如图3所示,各处理根长随处理时间延长逐渐增加。移栽后45~60 d,CK、T3和T4处理根长增长速率较大,而T1和T2处理根长增长缓慢;移栽后75 d,各处理根长表现为T4>CK>T3>T2>T1,此时T4、T3处理的根长分别为T1处理的2.34倍和1.72倍。根表面积和根体积的变化趋势相似,表现为随着时间延长,根表面积和根体积增大,其中T1和T2处理增长速率较小,其他处理增长速率较大,在移栽后75 d,T4处理的根表面积是T1处理的2.92倍,各处理根表面积为CK>T4>T3>T2>T1,根体积为T4>CK>T3>T2>T1。各处理根系平均直径随时间增加先降低后升高,这可能是因为前期根系数量虽然较多,但以细根为主,随着烟株的生长,根系逐渐开始增粗生长,其中T3处理的根系平均直径最大。根尖数以CK相对较多,添加NaCl抑制了根尖数目的增长趋势;施用生物炭可有效促进盐胁迫下烟株新根数目的增多,促进效果表现为T4>T3>T2,其中T4处理的根尖数在移栽75 d后为处理T1的2.03倍。
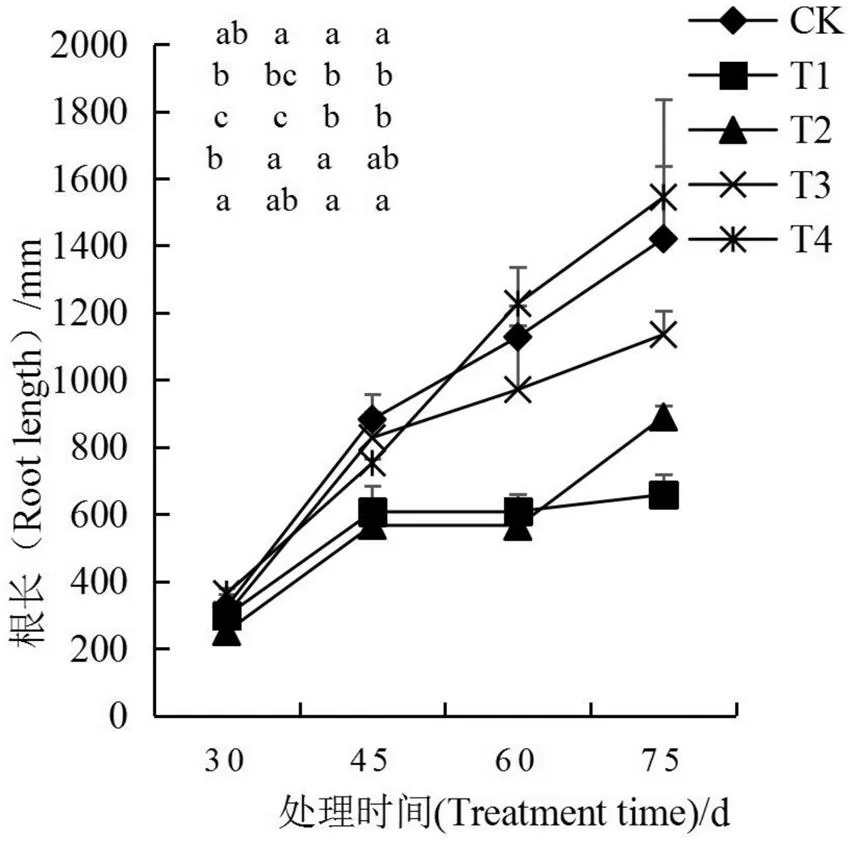
2.4 生物炭对盐胁迫下烟叶叶绿素含量的影响
由图4可知移栽30 d后,T2处理叶绿素a含量最高,为1.45 mg/g,与其他处理差异显著;移栽后45 d和60 d时T3处理叶绿素a含量最大,75 d时T2、T3、T4处理差异不显著。移栽后30 d各处理叶绿素b含量变化趋势与叶绿素a相似;移栽后60 d时T3处理叶绿素b含量最高;移栽后75 d,T3处理叶绿素b含量较CK高0.23 mg/g,与其他处理差异显著。总叶绿素含量变化趋势与叶绿素b相似,移栽后30 d时T2处理总叶绿素含量最高,为2.04 mg/g;45~75 d,T3处理叶绿素含量最高,在75 d时达到0.81 mg/g;在整个处理期间,T1处理的总叶绿素含量始终大于CK。

图4 不同用量生物炭对盐胁迫下叶片叶绿素含量的影响
2.5 生物炭对盐胁迫下叶片MDA、H2O2含量的影响
从图5可以看出,T1处理叶片MDA含量总是保持较高水平,在移栽后75 d达到最高值,为17.89 nmol/g。添加生物炭的处理中,T3处理叶片MDA含量较高。添加生物炭可降低叶片H2O2含量,且生物炭用量不同,降低效果不同。T1处理叶片H2O2含量始终维持在较高水平;移栽后75 d,盐胁迫处理中,T4处理的H2O2含量最低,为2.90 μmol/g,是T1处理的62.6%。

图5 不同用量生物炭对盐胁迫下烟草丙二醛、H2O2含量的影响
2.6 生物炭对盐胁迫下叶片POD、SOD活性和GSH含量的影响
对POD活性分析发现(图6),移栽后30d,CK的POD活性最低,为3898.46 U/g F.W,而添加NaCl的处理POD活性较高,在6900~8100 U/g F.W;移栽后45 d,T1和T3处理的POD活性与T2和T4处理差异显著;移栽后75 d,T1处理的POD活性最高。SOD活性的变化规律与POD稍有不同,在移栽后30 d,SOD活性表现为T1>T4>T3>T2>CK;在移栽45~75 d,T1处理的SOD活性最高,为CK的2.81倍,T2处理的SOD活性最低,仅为87.52 U/g F.W;添加生物炭的处理,在移栽45 d和75 d处理间差异显著。对各处理的GSH含量分析,其中CK的GSH含量一直保持较低值,在0.11~0.17 μmol/g;而添加NaCl的处理GSH含量均较高,在移栽后30 d,T1处理的GSH含量最高,为0.84 μmol/g;在移栽30~60 d,添加生物炭处理与T1处理差异不显著,但在移栽后75 d时,T2、T4处理与T1、T3处理差异显著。表明150 mmol/L NaCl可提高烟草叶片的POD和SOD酶活性,增加GSH含量,在盐胁迫基础上添加生物炭可降低POD和SOD酶活性,但对GSH含量无较大影响。

2.7 生物炭对盐胁迫下烟株地上部钾、钠、钙、镁含量的影响
由图7可知,随着烟株的生长发育,K+含量不断增加(T1处理除外),移栽后45 d时CK的K+含量达到最高值,为113.19 g/kg,T3和T4处理K+含量与其他处理差异显著;移栽后75 d,各处理K+含量差异显著。Na+含量变化与K+含量相反,CK的Na+含量变化较小;移栽后45 d,各处理Na+含量差异显著,随着处理时间增加,T1处理Na+含量逐渐增加,与其他处理呈显著差异,在移栽75 d达到最大值8.91 g/kg,为CK的6.43倍,在移栽后75 d各处理Na+含量为T1>T4>T3>T2>CK。
随着时间延长CK的Ca2+和Mg2+含量呈波动增加趋势,而T1处理Ca2+和Mg2+的积累较CK大幅度降低,移栽后75 d,分别较CK降低11.60 g/kg和0.53 g/kg;添加生物炭对Ca2+和Mg2+的影响并不一致,T4处理的Ca2+含量随处理时间增加呈缓慢增加趋势,在移栽后75 d较T1处理增加7.54 g/kg,T2处理则呈降低趋势。移栽后75 d,CK的Mg2+含量最高,为4.63g/kg ,T3和T4处理Mg2+含量随时间增加呈降低趋势。
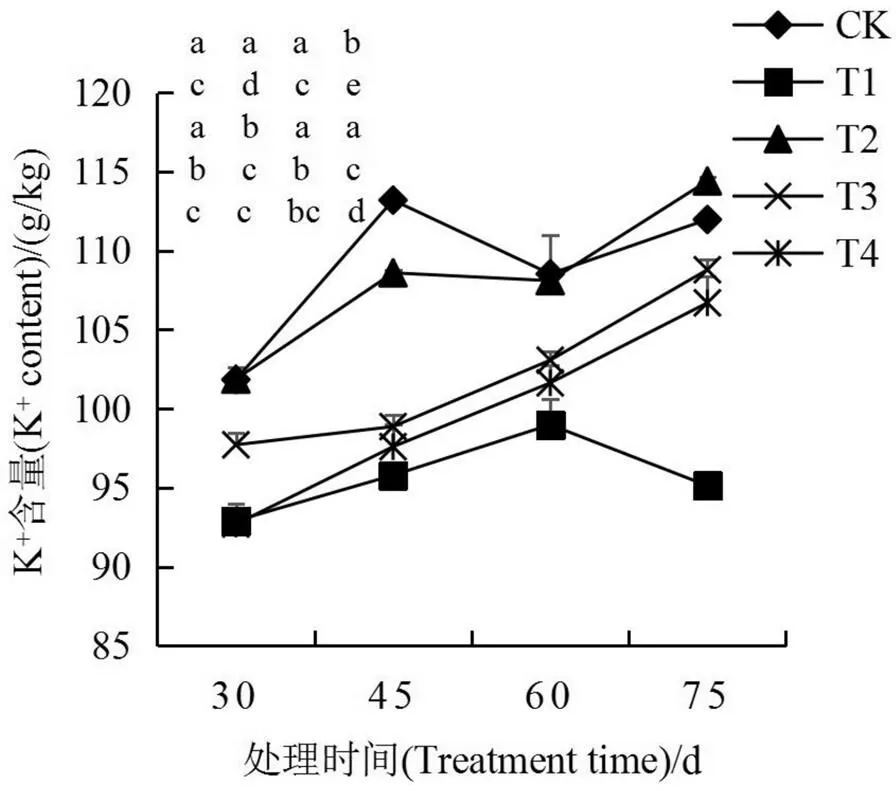
3 讨论
盐渍土壤的Na+含量较多,会与土壤颗粒相互作用形成坚硬的梭状结构[18],同时高浓度的Ca2+和Mg2+也会让土壤小颗粒趋于紧实,破坏土壤孔隙结构,抑制水分渗透,减少根系获得氧气的能力,影响植物根系的生长和深扎,不利于植物对水分和养分的吸收运输[18-19]。添加生物炭可以改良土壤理化性质,疏松土壤,缓解盐渍土壤对植物根系发育造成的抑制作用[20-21]。在逆境条件下,应用生物炭可以促进植物对养分的吸收,进而增加生物量[12-13,22],本研究结果也证实了该结论,在盐胁迫条件下添加生物炭可以促进叶片的伸展、促进有效叶数增加及根系发育,用量不同其促进效果不同。这可能是由于生物炭的多孔性、巨大的比表面积以及丰富的含氧官能团,使生物炭具有较强的吸附作用,当生物炭施入土壤中,能够吸附土壤中的Na+,减少Na+与根表面的接触;另一方面可以降低土壤容重从而减少根系下扎阻力,促进根系发育[23],使得根系对水分和养分的吸收和运输能更好的进行。
与盐胁迫相比,添加20 g/kg生物炭,烟叶的叶绿素含量增加。根据Kanwal[24]的研究可知生物炭可以促进小麦叶绿素含量增加,这与本研究结果一致,分析表明添加生物炭后根系发育得到促进,从而吸收更多的氮素以供叶片合成叶绿素[21],促进植物的光合作用,增加烟株的生物量。
盐胁迫会导致植物体内活性氧的过量产生,为减轻胁迫,植物进化出一套完整的活性氧清除系统[25]。本试验结果指出在150 mmol/L NaCl处理下,叶片MDA和H2O2含量都呈增加趋势;在处理前期,添加生物炭会降低烟株体内MDA含量,但随着时间延长,MDA含量又呈增加趋势,可能是因为生物炭对Na+和Cl-的吸附有一个动态平衡过程,当生物炭的离子吸附达到峰值后逐渐趋于平衡,之后又对烟株生长产生了不同程度的胁迫,因生物炭用量不同其对Na+和Cl-的吸附量也不同,导致了不同处理间MDA含量变化的差异。添加生物炭可以调节植物体内抗氧化酶的合成来缓解植物体内的盐胁迫[26],Kim等[13]指出与对照相比,生物炭的施用降低了盐胁迫下玉米抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)的活性,改善了玉米在盐胁迫下的生长和生物量。本结果表明在盐胁迫下添加生物炭可以降低SOD和POD的活性,但对GSH含量影响不大,这表明应用生物炭提高植物抵御氧化应激的能力可能更多通过提高酶促反应完成,且其效果存在剂量效应。
本试验结果表明,随盐胁迫时间延长,Na+含量增加,Ca2+和Mg2+含量变化幅度相对较小,添加生物炭后,烟株地上部K+含量增加,Na+含量降低,这与生物炭可以通过直接或间接作用对植物体内离子含量进行调节以适应植物正常生长有关,Cheng[27]、Enders[28]和Peng[29]等指出生物炭通过对土壤矿质元素的吸附和活化,从而向植物提供矿质养分,如P、K、Ca、Mg、S等;生物炭的多孔性和吸附性可有效降低土壤中Na+含量,降低根际土壤Na+浓度,从而有效缓解根系附近Na+浓度过高的问题,对维持盐胁迫下植物体内的离子稳态存在有益作用;通过对盐渍土的淋洗试验表明,生物炭对土壤中不同离子的淋洗效果有较大差 异[30],同时,不同种类的生物炭其表面含氧官能团差异较大,对某些特定离子的吸附性能也存在差异,这可能是导致添加生物炭后Ca2+含量增加、Mg2+含量减少的原因。
在盐胁迫条件下,烤烟受到的负面影响主要是渗透效应、离子毒性和降低水分可用性,而生物炭具有良好的孔隙特性和吸附性能,在疏松土壤、促进烟草根系生长的同时,可有效吸附土壤溶液中的Na+和Cl-,降低其有效性,缓解对烟草的离子毒性,此外生物炭还可提高烟草的氮肥利用率。因此,生物炭对烟草幼苗受到的盐胁迫的缓解作用主要表现为施用生物炭促进了烟草根系发育,烟株可以从土壤中吸收更多的水分和养分以供应地上部的生长,促进烟株的干物质积累,提升烟株体内的抗氧化酶系统能力,从而缓解盐胁迫,改善生长状况。
4 结论
不同用量生物炭对盐胁迫下烟苗生长有不同程度的缓解作用,其中30 g/kg生物炭处理对烟株的叶片发育、根系生长有较好的促进作用;20 g/kg生物炭处理可以促进烟叶对水分的保持和叶绿素的合成;30 g/kg生物炭对降低由盐胁迫诱导的MDA和H2O2含量的增加有良好效果,且能有效降低SOD和POD的活性,活性氧清除效果较好,同时提高烟株对K+的吸收,抑制对Na+的吸收。综合评价,生物炭用量为20~30 g/kg时可有效缓解盐胁迫对烟株生长的抑制。
[1] FAO.Global network on integrated soil management for sustainable use of salt-affected soils.2005.Available online at: http://www. fao.org/ag/agl/agll/spush.
[2] Siddiqui M H, Mohammad F, Khan M N. Morphological and physio-biochemical characterization ofLCzern. & Coss. genotypes under salt stress[J]. Journal of Plant Interactions, 2009, 4(1): 67-80.
[3] Siddiqui M H, Mohammad F, Khan M N , et al. Nitrogen in relation to photosynthetic capacity and accumulation of osmoprotectant and nutrients ingenotypes grown under salt stress[J]. Agricultural Sciences in China, 2010, 9(005): 671-680.
[4] Siddiqui M H, Mohammad F, Khan M M A,et al. Cumulative effect of nitrogen and sulphur onL. genotypes under NaCl stress[J]. Protoplasma, 2012, 249(1): 139-153.
[5] Bhaskar, Gupta, Bingru, et al. Mechanism of salinity tolerance in plants: physiological, biochemical, and molecular characterization [J]. International journal of genomics, 2014(1):701596.
[6] Dowse R, Palmer C G, Hills K,et al. The mayfly nymphHarker defies common osmoregulatory assumptions[J]. Royal Society,open sci., 2017(4): 160520.
[7] East J L, Wilcut C, Pease A A . Aquatic food-web structure along a salinized dryland river[J]. Freshwater Biology, 2017, 62(4): 681-694.
[8] Setia R, Gottschalk P , Smith P,et al. Soil salinity decreases global soil organic carbon stocks[J]. Science of The Total Environment, 2012, 465(6): 267-272.
[9] Samir Rafla. Web of science-clarivate analytics-2019 journal citation report. October 2020.
[10] 曹志洪. 生物炭与污染土壤修复及烟草行业的研发进展[J]. 中国烟草学报,2019, 25(3): 12.
CAO Zhihong. Biochar and soil remediation technologies and their research development in tobacco industry[J]. Acta Tabacaria Sinica, 2019, 25(3): 1-12.
[11] Thomas SC, Frye S, Gale N,et al. Biochar mitigates negative effects of salt additions on two herbaceous plant species[J]. Journal of Environmental Management, 2013(129): 62-68.
[12] Akhtar SS, Andersen MN, Liu F. Biochar mitigates salinity stress in potato[J]. Journal of Agronomy and Crop Science , 2015(201): 368-378.
[13] Kim HS, Kim KR, Yang JE,et al. Effect of biochar on reclaimed tidal land soil properties and maize (L) response[J]. Chemosphere, 2016(142): 153-59.
[14] Farhangi-Abriz S, Torabian S. Antioxidant enzyme and osmotic adjustment changes in bean seedlings as affected by biochar under salt stress[J].Ecotoxicology & Environmental Safety, 2017, 137: 64-70.
[15] 侯福林. 植物生理学实验教程[M]. 北京:科学出版社,2004.
HOU Fulin. Experimental Course of Plant Physiology[M]. Beijing: Science publishing, 2004.
[16] 刘绚霞,董振生,刘创社,等. 油菜叶绿素提取方法的研究[J].中国农学通报,2004, 20(4): 62-63.
LIU Xuanxia, DONG Zhensheng, LIU Chuangshe, et al. Study on extracting methods of chlorophyll in rape[J]. Chinese Agricultural Science Bulletin, 2004, 20(4): 62-63.
[17] 张志良,瞿伟菁,李小方. 植物生理学实验指导[M]. 高等教育出版社,2009.
ZHANG Zhiliang, QU Weijing, LI Xiaofang. Plant physiology experimental guidance[M]. Higher Education Press, 2009.
[18] B.D.Seeding. Salinity and Sodicity in North Dakota Soils [J]. 2000.https://library.ndsu.edu/ir/bitstream/handle/10365/5412/eb57.pdf?sequence=1.
[19] Sparks, D. L. Methods of soil analysis Part 3—Chemical Methods || Salinity: electrical conductivity and total dissolved solids[M]. SSSA Book Series.1986.
[20] Novak J M, Busscher W J, Watts D W, et al. Biochars impact on soil-moisture storage in an ultisol and two aridisols[J]. Soil Science, 2013, 177(5): 310-320.
[21] Akhtar S S, Andersen M N, Liu F. Residual effects of biochar on improving growth, physiology and yield of wheat under salt stress[J]. Agricultural Water Management, 2015, 158: 61-68.
[22] Akhtar S S, Li G, Andersen M N, et al. Biochar enhances yield and quality of tomato under reduced irrigation[J]. Agricultural Water Management, 2014(138): 37-44.
[23] Bruun E W, Petersen C T, Hansen E, et al. Biochar amendment to coarse sandy subsoil improves root growth and increases water retention[J]. Soil Use and Management, 2014, 30(1):109-118.
[24] Kanwal S, Ilyas N, Shabir S, et al. Application of biochar in mitigation of negative effects of salinity stress in wheat (L.) [J]. Journal of Plant Nutrition, 2018, 41(4): 526-538.
[25] Sonar B A, Nivas D, Gaikwad D K, et al. Assessment of salinity-induced antioxidative defense system in Colubrina asiatica Brongn[J]. Journal of Stress Physiology & Biochemistry,2011, 7(3).
[26] Farhangi-Abriz S, Torabian S. Antioxidant enzyme and osmotic adjustment changes in bean seedlings as affected by biochar under salt stress[J]. Ecotoxicology & Environmental Safety, 2017, 137(4): 64-70.
FENG Xiaohui, WANG Mingquan. The main physiological and biochemical reactions of plants under salt stress[J]. Bulletin of Agricultural Science and Technology, 2015(9): 41-43.
[27] Cheng Y, Cai ZC, Chang S, et al.Wheat straw and its biochar have contrasting effects on inorganic N retention and N2O production in a cultivated black chernozem[J]. Biology and Fertility of Soils, 2012, 48(8): 941-946.
[28] Enders A, Hanley K, Whitman T, et al. Characterization of biochar to evaluate recalcitrance and agronomic performance[J]. Bioresource Technology, 2012(114): 644-653.
[29] Peng F, He PW, Luo Y, et al.Adsorption of phosphate by biomass char deriving from fast pyrolysis of biomass waste[J]. Acta Hydrochimica Et Hydrobiologica, 2012, 40(5): 493-498.
[30] 项子宸. 土壤改良剂对滨海盐碱土及水稻生长的影响研究[D].杭州:浙江农林大学, 2020.
XIANG Zichen. Effects of amendments on coastal saline-alkalisoil and rice growth [D]. ZhejiangA&F University, 2020.
Alleviating effect of biochar on sodium chloride stress in tobacco seedlings
LIU Xiaohan1,2, LIU Xiaohui3, ZHENG Hao4, JING Yongfeng5, ZHOU Wenhui5, YU Haitao5, QIAN Hua5, YE Xiefeng1*
1 College of Tobacco Science, Henan Agricultural University, National Tobacco Cultivation and Physiology and Biochemistry Research Center, Key Laboratory for Tobacco Cultivation of Tobacco Industry, Zhengzhou 450002, China;2 Guangdong Shaoguan Tobacco Recuring Co., LTD., Shaoguan 512000, China; 3 China Tobacco Shenzhen Industry LLC, Shenzhen 518000, China;4 Ledao Logistics, Wuhan 430000, China;5 China Tobacco Hunan Industry LLC, Changsha 410000, China
This study aims to study the alleviating effect of exogenous biochar on NaCl stress of tobacco seedlings.Using flue-cured tobacco K326 as material, pot experiment was carried out by applying 150mmol/L NaCl solution as salt stress and setting biochar addition amount of 0, 10, 20 and 30 g/kg biochar addition amount. Meanwhile, control experiment was carried out by not adding salt and biochar treatment as control (CK). The biomass and moisture content of tobacco, physiological index and the content of mineral elements were detected to clarify the alleviating effect of biochar on salt stress of flue-cured tobacco.Salt stress resulted in growth retarding of tobacco plant, decreased leaf water content and ratio of free water to bound water. The addition of 20-30 g/kg biochar significantly increased dry fresh weight of tobacco plant, leaf relative water content, and ratio of free water to bound water. In the same period, adding 20 g/kg biochar under salt stress could increase chlorophyll a and chlorophyll b contents and total chlorophyll content significantly in leaves. The addition of 30 g/kg biochar significantly reduced the contents of MDA and H2O2. Meanwhile, salt stress increased the activities of SOD and POD in leaves, while the addition of of biochar decreased the activities of SOD and POD significantly. Compared with CK, the content of Ca2+, K+and Mg2+under salt stress decreased by 34.36%, 15.04% and 11.37%, respectively, and the content of Na+increased by 542.90%. After 75 days of transplanting, adding 30 g/kg biochar increased the content of Ca2+in shoot by 34.05% and decreased the content of Na+by 54.99%.Exogenous addition of biochar can improve the water status of tobacco leaves under salt stress, promote the root development and biomass accumulation of tobacco plants, alleviating the membrane lipid peroxidation reaction caused by the increase of reactive oxygen species under salt stress, and regulate the ion balance of tobacco overground parts. In particular, adding 20-30 g/kg biochar had the best mitigation effect on tobacco growth under the stress of 150 mmol/L NaCl.
NaCl; tobacco; biochar; salt stress
Corresponding author. Email:yexiefeng@163.com
烟草行业烟草栽培重点实验室项目“植烟土壤肥力培育及提高肥料利用率技术研究”(No.30800665)
刘晓涵(1992—),硕士,研究方向:烟草栽培生理和复烤烟叶质量评价,Tel:15038280097,Email:849954348@qq.com
叶协锋(1979—),Tel:0371-63555713,Email:yexiefeng@163.com
2021-08-24;
2022-02-10
刘晓涵,刘晓晖,郑好,等.生物炭对烟草幼苗氯化钠胁迫的缓解效应[J]. 中国烟草学报,2022,28(3).LIU Xiaohan, LIU Xiaohui,ZHENG Hao, et al. Alleviating effect of biochar on sodium chloride stress in tobacco seedlings[J]. Acta Tabacaria Sinica, 2022,28(3). doi: 10.16472/j.chinatobacco. 2021.163

