喷施外源EBR和H2O2对低温胁迫烟苗恢复生长期生理特性的影响
许金亮,谢鹏飞,向世鹏,范敏,陈治峰,沈子奇,张芸萍,李强*
喷施外源EBR和H2O2对低温胁迫烟苗恢复生长期生理特性的影响
许金亮1,谢鹏飞2,向世鹏2,范敏1,陈治峰2,沈子奇1,张芸萍1,李强1*
1 湖南农业大学 农学院 湖南长沙 410128; 2 湖南省烟草公司长沙市公司 湖南长沙 410001
【】探讨表油菜素内酯(EBR)和过氧化氢(H2O2)对低温胁迫后烟草幼苗生理和生长特性的影响。【】以烤烟品种K326为材料,研究低温胁迫后喷施外源表油菜素内酯(EBR,0.01 mg/L)和过氧化氢(H2O2,340 mg/L)对烤烟苗期抗氧化酶(SOD、POD、CAT)活性、渗透调节物质、丙二醛(MDA)和生物量的影响。【】(1)烟草苗期低温胁迫(CK1)4 d与正常生长(CK2)烟株相比SOD活性降低,POD、CAT活性升高,MDA、可溶性糖和脯氨酸含量上升,可溶性蛋白含量下降,生物量降低;(2)低温胁迫结束后,喷施外源EBR(T1)和H2O2(T2)相比低温对照(CK1),恢复生长12 d烟苗SOD、POD、CAT活性分别提高61.87%和47.37%、239.06%和193.11%、168.07%和139.63%,MDA含量分别降低60.00%和50.00%,渗透调节物质含量和生物量显著增加;(3)喷施外源EBR(T1)和H2O2(T2)与正常生长(CK2)烟株相比,在恢复生长8 d和12 d时SOD、POD、CAT活性与可溶性糖含量无显著差异,MDA含量降低,脯氨酸含量显著上升。【】喷施外源EBR(0.01 mg/L)和H2O2(340 mg/L)能加快低温胁迫后烤烟K326幼苗的生理和生长恢复进程。
K326;低温胁迫;EBR;H2O2;酶活性;渗透调节物质;生物量
烟草属喜温作物,低温条件下生长发育迟缓,植株矮小,易出现早花,造成烟叶产质量降低。不同烟草品种间耐低温能力存在较大差异,我国主栽品种K326属低温敏感型,低温耐受能力较差[1-2],研究其低温胁迫后恢复生长阶段的机理对烤烟生产具有长远意义。早在1973年,Lyons[3]提出了“膜脂相变”假说,认为低温使生物膜发生膜脂物相变化,膜脂从液晶相转化为凝胶相,导致膜脂收缩,外部出现孔道或龟裂,膜的厚度也发生相应的变化;同时,细胞内外平衡被破坏,出现可溶性物质和电解质渗漏现象,造成生理干旱和有毒物质积累,且胁迫时间越长作物所受到的损害越严重。已有研究表明[4-5],受低温胁迫时烟草幼苗根系活力、叶绿素与可溶性蛋白含量降低,丙二醛(MDA)含量上升,膜脂透性增大,可溶性糖与脯氨酸含量上升,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性下降,过氧化物酶(POD)活性升高。低温胁迫解除后,作物在常温下恢复生长,细胞器结构完整性和抗氧化酶活性逐渐增强,相对电导率下降,线粒体数量、叶绿素、渗透调节物质和内源激素含量增加,作物抗寒性增强[6-7]。
外源植物生长物质是由人工合成的,与植物激素具有类似生理作用的一类物质,使用外源植物生长物质对低温胁迫后作物的恢复生长进程有促进作用。已有研究表明[8-9],叶面喷施氯化钙(CaCl2)、聚糠萘(PKN)、多效挫(MET)、矮壮素(CCC)等植物生长物质能通过调节作物体内抗氧化系统、渗透调节物质等来提高作物低温胁迫后的恢复能力。西瓜幼苗遭受低温胁迫后,前期喷施复硝酚钠(CSN)可促使植株快速恢复生长,后期追施海藻叶面肥可促进果实糖分的积累[10];脱落酸(ABA)处理低温后香蕉幼苗,其叶片POD、SOD活性上升,MDA含量与相对电导率降低,叶绿素含量与叶片组织细胞结构疏松度(SR)增加,叶片膜脂受损率与死亡率减少,植株恢复生长率上升[11];此外,在油茶花[12]与沟叶结缕草[13]中施用植物生长物质也得出了相似的结论。表油菜素内酯(Epibrassinosteroids,EBR)是一类具有高生理活性的甾体激素,广泛存在于植物的花粉、茎和叶中[14],能有效协助植物抵御非生物胁迫[15]。低温胁迫条件下,EBR可以通过增强抗氧化酶基因表达水平,诱导SOD、POD和CAT等抗氧化酶活性,从而增强植物抗氧化能力[16],增加渗透调节物质含量,提高植物抗寒性[17]。H2O2是一种无机化合物,是活性氧(ROS)的一种,在作物生长发育、氧化应激、衰老和细胞程序性死亡等过程中均有非常重要的作用[18]。传统观念认为H2O2对作物有毒害作用,但有研究表明[19],适宜浓度的H2O2能作为局部和系统信号起作用,从而增强作物对多种生物和非生物胁迫的耐受性,且参与调控植物体内多种生理代谢过程和众多基因表达。
目前,外源EBR[20]和H2O2[21]已经广泛应用于调节作物生长发育。但关于外源EBR和H2O2对烤烟低温胁迫后恢复效应的研究罕见报道。本试验通过模拟低温环境,研究低温胁迫后,喷施EBR和H2O2对烤烟K326苗期恢复生长的调控作用,旨在为生产上利用外源EBR和H2O2修复低温胁迫对烤烟幼苗造成的伤害提供理论参考。
1 材料与方法
1.1 供试材料
低温敏感型烤烟品种K326(湖南省烟草科学研究所提供);EBR(0.01 mg/L)和H2O2(340 mg/L)(南京建成生物工程研究所有限公司),EBR和H2O2浓度由前人研究[17,22]和预实验确定。
1.2 试验设计
取饱满一致的K326种子,依次在50℃温水浸泡10 min、75%乙醇溶液浸泡30 s、10%NaClO溶液浸泡10 min,无菌水洗净后将种子点于经1/4霍格兰(Hoagland)营养液完全浸湿的脱脂棉培养皿上,每皿50~60粒,将培养皿置于28℃人工气候箱中避光催芽4 d,取萌动一致的种子播种于育苗盘(育苗盘中事先放入JIFFY育苗块,并用1/4 Hoagland营养液充分湿润,每日下午14时向育苗盘中添加1/4 Hoagland营养液至1/2刻度处),每盘播种24株。置人工气候培养箱培养,培养条件为光照时长14 h/10 h(昼/夜),温度28℃/18℃(昼/夜),相对湿度75%、光照强度为7000 lux。待烟苗长至七叶一心时,进行低温处理4 d后(昼/夜温度4℃/4℃,相对湿度75%,光照强度7000 lux),转入正常环境条件下(昼/夜温度28℃/18℃,相对湿度75%,光照强度7000 lux),分别喷施EBR(0.01 mg/L)和H2O2(340 mg/L),喷施时间为上午9时和下午14时,连续喷施4 d后,置前述正常环境条件下恢复生长20 d。以进行低温处理后喷施蒸馏水的烟苗为低温胁迫对照(CK1),以未经低温处理喷施蒸馏水的烟苗为常温对照(CK2),处理设置见表1。试验共4个处理,每个处理重复3次,每次重复种植8株。
表1 处理方法

Tab.1 Treatment methods
1.3 测定项目与方法
1.3.1 抗氧化酶活性、MDA及渗透调节物质含量
于连续温度处理4 d结束时、恢复生长4 d、恢复生长8 d和恢复生长12 d,分别取自上而下第2、3片完全展开叶样品测定烟叶生理指标(每个重复取2株)。SOD活性测定采用氮蓝四唑(NBT)光还原比色法[23];POD活性测定采用愈创木酚法[24];CAT活性测定采用过氧化氢分解法[24];MDA含量测定采用硫代巴比妥酸(TBA)显色法[24];游离脯氨酸含量使用试剂盒(南京建成生物工程研究所有限公司)检测;可溶性糖含量测定采用蒽酮比色法[25];可溶性蛋白含量测定采用考马斯亮蓝法[24]。
1.3.2 生物量
温度处理结束后恢复生长20 d时,分别称量各处理地上、地下部烟株鲜重,后将烟株105℃杀青40 min,于80℃烘干至恒重,称量各样品干重,计算根冠比(根干重/地上部干重)。
1.4 数据分析
采用SPSS 22.0和Excel 2010软件进行数据处理和绘图,采用Duncan's新复极差法进行多重比较(<0.05)。
2 结果与分析
2.1 外源EBR和H2O2对温度处理后恢复生长过程中烟草幼苗抗氧化酶活性的影响
2.1.1 外源EBR和H2O2对温度处理后恢复生长过程中烟草幼苗SOD活性的影响
由图1A可知,常温对照(CK2)烟株SOD活性呈现持续上升的趋势,而低温胁迫对照(CK1)的烟株SOD活性则先上升后下降;连续低温胁迫4 d 后,T1、T2、CK1处理SOD活性显著低于常温对照(CK2);恢复生长过程中喷施外源EBR(T1,0.01 mg/L,下同)和H2O2(T2,340 mg/L,下同),SOD活性显著高于CK1,在恢复生长12 d时SOD活性分别比CK1高61.87%和47.37%,与CK2相比,在恢复生长8 d和12 d 时无显著差异。说明低温胁迫使SOD活性降低,而喷施外源EBR与H2O2能显著提高SOD活性,增强烟株对体内活性氧(ROS)的清除功能。
2.1.2 外源EBR和H2O2对温度处理后恢复生长过程中烟草幼苗POD活性的影响
不同处理模式下POD活性变化见图1B,连续低温胁迫4 d,烟株POD活性显著高于CK2,但在恢复生长过程中CK1的POD活性均低于CK2烟株,且在恢复生长8 d和12 d达显著水平;恢复生长过程中,T1、T2 处理POD活性均高于CK1,在恢复生长8 d和12 d 时达显著水平,恢复生长12 d时POD活性分别比CK1高239.06%和193.11%,与CK2烟株相比无显著差异,除恢复生长8 d时T2略低于CK2外,T1、T2 处理POD活性均高于CK2。表明低温胁迫条件下烟株POD活性增强,而外源EBR与H2O2对烟株POD活性的上升具有较强的促进作用。
2.1.3 外源EBR和H2O2对温度处理后恢复生长过程中烟草幼苗CAT活性的影响
由图1C可知,连续低温胁迫4 d对烟株CAT活性的影响不显著;恢复生长过程中CK1的CAT活性显著低于CK2,且一直处于较低水平,说明低温处理降低了烟株恢复生长过程中CAT活性;恢复生长过程中T1、T2 处理CAT活性显著高于CK1,且在恢复生长12 d时差异最大,分别比CK1高168.07%和139.63%,但与CK2无显著差异。这表明短时间低温胁迫对烟草幼苗CAT活性影响较小,而外源EBR与H2O2能促进低温处理后烟草幼苗CAT活性的增强。
2.2 外源EBR和H2O2对温度处理后恢复生长过程中烟草幼苗MDA含量的影响
连续低温胁迫导致烟株体内MDA含量迅速升高(图1D),解除低温胁迫后MDA含量迅速降低;在恢复生长12 d时CK1处理MDA含量显著高于CK2,升幅达50.00%,说明低温胁迫对烟苗恢复生长过程中MDA含量影响较大;恢复生长过程中T1、T2与CK1相比MDA含量始终处于较低水平,且在恢复生长8 d和12 d时差异达显著水平,在恢复生长12d时差异最大,分别比CK1低60.00%和50.00%,与CK2相比在恢复生长4 d和8 d时MDA含量显著降低,恢复生长12 d时CK2处理MDA含量高于T1、T2。表明喷施外源EBR和H2O2能减少烟苗体内MDA含量,有利于降低烟苗体内膜脂过氧化水平。
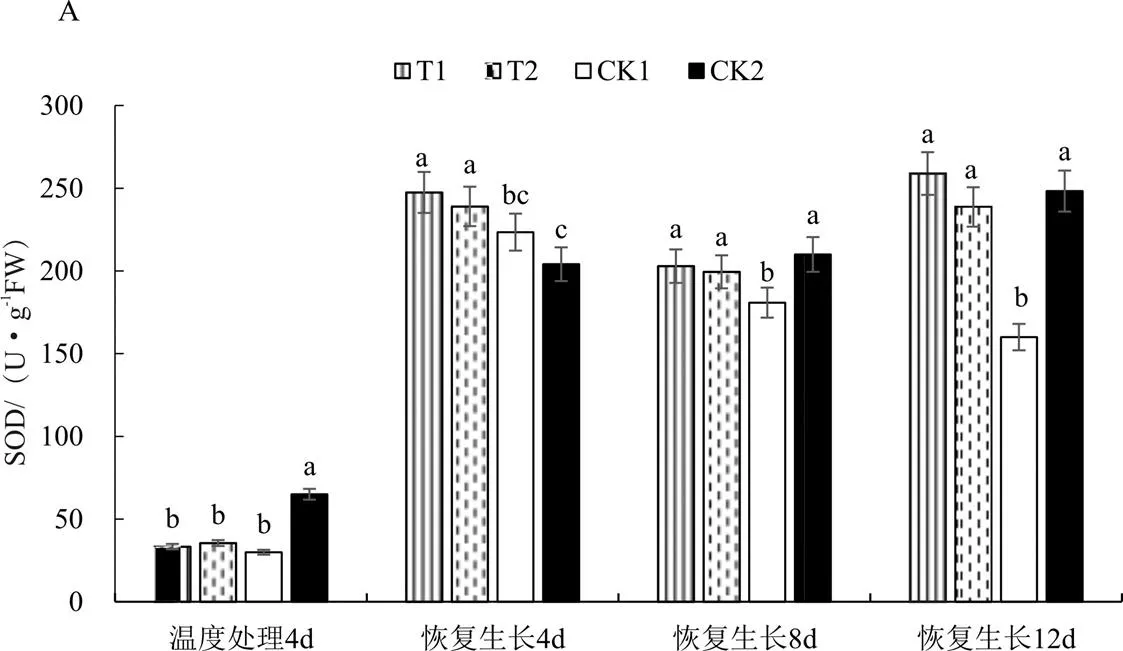
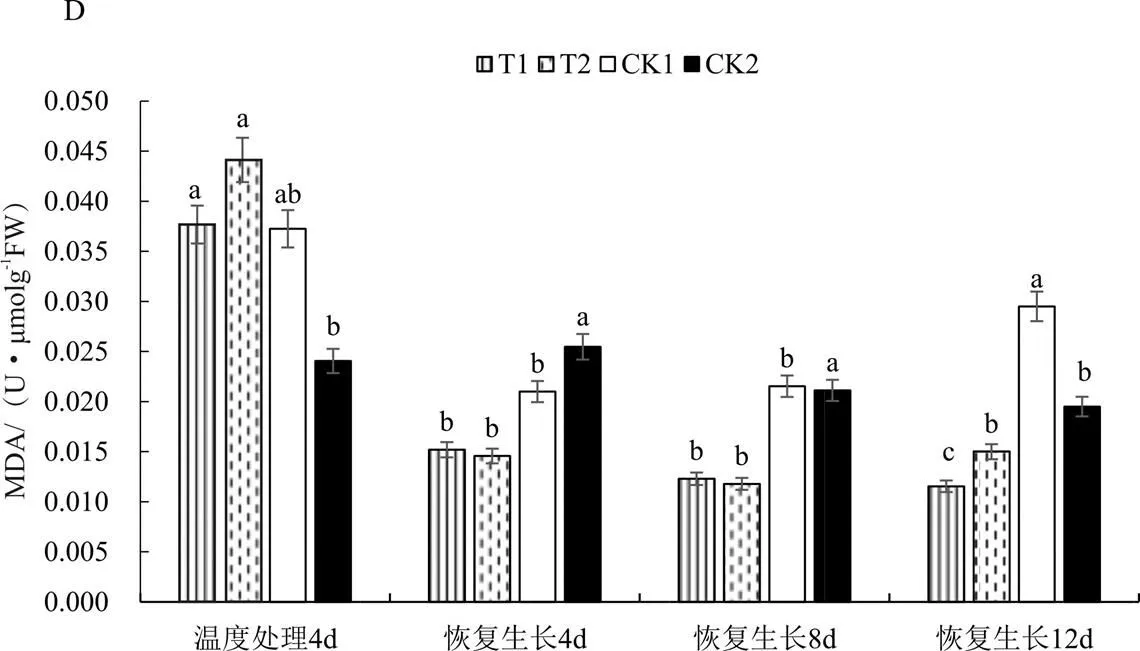
注:不同小写字母表示在0.05水平下显著。
Note: Different lowercase letters indicate significant at the 0.05 level.
图1 不同药剂和温度处理后恢复生长K326幼苗SOD、POD、CAT活性及MDA含量的影响
Fig. 1 Effects of different chemicals and temperatures on SOD, POD, CAT activities and MDA content of K326 seedlings after resuming growth
2.3 外源EBR和H2O2对温度处理后恢复生长过程中烟草幼苗渗透调节物质的影响
2.3.1 外源EBR和H2O2对温度处理后恢复生长过程中烟草幼苗可溶性糖含量的影响
不同低温处理可溶性糖含量变化趋势一致,均为先降低后升高(表2);常温对照(CK2)表现为持续上升。与CK2相比,连续低温胁迫4 d可溶性糖含量显著上升;低温胁迫结束后,在恢复生长过程中CK1可溶性糖含量显著低于CK2,T1、T2可溶性糖含量高于CK1,且在恢复生长8 d和12 d达显著水平。此外,在恢复生长8 d和12 d时,T1、T2处理与CK2差异不显著。说明外源EBR和H2O2能有效提高可溶性糖的积累速度。
表2 不同药剂处理对温度处理后恢复生长K326幼苗可溶性糖的影响
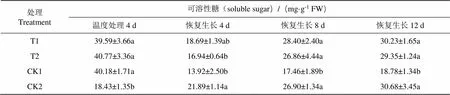
Tab.2 Effects of different chemical treatments on the soluble sugar of K326 seedlings after temperature treatment
注:同列数字后标有小写字母表示处理间差异达到 5% 水平,下同。
Note: The numbers in the same column are marked with lowercase letters to indicate difference at level of 5% between treatments. The same below.
2.3.2 外源EBR和H2O2对温度处理后恢复生长过程中烟草幼苗脯氨酸含量的影响
与CK2相比,连续低温胁迫后烟株脯氨酸含量显著上升(表3);低温胁迫后不同处理脯氨酸含量变化趋势一致,均为先下降后上升;常温对照表现为持续上升。连续低温胁迫结束后,在恢复生长过程中脯氨酸含量CK2均高于CK1,且在恢复生长8 d和12 d时达显著水平,表明短时间低温胁迫虽然提高了烟草苗期脯氨酸含量,但在恢复生长过程中与常温对照烟株相比脯氨酸积累受限。在恢复生长过程中T1、T2处理脯氨酸含量显著高于CK1、CK2,说明外源EBR和H2O2对烟草苗期低温胁迫恢复生长后脯氨酸的积累具有极强的促进作用。
表3 不同药剂处理对温度处理后恢复生长K326幼苗脯氨酸的影响
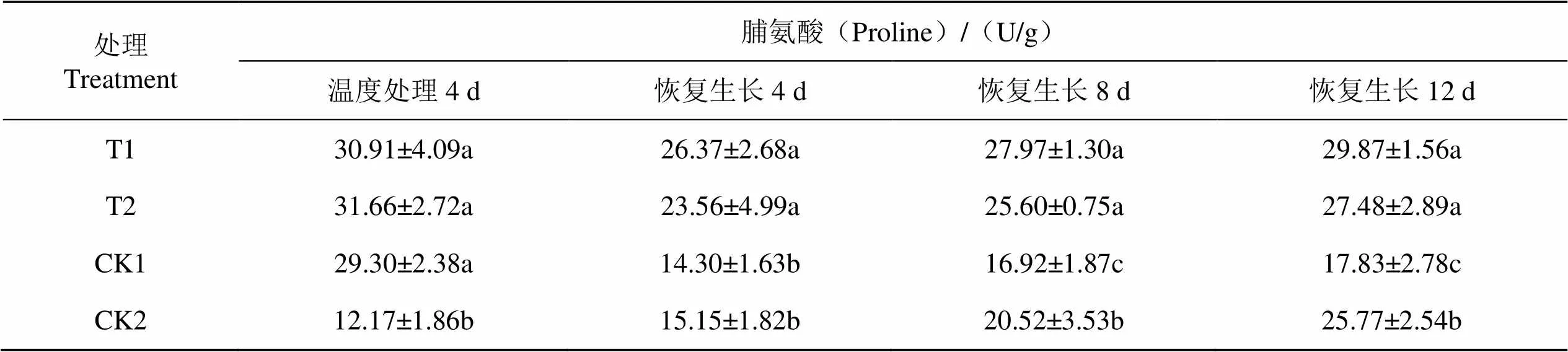
Tab.3 Effects of different chemical treatments on the proline growth of K326 seedlings after temperature treatment
2.3.3 外源EBR和H2O2对温度处理后恢复生长过程中烟草幼苗可溶性蛋白含量的影响
可溶性蛋白是植物抗逆性的重要指标之一。由表4可知,可溶性蛋白含量在连续低温胁迫4 d时增加,这与逆境胁迫抑制正常蛋白形成,合成新的逆境蛋白有关。解除低温胁迫后可溶性蛋白含量呈下降趋势。在恢复生长过程中T1、T2处理与CK1相比可溶性蛋白含量增加,且在恢复生长4 d和8 d时T1与CK1差异显著;T1、T2处理与正常生长烟株(CK2)相比无显著差异。说明EBR和H2O2能缓解低温胁迫后可溶性蛋白的下降速率,促进烟苗恢复生长进程。
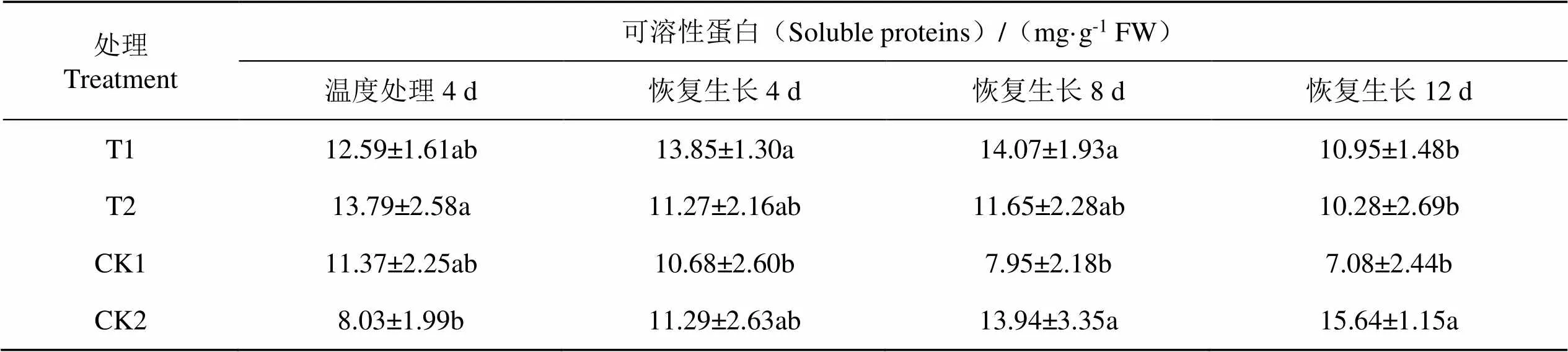
表4 不同药剂处理对温度处理后恢复生长K326幼苗可溶性蛋白的影响
2.4 外源EBR和H2O2对温度处理后恢复生长过程中烟草幼苗生物量的影响
由表5可知,烟苗经不同温度处理并恢复生长20 d后,与CK2相比,CK1地上部鲜重和干重分别降低24.8%和41.4%,根部鲜重和干重分别降低44.4%和62.5%,根冠比降低35.7%。表明低温胁迫后烟苗生长发育和干物质积累受阻。与CK1相比,T1、T2处理烟株地上部鲜重分别增加3.7%和14.7%,干重分别增加5.4%和11.8%;根鲜重分别增加49.2%和100%,干重分别增加3.1%和33.3%;根冠比分别增加66.7%和33.3%。与CK1相比,T1、T2和CK2的各生物量指标差距均缩小,且T1与CK2根冠比无显著差异。说明喷施外源EBR和H2O2能缓解低温胁迫对烟苗生长造成的抑制效果,促进烟苗生物量的积累。
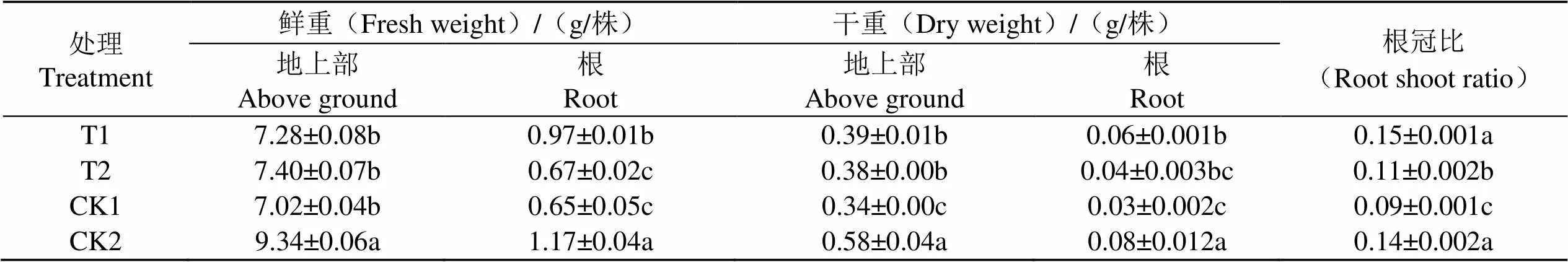
表5 不同药剂处理对温度处理后恢复生长K326幼苗生物量的影响
3 讨论
低温是烟草栽培中常见的非生物胁迫之一,严重影响烤烟的产量和质量[26]。低温对烤烟生长的影响主要分为两方面[27]:一是苗床期遭遇低温,导致烤烟幼苗根系生长受阻,出现茎秆木质化,影响正常成苗;二是大田早期遭遇低温,会抑制其营养生长,加速生殖生长,出现叶片狭长,有效叶数减少和烟株早花等现象,导致烤烟产量低、品质差。低温胁迫对烤烟生理指标的影响尤为突出,陈卫国等[1]研究表明,冷害指数与MDA含量呈极显著正相关关系,与细胞膜透性呈显著正相关关系,同时烤烟低温耐受能力与抗氧化酶活性呈显著正相关关系,即抗寒性越强MDA含量与细胞膜透性越低,抗氧化酶活性越高。本研究发现,低温胁迫后SOD活性下降,POD活性上升,MDA、可溶性糖与脯氨酸含量增加,生物量减少,与前人研究结果一致[5];CAT活性无显著差异,可能与CAT活性受光照、温度和外界环境影响有关[28];可溶性蛋白含量增加,可能是低温诱导了新蛋白的合成,增加了可溶性蛋白含量,其内在机理尚待进一步研究。连续低温胁迫结束后恢复生长4 d可溶性糖和脯氨酸含量出现大幅度下降,其中可溶性糖含量的降低可能与温度上升细胞呼吸作用大幅度上升,可溶性糖迅速分解有关;脯氨酸含量大幅度下降可能与脯氨酸在植物体内参与渗透调节与蛋白质的形成、保护蛋白质分子、增加蛋白质分子的水合度、维持光合活性、作为活性氧的清除剂等功能有关[29-30]。在恢复生长过程中,SOD活性先上升后缓慢下降,POD与CAT活性无明显规律,MDA含量先降低后升高,可溶性糖与脯氨酸含量增加,可溶性蛋白含量降低,这可能与低温胁迫造成质膜损伤,细胞结构遭到破坏[26],解除低温胁迫后不能及时修复有关。
EBR作为植物应答逆境胁迫的重要生长调节物质,在植物抗逆性方面有重要的促进作用[31]。已有研究表明,EBR处理小麦植株,可通过提高游离脯氨酸和可溶性蛋白含量来增强抗渗透胁迫能力,并通过提高抗氧化酶活性来增强抗氧化胁迫能力,促进小麦植株生长[32];叶面喷施EBR,可增强葡萄幼苗叶片抗氧化酶活性,增加渗透调节物质含量,减少MDA含量,从而增强其抗氧化能力[33]。本研究发现,受低温胁迫烟株在恢复生长过程中喷施外源EBR,与连续低温处理烟株相比抗氧化酶活性上升,渗透调节物质含量、生物量增加,MDA含量降低,与前人研究结果一 致[8-10]。抗氧化酶活性的提高,可能是由于EBR促进了相关酶的合成或通过调节特定基因的转录与翻译从而激活这些保护酶基因的表达[34];渗透调节物质的增加与MDA含量的降低,可能是EBR减少了植物细胞膜受损率,降低了细胞膜通透性与细胞液电导率,减轻了细胞膜脂过氧化作用[27],进而增加烤烟K326幼苗生物量。
H2O2预处理是一种诱导植物适应非生物胁迫的信号途径。已有研究表明[20,35],H2O2可作为信号减轻低温胁迫下ROS的积累对作物幼苗的氧化损伤,增强作物抗氧化能力,同时通过增加渗透调节物质含量,提高作物对低温的适应能力,从而缓解低温对作物生长的抑制效果,增加作物生物量。本研究发现,喷施外源H2O2对K326的影响与EBR对烤烟幼苗低温胁迫后恢复生长的效果一致,均表现为明显的促进作用,说明适宜浓度的外源H2O2可以缓解低温胁迫对植物生长的抑制作用,其原因可能是适宜浓度的H2O2处理作物幼苗,能够模拟冷驯化,诱导保护酶基因的表 达[36],促进渗透调节物质的积累[21],降低MDA含量,进而增加生物量,但其内部分子机制还需进一步研究,特别是外源H2O2关于低温胁迫结束后恢复生长过程中对作物的诱导机制及分子机制有待进一步研究。
4 结论
本研究发现低温胁迫后,烤烟K326幼苗SOD活性降低,POD活性升高,CAT活性无显著变化,MDA、可溶性糖和脯氨酸含量增加,可溶性蛋白含量减少,生物量降低。低温胁迫后喷施外源EBR和H2O2显著提高了烤烟K326幼苗体内抗氧化酶活性、渗透调节物质含量与生物量,且显著降低了MDA含量。与常温对照相比,解除低温胁迫后喷施外源EBR和H2O2在幼苗恢复生长12 d时保护酶活性(SOD、POD、CAT)及可溶性糖含量无显著差异,且MDA含量降低,脯氨酸含量增加。综上所述,喷施外源EBR(0.01 mg/L)和H2O2(340 mg/L)不仅能加快低温胁迫后烤烟K326幼苗的生理和生长恢复进程,并且在恢复生长8 d和12 d时整体生理指标优于常温对照幼苗,两种外源物质对低温胁迫后恢复生长过程中K326幼苗的调节效果基本一致。
[1] 陈卫国,李永亮,周冀衡,等. 烤烟品种耐寒性及相关生理指标的研究[J]. 中国烟草科学,2008, 29(3): 39-42, 47.
CHEN Weiguo, LI Yongliang, ZHOU Jiheng, et al. Study on chilling tolerance and related physiological indexes of flue-cured tobacco varieties[J]. Chinese Tobacco Science, 2008, 29(3): 39-42, 47.
[2] 马文广,周义和,刘相甫,等. 我国烤烟品种的发展现状及对策展望[J]. 中国烟草学报,2018, 24(1): 116-122.
MA Wenguang, ZHOU Yihe, LIU Xiangfu, et al. Current status and outlook of flue-cured tobacco variety development in China[J]. Acta tabacaria sinica, 2018, 24(1): 116-122.
[3] Lyons J M. Chilling injury in plants[J]. Ann. Rev. Plant Physiol, 1973, 24(24): 445-448.
[4] 尹航,王欣亚,金大翔,等. 低温诱导胁迫下不同烟草品种电导率及抗氧化酶活性的变化[J]. 延边大学农学学报,2018, 40(1): 46-52.
YIN Hang, WANG Xinya, JIN Daxiang, et al. Changes of antioxidant enzyme activity and conductivity of different tobacco varieties under low temperature induced stress[J]. Agricultural Science Journal of Yanbian University, 2018, 40(1): 46-52.
[5] Noman H, Qasim A, Shafaqat A, et al. Use of Nitric Oxide and Hydrogen Peroxide for Better Yield of Wheat (L.) under Water Deficit Conditions: Growth, Osmoregulation, and Antioxidative Defense Mechanism[J]. Plants, 2020, 9(2): 285.
[6] 胡翠翠,路雄,王虹. 冰川两种藓在超低温胁迫与恢复生长状态下叶肉细胞的超微结构[J]. 广西植物,2020, 40(11): 1653- 1660.
HU Cuicui, LU Xiong, WANG Hong. Ultrastructure of mesophyll cells of two species of mosses under ultra-low temperature stress and restored growth from glacier[J]. Guihaia, 2020, 40(11): 1653-1660.
[7] 王璐珺,丁彦芬. 低温胁迫对4种景天属植物恢复生长后的生理影响[J]. 江苏林业科技,2016, 43(3): 5-8, 11.
WANG Lujun, DING Yanfen. Effects of low temperature stress on the physiological in the recovery growth of four plants ofspecies[J]. Journal of Jiangsu Forestry Science & Technology, 2016, 43(3): 5-8, 11.
[8] 杨德光,马月,蒋芳芳,等. CaCl2对低温胁迫及恢复后玉米自交系种子萌发及幼苗生理特性的影响[J]. 华北农学报,2017, 32(S1): 147-152.
YANG Deguang, MA Yue, JIANG Fangfang, et al. Effects of CaCl2on maize inbred lines seed germination and seedling physiological characteristics under low temperature stress and recovery[J]. Acta Agriculturae Boreali-Sinica, 2017, 32(S1): 147-152.
[9] 周雅卓. 低温胁迫下不同生长调节剂对玉米主要生理特性及产量的影响[D]. 延吉:延边大学,2018.
ZHOU Yazhuo. Effects of growth regulators on main physiological characteristics and yield of maize at different growth stages under low temperature stress[D]. Yanji: Yanbian University, 2018.
[10] 李长根,孙兴祥,马江黎. 6种生长调节剂对西瓜低温胁迫的恢复效果[J]. 中国瓜菜,2019, 32(8): 120-123.
LI Changgen, SUN Xingxiang, MA Jiangli. Effects of six growth-regulating substances on watermelon recovery under low temperature stress[J]. Zhongguo Gua-cai, 2019, 32(8): 120-123.
[11] 方仁,龙兴,邓彪,等. 脱落酸对低温胁迫后香蕉幼苗恢复生长的影响[J]. 湖北农业科学,2014, 53(20): 4878-4881.
FANG Ren, LONG Xing, DENG Biao, et al. Effects of abscisic acid on the recovery growth of banana seedlings under low temperature stress[J]. Hubei Agricultural Sciences, 2014, 53(20): 4878-4881.
[12] 邓全恩. 油茶花器官发育逆境响应机制及植物生长调节剂调控技术研究[D]. 长沙:中南林业科技大学,2020.
DENG Quanen. Response mechanism offloral organ development to adverse circumstances and regulation technique of plant growth regulator[D]. Changsha: Central South University of Forestry and Technology, 2020.
[13] 许静雯. EBL调控4℃胁迫下及恢复后沟叶结缕草愈伤组织的生长与再生[D]. 浙江:浙江大学,2020.
XU Jingwen. EBL regulates the growth and regeneration of callus ofunder 4℃ stress and after recovery[D]. Zhejiang: Zhejiang University, 2020.
[14] Zafari M, Ebadi A, Jahanbakhsh S. Safflower () biochemical properties, yield and oil content affected by 24-epibrassinosteroid and genotype under drought stress[J]. Journal of agricultural and food chemistry, 2020, 68(22): 6040-6047.
[15] Hu W H, Wu Y, Zeng J Z, et al. Chill-induced inhibition of photosynthesis was alleviated by 24-epibrassinolide pretreatment in cucumber during chilling and subsequent recovery[J]. Photosynthetica, 2010, 48(4): 537-544.
[16] Anelia G D, Radka S V, Georgi D R, et al. Effects of exogenous 24-epibrassinolide on the photosynthetic membranes under non- stress conditions[J]. Plant Physiology and Biochemistry, 2014, 80: 75-82.
[17] 刘丽杰,丁美云,刘晓娜,等. 外源表油菜素内酯对小麦幼苗抗冷性的诱导效应[J]. 分子植物育种,2020, 18(20): 6815-6821.
LIU Lijie, DING Meiyun, LIU Xiaona, et al. Induction effects of exogenous epibrassinolide on cold resistance of wheat seedlings[J]. Molecular Plant Breeding, 2020, 18(20): 6815-6821.
[18] Xiong Y, Tian X D, Ai H W. Molecular tools to generate reactive oxygen species in biological systems[J]. Bioconjugate chemistry, 2019, 30(5): 1297-1303.
[19] Rahman M A, Alam I, Sharmin S A, et al. Physiological and proteomic analyses reveal the protective roles of exogenous hydrogen peroxide in alleviating drought stress in soybean plants[J]. Plant Biotechnology Reports, 2021, 15(6): 805-818.
[20] Shahzad R, Harlina P W, Ewas M, et al. Foliar applied 24-epibrassinolide alleviates salt stress in rice (L.) by suppression of ABA levels and upregulation of secondary metabolites[J]. Journal of Plant Interactions. 2021, 6(1): 533-549.
[21] Faroza N, Qazi F, Tanveer A K. Hydrogen peroxide as a signalling molecule in plants and its crosstalk with other plant growth regulators under heavy metal stress[J]. Chemosphere, 2020, 252(prepublish).
[22] 白永富,王荔,王绍坤. H2O2浸种处理提高K326烤烟种子活力的研究[J]. 种子,2001(1): 29-30.
BAI Yongfu, WANG Li, WANG Shaokun. Study on improving seed vigor of K326 Flue-cured tobacco[J]. Seed, 2001(1): 29-30.
[23] Superoxide Dismutases: II. Purification and quantitative relationship with water-soluble protein in seedlings[J]. Plant Physiology, 1977, 59(2): 315-318.
[24] 郝建军,康宗利,于洋. 植物生理学实验技术[M]. 化学工业出版社,2007.
HAO Jianjun, KANG Zongli, YU Yang. Plant physiology experiment technology[M]. Chemical Industry Press, 2007.
[25] Yong I K, Ji S S, Nilda R, et al. Antioxidative enzymes offer protection from chilling damage in rice plants[J]. Crop Sci, 2003, 43(6): 2109-2117.
[26] 李琦瑶,陈爱国,王程栋,等. 低温胁迫对烤烟幼苗光合荧光特性及叶片结构的影响[J]. 中国烟草学报,2018, 24(2): 30-38.
LI Qiyao, CHEN Aiguo, WANG Chengdong, et al. Effects of low temperature stress photosynthetic fluorescence characteristics and leaf tissue structure of flue-cured tobacco seedlings[J]. Acta Tabacaria Sinica, 2018, 24(2): 30-38.
[27] 杜鑫宇. 低温胁迫下不同烟草品种花芽分化进程及耐寒性生理生化指标的变化[D]. 延吉:延边大学,2020.
DU Xinyu. The process of flower bud differentiation and the changes of physiological and biochemical indexes of cold tolerance in different tobacco varieties under low temperature stress[D]. Yanji: Yanbian University, 2020.
[28] C.Robertson McClung. Regulation of catalase in[J]. Free Radical. Biol. Med. 1997, 23(3): 489-496.
[29] 汤章城. 逆境条件下植物脯氨酸的累积及其可能的意义[J]. 植物生理学通讯,1984(1): 15-21.
TANG Zhangcheng. Accumulation of plant proline under adversity conditions and its possible significance[J]. Plant Physiology Communications, 1984(1): 15-21.
[30] 王娟,李德全. 逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J]. 植物学通报,2001(4): 459-465.
WANG Juan, LI Dequan. The accumulation of plant osmoticum and activated oxygen metabolism under stress[J]. Chinese Bulletin of Botany, 2001(4):459-465.
[31] Cunha L F D, Oliveira, V P D, Nascimento A W S D, et al. Leaf application of 24-epibrassinolide mitigates cadmium toxicity in youngplants by modulating leaf anatomy and gas exchange[J]. Physiologia plantarum, 2020, 173(1): 67-87.
[32] Dong Y J, Wang W W, Hu G Q, et al. Role of Exogenous 24-Epibrassinolide in Enhancing the Salt Tolerance of Wheat Seedlings[J]. Journal of soil science and plant nutrition, 2017, 17(3): 554-569.
[33] 惠竹梅,王智真,胡勇,等. 2,4-表油菜素内酯对低温胁迫下葡萄幼苗抗氧化系统及渗透调节物质的影响[J]. 中国农业科学,2013, 46(5): 1005-1013.
HU Zhumei, Wang Zhizhen, HU Yong, et al. Effects of 24-epibrassinolide on the antioxidant system and osmotic adjustment substance in grape seedlings (L.) under chilling stress[J]. Scientia Agricultura Sinica, 2013, 46(5): 1005-1013.
[34] Yin Y L, Qin K Z, Song X W, et al.transcription factor regulates heat stress tolerance through FERONIA receptor-like kinases-mediated reactive oxygen species signaling in tomato[J]. Plant & cell physiology, 2018, 59(11): 2239-2254.
[35] 刘建新,欧晓彬,刘秀丽,等. 过氧化氢缓解裸燕麦幼苗低温胁迫的主成分和隶属函数分析[J]. 植物研究,2018, 38(5): 748- 756.
LIU Jianxin, OU Xiaobin, LIU Xiuli, et al. Principal components and subordinate function of the alleviating effects of hydrogen peroxide (H2O2) on low temperature stress in naked oat() seedlings[J]. Bulletin of Botanical Research, 2018, 38(5): 748-756.
[36] Sies H, Jones D P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents[J]. Nature reviews. Molecular cell biology, 2020, 21(7): 363-383.
Effects of spraying exogenous EBR and H2O2on the physiological characteristics of tobacco seedlings in the recovery period under low temperature stress
XU Jinliang1, XIE Pengfei2, XIANG Shipeng2, FAN Min1, CHEN Zhifeng2, SHEN Ziqi1, ZHANG Yunping1, LI Qiang1*
1 College of Agronomy, Hunan Agricultural University 410128;2 Changsha Branch of Hunan Provincial Tobacco Company 410001
This study aims to explore the effects of epibrassinolide and hydrogen peroxide on physiological and growth characteristics of tobacco seedlings under low temperature stress.Using flue-cured tobacco variety K326 as material, the effects of exogenous epibrassinolide (EBR, 0.01 mg/L) and hydrogen peroxide (H2O2, 340 mg/L) on antioxidant enzymes activity (SOD, POD, CAT) , osmotic regulation substances, malondialdehyde (MDA) and biomass of flue-cured tobacco at seedling stage were studied.(1) Compared with normal growth (CK2), SOD activity decreased, POD and CAT activity increased, MDA, soluble sugar and proline content increased, soluble protein content decreased, and biomass decreased in tobacco seedlings under low temperature stress (CK1) at 4 d. (2) After the end of low temperature stress, the SOD, POD and CAT activities of tobacco seedlings sprayed with exogenous EBR (T1) and H2O2(T2) increased by 61.87% and 47.37%, 239.06% and 193.11%, 168.07% and 139.63%, respectively as compared with the control (CK1). MDA content decreased by 60.00% and 50.00%, respectively, while osmoregulation substances contents and biomass increased significantly. (3) Compared with normal growth (CK2), the tobacco plants sprayed with exogenous EBR (T1) and H2O2(T2) had no significant differences in SOD, POD, CAT activity and soluble sugar content at 8 days and 12 days after resuming growth, but exhibited decreased MDA content and significantly increased proline content.Spraying exogenous EBR (0.01 mg/L) and H2O2(340 mg/L) can accelerate the physiological and growth recovery process of flue-cured tobacco K326 seedlings under low temperature stress.
K326; low temperature stress; EBR; H2O2; enzyme activity; osmoregulation substance; biomass
Corresponding author. Email:zqiangli@126.com
湖南省烟草公司长沙市烟草公司项目(20-24A01)
许金亮(1994—),硕士,主要从事烟草栽培生理方面的研究,Email:1250236276@qq.com
李强(1982—),副教授,Email:zqiangli@126.com
2021-08-16;
2022-02-23
许金亮,谢鹏飞,向世鹏,等.喷施外源EBR和H2O2对低温胁迫烟苗恢复生长期生理特性的影响[J]. 中国烟草学报,2022,28(3).XU Jinliang, XIE Pengfei, XIANG Shipeng, et al. Effects of spraying exogenous EBR and H2O2on the physiological characteristics of tobacco seedlings in the recovery period under low temperature stress[J]. Acta Tabacaria Sinica, 2022,28(3). doi:10.16472/j.chinatobacco. 2021.T0131

