茶芎根茎抗脑卒中有效组分及化学成分△
杨建波,王爱国,程显隆,魏锋,马双成*
1.中国食品药品检定研究院 中药民族药检定所,北京 100050;2.中国医学科学院 北京协和医学院 药物研究所 天然药物活性物质与功能国家重点实验室,北京 100050
茶芎Lgusticum sinenseOliv.cv.Chaxiong又名抚芎,为江西省特产药材之一,为伞形科藁本属植物茶芎的干燥根茎。其味辛,性温,归肝、心经,具有活血行气、祛风止痛等功效,可用于治疗月经不调、痛经、闭经、产后淤阻腹痛、头痛、风湿痹痛等疾病[1]。文献报道,茶芎中含有苯酞类、有机酸类、黄酮类、香豆素类和生物碱类等成分,其中苯酞类为其主要活性成分,具有增加冠状动脉血流量、舒张血管等作用,可用于抗血栓及改善局部脑缺血引起的脑水肿等[2-10]。因此,本研究对茶芎不同组分进行了抗脑卒中活性筛选,发现组分B 具有较好的抗脑卒中活性,并对其进行化学成分研究,得到7个化合物(1~7),其中正丁基苯酞(2)具有较好的抗脑卒中作用,且中国医学科学院药物研究所前期从芹菜中也获得该类成分,并成功开发成为治疗急性缺血性脑卒中国家级一类新药丁苯酞胶囊[11];从组分C中分离得到6个苯酞二聚体化合物(8~13),具体结构式见图1。
1 材料
1.1 实验动物
清洁级雄性SD大鼠40只,体质量(320±20)g,购自维通利华实验动物繁殖中心,实验动物生产许可证号为SCXK(京)2012-0001。饲养温度保持为23~25 ℃,自由进食和进水。
1.2 仪器与耗材
Avance-500 和600 型核磁共振波谱仪(德国布鲁克公司);HP1200 型高效液相色谱仪(美国安捷伦公司);LC-6AD 型制备高效液相色谱仪(日本岛津公司);C18反相填料(日本YMC 公司);MCI GEL CHP20P 填料(日本三菱化学公司);QUINTIX313-1CN 型万分之一电子天平(德国Sartorius 公司);VIM3000 型小动物专用吸入麻醉机(美国SurgiVet 公司);SZX16 型体视显微镜(德国奥林巴斯公司);硅酮包被尼龙栓线(硅酮树脂包被长度为5 mm,包被区域直径为0.34 mm;尼龙线直径为0.20 mm,包被硅酮固化后再以0.05%多聚赖氨酸包被);Pope 2inch WFS 型分子精馏仪器(美国Pope科学公司)。
1.3 试药
样品采集于江西省武宁,由中国医学科学院药物研究所马林副研究员鉴定为伞形科(Umbelliferae)藁本属(Ligusticum)植物茶芎Ligusticum sinenseOliv.cv.Chaxiong的干燥根茎,标本号为ID-5-2437,现存于中国医学科学院北京协和医学院药物研究所。
消旋丁基苯酞(NBP,批号:08010151,石药集团恩必普药业有限公司);异氟烷(isoflurane,河北九派制药有限公司);羧甲基纤维素钠(CMC-Na,批号:F20051103,中国医药集团有限公司);多聚赖氨酸、氯代三苯基四氮唑(TTC)均购自Sigma公司;常规试剂为分析纯;高效液相用试剂为色谱纯。
2 方法
2.1 茶芎不同组分制备
取茶芎干燥根茎30 kg 粉碎,95%乙醇回流提取,减压浓缩得浸膏4.8 kg。将浸膏分散于水(8 L)中,充分混匀,然后用乙酸乙酯萃取,减压回收溶剂得到乙酸乙酯萃取部位(组分A,1.5 kg)。对乙酸乙酯萃取部位进行精馏,得到茶芎挥发油(组分B,280 g)和重组分(组分C,1100 g)。
2.2 茶芎抗脑卒中有效组分筛选
2.2.1 样品制备 茶芎组分A、组分B 和NBP用食用植物油配制成20 mg·mL-1溶液。
2.2.2 实验分组及给药 雄性SD 大鼠,按体质量随机分为4 组,分别为模型组、阳性对照(恩必普,100 mg·kg-1)组、组分A(100 mg·kg-1)组和组分B(100 mg·kg-1)组,每组10 只。各组大鼠大脑中动脉阻塞后10 min灌胃给药(5 mL·kg-1)。
2.2.3 局部脑缺血再灌注模型(tMCAO)制备 按照文献[12-13]的方法制备tMCAO 模型。大鼠用3%异氟烷诱导麻醉,1.5%异氟烷维持麻醉。仰卧于手术台上,沿颈中线切开皮肤,仔细分离右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)。将ECA 结扎剪断,拉直与ICA 成一直线,在ECA 上剪小口,将硅酮树脂包被的硅化尼龙线由此开口插入ICA 1.85~2.00 cm,至大鼠大脑前动脉起始处,阻断大脑中动脉的血流供应。缝合手术切口,大鼠放回鼠盒。在大脑中动脉阻塞后2 h 将栓线小心拔出,完成脑缺血后再灌注。全部过程中室温保持在23~25 ℃。
2.2.4 神经行为学评分 于术后24 h进行大鼠的行为学观察,参照Bederson 等[14]和Belayev 等[15]的方法,提鼠尾离开地面约30 cm,观察两前肢状况;将大鼠置于水平地面,推动其双肩,观察两侧抵抗力有无差异;大鼠置于地面,观察其行走情况。采用四级评分法(0~5 分),分数越高,说明其神经行为损伤越严重,具体评分标准如下:行为完全正常为0 分;提起鼠尾离开地面,手术对侧前肢内旋、内收者为1 分;大鼠至地面,用手挤压两侧检查其抗力,手术对侧抗力下降者为2 分;大鼠至地面,观察其行走,围绕手术对侧转圈者为3 分;损伤极其严重,已无法自主活动者为4分。
2.2.5 脑梗死体积的测定 实验动物神经行为学评分后,即刻断头取脑,去除嗅束、小脑和低位脑干,将其冠状切成6 片(第1~5 片2 mm,第6 片4 mm),迅速置于TTC溶液中染色(37 ℃,避光)20~30 min,其间每隔5 min 翻动1 次[16]。经TTC 染色后,正常组织深染呈红色,梗死组织呈白色。将每组脑片排列整齐,拍照保存。应用图像分析系统软件处理并统计,求算每片的梗死面积,并最终叠加换算成梗死体积。梗死体积分数按照公式(1)计算,以所占大脑半球的百分率来表示,以消除脑水肿的影响。

2.3 提取与分离
取茶芎挥发油(组分B,50 g),干法上样,经硅胶H 柱分离,用环己烷-乙酸乙酯(4∶1)洗脱,得到3 个流分,分别为A1~A3。其中A3经十八烷基硅烷键合硅胶(ODS)中压柱色谱分离,以65%甲醇洗脱,再利用高效液相色谱法(HPLC)进行检测、合并,共获得3 个亚组分,分别为B1~B3。流分B1利用HPLC 制备,流动相为甲醇-水(65∶35),检测波长为230 nm,流速为5.0 mL·min-1,得化合物4(80 min,50 mg)、6(50 min,5 mg)和7(70 min,8 mg)。流分B2采用干法上样,经硅胶H柱分离,用石油醚-乙酸乙酯(9∶1、4∶1)洗脱,分别得到化合物2(15 mg)和3(20 mg)。流分B3采用干法上样,经硅胶H柱分离,用石油醚-丙酮(9∶1、4∶1)洗脱,分别得到化合物1(100 mg)和5(5 mg)。
取茶芎重组分(组分C,110 g),干法上样,经硅胶H 柱分离,经减压柱色谱,依次用石油醚-乙醚(9∶1)、石油醚-乙酸乙酯(4∶1)和甲醇洗脱,分别得到3 个不同流分D1~D3。其中D2组分经ODS 中压柱色谱分离,分别以50%甲醇、80%甲醇和甲醇洗脱,得到3 个不同流分E1~E3。其中E1采用干法上样,经硅胶H 柱分离,用石油醚-丙酮(4∶1)洗脱,得到化合物8(6 mg)。流分E2采用干法上样,经硅胶H柱分离,用石油醚-乙酸乙酯(6∶1→1∶1)梯度洗脱,分别得到化合物9(7 mg)、10(8 mg)、11(4 mg)、12(50 mg)和13(25 mg)。
3 结果
3.1 茶芎不同提取物对tMCAO 模型大鼠的脑缺血保护作用
实验结果显示,大鼠大脑中动脉阻塞10 min 后灌胃给予NBP 和茶芎组分B 可以显著减小脑梗死体积,而对其神经行为学损伤则无改善作用(表1)。
表1 茶芎不同提取物对tMCAO模型大鼠的脑缺血保护作用(xˉ, n=10)
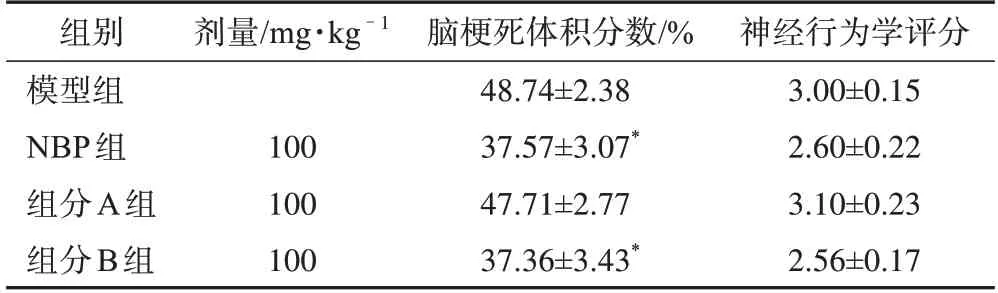
表1 茶芎不同提取物对tMCAO模型大鼠的脑缺血保护作用(xˉ, n=10)
注:与模型组比较,*P<0.05。
3.2 化合物结构鉴定
化合物1:淡黄色油状液体,电喷雾离子源-质谱法(ESI-MS)m/z:215 [M+Na]+,193 [M+H]+。1H-NMR (300 MHz,CDCl3)δ:6.15 (1H,d,J=9.9 Hz,H-7),5.88 (1H,dt,J=3.6,9.9 Hz,H-6),4.91 (1H,m,H-3),2.46 (4H,m,H-4,5),1.85 (1H,m,H-8),1.52(1H,m,H-8′),1.40 (4H,m,H-9,10),0.87 (3H,t,J=7.2 Hz,Me-11)。化合物1 与洋川芎内酯A 对照品比移值(Rf)一致,且数据与参考文献[17]基本一致,因此化合物1鉴定为洋川芎内酯A。
化合物2:无色油状液体,电子轰击源-质谱法(EI-MS)m/z:190[M]+。1H-NMR(300 MHz,CDCl3)δ:7.87(1H,d,J=7.8 Hz,H-7),7.59(1H,t,J=7.5 Hz,H-5),7.50 (1H,t,J=7.5 Hz,H-6),7.37 (1H,t,J=7.5 Hz,H-4),5.45 (1H,d,J=5.2 Hz,H-3),2.02 (1H,m,H-8),1.77 (1H,m,H-8′),1.25~1.50 (4H,m,H-9,10),0.88 (3H,t,J=7.2 Hz,Me-11)。化合物2 与正丁基苯酞对照品Rf 一致,且数据与参考文献[17]基本一致,因此化合物2鉴定为正丁基苯酞。
化合物3:无色油状液体,EI-MSm/z:188[M]+。1H-NMR (300 MHz,CDCl3)δ:7.40~7.95 (4H,m,H-4,5,6,7),5.60 (1H,t,J=7.5 Hz,H-8),2.50 (2H,m,H-9),1.11 (2H,m,H-10),1.03 (3H,t,J=7.5 Hz,Me-11)。化合物3 与正丁烯基苯酞对照品Rf一致,且数据与参考文献[17]基本一致,因此化合物3鉴定为正丁烯基苯酞。
化合物4:白色固体,EI-MSm/z:194[M]+。1HNMR (300 MHz,CDCl3)δ:6.75 (1H,d,J=3.0 Hz,H-7),3.95 (1H,m,H-3),2.47 (1H m,H-3a),2.30 (1H,m,H-6),2.20 (1H,m,H-6′),2.04~1.92 (2H,m,H-5),1.70~1.80 (2H,m,H-4),1.45~1.53 (2H,m,H-8),1.30~1.44 (3H,m,H-9,10),1.05~1.21 (1H,m,H-10),0.90 (3H,t,J=7.2 Hz,Me-11);13C-NMR(125 MHz,CDCl3)δ:170.0 (C-1),135.1 (C-7a),131.1 (C-7),85.3 (C-3),43.0 (C-3a),34.2 (C-6),27.4 (C-4),25.3 (C-8),24.9 (C-5),22.4 (C-9),20.7(C-10),13.8 (C-11)。化合物4 与新蛇床内酯对照品Rf 一致,且数据与参考文献[17-18]基本一致,因此化合物4鉴定为新蛇床内酯。
化合物5:淡黄色油状物,EI-MSm/z:204[M]+。1H-NMR (400 MHz,CDCl3)δ:7.53 (1H,t,J=8.0 Hz,H-5),7.12 (1H,d,J=8.0 Hz,H-4),6.91 (1H,d,J=7.8 Hz,H-6),5.66 (1H,t,J=8.0 Hz,H-8),2.42 (2H,m,H-9),1.55 (2H,m,H-10),0.98 (3H,t,J=8.0 Hz,H-11)。以上数据与参考文献[10]基本一致,因此化合物5鉴定为Z-7-羟基正烯基苯酞。
化合物6:白色固体粉末,EI-MSm/z:208[M]+。1H-NMR (400 MHz,CDCl3)δ:6.93 (1H,d,J=1.8 Hz,H-2),6.85 (1H,d,J=8.4 Hz,H-5),6.89 (1H,dd,J=1.8,8.4 Hz,H-6),6.52(1H,d,J=14.2 Hz,H-7),6.15(1H,dt,J=14.2,6.0 Hz,H-8),4.12 (2H,d,J=6.0 Hz,H-9),3.54 (2H,q,J=7.2 Hz,H-1′),1.25 (3H,t,J=7.2 Hz,H-2′),3.91 (3H,s,3-OMe)。以上数据与参考文献[19]基本一致,因此化合物6 鉴定为4-[(E)-3-乙氧基-1-丙烯基]-2-甲氧基苯酚。
化合物7:白色固体粉末,EI-MSm/z:150[M]+。1H-NMR (400 MHz,CDCl3)δ:6.94 (1H,s,H-2),6.87(1H,d,J=7.8 Hz,H-5),6.93 (1H,d,J=7.8 Hz,H-6),5.59 (1H,d,J=17.7 Hz,H-7),6.65 (1H,dd,J=10.8,17.7 Hz,H-8a),5.12 (1H,d,J=10.8 Hz,H-8b),3.91(3H,s,OMe-3)。以上数据与参考文献[20]基本一致,因此化合物7鉴定为4-羟基-3-甲氧基-苯乙烯。
化合物8:白色针状结晶(甲醇),EI-MSm/z:380 [M]+。1H-NMR (300 MHz,CDCCl3)δ:7.37 (1H,d,J=6.0 Hz,H-7′),5.59 (1H,d,J=7.5 Hz,H-8),4.99 (1H,d,J=7.5 Hz,H-8′),3.26 (1H,d,J=9.0 Hz,H-7),0.91 (6H,d,J=7.5 Hz,CH3-11,11′);13C-NMR(300 MHz,CDCl3)δ:168.1 (C-1),153.4 (C-3),147.5(C-3a),23.0 (C-4),29.1 (C-5),38.2 (C-6),41.1 (C-7),129.7 (C-7a),115.7 (C-8),27.8 (C-9),23.1 (C-10),13.9 (C-11),164.8 (C-1′),150.3 (C-3′),47.7(C-3a′),31.2(C-4′),25.7(C-5′),41.4(C-6′),142.0(C-7′),134.3 (C-7a′),108.8 (C-8′),27.4 (C-9′),22.2(C-10′),13.6(C-11′)。以上数据与参考文献[21]基本一致,确定化合物8为洋川芎内酯O。
化合物9:白色针状结晶(甲醇),EI-MSm/z:382 [M]+。1H-NMR (400 MHz,CDCl3)δ:7.30 (1H,d,J=6.0 Hz,H-7′),5.18 (1H,d,J=8.0 Hz,H-8),3.26(1H,d,J=9.0 Hz,H-7),0.91 (3H,d,J=8.0 Hz,CH3-11),0.85 (3H,d,J=8.0 Hz,CH3-11′);13C-NMR(400 MHz,CDCl3)δ:170.5 (C-1),156.1 (C-3),148.3(C-3a),19.8 (C-4),28.8 (C-5),39.1 (C-6),39.9 (C-7),126.1 (C-7a),113.2 (C-8),28.0 (C-9),22.3 (C-10),13.9 (C-11),167.6 (C-1′),84.3 (C-3′),48.3 (C-3a′),25.6(C-4′),25.9(C-5′),40.7(C-6′),141.8(C-7′),136.1(C-7a′),32.1(C-8′),28.7(C-9′),22.6(C-10′),13.9(C-11′)。以上数据与参考文献[21]基本一致,确定化合物9为洋川芎内酯P。
化合物10:白色针状结晶(甲醇),EI-MSm/z:382 [M]+。1H-NMR (400 MHz,CDCl3)δ:7.32 (1H,d,J=6.0 Hz,H-7′),4.98 (1H,d,J=8.0 Hz,H-8),4.79(1H,m,H-3),3.21 (1H,m,H-7),2.98 (1H,m,H-6′),2.54 (1H,m,H-6),0.91 (3H,d,J=8.0 Hz,CH3-11),0.86(3H,d,J=8.0 Hz,CH3-11′);13C-NMR(400 MHz,CDCl3)δ:171.9 (C-1),81.3 (C-3),167.8 (C-3a),31.1(C-4),29.2 (C-5),38.2 (C-6),41.0 (C-7),127.6 (C-7a),26.4 (C-8),26.2 (C-9),22.4 (C-10),13.9 (C-11),165.0 (C-1′),150.4 (C-3′),47.4 (C-3a′),31.0 (C-4′),25.5 (C-5′),41.6 (C-6′),142.0 (C-7′),134.4(C-7a′),108.7 (C-8′),27.4 (C-9′),22.3 (C-10′),13.8 (C-11′)。以上数据与参考文献[22]基本一致,确定化合物10 为(3Z′)-(3a′R,6′R,3R,6R,7R)-3,8-二氢-6,6′,7,3a′-二聚藁本内酯。
化合物11:白色针状结晶(甲醇),EI-MSm/z:412 [M]+。1H-NMR (400 MHz,CDCl3)δ:6.70 (1H,d,J=8.0 Hz,H-5′),5.06 (1H,d,J=8.0 Hz,H-8),3.32(1H,m,H-7),3.07 (1H,m,H-8′),3.59 (3H,s,COOMe),2.59 (1H,m,H-4′),0.93 (3H,s,Me-11),0.92 (3H,s,Me-11′);13C-NMR (400 MHz,CDCl3)δ:168.9 (C-1),149.0 (C-3),153.6 (C-3a),19.1 (C-4),25.9 (C-5),38.5 (C-6),38.6 (C-7),127.5 (C-7a),110.8 (C-8),28.1 (C-9),22.6 (C-10),13.9 (C-11),57.4 (C-1′),28.0 (C-2′),28.5 (C-3′),38.3(C-4′),138.9 (C-5′),138.2 (C-6′),208.2 (C-7′),39.7 (C-8′),28.5(C-9′),22.6(C-10′),14.0(C-11′)。以上数据与参考文献[23]基本一致,确定化合物11为川芎酞。
化合物12:白色针状结晶(甲醇),ESI-MSm/z:381 [M+H]+。1H-NMR (500 MHz,CDCl3)δ:7.37(1H,d,J=7.5 Hz,H-7′),5.05 (1H,t,J=8.0 Hz,H-8),4.99 (1H,t,J=8.0 Hz,H-8′),3.25 (1H,d,J=9.0 Hz,H-7),2.99(1H,m,H-6′),2.54(1H t,J=8.0 Hz,H-6),0.93(6H,t,J=7.5 Hz,Me-11,11′);13C-NMR(125 MHz,CDCl3)δ:168.5 (C-1),147.8 (C-3),154.9 (C-3a),19.6 (C-4),28.8 (C-5),38.2 (C-6),41.6 (C-7),126.6(C-7a),112.0(C-8),27.9(C-9),22.2(C-10),13.9(C-11),164.9 (C-1′),150.5 (C-3′),47.6 (C-3′a),31 (C-4′),25.8(C-5′),41.4(C-6′),142.1(C-7′),134.0(C-7′a),108.5 (C-8′),27.4 (C-9′),22 (C-10′),13.7 (C-11′)。以上数据与参考文献[24]基本一致,确定化合物12为欧当归内酯A。
化合物13:白色针状结晶(甲醇),ESI-MSm/z:381 [M+H]+。1H-NMR (500 MHz,CDCl3)δ:6.16(1H,d,J=7.5 Hz,H-7′),5.93 (1H,d,J=7.5 Hz,H-6′),5.21 (1H,d,J=7.5 Hz,H-8),3.46 (1H,d,J=7.5 Hz,H-7),2.96 (1H,q,J=7.5 Hz,H-8′),2.73~2.81 (1H,m,H-6),2.52~2.63 (4H,m,H-4′,5′),2.33(4H,m,H-9),2.16(2H,m,H-4),2.02(2H,m,H-5),1.44(2H,m,H-10),1.50(2H,m,H-9′),1.14(2H,m,H-10′),0.95 (3H,t,J=7.5 Hz,CH3-11),0.84 (3H,t,J=7.5 Hz,CH3-11′);13C-NMR(125 MHz,CDCl3)δ:170.4 (C-1′),168.5 (C-1),160.3 (C-3′a),154.6 (C-3a),149.1 (C-3),128.7 (C-6′),123.4 (C-7′a),122.2(C-7a),116.8 (C-7′),112.2 (C-8),91.9 (C-3′),43.8(C-7),34.8 (C-6),32.2 (C-8′),27.1 (C-9),26.2 (C-5),22.5 (C-10′),22.3 (C-10),20.9 (C-4′),20.6 (C-5′),20.1 (C-9′),19.5 (C-4),14.1 (C-11′),13.8 (C-11)。以上数据与参考文献[25]基本一致,确定化合物13为Z-6,8′,7,3′-二聚藁本内酯。
4 讨论
本研究对江西省特产中药茶芎进行了抗脑卒中活性筛选,初步确定了茶芎组分B(100 mg·kg-1)具有较好的抗脑卒中作用。在后续的研究中,有必要进一步考察其不同剂量的抗脑卒中活性,进而获得其半数有效剂量,这有助于茶芎的新药开发与研究。对茶芎有效组分B 进行化学成分研究,结果发现其主要成分为Z-藁本内酯[8]、洋川芎内酯、新蛇床内酯、丁苯酞和丁烯基苯酞等单苯酞类化合物。茶芎组分C 中存在大量的苯酞二聚体类成分,但是该类成分含量较低,且极性较为相似,分离有一定困难。而文献报道[7,26],苯酞二聚体类成分表现较好的抗肿瘤和抗菌活性,所以也有必要对该类成分进行系统而深入的研究。本研究结果为充分开发此类药用植物资源提供了参考。

