2021年国家药品抽检中成药质量分析△
刘静,朱炯,王翀,戴忠,马双成
中国食品药品检定研究院,北京 102629
随着国家对中医药重视程度的不断提高,人民对中医药的需求日益增长,中成药作为我国特有的中药制剂,近年来取得了长足的发展,其质量直接关系到人民用药的安全与疗效。因此,如何全面评价中成药质量显得尤为重要。
国家药品抽检作为对上市后药品监管的重要手段,近年来为我国药品质量评价、药品监管及药品质量控制水平的提高与完善等提供了强有力的技术支撑。国家药品评价抽检工作的模式是基于全国范围内的广泛抽样,在完成标准检验的基础上,进一步以问题为导向、以风险防控为原则,重点针对药品安全性、真实性、有效性和质量均一性等开展深入的探索性研究[1-6]。本文基于2021 年全国药品抽检中成药品种的质量分析报告,梳理了各品种标准检验及探索性研究发现的主要问题,通过进一步归纳分析,对中成药整体质量状况进行总结并提出相关建议,有利于相关药品质量的进一步提升,更好地保障人民用药的安全性与有效性,也可为今后中成药质量与安全控制提供参考。
1 基本情况
2021 年,国家药品抽检涉及中成药品种46 个,其中柏子养心丸、二母宁嗽丸、感冒清热颗粒、脑安片/胶囊/颗粒、伤科接骨片和天王补心丸6 个品种收载于《国家基本药物目录(2018 年版)》。剂型覆盖范围广,包括片剂、胶囊剂、丸剂、颗粒剂、散剂、膏剂、口服液和糖浆剂等,以片剂、胶囊剂和丸剂为主。2021 年度共抽检6379 批次样品,抽样环节与历年情况相同,以经营单位为主,生产单位和医疗机构抽样批次少,抽样地域覆盖全国31 个省、自治区、直辖市。执行标准涉及《中华人民共和国药典》(以下简称《中国药典》)2020 年版(一部)、《中国药典》2015 年版(一部)、《国家药品监督管理局国家药品标准》《中华人民共和国卫生部药品标准》和《药品注册标准》等,共计180 项,其中个别品种涉及标准较多,如肤痒颗粒、风湿定胶囊。
2 整体质量情况
2.1 标准检验
标准检验是检验部门根据法定标准对药品进行的全项目检验,是药品质量评价的基础,也是行政监管的法律依据。随着国家药品抽检工作的不断开展,中成药总体质量状况良好。2021 年,有35 个中成药品种标准检验合格率为100%。与历年整体结果比较(图1~2),近5 年标准检验总合格率均在98%以上,近3 年合格率均高于99%。2021 年度标准检验不合格率为0.4%,不合格项目涉及显微鉴别、薄层鉴别、水分、装量差异、微生物限度、含膏量和含量测定。此外,单品种情况以止咳桃花散合格率最低(33.3%),8 批次不合格,均为薄层鉴别项不符合规定,经承检单位分析主要因薄荷在处方中占比过低,且检测指标成分薄荷脑易挥发所致。从标准检验的结果分析,所抽检中成药整体质量较好。

图1 近5年中成药抽检品种数
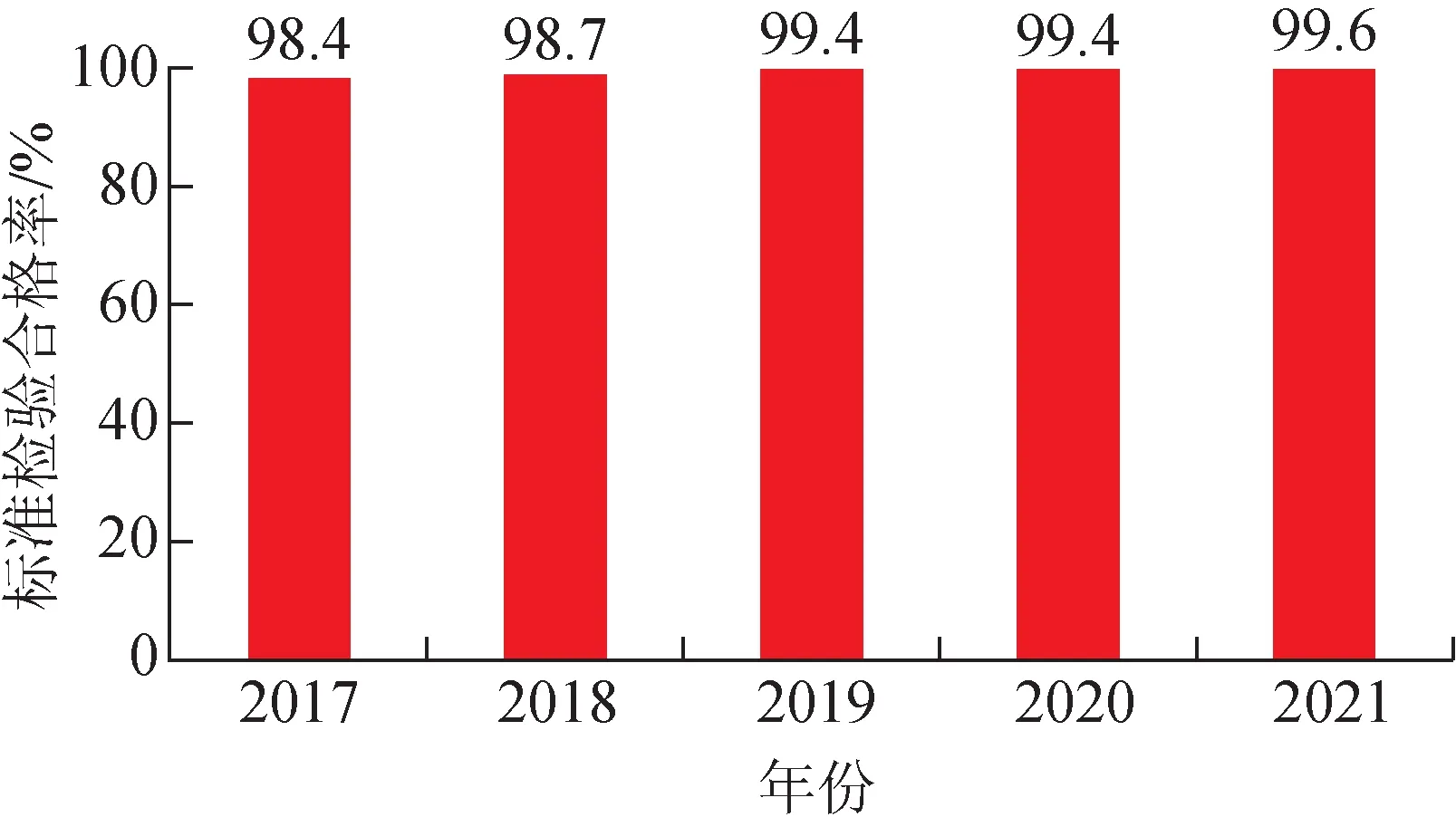
图2 近5年中成药抽检标准检验合格率
2.2 探索性研究
除心脑健胶囊/片原料为茶叶提取物外,其余品种均为复方制剂,其中处方含10 味药及以上品种占比接近50%,因此成分更为复杂,仅通过标准检验往往难以全面评价其质量,特别是对于标准未涉及药味的评价。探索性研究通常以药材原料和制剂的质量问题为导向,深入开展与药品安全性、真实性、有效性和质量均一性相关研究,旨在揭示和排查药品可能存在的质量问题,从而能够更全面地考察药品质量。通过总结2021年度46个中成药品种质量分析报告,发现主要的质量问题与历年情况基本类似[1-6],仍以药材原料质量问题为主,涉及药品安全性、真实性、有效性和质量均一性;其次为生产工艺相关的问题,个别品种还涉及辅料与包装问题。
2.2.1 药材原料质量问题
2.2.1.1 安全性相关 随着人们用药意识的不断提高,中药安全性问题越来越受关注。中药安全性风险主要来源于内源性毒性成分和外源性有害残留两方面。综合2021 年中成药质量分析报告发现,内源性毒性成分整体安全性风险较低,外源性有害残留安全性风险以重金属及有害元素和真菌毒素相对较高。
1)内源性毒性成分。46 个中成药品种中仅个别处方中涉及毒性药材,这些药材所含主要成分既是有效成分也是毒性成分。因此,相关成分与药品安全性和有效性均密切相关,需要严格控制其含量。例如,风湿定胶囊处方中含有八角枫药味,其所含毒藜碱具有一定毒性,承检单位研究建立了制剂中毒藜碱的高效液相色谱法(HPLC)限量检查方法,结果136 批样品毒藜碱测定值均低于拟定限度,但测定值差异较大,存在部分接近限度的情况。肤痒颗粒不良反应常见恶心、腹泻、呕吐和头晕等,承检单位分析可能与处方中苍耳子所含毒性成分羧基苍术苷和苍术苷有关,因此,研究建立了同时测定羧基苍术苷和苍术苷含量的HPLC。结果显示,52 批样品中羧基苍术苷测定值均较低或未检出,因此选择羧基苍术苷作为限量指标成分,其中2 批样品羧基苍术苷测定值超出拟定限度上限。麝香壮骨膏处方中药材浸膏含生川乌、生草乌,承检单位研究建立了其中乌头双酯型生物碱含量测定的HPLC,结果236 批样品中有3 批乌头双酯型生物碱测定值高于拟定上限。上述研究结果表明,内源性毒性成分整体安全性风险相对较低,但由于这些饮片/成分的特殊性,应继续加强相关质量控制,更好地保障用药安全性。
2)外源性有害残留相关。外源性有害残留相关安全性风险因素主要包括重金属及有害元素、农药残留、真菌毒素和染色等方面。随着国家药品抽检工作的持续开展、相关检查方法的不断建立与普及,国家药品监管部门对有关问题的重视与强化管理,这些安全性风险问题改善较为显著[4-12]。
2021 年,42 个中成药品种开展重金属及有害元素的探索性研究,结果显示,加味藿香正气丸、抗栓胶囊、麝香止痛贴膏和胃康灵胶囊等12 个品种存在个别批次砷、汞和铅超标的情况。32 个品种开展了农药残留相关的研究,农药残留主要检测几十种指标,其中导赤丸、脑安制剂和心脑健制剂检测指标在200种以上,最高达592种。结果显示,保心宁制剂、参苓白术制剂、抗栓胶囊和脑安制剂4 个品种存在个别批次五氯硝基苯、甲拌磷等农药残留超标的情况。27 个品种开展了黄曲霉毒素等真菌毒素方面的筛查,其中骨刺宁制剂、红药制剂和抗栓胶囊等8 个品种存在黄曲霉毒素或赭曲霉毒素A 超出拟定标准限度的情况。染色筛查方面,导赤丸、风湿定胶囊、肤痒颗粒和脑安系列制剂等19 个品种对可能存在的染色风险进行了较为广谱的筛查,筛查化工染料种类最多的涉及71 种,覆盖了市场上容易获得的、食品中常用色素添加剂及禁用色素等。结果显示,仅风湿定胶囊检出染色问题。上述研究结果表明,外源性有害残留仍存在一定安全性风险,仍应持续关注与重视。染色问题逐年降低,表明多年来打假工作取得了良好效果。
除采用色谱等分析技术考察安全性相关成分外,伤湿止痛膏还采用豚鼠和兔子进行皮肤刺激及致敏性实验,结果6批样品有轻度刺激性反应,5批样品有弱致敏性。
2.2.1.2 真实性相关 随着国家药品监管部门监管力度的不断加大,当前市场上直接采用伪品替代正品使用的情况已得到有效遏制,但受经济利益驱使或同属近缘种外观性状难以甄别导致掺伪掺杂的现象还时有发生[1-6]。基于往年国家药品抽检发现的有关问题,2021 年,参桂鹿茸丸、参苓白术制剂等22 个品种重点对处方中可能存在的真实性问题进行了探索性研究,主要涉及人参、三七、柴胡、麦冬、金银花、羚羊角和酸枣仁等。
针对处方中人参可能存在西洋参或边角料掺伪掺杂的情况,参桂鹿茸丸、参苓白术制剂、红药制剂、活血止痛胶囊、脑安制剂和脑灵素制剂6 个品种分别研究建立了相应的薄层色谱法(TLC)和/或液相色谱-质谱联用法(LC-MS/MS)检查方法,各品种均以人参专属性成分人参皂苷Rf 和西洋参专属性成分拟人参皂苷F11为检测指标。结果显示,参桂鹿茸丸、参苓白术制剂、脑安制剂和脑灵素制剂均有部分批次样品中检出拟人参皂苷F11,提示存在西洋参或其边角料掺伪掺杂的问题;红药制剂和活血止痛胶囊所有样品均未检出拟人参皂苷F11,提示不存在西洋参掺伪的问题。
针对处方中三七可能存在三七茎叶掺伪掺杂的情况,保心宁系列制剂、红药制剂、活血止痛胶囊和胃康灵胶囊4个品种分别研究建立了相应的HPLC或超高效液相色谱法(UPLC)或TLC检查方法,各品种均以三七茎叶特征性成分人参皂苷Rb3为检测指标。结果显示,4 个品种样品均未检出人参皂苷Rb3,提示不存在三七茎叶掺伪掺杂的问题。表明经过几年的打假行动,三七茎叶掺伪的情况基本消失。
针对处方中柴胡可能存在藏柴胡掺伪掺杂的问题,妇炎康复片、感冒清热颗粒、龙胆泻肝丸、小儿肺热平胶囊和小儿清热宁颗粒5 个品种分别研究建立了相应的LC-MS/MS 检查方法,各品种均以藏柴胡特征性成分尼泊尔柴胡皂苷k 为检测指标。研究结果显示,龙胆泻肝丸、小儿肺热平胶囊和小儿清热宁颗粒所有样品中均未检出尼泊尔柴胡皂苷k,提示不存在藏柴胡掺伪掺杂的问题。妇炎康复片和感冒清热颗粒均有部分批次样品中检出尼泊尔柴胡皂苷k,提示可能存在藏柴胡掺伪掺杂的问题。
针对麦冬可能存在山麦冬掺伪掺杂的问题,川贝清肺糖浆、天王补心丸和清热解毒制剂3 个品种分别研究建立了相应的LC-MS/MS 检查方法,各品种均以山麦冬皂苷B 和短葶山麦冬皂苷C 为检测指标进行研究。结果显示,3 个品种均有个别或部分批次样品中检出相关指标,表明存在山麦冬掺伪掺杂的问题。
针对金银花可能存在山银花掺伪掺杂的问题,清热解毒制剂、小儿清热宁颗粒和银花感冒颗粒3个品种均以灰毡毛忍冬皂苷乙为检测指标,分别研究建立了相应的高效液相色谱-蒸发光散射法(HPLC-ELSD)或TLC结合LC-MS/MS的检查方法。结果显示,清热解毒片均未检出灰毡毛忍冬皂苷乙;清热解毒口服液、小儿清热宁颗粒和银花感冒颗粒均有部分批次样品中检出灰毡毛忍冬皂苷乙,有的超出拟定限度,提示可能存在山银花掺伪掺杂的问题。整体而言,中成药中金银花掺伪山银花的情况近几年得到了有效遏制。
针对处方中羚羊角可能存在其他角类药材掺伪掺杂的问题,小儿清热宁颗粒和小儿肺热平胶囊2个品种分别研究建立了相应的DNA 分子鉴定技术和/或特征肽段的LC-MS/MS 检查方法。结果显示,小儿清热宁颗粒所有企业均正常投料,但不同企业羚羊角粉及水牛角浓缩粉质量存在明显差异。小儿肺热平胶囊所有样品未检出黄牛角、绵羊角、水牛角和山羊角中共同的角蛋白特征肽,均检出羚羊角肽,证明投料状况良好。
针对酸枣仁可能存在理枣仁掺伪掺杂的问题,脑灵素制剂和天王补心丸2 个品种分别研究建立了LC-MS/MS 检查方法,检测指标有所不同。脑灵素制剂检测指标为酸枣仁特征成分酸枣仁皂苷A 和理枣仁特征成分O-去甲基荷叶碱。结果显示,部分批次样品未检出酸枣仁成分,同时检出理枣仁成分;天王补心丸检测指标为欧鼠李叶碱,结果部分批次样品中检出理枣仁成分。
此外,对于薄荷、半夏、川贝母、大黄和黄柏等一些饮片的掺伪掺杂问题,往年抽检有关品种已建立了气相色谱法(GC)、UPLC及LC-MS/MS等检查方法。随着国家药品监管部门的有力监管,本次抽检涉及品种研究结果表明上述饮片的掺伪掺杂问题整体改善显著。其中未检出问题样品的有以下品种:川贝清肺糖浆和感冒清热颗粒2 个品种针对留兰香掺伪薄荷的问题,以留兰香特征性成分香芹酮为指标,结果川贝清肺糖浆样品中均未检出香芹酮;感冒清热颗粒个别批次样品中检出香芹酮,但均低于拟定限度。止咳桃花散和加味藿香正气丸2 个品种所有样品均未检出虎掌南星特征性成分水麦冬酸,表明不存在虎掌南星掺伪半夏的情况。导赤丸和龙胆泻肝丸所有样品中均未检出关木通特征性成分马兜铃酸Ⅰ和/或马兜铃酸Ⅱ、马兜铃酸Ⅳa,表明不存在用关木通替代/混用现象。骨折挫伤胶囊所有样品均未检出松香酸掺伪乳香、没药的问题。清肺抑火制剂和心脑静片均未发现关黄柏替代/掺伪黄柏投料的情况。清肺抑火制剂未检出紫花前胡特征成分,表明不存在紫花前胡替代/掺伪前胡的情况。肾石通颗粒所有样品均未检出川牛膝特征性成分杯苋甾酮和蒲黄特征性成分异鼠李素-3-O-新橙苷和香蒲新苷,表明不存在川牛膝掺伪牛膝和蒲黄掺伪海金沙的问题。心脑静片所有样品均未检出威灵仙指标成分齐墩果酸,表明不存在威灵仙掺伪铁丝威灵仙的问题。柏子养心丸未检出南五味子特征性成分安五脂素,表明不存在南五味子掺伪醋五味子的问题。保心宁系列制剂和天王补心丸2 个品种均未检出欧当归掺伪当归的问题。心可舒制剂未发现以粉葛替代葛根投料的情况。检出问题样品的品种:止咳桃花散采用高通量基因组测序、显微鉴别、HPLC、LC-MS/MS 等多重技术手段检测,结果1 批样品检出湖北贝母特征性成分湖贝甲素,疑似存在湖北贝母掺伪投料的现象。导赤丸、黄连上清系列制剂、骨折挫伤胶囊3 个品种均未检出土大黄苷,表明不存在华北大黄等掺伪大黄的问题。清肺抑火制剂个别批次样品中检出土大黄苷,提示相关企业对大黄原料质量把关不严,存在非《中国药典》2020 年版(一部)品种掺杂的问题。清热解毒片剂、口服液均有个别批次检出紫花地丁指标性成分秦皮乙素超出拟定限度的情况,提示可能存在紫花地丁掺伪甜地丁的现象。肾石通颗粒个别批次检出广金钱草特征性成分夏佛塔苷,提示可能存在广金钱草替代/掺伪金钱草投料的情况。保心宁胶囊个别批次样品中检出香圆或柚的特征性成分水合氧化前胡素,提示可能存在这些混淆品掺杂枳壳的问题。
2.2.1.3 有效性与均一性相关 中成药处方多样、成分复杂,通过以个别药味单一成分或某几个成分控制为主的标准检验往往难以实现对中成药质量的全面评价,特别是对于标准未涉及的药味。针对这一问题,目前普遍采用指纹图谱结合多成分含量测定的手段,为药品有效性和均一性控制提供更为全面的数据支持。
综合2021 年全国药品抽检中成药品种质量分析报告,指纹图谱结合多指标成分含量测定方法以UPLC/HPLC、GC 和LC-MS/MS 为主。指纹图谱研究结果显示,多数品种不同企业样品相似度较高,或除个别企业批次样品相似度低外,其余企业样品整体相似度较好,如柏子养心丸、参桂鹿茸丸、川贝清肺糖浆、肤痒颗粒、清肺抑火制剂、消炎片、小儿肺热平胶囊、泻白糖浆、心脑健制剂和心脑静片;部分品种指纹图谱企业间差异明显,甚至部分企业产品均一性较差,如保心宁制剂、脑安制剂、脑灵素制剂、肾石通颗粒、石榴健胃制剂、胃康灵胶囊、银花感冒颗粒等。多指标成分含量测定结果表明,部分品种存在个别或部分批次中检测成分含量测定值较低甚至未检出的情况,如导赤丸中黄芩、黄连、木通和玄参等8 味药中26 个代表性成分的UPLC-MS/MS 含量测定结果表明,部分批次样品中黄芩、木通和玄参代表性成分含量较低,提示相关企业这些原料饮片可能存在一定质量或投料问题。脑安制剂中人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1及红花的HPLC 含量测定结果表明,颗粒剂样品所用人参原料质量较差,胶囊剂和颗粒剂中羟基红花黄色素A 和羟基红花黄色素B 含量极低,甚至未检出(经质谱验证存在红花成分),表明所用红花质量差或投料少。小儿清热宁颗粒中羚羊角及水牛角中特征肽段的UPLC-MS/MS 分析结果表明,3 家企业均正常投料,但某企业样品中特征肽含量普遍偏低,分析可能因为降低生产成本使用骨塞比例较高的羚羊角投料所致。心脑静片中绿原酸、龙胆苦苷、钩藤碱等15 个成分的HPLC-MS/MS 含量测定结果表明,个别批次钩藤碱类成分含量较低,分析主要与原料饮片质量及工艺有关。
除采用以上检测方法分析有效成分外,个别品种还采用活性评价方式来考察有效性,如保心宁制剂采用基于斑马鱼模型的抗血栓活性评价,结果发现4 家企业样品对血栓模型的外周血流均有显著恢复作用,其余6 家企业样品未观察到显著抗血栓活性;同时结合缺味制剂药效和成分相关性分析发现当归、丹参、三七可能为抗血栓主要活性药味。
2.2.2 辅料问题 辅料以炼蜜为主,品种涉及参桂鹿茸丸、导赤丸、加味藿香正气丸和天王补心丸等,检测方法除天王补心丸采用HPLC-MS外,其余品种均采用HPLC。其中,参桂鹿茸丸通过对果糖、葡萄糖、蔗糖、麦芽糖和5-羟甲基糠醛(5-HMF)含量进行测定,结果2 批样品中果糖和葡萄糖总和低于拟定限度;部分企业样品中5-HMF 含量批间波动较大,分析可能与炼蜜工艺或原蜜质量差异大有关。导赤丸测定了果糖、葡萄糖、蔗糖、麦芽糖的含量,结果发现部分批次样品中果糖与葡萄糖比值<1,表明炼蜜存在一定的质量问题。加味藿香正气丸仅测定5-HMF 含量,结果个别批次样品存在含量超标的情况。天王补心丸针对以淀粉糖浆替代炼蜜投料的问题,以麦芽六糖为指标建立了相应的检查方法,结果个别企业样品中有检出麦芽六糖,表明其所用炼蜜存在质量问题。
此外,清肺抑火制剂中检出未标示的辅料滑石粉。小儿肺热平胶囊某企业样品中检出较大量的玉米淀粉团块,提示该企业可能违规添加辅料。小儿止咳糖浆所有样品均未检出山梨酸、羟苯甲酯、羟苯乙酯、羟苯丙酯和羟苯丁酯等添加剂,但某企业2批样品中防腐剂苯甲酸钠含量超限。
2.2.3 生产工艺相关问题 生产工艺相关问题以标准未控制药味投料规范性问题为主,包括原料饮片未按生产工艺足量投料或使用存在质量问题的饮片投料甚至不投料等情况。品种涉及保心宁制剂、黄连上清制剂、天王补心丸等。同时,针对往年发现的违规使用黄芩提取物替代黄芩投料生产的现象,二母宁嗽丸、清肺抑火制剂、小儿清热宁颗粒和心脑静片4 个品种以特征图谱或指纹图谱分别结合汉黄芩苷与黄芩苷峰面积或含量比值,或结合对照药材比对,或结合黄芩苷、汉黄芩苷、黄芩素与汉黄芩素分析的方式进行了深入的探索性研究,结果所有品种均未发现黄芩提取物投料的问题。
此外,生产工艺还对一些挥发性成分或热稳定性差的成分存在影响,如冰片、薄荷、川芎、苦杏仁、荆芥穗、广藿香、红花和钩藤等药材所含主要成分。川贝清肺糖浆部分批次样品中苦杏仁主要成分氢氰酸和D-苦杏仁苷、L-苦杏仁苷含量测定结果较低,承检单位经分析认为这可能与工艺相关,现生产工艺易造成这些挥发性有效成分的损失。心脑静片个别批次样品中冰片成分龙脑和异龙脑含量测定结果异常偏低,提示可能存在冰片投料不足或生产工艺控制不够严格,从而导致龙脑和异龙脑含量极低的情况;同时,某企业样品中钩藤碱类成分含量较低,分析因钩藤碱类成分热不稳定,提示生产企业应关注原料饮片质量及工艺参数对有效成分的影响。
针对是否存在未按生产工艺违规添加化学药品的问题,导赤丸、二母宁嗽丸、风湿定胶囊、肤痒颗粒等18 个品种分别开展了相应的探索性研究,考察的非法添加药品种类涉及泻药类、止咳平喘类、化学药激素类、抗组胺类、消炎镇痛类和止痛类等多种成分,结果导赤丸、二母宁嗽丸等14 个品种均未检出相应的非法添加成分;关节止痛膏和壮骨麝香止痛膏2 个品种均有个别批次样品中检出阿托品;麝香壮骨膏有企业样品中检出非法添加成分麝香草酚;小儿止咳糖浆有部分批次样品中检出极微量的麻黄碱和/或罂粟碱。
生产工艺相关的其他问题还包括辐照、残留溶剂问题。保心宁制剂、二母宁嗽丸、骨折挫伤胶囊、清火抑肺制剂等7 个品种均有个别或部分批次样品高剂量辐照或与工艺不符的辐照问题。川贝清肺糖浆、清热解毒口服液和肾石通颗粒3 个品种均有部分批次样品检出乙醇残留量超限的问题。
2.2.4 包装及包装材料存在的问题 包装及包装材料方面的问题涉及关节止痛膏、小儿肺热宁颗粒、止咳桃花散和泻白糖浆4 个品种。其中,关节止痛膏处方中樟脑、薄荷素油、水杨酸甲酯均为挥发性成分,且不同企业包装材料不同,因此有可能会影响制剂中有效成分的含量。考察结果显示,高温高湿条件下,内包装袋使用铝塑复合膜时对盐酸苯海拉明影响较大,使用塑料袋时有一定影响。小儿肺热宁制剂通过加速试验对不同厂家颗粒剂中水分值,颗粒剂和口服液中黄芩、人工牛黄、金银花、冰片的含量变化进行考察,结果显示,易挥发成分含量变化较小,而易氧化成分含量下降较明显,提示聚酯/铝/聚乙烯药用复合膜包装材料对氧气的阻隔性能会影响制剂质量。止咳桃花散考察结果表明,2家企业包装材料均存在问题,所用铝塑包装对人工麝香麝香酮吸附性强,不适用于止咳桃花散的包装,建议企业加强包材与药品相容性(或药品中挥发性成分相容性)的研究,并更换包装材料。泻白糖浆有2 家企业存在包装及说明书书写不规范等问题。
3 措施与建议
3.1 生产企业
综上所述,中药材及饮片对于中成药的质量影响至关重要,“药材好,药才好”。由于中药材本身的自然属性,其质量必然会存在一定客观差异。因此,规范化种植、采收、加工、炮制等环节能够从源头上控制相关因素导致的波动。作为药品质量安全的责任主体,生产企业应将人民用药安全、有效放在首位,严把原料与辅料质量关,加强生产过程控制,对于受生产工艺影响显著的情况应注重工艺优化,严格按照处方量投料并按规定工艺生产,不得擅自改变工艺、偷工减料。
3.2 标准提升
一些中成药品种由于受历史因素等限制,导致标准存在不统一或不够完善的情况,通过国家药品评价抽检工作,能够大大推动相关品种质量标准的提升,为行政监管部门提供依据,为问题样品的研判处理提供技术支持。随着国家对中医药的重视程度的不断提高,广大中药科研与检验人员也在积极探索中药质量控制与评价的新模式[13-19],希望能够更全面地反映产品真实质量,从而更好地保障人民用药的安全性与有效性。此外,建议国家制定相应措施进一步鼓励企业积极主动自主研究并提高药品质量标准。
3.3 监管措施
中成药掺伪使假、偷工减料等问题严重影响了药品质量,也给国家药品监管部门提出了挑战。综合近年来中成药质量状况,随着国家药品部门监管力度的不断加大,一些非法染色、部分药材掺伪使假问题治理取得了良好的效果,但个别质量问题还较为明显,仍需重视[1-6]。对于国家药品评价抽检工作中发现的问题样品,药品监管部门及时组织研判,一经查实,及时处理。今后对于可能出现的药品质量问题,国家药品监管部门应遵循国家对于药品监管体系和监管能力现代化建设的倡导,做好风险预判和技术储备,以便更好地保障人民用药安全与有效。

