鸡CCDC174基因生物信息学分析及其相关载体构建
周 静 ,夏 钱 ,孙国兴 ,靳 锴 ,牛英杰 ,孙红艳 ,左其生 *,张亚妮 ,李碧春
(1.扬州大学动物科学与技术学院,江苏 扬州 225009;2.教育部农业与农产品安全国际合作联合实验室,江苏 扬州 225009)
一般生物体均由精子进入卵子后形成受精卵发育而来[1]。作为精卵发育祖先细胞[2],原始生殖细胞(Primordial germ cells,PGCs)可在体外诱导分化为精原细胞或卵原细胞,作为工具细胞广泛应用于细胞治疗、再生医学和生殖医学等领域,是胚胎学和发育生物学重要研究议题。一直以来,因其具体生成和发生机制不明确,导致在体外诱导PGCs 效率较低,极大限制相关应用和推广,因此需进一步研究其机制以提高其诱导效率[3]。PGCs发生包括起源、迁移、增殖、分化等过程,受多个因素影响[4],主要包括:①关键基因:Fragilis[5]、Blimp1(即Prdm1)[6]、Prdm14[7]、Tcfap2c[8]、Oct4[9]、Nanog[10]、Wnt5A[11]、Dazl 等;②细胞因子:BMP4(Bone Morphogenetic Protein 4,BMP4)[12]、bFGF(basic Fibroblast Growth Factor, bFGF)[13]、 LIF(Leukemia Inhibitory Factor,LIF)、SCF(Stem Cell Factor,SCF)等;③信 号 通 路:BMP/smads[14]、Wnt、Notch[15]、MAPK[16]等;④表观遗传学修饰:DNA 甲基化、基因组印迹、组蛋白修饰等。但目前仍未明确影响PGCs 生成和发生的关键因子,因此需寻找新的调控因子提高其诱导效率。
本课题组长期围绕鸡PGCs 生成和发生展开研究,前期筛选并鉴定鸡PGCs 上特异性功能基因C2EIP(Chromosome 2 expression in PGCs,C2EIP),可通过调节细胞泛素化修饰水平在鸡体内有效促进PGCs形成,同时提高体外PGCs诱导效率,但其具体机制尚不明确[17]。进一步研究发现C2EIP 在PGCs 形成过程中能与CCDC174(Coiled-coil domain containing 174,CCDC174)蛋白特异性结合,关于CCDC174 功能目前尚无相关报道,与C2EIP 互作促进PGCs 形成机理尚未知晓。因此,本研究对该基因进行分析和载体构建,为进一步研究其在鸡PGCs形成过程中功能提供参考。
生物信息学[18]作为热门学科之一,紧密结合生命科学和计算机科学相关研究手段,可预测已知基因序列翻译后蛋白结构和功能[19]。本研究采用生物信息学研究方法,利用NCBI 等数据库,寻找CCDC174 基因CDS 区,以此为基础通过DNAMAN软件和在线网站对其翻译后蛋白进行理化性质、结构域和保守性等特性预测分析,以期明确其调控PGCs形成的途径和方式。
1 材料与方法
1.1 材料
鸡胚储存于中国农业科学院家禽研究所;无内毒素质粒小提中量试剂盒、通用型DNA 纯化回收试剂盒、TRIzol(购自北京天根生化科技有限公司);Trelief sosoo cloning kit、2×T5 super PCR Mix(购自北京擎科生物科技有限公司);T4连接酶(购自NEB(北京)有限公司);限制性内切酶Bam HⅠ、NheⅠ、大肠杆菌(Escherichia coli)DH5α 感受态、PrimeSTAR Max DNA 聚合酶与DL5000 DNA Maker(购自TaKaRa);反转录HisScript ⅢRT SuperMix for qPCR 试剂盒、BCA 蛋白质定量试剂盒(购自南京诺唯赞生物科技股份有限公司);引物合成和测序由南京擎科生物科技有限公司提供;转染试剂FuGENE®HD Transfection Reagen(购自Promega公司);高糖DMEM(Dulbecco's Modified Eagle's Me⁃diium,DMEM)、胎牛血清和0.25%胰蛋白酶-EDTA(购自Gibico);鼠抗鸡DDDDK-Tag(Flag)抗体(购自ABclonal公司),兔抗鸡β-Actin抗体(购自Abcam 公司);羊抗兔IgG二抗(购自康为世纪生物科技有限公司(中国北京))。无关干扰片段NCsiRNA、DF-1细胞由李碧春课题组实验室保存。
1.2 方法
1.2.1 提取总RNA
取入孵4.5 d 鸡胚,用消毒眼科镊凿开钝端,打开腹腔,收集其生殖嵴,经差速培养后得到PGCs 细胞。分别加入TRIzol 裂解细胞、氯仿分离抽提、异丙醇和乙醇纯化回收后得到PGCs 内总体RNA,并测量浓度。
1.2.2 PGCs的cDNA合成
将得到的RNA根据两步法反转录为cDNA。具体步骤如下:
①去除基因组DNA:在模板中加入4×gDNA wiper Mix 4 μL,加无酶水补足16 μL,放入PCR仪中42 ℃处理2 min;
②反转录反应:在上述产物中加5×HiScriptⅢqRT SuperMix 4 μL,混匀后放入PCR 仪中经37 ℃15 min,85 ℃5 s得到cDNA。
1.2.3 扩增CCDC174片段
利用NCBI 网站上CCDC174 的CDS 区设计其上下游引物,以反转录后PGCs cDNA 为模板扩增全长。引物序列为:上游引物F为AGTGACTTGAA TGGACAGGAGGAAGAAG;下游引物R 为TCCTG TCCATTCAAGTCACTTGTCTGTAATAAG,产物全长为2 241 bp,Tm 值为56 ℃。扩增体系为:模板50 ng,上游引物F 1 μL(10 μmol·L-1),下游引物R 1 μL(10 μmol·L-1), PrimeStar Max 10 μL,加ddH2O 补足20 μL。反应 程 序为:98 ℃5 min;98 ℃15 s;56 ℃30 s;72 ℃90 s;72 ℃7 min;4 ℃∞;步骤2~4 重复35 个循环。将得到产物进行测序。
1.2.4 生物信息学预测分析
利用生物信息学网站预测分析CCDC174 蛋白特性,具体网站和指标见表1。

表1 CCDC174 序列生物信息学分析相关网站Table 1 Websites related to bioinformatics analysis of CCDC174 sequence
1.2.5 CCDC174过表达载体构建及过表达效果检测
将pcDNA3.1 载体进行双酶切,得到产物电泳后切胶回收,前期测序成功的CCDC174 片段也同时电泳并切胶回收。利用同源重组连接体系将载体和目的基因连接,通过转化感受态试验将重组载体导入大肠杆菌中,过夜倒置培养后挑取克隆菌株,摇菌12 h 后进行菌液PCR 检测,上样体系为:2×T5 super PCR Mix 12.5 μL,菌液1 μL(OD值=1.2),上游引物F 1 μL(10 μmol·L-1),下游引物R 1 μL(10 μmol·L-1),加水补足9.5 μL,电泳对比条带长度并送测序。将测序成功的载体转染至DF-1细胞,提取其RNA 反转录后定量检测CCDC174 表达量,与未作处理的DF-1 细胞进行对比。同时,基于其CDS 序列,在起始密码子ATG 前添加kozak结构(gccacc),终止密码子前添加Flag 蛋白编码序列,5'端和3'端分别添加XhoⅠ/Eco RⅠ酶切位点。通过化学合成法合成序列后,经双酶切回收片段并与酶切后pcDNA 3.1载体连接,构建带有Flag标签的CCDC174蛋白(CCDC174-Flag)以备后用。
1.2.6 CCDC174干扰载体构建及干扰效果检测
本研究根据CCDC174 序列设计3 个干扰靶点,将干扰序列反向互补并在中间插入loop 环(TTCAAGAGA),上 游3'加TTTTTT,下 游5'加AAAAAA,形成Oligo DNA 双链并纯化、退火,用限制性内切酶BamH Ⅰ、Nhe Ⅰ对慢病毒载体pGMLV-SC5 双酶切,酶切反应液回收后把线性化载体与shRNA 模板用T4连接酶连接16 h。连接产物通过“冷激-热激-冷激”转化感受态后涂布在含Ampr抗性的LB平板上,37 ℃倒置过夜。次日挑取单菌落并送至公司测序。构建成功后干扰载体转染DF-1细胞,与未作处理DF-1细胞对比,48 h后加TRIzol 收RNA 样,通过qRT-PCR 分别检测三段干扰序列表达量。
1.2.7 Western blot 检测CCDC174 过表达和干扰载体的过表达和干扰效果
选取构建完成的过表达载体和干扰效率最优的干扰载体,分别转染至DF-1 细胞,48 h 后收集细胞,在冰上添加RIPA 蛋白裂解液充分裂解细胞以获取蛋白样品,于冷冻离心机内8 000 r·min-1离心30 min 后收取上清液。通过BCA 蛋白浓度测定试剂盒检测蛋白浓度,依此计算电泳时蛋白上样量,与上样缓冲液混匀后100 ℃变性15 min,经SDS-PAGE 电泳、转膜使目的蛋白固定至PVDF 膜上,用5%脱脂奶粉封闭2 h,将条带浸泡在Flag标签蛋白的特异性一抗溶液中过夜,第2天二抗孵育并观察其条带显影情况。
2 结果与分析
2.1 CCDC174 开放阅读框(ORF)预测及CDS 全长的确定
为明确CCDC174 的CDS 全长,本试验通过ORF Finder对NCBI公布的CCDC174序列进行ORF位置预测,结果发现虽然公布的序列中具有多个ORF,但42 bp处存在起始密码子(ATG),2 015 bp出现终止密码子(TGA),CCDC174 的CDS 全长,约1 971 bp,编码657 个aa。通过NovoPro 在线分析发现CCDC174编码的蛋白大小为74.58 ku,其氨基酸序列理论等电点(PI)为4.89,相对分子质量为74 566.12,理论分子式为C3221H5065N905O1063S34。
2.2 CCDC174克隆
为克隆CCDC174 全长,本试验提取原始生殖细胞RNA,经1.5%琼脂糖凝胶电泳检测发现RNA结构完整,具有28S,18S和5S片段(见图1A),未发生明显降解,可用于后续cDNA合成。反转录为cDNA后利用特异性引物进行PCR扩增CCDC174全长,1%琼脂糖凝胶电泳检测结果发现目的条带长度为2 241 bp,与预期结果相符(见图1B)。经测序发现与NCBI 数据库公布序列匹配率为99%,说明鸡CCDC174全长克隆成功。
2.3 CCDC174 CDS序列生物信息学分析
2.3.1 CCDC174蛋白二级、三级结构分析
蛋白结构与蛋白功能密切相关,本试验利用SOPMA 分析CCDC174 蛋白二级结构,结果发现,α-螺旋比例为38.81%,无规则卷曲Random coil(Cc)比例为53.58%,延伸链Extended strand(Ee)比例为4.87%,以及β 转角比例为2.74%(见图2)。利用SWISS-MODEL数据库对CCDC174蛋白作三级结构建模,发现其三级结构与PRKR相互作用蛋白1相似,推测CCDC174 蛋白可与其他蛋白发生结合发挥功能(见图3)。
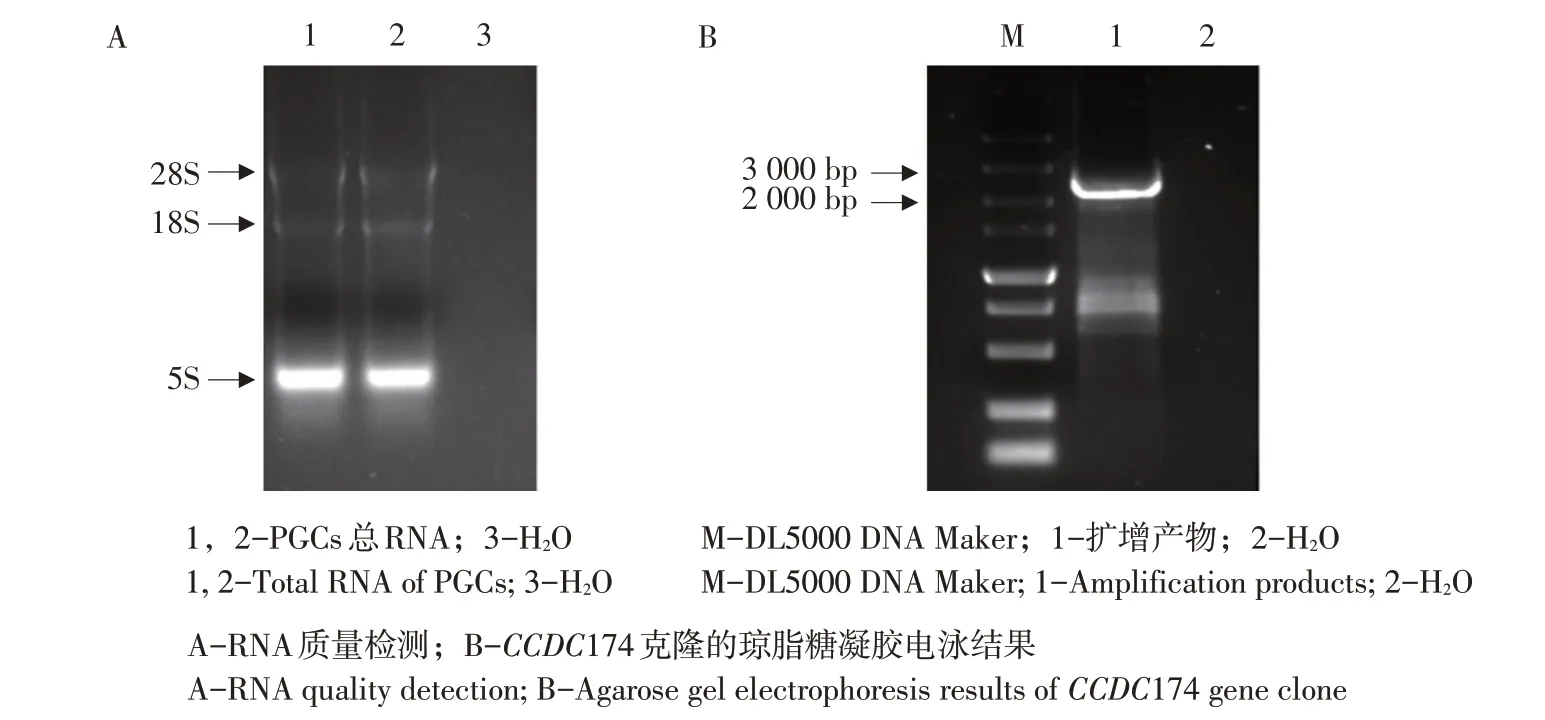
图1 CCDC174克隆Fig.1 CCDC174 gene clone

图2 CCDC174蛋白二级结构分析Fig.2 Secondary structure analysis of CCDC174 protein

图3 CCDC174蛋白三级结构Fig.3 Tertiary structure analysis of CCDC174 protein
2.3.2 CCDC174蛋白功能结构域预测
为进一步预测CCDC174 蛋白功能,本试验利用NCBI 数据库CDD 平台分析CCDC174 蛋白功能域,结果发现CCDC174 存在3 个结构域:①DUF 4078 功能域,位于655~903 bp;②PTZ00-121 功能域,位于55~1 164 bp;③PABP 功能域,位于1 555~1 893 bp(见图4)。其中PABP 功能域参与mRNA从细胞核到细胞质运输过程。
2.3.3 CCDC174信号肽预测和亚细胞定位预测
为明确CCDC174 发挥功能的具体位置,利用SignalP 5.0 Server 预测其信号肽,结果发现Sec/SPI信号肽仅占0.02%,初步说明CCDC174为非分泌蛋白(见图5A),与DSA分析结果一致(见图5B),即CCDC174 蛋白仅在细胞内发挥功能。进一步通过PSORT II Prediction,预测发现CCDC174 主要在细胞核中发挥功能,69.6%在细胞核中分布,而其余26.1%定位于细胞质,4.3%在线粒体。
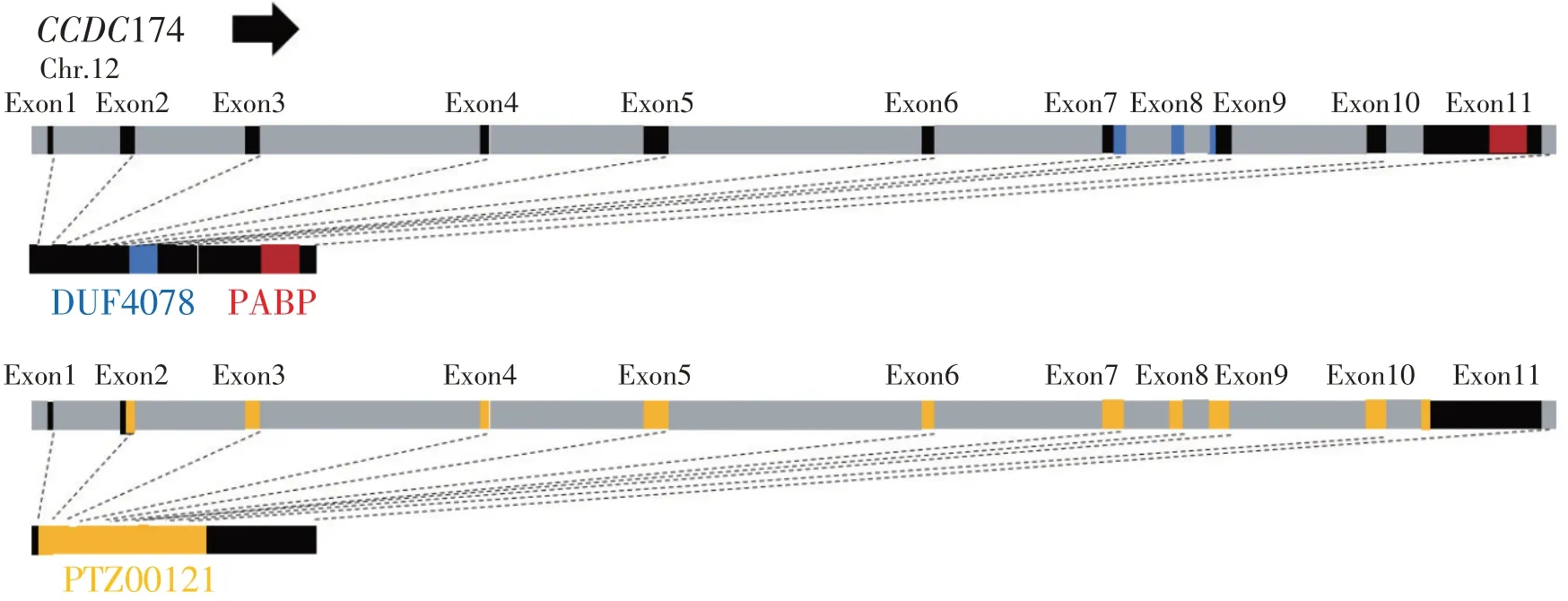
图4 CCDC174蛋白功能结构域预测Fig.4 Prediction of functional domain of CCDC174 protein
2.3.4 CCDC174修饰位点预测
蛋白翻译后修饰将直接影响蛋白功能,为确定CCDC174 蛋白潜在翻译后修饰类型,本试验利用NetPhos 对CCDC174 蛋白进行磷酸化位点预测(见图6)。结果表明,CCDC174 蛋白具有有丝氨酸的磷酸化位点26个,苏氨酸23个,酪氨酸13个。
2.3.5 CCDC174保守性分析
为比较CCDC174 在不同物种进化过程中保守性,利用DNAMan 软件对不同物种中CCDC174 进行序列分析。分析表明,在不同物种进化过程中,该基因在哺乳动物如人、大鼠和小鼠之间相近;鸟类间保守性较高,与哺乳动物、斑马鱼以及非洲爪蟾间差异较大,可初步推测CCDC174 在不同物种中功能存在差异(见图7)。
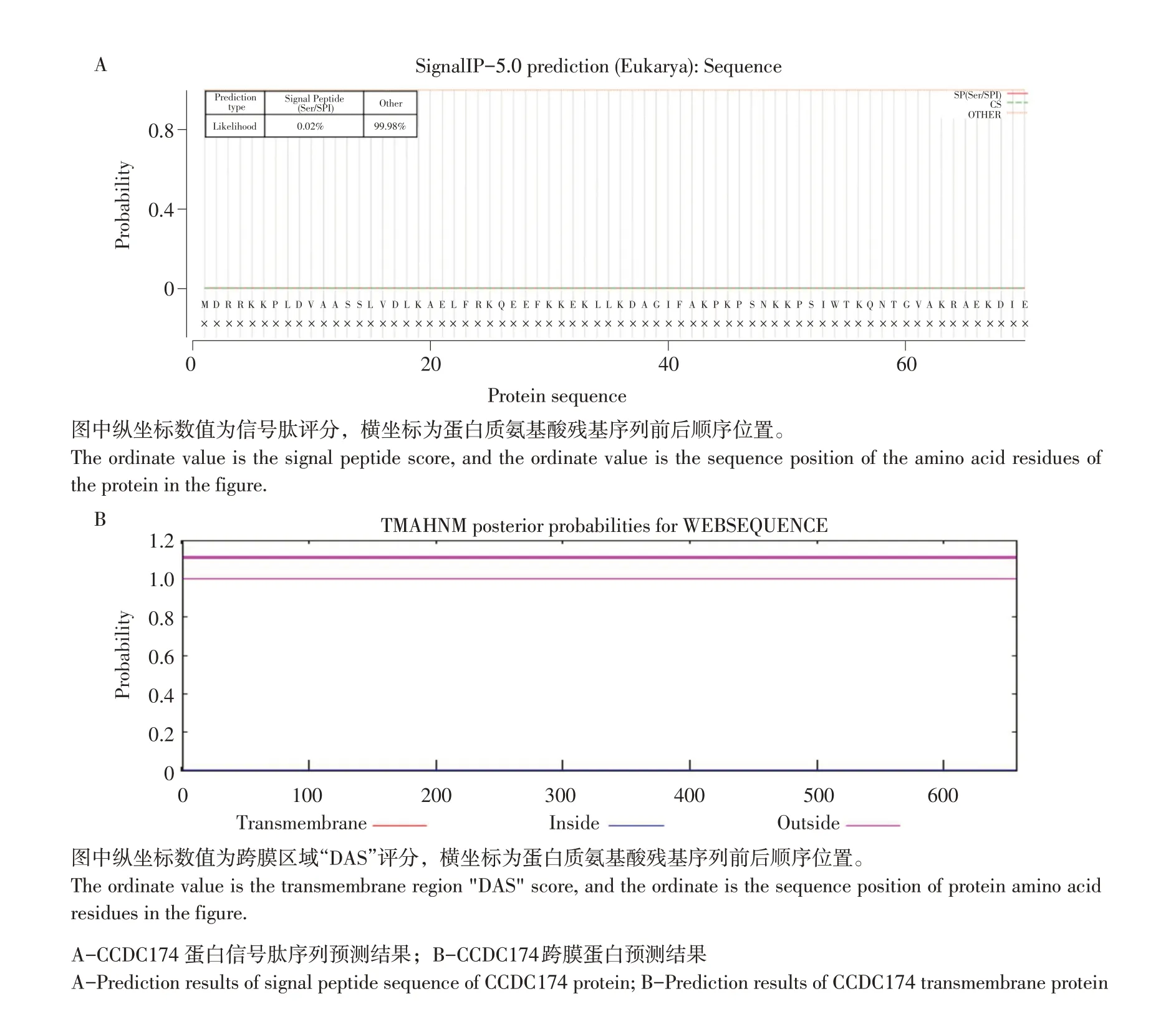
图5 CCDC174信号肽预测Fig.5 Prediction of CCDC174 signal peptide
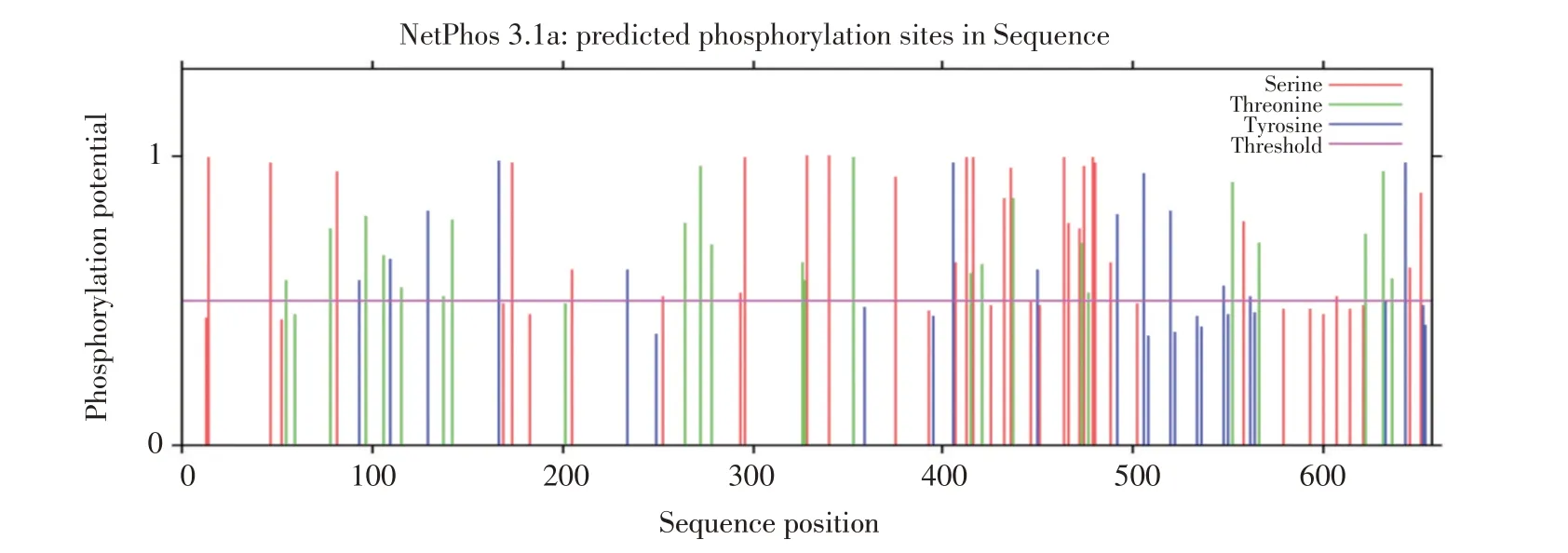
图6 CCDC174修饰位点预测Fig.6 Prediction of CCDC174 modification sites

图7 CCDC174保守性分析Fig.7 Conservative analysis of CCDC174
2.4 CCDC174过表达与干扰表达载体构建及表达效果检测
2.4.1 CCDC174过表达载体构建及过表达效果检测
为便于后续研究CCDC174 在PGCs 形成过程中具体功能,本研究将克隆获得的CCDC174序列连入pcDNA3.1载体中,通过双酶切验证(见图8A)和测序证实CCDC174过表达载体构建成功,将构建好的过表达载体转染至DF-1细胞后,通过qRT-PCR检测发现与对照组相比,转染CCDC174 过表达载体的DF-1细胞中CCDC174表达水平显著增加(见图8B)。
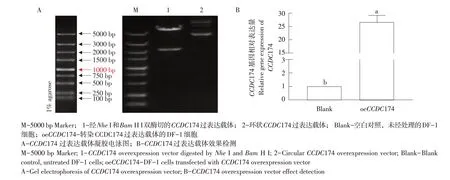
图8 CCDC174过表达载体构建与鉴定Fig.8 Construction and identification of CCDC174 overexpression vector
2.4.2 CCDC174干扰表达载体及干扰效果检测
利用在线网站根据CCDC174 序列设计3 个干扰靶点和一个无关干扰靶点,合成片段序列后连入pGMLV-SC5 载体中,结果显示载体构建成功(见图9A)。将其转染至DF-1细胞中,qRT-PCR检测发现与对照组相比,转染CCDC174干扰载体均在不同程度上导致CCDC174 表达量下降(见图9B)。
其中,1号靶点干扰效果最佳。
2.5 Western blot 检测CCDC174 过表达和干扰载体的过表达和干扰效果
为验证CCDC174 过表达和干扰载体能在翻译层面发挥作用,采用Western blot 检测CCDC174 蛋白表达情况。结果表明,单独转染CCDC174 过表达载体的细胞能够表达CCDC174 蛋白;同时,共转染CCDC174 过表达载体和CCDC174 干扰载体的细胞中,CCDC174 蛋白的条带亮度略弱于过表达组,说明CCDC174 干扰载体能够一定程度下调CCDC174蛋白表达,具有一定干扰效果(见图10)。
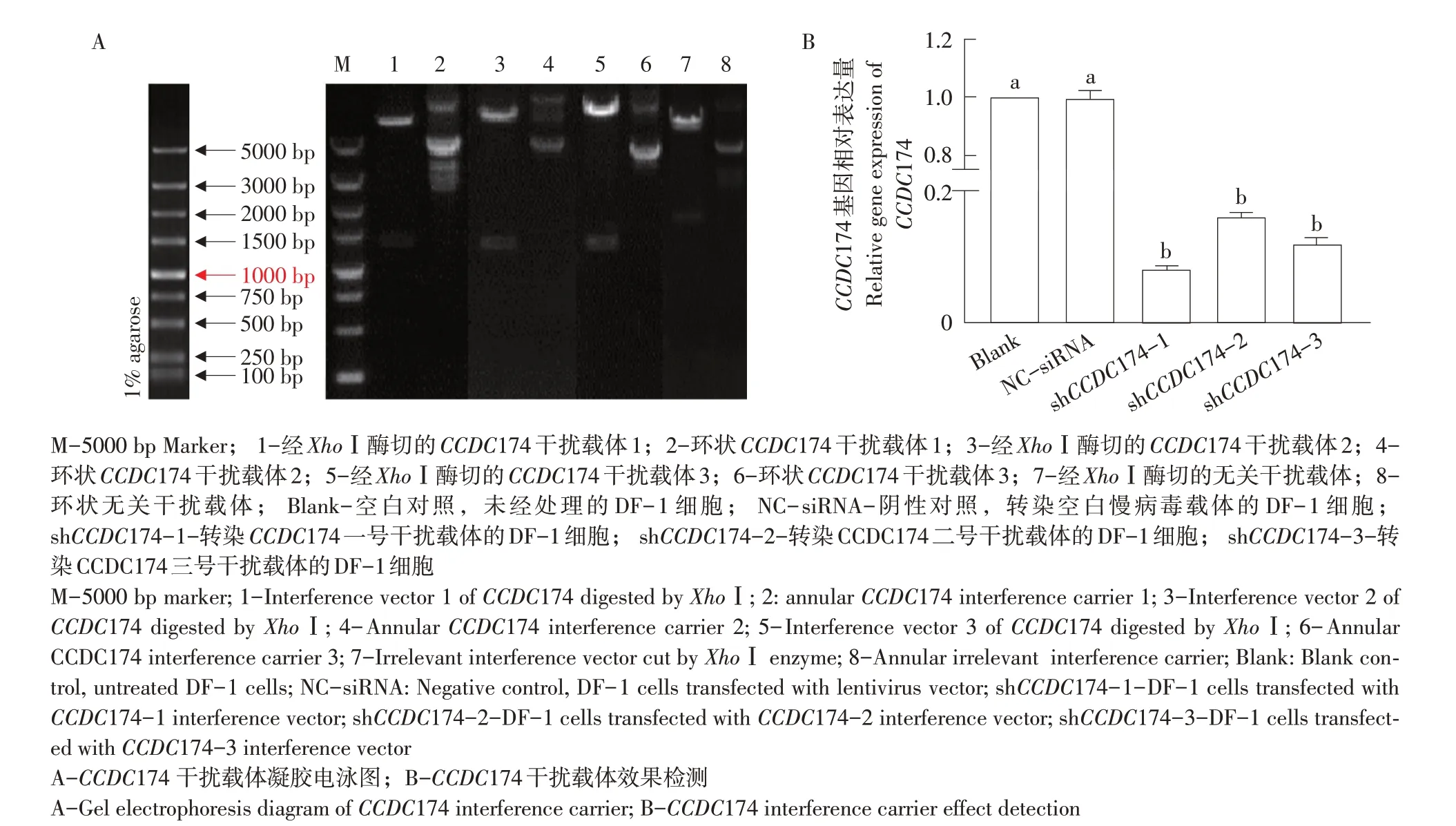
图9 CCDC174干扰载体构建与鉴定Fig.9 Construction and identification of CCDC174 interference carrier

图10 Western blot检测CCDC174载体的过表达和干扰效果Fig.10 Overexpression and interference effect of CCDC174 vector detected by Western blot
3 讨 论
本课题组长期关注鸡原始生殖细胞发生调控的研究,包括鸡PGCs 起源[20]、迁移[21]和聚集[12]规律,但对PGCs 发生的分子机制研究较少。为全面探索鸡PGCs 发生过程分子机制,前期通过转录组测序筛选到在鸡原始生殖细胞上特异性高表达的基因C2EIP,发现C2EIP 为鸡PGCs 发生的一个正向调控因子[17],C2EIP 蛋白可与CCDC174 蛋白互作,但CCDC174蛋白在PGCs上的作用研究尚属空白。本研究利用生物信息学方法详细分析预测CCDC174蛋白潜在结构、定位和保守性等生物学特性,旨在为后期探索CCDC174 功能奠定初步研究方向。
蛋白功能与细胞中具体位置密切相关。本研究通过生物信息学预测发现,CCDC174 无信号肽,为非分泌蛋白,主要存在于细胞核中,直接通过核孔进入细胞核与相应染色体结合,发挥基因转录调控作用,无需跨膜,也不存在跨膜区。系统进化树显示,CCDC174在家禽中呈现高保守性,并且同源性较强,种间差异小;但与哺乳动物相比,其同源性相差较大,可能因哺乳动物和禽类在PGCs 的产生和发育上存在较大差异,而CCDC174的互作蛋白是在PGCs上特异性高表达的C2EIP,故CCDC174可能参与PGCs形成的调控网络。
通过CDD 平台分析CCDC174 蛋白功能域发现,CCDC174 是含卷曲螺旋结构域的蛋白质,存在DUF4078、PTZ00121和PABP 3个功能域,分别位于655~903 bp、55~1 164 bp 和1 555~1 893 bp。其中,原核生物到高等动植物中均发现DUF4078家族(Domain of unknown function 4078,DUF4078),但其确切结构域功能尚不知晓;PTZ00121 被分类为可能跨越多个域的结构蛋白,是超家族cl31754的唯一 成 员;PABP(Poly-adenylate binding pro⁃tein,PABP)功能域广泛存在于真核生物中,靠近poly A结合蛋白(PABP)的C末端,通过与mRNA的3' poly A 尾部结合在基因表达途径中发挥重要作用[22]。PABP 结构域在表达调控中起支架作用,其他蛋白质可在此支架上结合并介导转录物输出,进行翻译和修饰等过程[23]。同时,PABP 可充当促进mRNA 降解结合物的拮抗剂,稳定mRNA 活性,调节mRNA 寿命[24]。此外,PABP 参与核运输,通过RNA 识别基序pfam00076 与poly A 尾巴相互作用,将mRNA 从细胞核运输到细胞质[25]。结果显示,CCDC174 蛋白主要通过PABP 结构域与C2EIP蛋白互作,参与泛素化修饰以调控PGCs形成。
本试验后续需通过Western blot检测载体表达效果,而目前并无CCDC174蛋白对应抗体,故此在构建过表达载体过程中,将Flag 标签与CCDC174 融合,以Flag 对应的特异性抗体检测CCDC174 蛋白表达情况。而Flag-Tag作为一种常见标签蛋白,因其本身分子质量较小,由“N-DYKDDDDK-C”8 个氨基酸残基组成,大小仅为1.012 ku,对目的蛋白的结构与功能影响小,更有利于检测和鉴定含有Flag的融合蛋白。
4 结 论
本研究克隆CCDC174 序列全长,通过生物信息学预测发现CCDC174 定位在细胞核中,无信号肽和跨膜区,存在磷酸化位点,拥有DUF4078、PTZ00121和PABP 3个功能域,在家禽中具有较高的保守性且与哺乳动物不相近。成功构建CCDC174过表达和干扰载体,并转染DF-1 细胞验证其活性,为后续探索CCDC174功能奠定试验基础。

