不同部位采后烟叶颜色变化差异与能量代谢的关系
牛 浩,李静浩,李鹏程,孙光伟,白 涛,陈振国,宋朝鹏,王 涛
(1. 河南农业大学烟草学院,河南 郑州 450002;2. 云南省烟草公司曲靖市公司,云南 曲靖 655000;3. 湖北省烟草科学研究院,湖北 武汉 430030)
颜色是烤烟外观质量评价中的重要指标,也在一定程度上反映烟叶的内在品质[1]。唐宇等[2]研究发现,烟叶颜色与总氮、烟碱、淀粉等化学成分呈极显著的相关关系,与烟气浓度,香气质、甜度等感官指标呈显著的相关关系。梁太波等[3]研究发现,烟叶的多酚含量与颜色特征值L*呈显著的正相关关系,与颜色特征值a*呈负相关关系。烘烤是决定烟叶外观品质和工业可用性的重要环节,其本质是烟叶脱水干燥的物理过程与生物化学变化过程的统一,注重烟叶脱水与变黄相协调。但在生产实践中,由于对烟叶的变黄变褐特征把握不准确,造成烘烤中烟叶变黄与脱水不协调,经常会烤坏烟。烤坏烟在外观上表现为烤青、挂灰、蒸片、黑糟、烤红等类型。这类烟叶化学成分不协调,工业可用性差,在实际生产中常常不予收购,给烟农带来了巨大的经济损失。
着生部位是影响采后烟叶变黄变褐特征的重要因素之一[4],一般认为,随着部位的提升,烟叶的耐烤性变好而易烤性变差,同时烟叶失水难度也逐渐提升[5]。霍开玲等[6]研究发现,烟叶的着生部位影响并决定了烟叶成熟时的素质,包括叶片的薄厚、干物质含量、叶肉细胞的致密程度等,可能是其变黄失水过程差异的原因。近年来,在对果蔬作物的研究中发现,果蔬采后衰老褐变与能量代谢活动密切相关。LIU等[7]研究发现,外源ATP处理能够有效控制荔枝果皮细胞的膜脂过氧化发展,延缓了褐变过程。董栓泉等[8]研究发现,外源蔗糖处理通过维持能量水平延缓了青花菜采后黄化过程。程顺昌等[9]的研究结果表明,1-甲基环丙烯(1-MCP)处理和CO2充气包装处理均可以通过影响南果梨果实的能量代谢特性从而延缓采后果实的衰老褐变进程。然而在烟草领域,鲜有学者对烟叶颜色变化与能量代谢的关系开展研究。基于此,以烤烟品种云烟87为研究对象,采用暗箱试验的方式研究了不同部位烟叶采后黄化褐变的发展过程,通过测定试验期间烟叶的变黄变褐程度、丙二醛(MDA)含量、糖(总糖、还原糖、淀粉)含量、能量相关物质(ATP、ADP、AMP)含量、能荷(EC)以及细胞色素氧化酶(CCO)、琥珀酸脱氢酶(SDH)等呼吸代谢相关酶的活性变化,探讨不同部位烟叶颜色变化差异及其能量代谢机制,以期为提升烟叶生产水平,合理制定烘烤工艺提供参考。
1 材料和方法
1.1 试验材料
试验于2020—2021 年在河南农业大学试验基地(河南许昌,N113°48´25″,E34°8´22″)进行,供试烟叶品种为云烟87。栽培时田间管理均按照当地优质烟叶生产方法进行。在当地烟叶适熟季节,采收叶片变黄约30%、主脉变白约50%的下部叶(第5—8 叶位)、中部叶(第10—13 叶位)、上部叶(第15—18 叶位)各200 片。采收后的烟叶立刻送回实验室进行暗箱试验。在暗箱试验期间,每隔24 h 观察变黄变褐情况;每隔48 h随机选取3片烟叶,去除主脉后,混合第6 至第7 支脉叶肉,用液氮速冻后置于超低温冰箱中保存(-80 ℃)。待试验结束后测定生理指标,各项生理指标均重复测定3 次。试验开始当天记为0 d,进行至所有烟叶变褐程度达到30%时结束。
1.2 测定指标及方法
1.2.1 变黄变褐程度测定 参考文献[10]的方法进行暗箱试验。每隔24 h 观察并记录烟叶的变黄变褐程度,直至所有烟叶变黄变褐程度均达到30%为止。计算变黄指数(Yellowing index,YI)和变褐指数(Browning index,BI)。


其中,n为统计次数,Y为各次观察时的烟叶变黄比例,B为各次观察时烟叶的变褐比例。
1.2.2 MDA 含量和浸出液电导率测定 参考文献[11]的方法测定MDA 含量。准确称取0.5 g 烟叶置于4 ℃预冷研钵中,加入2 mL 磷酸缓冲液(0.05 mol/L,pH 值7.8)冰浴研磨,将匀浆转移到EP管中,定容至5 mL。随后,使用冷冻离心机,将匀浆在4 ℃条件下离心10 min(4 500 r/min)。取离心后的上清液2 mL 转移到试管中,向其中加入3 mL 质量分数为5%的TBA 溶液混匀,沸水浴条件下精确反应10 min 后,立即冰水浴使其冷却。冷却后,再次在4 ℃条件下离心10 min(4 500 r/min)。取离心后的上清液,分别测定其在532 nm 和600 nm 波长处的吸光度。
浸出液电导率的测定参考文献[12]中的方法。准确称取0.1 g 烟叶样品,用去离子水冲洗5 次,之后用滤纸吸干叶片表面水分。取15 mL 玻璃试管,用去离子水反复冲洗后加入10 mL蒸馏水。将吸干水分的烟草叶片放入试管中,使其全部浸入液面以下。充分浸泡3 h 后,使用DDS-11A 型电导仪测定浸出液的电导率。
1.2.3 总糖、还原糖和淀粉含量测定 总糖、还原糖含量的测定采用连续流动分析法[13]。称取0.5 g烟草样品置于50 mL 三角瓶中,加入25 mL 冰醋酸,用封口膜封口后振荡萃取30 min。萃取液用定性滤纸过滤后,用连续流动化学分析仪(AAⅢ型,德国BRAN+LUEBBE 公司)测定总糖和还原糖含量。淀粉含量测定采用蒽酮比色法[14]。
1.2.4 ATP、ADP、AMP 含量和EC 测定 采用高效液相色谱法测定ATP、ADP 和AMP 含量[15]。准确称取2.0 g 烟叶置于洁净的研钵中,液氮研磨后加入1 mL高氯酸溶液(0.4 mol/L)继续研磨20 min。研磨后的匀浆在4 ℃条件下离心10 min(14 000 r/min)。弃取沉淀,留上清液,调pH 值至6.5~6.8 后定容至5 mL,随后使用微孔滤膜过滤(孔径为0.45 µm)。使用Agilent 1260 型高相液相色谱仪对滤液进行测定,使用的色谱柱为Diamonsil C18(2)(250 mm×4.6 mm×5 µm),流动相为20 mmol/L、pH 值6.5 的磷酸盐缓冲液-乙腈水溶液(99∶1,体积比),流速设定为1 mL/min,柱温设定为30 ℃。检测波长254 nm。进样量为10µL,重复3次。EC计算公式如下。
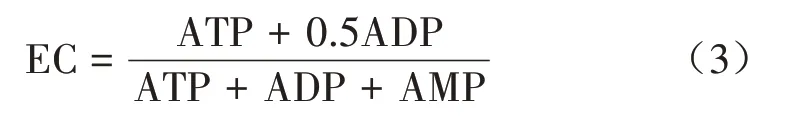
1.2.5 烟草叶片线粒体提取 采用差速离心法提取烟草叶片线粒体[15]。准确称取1 g烟叶样品,用蒸馏水冲洗干净后擦干表面水分,置于干净的预冷研钵之中。加入10 mL 50 mmol/L、pH 值为7.5的Tris-HCl 缓冲液(内含0.3 mol/L 甘露醇、1 mmol/L EDTA-Na2、质量分数为0.1%的PVP),在4 ℃条件下匀浆。随后,使用4 层纱布过滤匀浆,滤液在4 ℃条件下离心分离10 min(4 000×g);将上清液在4 ℃条件下再次离心20 min(14 000×g),离心后丢弃上清液,向沉淀中加入上述缓冲液,用毛刷小心地使沉淀溶解;接着再次在4 ℃条件下离心分离20 min(14 000×g),得到线粒体沉淀。将沉淀用1.5 mL 上述缓冲溶液溶解。
1.2.6 线粒体SDH 活性测定 SDH 活性采用南京建成科技生产的试剂盒进行测定,以2,6-二氯酚靛酚在600 nm波长处还原速度表示SDH活性。
1.2.7 线粒体CCO 活性测定 参考KAN 等[16]的方法测定CCO 的活性。向工作液(内含0.2 mL 0.04%细胞色素C水溶液和2 mL 蒸馏水)中加入0.1 mL的上述线粒体溶液。混匀后,加入0.5 mL 0.4%的二甲基对苯二胺溶液,以细胞色素C 在540 nm 波长处被氧化的速度表示CCO活性。
1.3 数据分析
采用Excel 软件进行数据整理分析,利用Origin 7.5 软件作图,采用SPSS 17.0 软件进行方差分析和显著性检验。
2 结果与分析
2.1 不同部位采后烟叶黄化褐变的发展
不同部位烟叶的变黄变褐情况如图1 所示,变黄变褐程度和变黄变褐指数如图2 所示。从图1 可以看出,随着部位的提高,烟叶的变黄变褐速度逐渐放缓。在变黄情况方面,下、中、上部叶分别在采后4 d、5 d 和6 d 达到十成黄(图2A);下部叶的变黄指数最高,为7.56,相较中、上部叶分别高6.95%和17.14%(图2B)。在变褐方面,下、中、上部叶在采后6 d、8 d 和10 d 褐变程度分别达到30%(图2A);下部叶的变褐指数最高,为5.5,相较中、上部叶分别高出140.63%和381.25%(图2B)。
图1 不同部位烟叶变黄变褐情况Fig.1 Yellowing and browning of tobacco leaves in different leaf positions
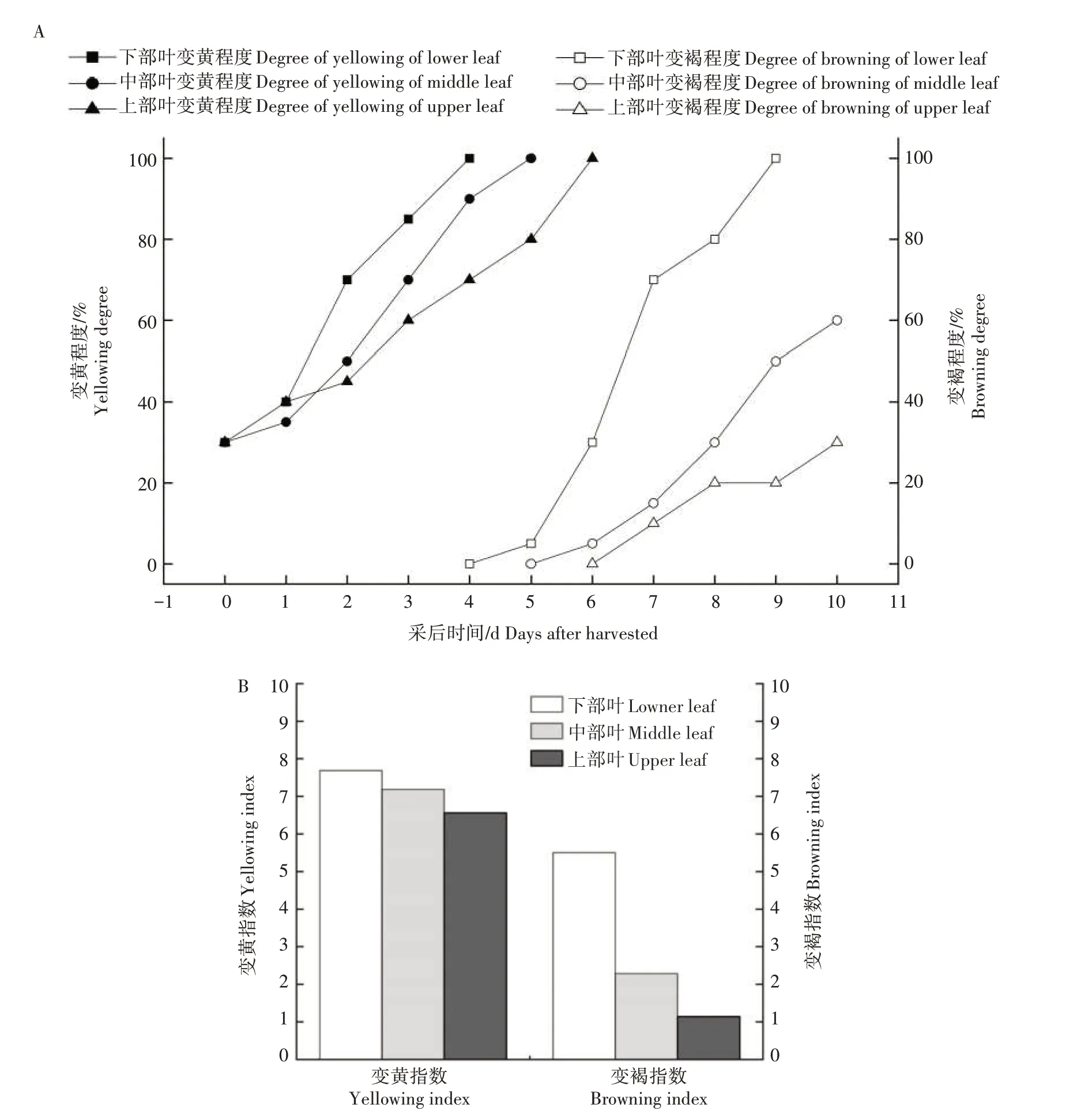
图2 不同部位烟叶变黄变褐程度(A)及变黄变褐指数(B)Fig.2 Yellowing and browning degree(A)and yellowing and browning index(B)of tobacco leaves in different leaf positions
2.2 不同部位采后烟叶MDA含量和浸出液电导率的变化
由图3 可知,不同部位采后烟叶的浸出液电导率和MDA含量均呈前期增长缓慢、后期增长迅速的趋势。由图3A 可以看出,下部叶的渗出液电导率始终处于较高水平,较中、上部叶分别平均高出20.88%和47.35%,同时下部叶浸出液电导率上升幅度较大。在采后2~10 d,下部叶的浸出液电导率均显著高于中上部叶(P<0.05)。由图3B可知,整体来看下部叶的MDA 含量较高,较中、上部叶分别平均高出17.78%和42.79%,且下部叶的MDA 含量随时间增长较快。在采后2~10 d,下部叶的MDA含量均显著高于中、上部叶(P<0.05)。
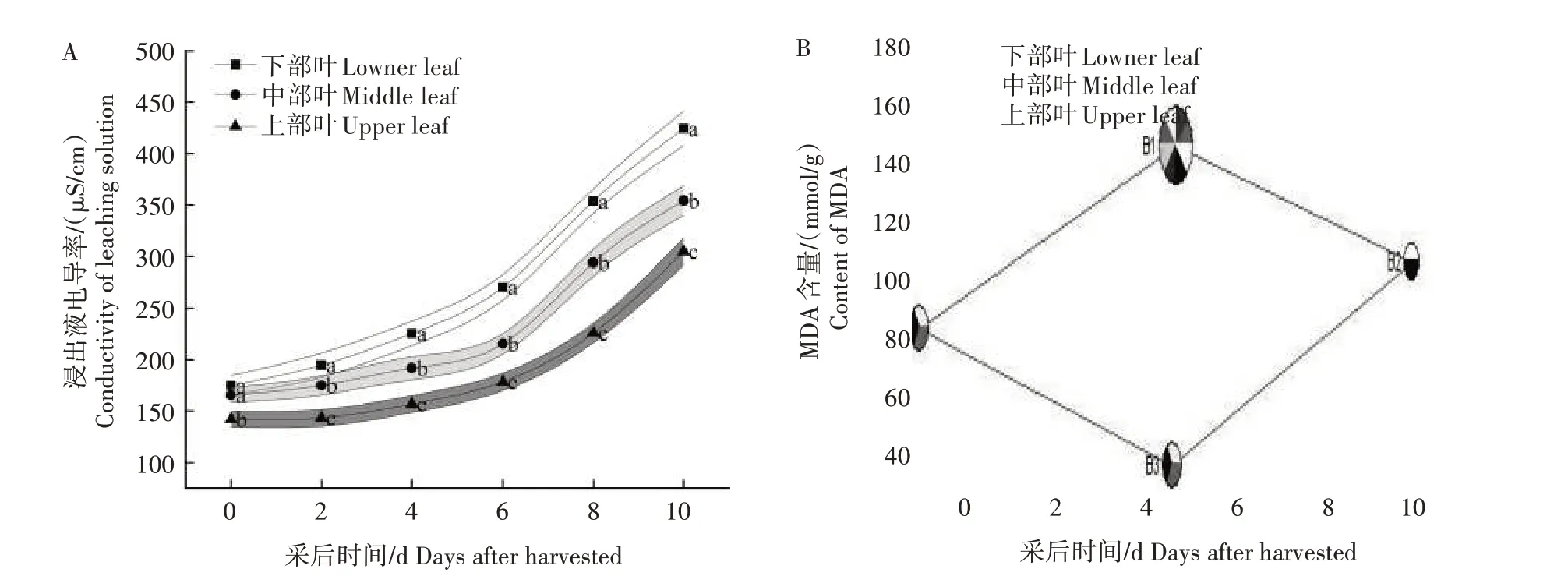
图3 不同部位烟叶浸出液电导率(A)和MDA含量(B)的变化Fig.3 Changes of conductivity(A)and MDA content(B)of tobacco leaf extract from different parts
2.3 不同部位采后烟叶总糖、还原糖和淀粉含量的变化
从图4可以看出,随着采后时间的延长,各处理烟叶总糖和还原糖含量呈先上升后下降的趋势;淀粉含量呈下降趋势。由图4A 可知,下部叶总糖含量上升较早下降较快,在采后4 d 达到了峰值;中、上部叶总糖含量高峰分别出现在采后6 d 和8 d。由图4B 可知,下部叶还原糖含量上升较早,在采后4 d 达到高峰;中、上部叶还原糖含量的高峰则出现在采后6 d。由图4C 可知,下部叶淀粉降解主要集中在采后0~4 d,淀粉含量下降9.42 个百分点,占总淀粉降解量的75.48%;中部叶淀粉降解主要集中在采后2~8 d,淀粉含量下降7.16 个百分点,占总淀粉降解量的65.99%;上部叶淀粉降解主要集中在采后4~8 d,淀粉含量下降了7.59 个百分点,占总淀粉降解量的87.34%。相较而言,下部叶淀粉降解更彻底。采后10 d,与刚采收时相比,下、中、上部叶淀粉含量分别下降12.48 个百分点、10.85 个百分点和8.69个百分点。
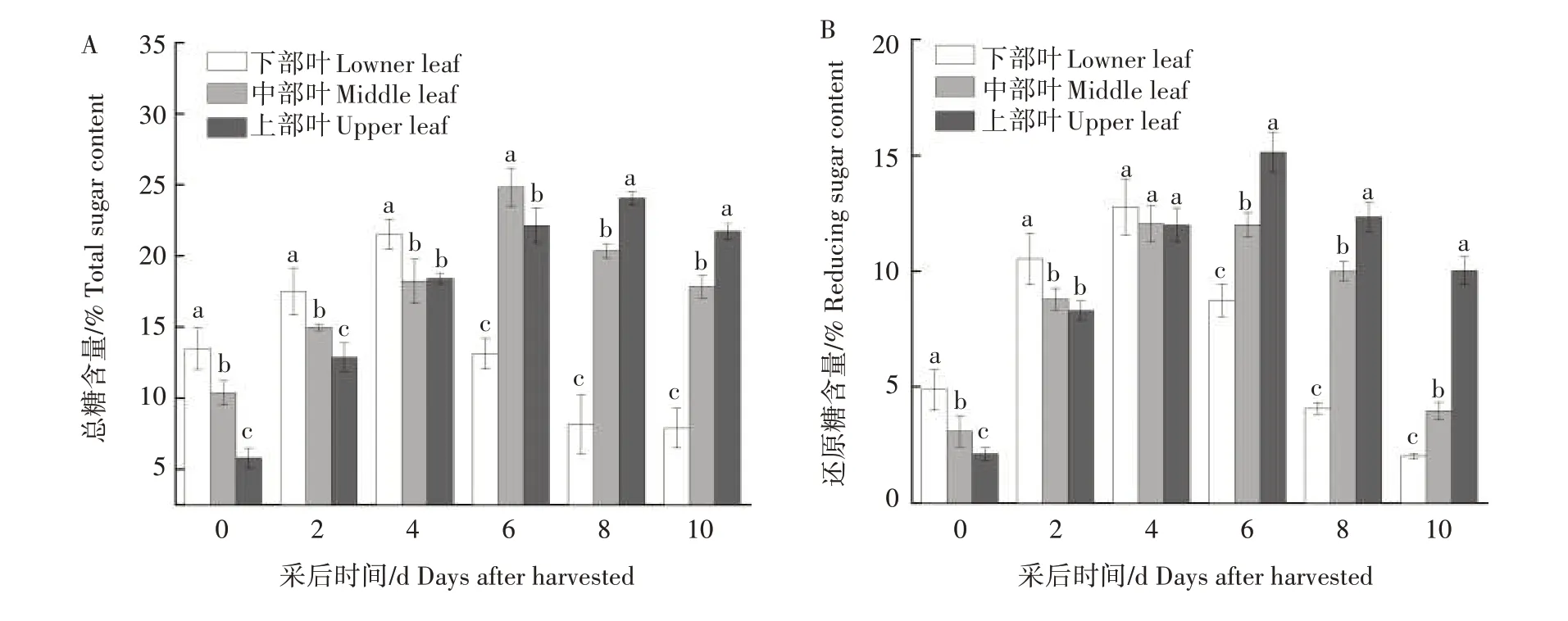
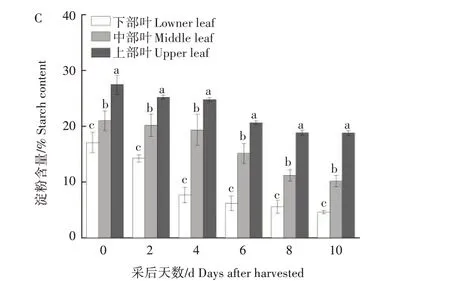
图4 不同部位烟叶总糖(A)、还原糖(B)和淀粉(C)含量的变化Fig.4 Changes of total sugar(A),reducing sugar(B)and starch(C)content in different parts of tobacco leaves
2.4 不同部位采后烟叶ATP、ADP、AMP含量及EC的变化
由图5A 可知,不同部位烟叶ATP 含量变化均呈先增加后减少的趋势。在刚采收时,上部叶ATP含量显著高于中、下部叶(P<0.05),随后各处理烟叶ATP 含量均呈上升趋势。上、中、下部叶的ATP含量分别在采后8 d、8 d 及6 d 达到峰值。随后,各处理ATP 含量均呈下降趋势。在整个试验期间,上部叶的ATP 含量均显著高于中、下部叶(P<0.05)。由图5B 可知,不同部位烟叶ADP 含量变化趋势与ATP 相似。在刚采收时,上部叶的ADP 含量显著高于中、下部叶(P<0.05);随后,各处理烟叶ADP 含量均呈小幅度上升;上、中部叶的ADP 含量在采后4 d达到高峰,而下部叶则在采后2 d 达到峰值;随后各处理ADP 含量呈缓慢下降趋势。不同部位烟叶AMP 含量的变化如图5C 所示,可以看出,各部位烟叶AMP 含量均呈逐渐上升的趋势。在整个试验期间,上部叶的AMP 含量显著高于中、下部叶(P<0.05)。不同部位烟叶EC 的变化如图5D 所示,可以看出,不同部位烟叶EC 均呈先上升后下降的趋势。在刚采收时,各部位烟叶EC 的差异不显著(P>0.05);随后各处理烟叶的EC呈上升趋势,上、中、下部叶的EC分别在采后6 d、4 d和2 d达到峰值;之后各处理EC均呈下降趋势。
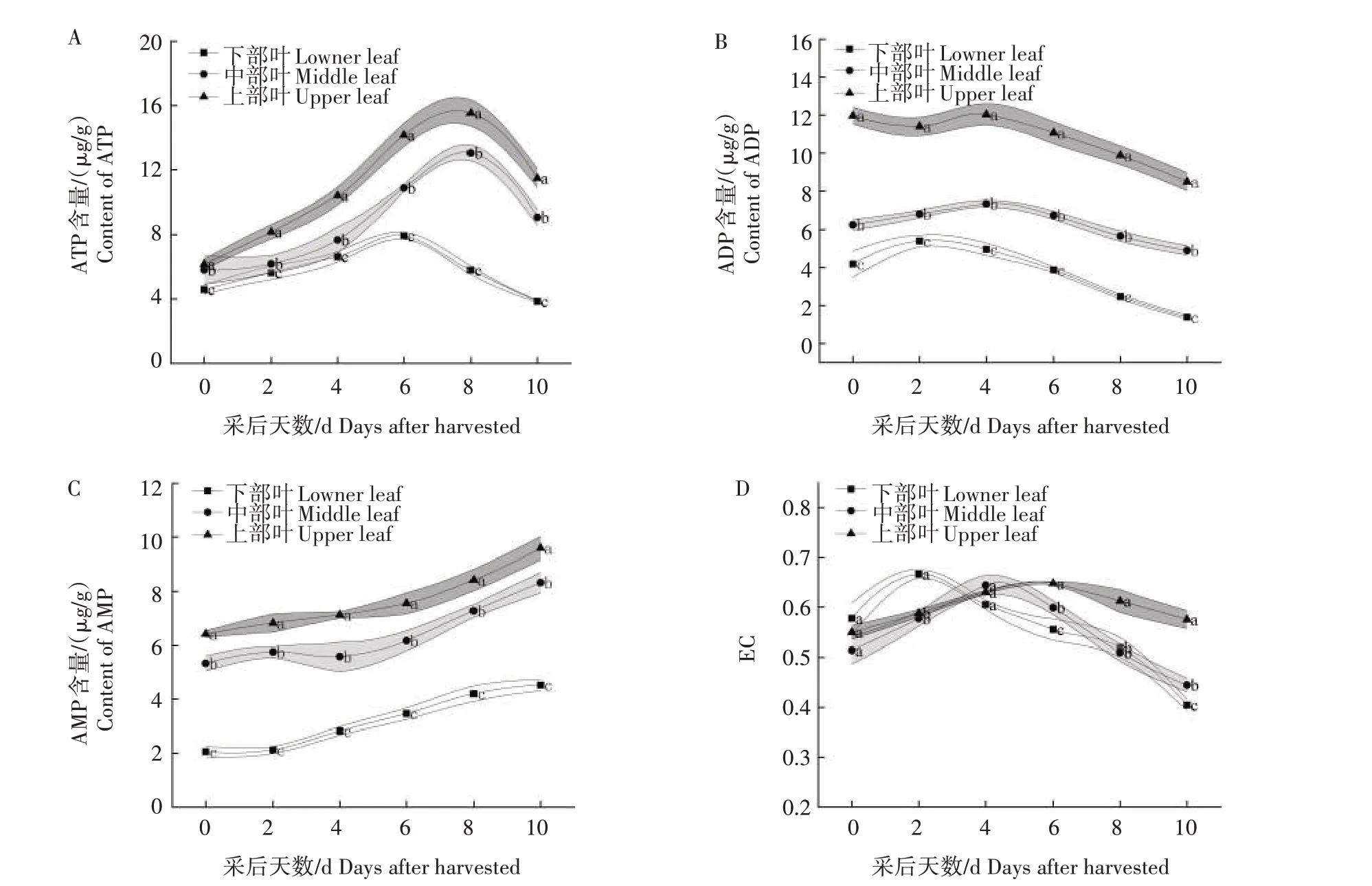
图5 不同部位烟叶ATP(A)、ADP(B)、AMP(C)含量及EC(D)的变化Fig.5 Changes of ATP(A),ADP(B),AMP(C)contents and EC(D)in different parts of tobacco leaves
2.5 不同部位采后烟叶CCO和SDH活性的变化
由图6A 可知,不同部位采后烟叶CCO 活性均呈先增大后减小的趋势。采收后,各处理烟叶CCO活性均出现明显升高,上、中、下部烟叶的CCO 活性均在采后2 d达到高峰。之后各处理烟叶CCO 活性均呈下降趋势。总体来看,上部叶CCO 活性较高,在整个试验期间分别比中、下部叶高出12.54%和14.11%。由图6B 可以看出,不同部位采后烟叶SDH 活性同样呈先增大后减小的趋势。在刚采收时,各部位烟叶SDH活性差异不大。下部叶SDH活性高峰出现在采后2 d,而中、上部叶在采后4 d 达到活性高峰。随后,各部位烟叶SDH 活性均呈下降的趋势,但下部叶下降得更快。在采后4~10 d,中、上部叶CCO活性稍高于下部叶。
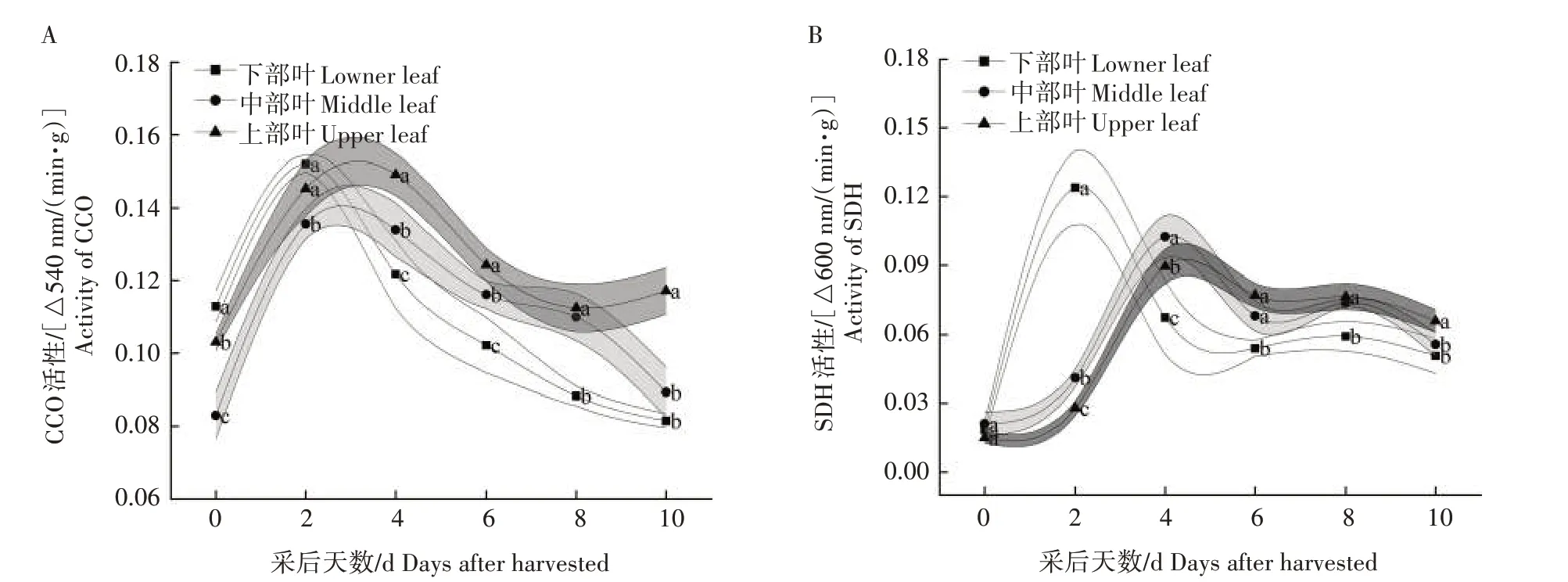
图6 不同部位烟叶CCO(A)和SDH(B)活性的变化Fig.6 Changes of CCO(A)and SDH(B)activities in different parts of tobacco leaves
2.6 不同部位采后烟叶变黄变褐程度与糖含量及能量代谢的相关性分析
不同部位采后烟叶变黄变褐程度与糖含量及能量代谢的相关性分析见表1。从表1可以看出,烟叶的变黄程度与总糖、还原糖含量呈极显著的正相关关系(P<0.01),与EC 呈显著正相关关系;烟叶的变褐程度与还原糖、ADP 含量和EC 呈极显著负相关关系,与淀粉、ATP含量呈显著的负相关关系。
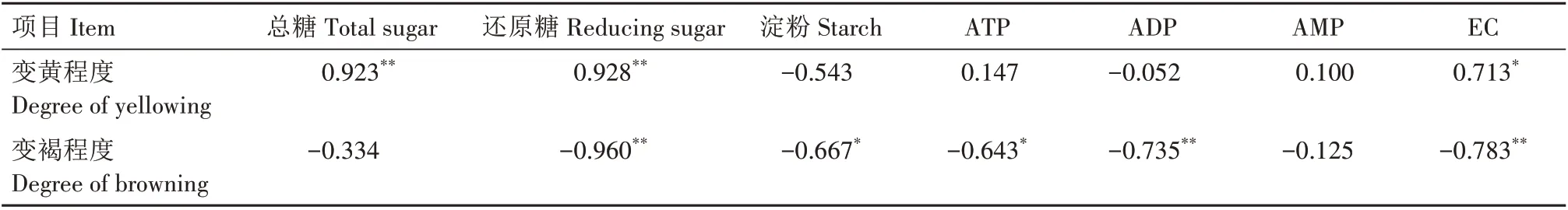
表1 不同部位采后烟叶变黄变褐程度与糖含量及能量代谢的相关性Tab.1 Correlation between the degree of yellowing and browning of postharvest tobacco leaves in different parts and sugar content and energy metabolism
3 结论与讨论
采后烟叶的变黄变褐过程是一个复杂的生理生化过程,已有研究将这一过程描述为离体环境下烟叶加速衰老的饥饿代谢过程[17]。近年来,果蔬保鲜方面的研究发现,多种果蔬衰老褐变的发生与能量供应不足有关[18‐20]。在烟草领域也有文献报道佐证了这一观点,认为采后烟叶黄化褐变并最终走向衰老死亡是能量代谢失衡的结果[21]。对烟草而言,糖类是重要的能量来源[22]。淀粉是烟叶内碳水化合物的主要贮藏形式[23],总糖和还原糖则是烟叶进行呼吸作用的直接能量来源[24]。本研究中,随着烟叶变黄变褐程度的不断加深,各处理烟叶的淀粉含量呈不断下降的趋势,总糖和还原糖则呈先上升后下降的趋势,表明淀粉首先在淀粉酶的作用下大量分解,但产生糖的总量大于呼吸作用产生能量所消耗的量,造成了总糖和还原糖含量的暂时上升;而后随着淀粉分解逐渐变缓,新产生的糖类不能满足产能活动的消耗,总糖和还原糖含量开始下降,这与马力等[25]的研究结果相似。相较而言,下部叶淀粉含量相对较低且降解时间更靠前,总糖和还原糖含量在前期能够保持较高水平但中后期相对较低,这表明下部叶的能源底物更早出现了短缺现象,导致烟叶细胞出现能量缺乏现象,进而引发褐变;而中、上部叶的淀粉含量降解时间靠后,总糖和还原糖含量在中后期仍能够保持较高的水平,为其产能活动提供了充足保障,因此褐变发生较晚。相关性分析结果表明,烟叶的变黄程度与总糖、还原糖含量呈较强的正相关关系,变褐程度则与还原糖含量呈较强的负相关关系,表明采后烟叶的颜色变化与作为能量来源的糖分含量密切相关。
ATP、ADP、AMP 含量和EC 水平能够较为直观地反映烟叶细胞内的能量代谢状态[26]。本研究中,各处理烟叶ATP 含量、ADP 含量和EC 水平呈先上升后下降的趋势,AMP 含量则逐渐上升,同时伴随着MDA含量和浸出液电导率上升,膜脂过氧化程度加重导致变黄变褐程度逐渐加深。这表明采后烟叶能量代谢活动与糖代谢活动类似,表现出先加强后减弱的趋势,这与前人的研究结果有相似之处[27]。同时,ATP 含量和EC 水平的高峰几乎与淀粉降解高峰及总糖、还原糖含量的高峰同时出现,提示能量代谢活动与淀粉降解及其他糖代谢活动可能存在较为密切的联系。相较而言,高叶位处理烟叶的ATP 含量和EC 水平较高且高峰到来较晚,并能够维持较长时间的高EC 水平,这种现象可能是因为其内含物质积累丰富,为应对长时间的逆境环境提供了充足能源保障,这与李春曦等[28]在桃软化研究中得出的结果有相似之处。CCO 和SDH 是反映线粒体能量代谢的关键标志酶,其活性大小直接影响烟叶细胞合成ATP 的能力。本研究中,各处理烟叶CCO 和SDH 活性均呈先增加后减少的趋势,与ATP含量的变化趋势相一致。相较而言,较高叶位烟叶CCO 和SDH 活性上升较为缓慢,活性高峰出现更晚,但整体水平较高,这也是其维持长时间高EC 水平状态的原因之一。相关性分析结果表明,EC与烟叶的变黄程度呈显著正相关关系,与变褐程度呈极显著负相关关系,表明EC 水平的提升促进了烟叶的变黄变褐过程,而在后期,EC 水平下降导致能量亏缺可能是烟叶褐变的原因。这一结果与果实储藏研究中“呼吸跃变”导致果实软化衰老的观点有相似之处[29]。
总体上,上部叶膜脂过氧化发展过程相对平和,内含物质积累丰富,能量代谢高峰出现较晚且能够维持较长时间的高EC 状态,表明上部叶对于离体逆境环境的耐受能力较强,在饥饿代谢的环境下能够维持更长时间生命活动,因而变黄变褐发展较为缓慢;而下部叶膜脂过氧化发展过程较为剧烈,内含物质积累相对薄弱,能量代谢高峰出现较早且高EC 状态维持时间较短,表明下部叶对离体的逆境环境耐受能力不佳,因而变黄变褐发展过程较快。在生产实践中,针对物质积累薄弱的下部叶,在烘烤时应注重避免其因能量代谢过度发生褐变;而对于物质丰富的上部叶,在烘烤时应采取措施适当提升前中期烟叶的能量代谢活动以促进烟叶顺利变黄。需要注意的是,本研究是在暗箱条件下分析烟叶颜色变化与能量代谢的关系,而实际烘烤过程与暗箱环境存在一定的差异。因此,继续研究烘烤工艺参数(如温度、湿度、稳温时间等)对烟叶能量代谢活动能够产生怎样的影响,是今后实践应用中应首要解决的问题。

