土壤微生态对二氯喹啉酸污染及Enterobacter ludwigii EM1 修复的响应
张智超,高 明,赵 昊,王晓雅,曹子敬,吴 坤,徐淑霞
(河南农业大学生命科学学院,河南 郑州 450002)
二氯喹啉酸是一种高度选择性的生长素类水田除草剂,能防除稻田中的单子叶杂草,是我国水稻田常用的除草剂之一[1]。二氯喹啉酸在水稻田中长期使用,会使土壤中的残留量逐渐增加,对水稻产生药害作用[2],导致“葱心苗”出现。因此,土壤中二氯喹啉酸残留成为作物轮作的主要问题之一。闫车太等[3]的研究表明,土壤被二氯喹啉酸污染后在10个月内仅能种植水稻,12 个月后仅能种植烟草、茄子等农作物。另外,LANG 等[4]的研究发现,土壤中二氯喹啉酸会被一些敏感的植物通过根、叶或发芽的种子吸收,从而激活1-氨基环丙烷-1-羧酸合成酶,最终导致氰化物和脱落酸在植物组织中积聚,严重的可致使植物死亡。二氯喹啉酸同样会对土壤微生态造成严重影响。ZHANG 等[5]的研究表明,在未淹水和淹水的水稻土中,真菌和细菌的生物量在二氯喹啉酸含量为83.3 µg/kg 的条件下,呈现下降的趋势,但在高含量二氯喹啉酸污染下细菌和真菌的生物量则呈现相反趋势,严重影响土壤生态稳定。解决土壤中二氯喹啉酸的药害问题迫在眉睫。
微生物的代谢途径多种多样,在农药降解中应用前景广阔,微生物修复也被广泛应用于土壤重金属和有机污染等领域,具有广阔的应用前景。目前,研究者们通过分离不同环境下的微生物,获得了能够降解二氯喹啉酸的微生物,如吕镇梅[6]从二氯喹啉酸污染的土壤中分离筛选出1株洋葱伯克氏菌(Burkholderia cepacia),具有良好的二氯喹啉酸降解效果。路德维希肠杆菌(Enterobacter ludwigii)EM1 是一种对水体中二氯喹啉酸和镉复合污染具有一定降解能力的菌株,可有效降低水体中二氯喹啉酸污染程度[7],然而EM1 添加后对土壤中二氯喹啉酸污染的修复能力以及微生物群落变化的影响尚不清楚。因此,模拟二氯喹啉酸污染土壤,通过定量添加EM1菌剂,研究其作用前后一定时间内对污染土壤中可培养菌落、酶活性、二氯喹啉酸含量的影响,并通过高通量测序方式对土壤中细菌多样性进行测定,从而为土壤中二氯喹啉酸污染防治提供新思路。
1 材料和方法
1.1 试验材料
试验用土采自河南农业大学文化路校区(E113° 66´98″,N34° 79´13″)1 号楼东南角花园,将其自然风干过2 mm筛子。
EM1 为河南农业大学环境微生物实验室分离得到的Enterobacter ludwigii菌株,初步研究后发现,该菌对二氯喹啉酸和重金属镉具有较好降解作用。
1.2 试验方法
1.2.1 试验设置 采用盆栽试验,每个花盆装1 kg风干土,加入二氯喹啉酸至终含量为0.5 mg/kg。EM1以菌液的形式加入,每1 kg干土添加100 mL的EM1 菌液(OD600≈1)和140 mL 蒸馏水。对照土壤加入240 mL 的蒸馏水。试验设置3 个处理,分别为无污染对照(CK)、二氯喹啉酸污染处理(QNC)、二氯喹啉酸污染EM1 修复处理(QNC+EM1),每组处理设置3个重复。试验过程保持各处理土壤含水量为土壤最大持水量的60%。每隔5 d取样1次。
1.2.2 土壤菌落计数 采用稀释涂布平板法测定各处理土样的细菌、放线菌和真菌数量。
1.2.3 土壤酶活性测定 脲酶、磷酸酶、蔗糖酶活性的测定分别采用苯酚钠次氯酸钠比色法、磷酸苯二钠比色法、3,5-二硝基水杨酸比色法进行。
1.2.4 土壤中二氯喹啉酸含量测定 取风干土壤样品5 g于50 mL离心管中。加入pH 值为10.0的硼砂缓冲液5 mL,静置1 h,35 ℃、220 r/min 振荡1 h。5 000 r/min离心20 min,上清液经0.45µm 的有机相滤膜过滤,用HPLC 色谱仪(UltiMate 3000,Thermo Fisher,Netherlands)进行检测,HPLC 色谱条件为:250 mm×4.6 mm,5 µm,Acclaim 120 C18 色谱柱,流动相为V(甲醇)∶V(0.2% 磷酸)=75∶25,流速1 mL/min,检测波长240 nm,柱温35 ℃。
1.2.5 土壤细菌多样性测定 将培养35 d 的土壤样品用Illumina 公司的MiSeq PE300 高通量测序平台进行测序,获得序列后利用生物信息学方法分析生物群落多样性。
2 结果与分析
2.1 土壤可培养微生物对二氯喹啉酸污染及EM1修复的响应
2.1.1 细菌对二氯喹啉酸污染及EM1 修复的响应 由图1可知,CK 土壤中的细菌数量呈先降低后增加再降低的变化趋势,培养35 d 时土壤细菌数量少于培养0 d 时。在QNC 处理中,培养5~20 d 时细菌数量高于CK,其中培养15 d 时达到最高,为1.1×107cfu/g,相比CK 增加49.1%;培养25~30 d 时细菌数量低于CK;培养结束时相比CK 增加26.6%。在QNC+EM1 处理中,土壤细菌数量呈现先升高后降低再升高的变化趋势,培养15 d 时细菌数量达到最大值,为1.7×107cfu/g,远高于CK 和QNC 处理,相较于QNC 处理增加54.5%;培养结束时相比于CK和QNC 处理分别增加36.5%和15.6%。因此,添加降解菌EM1可明显增加土壤中细菌的数量。

图1 二氯喹啉酸污染及添加EM1后对土壤中细菌数量的影响Fig.1 Effect of quinclorac pollution and addition of EM1 on the number of bacteria in soil
2.1.2 放线菌对二氯喹啉酸污染及EM1 修复的响应 由图2可知,CK 土壤中的放线菌数量随处理时间的延长呈增长趋势,培养25 d 时达到最大值,为0.9×106cfu/g。在QNC 处理中,土壤放线菌数量随培养时间延长而增加,在培养30~35 d 时数量急剧减少,并且除第30 天之外,QNC 处理放线菌数量相比CK 均有所下降,培养结束时相较于CK 下降18.5%。在QNC+EM1处理中,培养35 d时放线菌数量高于培养0 d 时,在培养25~30 d 时低于QNC 处理,培养结束时相比CK 和QNC 处理分别增加6.7%和29.4%。

图2 二氯喹啉酸污染及添加EM1后对土壤中放线菌数量的影响Fig.2 Effect of quinclorac pollution and addition of EM1 on the number of actinomycetes in soil
2.1.3 真菌对二氯喹啉酸污染及EM1 修复的响应 由图3 可知,在CK 中,培养35 d 时的土壤真菌数量为3.9×104cfu/g,比培养0 d 时降低了24.1%。在QNC 处理中,土壤真菌数量在培养20 d时达到最大值,为5.6×104cfu/g;培养20~30 d 时真菌数量持续下降;培养结束时,QNC 处理真菌数量为4.9×104cfu/g,相比CK 增加25.3%。在QNC+EM1 处理中,土壤真菌数量在培养10、30 d时达到最低,均为3.7×104cfu/g,但土壤真菌数量在培养30~35 d 时出现反弹,与CK 和QNC 处理呈现相似趋势。培养结束时QNC+EM1 处理相比CK 土壤真菌数量增加7.6%,相比QNC处理降低14.1%。
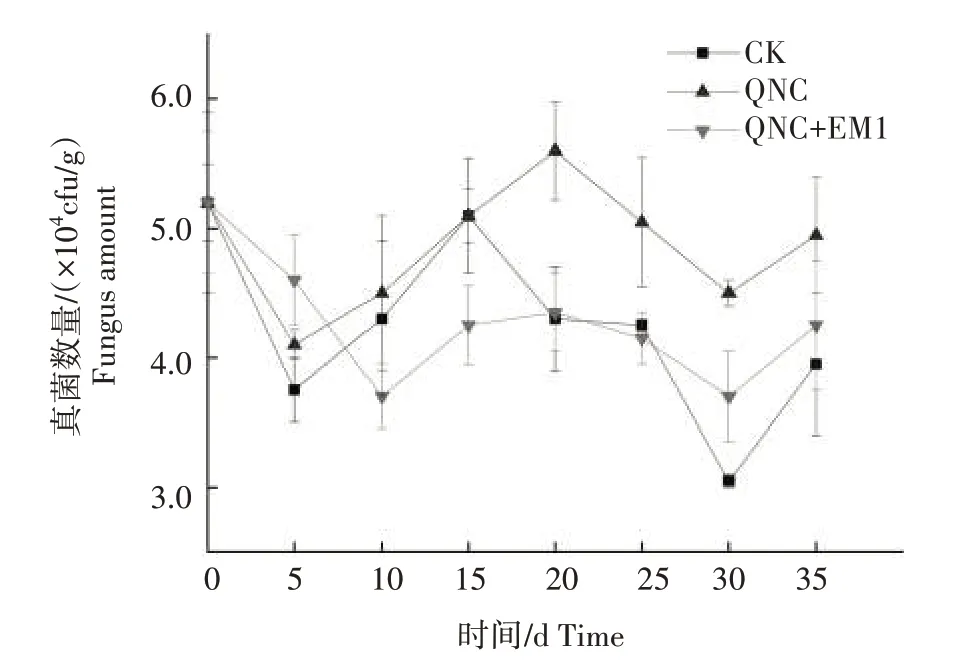
图3 二氯喹啉酸污染及添加EM1后对土壤中真菌数量的影响Fig.3 Effect of quinclorac pollution and addition of EM1 on the number of fungi in soil
2.2 土壤酶活性对二氯喹啉酸污染及EM1修复的响应
2.2.1 脲酶对二氯喹啉酸污染及EM1 修复的响应 土壤中的脲酶活性变化如图4 所示,3 个处理土壤脲酶活性均呈现先升高后降低再升高的变化趋势。在CK 中,土壤脲酶活性在培养结束时高于培养0 d 时。在QNC 处理中,土壤脲酶活性在培养15 d 时最高,达到134.1 mg/(g·d),相比CK 增加35.9%,其余时间其脲酶活性与CK 差别较小。在QNC+EM1 处理中,土壤脲酶活性在培养10、25 d 时低于CK 和QNC 处理,在培养15 d 时相比CK 升高27.8%,培养结束时土壤脲酶活性与CK 无明显差别,相比QNC处理下降6.8%。
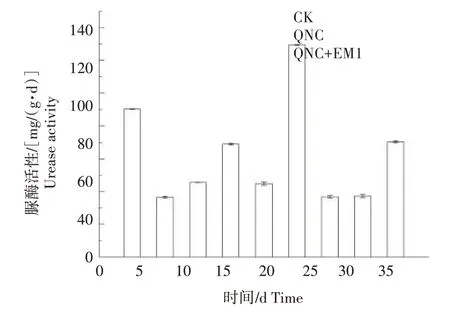
图4 二氯喹啉酸污染及添加EM1后对土壤脲酶活性的影响Fig.4 Effect of quinclorac pollution and addition of EM1 on soil urease activity
2.2.2 磷酸酶对二氯喹啉酸污染及EM1 修复的响应 土壤中的磷酸酶活性变化如图5 所示,3 个处理的土壤磷酸酶活性均为先升高后降低的变化趋势。QNC 处理的土壤磷酸酶活性在培养0~15 d 时升高,在培养25~35 d 时活性略低于CK,但不明显。在QNC+EM1 处理中,土壤磷酸酶活性在培养25 d时达到最大值,为18.6 mg/(g·d),之后呈下降趋势,但仍明显高于CK 和QNC 处理。在培养结束时QNC+EM1 处理土壤磷酸酶活性相比CK 和QNC 处理分别上升135.8%和149.7%。
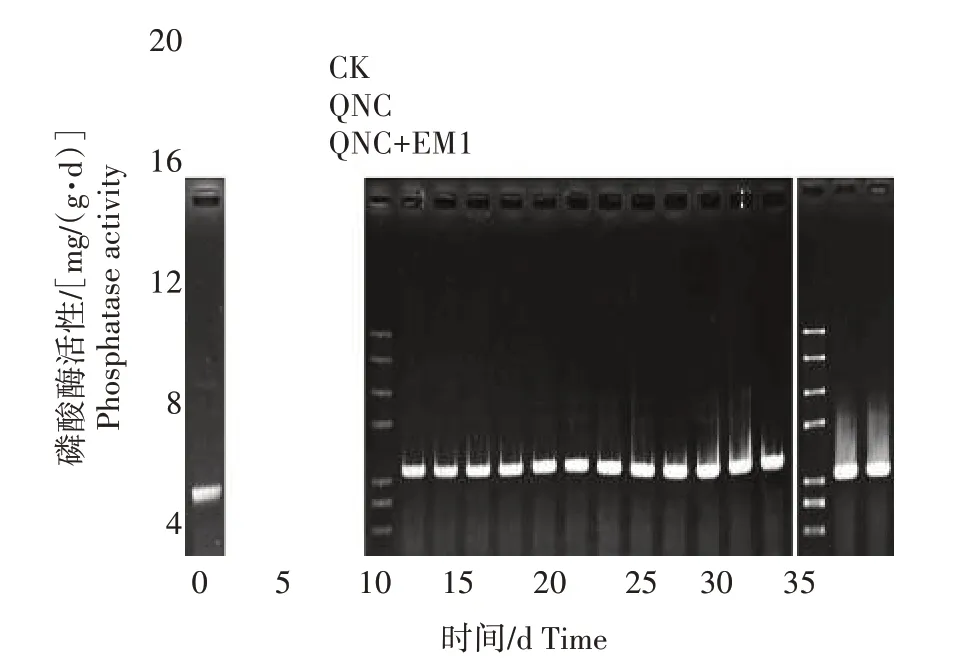
图5 二氯喹啉酸污染及添加EM1后对土壤磷酸酶活性的影响Fig.5 Effect of quinclorac pollution and addition of EM1 on soil phosphatase activity
2.2.3 蔗糖酶对二氯喹啉酸污染及EM1 修复的响应 土壤中的蔗糖酶活性变化如图6 所示,CK 与QNC 处理土壤蔗糖酶活性较稳定。与CK 相比,QNC 处理蔗糖酶活性在培养5、25、35 d 时略高于CK,但2 个处理蔗糖酶活性无明显差异。QNC+EM1 处理蔗糖酶活性呈增长趋势,且增幅较大,培养5~35 d 时明显高于其他2 个处理;在培养35 d 时达到最大值,为69.1 mg/(g·d),相比CK 和QNC 处理分别提升224.4%和199.9%。以上表明,添加降解菌EM1可明显提升污染土壤中蔗糖酶活性。
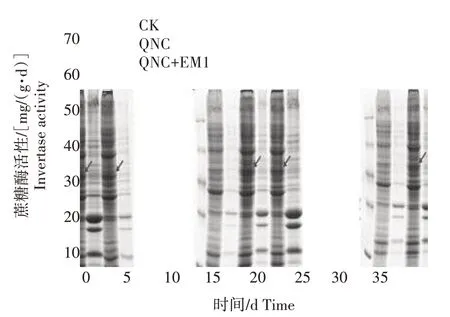
图6 二氯喹啉酸污染及添加EM1后对土壤蔗糖酶活性的影响Fig.6 Effect of quinclorac pollution and addition of EM1 on soil invertase activity
2.3 不同处理土壤中二氯喹啉酸的质量浓度变化
由图7 可知,2 个处理二氯喹啉酸质量浓度均呈下降趋势。QNC 处理土壤中二氯喹啉酸质量浓度在培养35 d 时达到最低,为0.20 mg/L,相比培养0 d 时下降23.9%。QNC+EM1 处理培养0~10 d 时二氯喹啉酸的质量浓度持续下降;培养10~15 d 时有所回升;培养15~35 d 时二氯喹啉酸的降解速度明显加快;培养35 d 时达到最低,为0.05 mg/L,相比培养0 d 时下降82.3%,相比QNC 处理下降76.7%。综上,添加降解菌EM1可明显降低土壤中二氯喹啉酸的质量浓度。
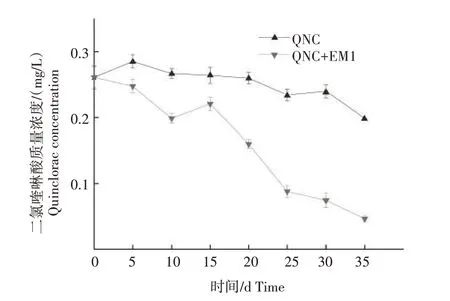
图7 二氯喹啉酸污染及EM1修复对二氯喹啉酸质量浓度的影响Fig.7 Effect of quinclorac pollution and EM1 remediation on quinclorac concentration
2.4 细菌群落Alpha多样性对二氯喹啉污染及EM1修复的响应
3 种处理土壤中的细菌群落Alpha 多样性指数见表1。由表1 可知,QNC 处理的Chao1 和Shannon指数大于CK,说明QNC处理细菌总数高于CK,且细菌群落多样性增加。QNC+EM1 处理的Chao1 指数和Shannon 指数较QNC 处理有所降低,说明添加降解菌EM1降低了土壤中的细菌丰度和群落多样性。

表1 二氯喹啉酸污染及EM1修复土壤的细菌群落Alpha多样性指数统计Tab.1 Statistics on the Alpha diversity index of bacterial communities in soils with quinclorac pollution andremediation by EM1
2.5 细菌群落的组成对二氯喹啉酸污染及EM1修复的响应
如图8 所示,3 个处理细菌丰度最高的门为变形菌门(Proteobacteria),其次为拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)。QNC 处理与CK 相比,芽单胞菌门的丰度增长5.3 个百分点,厚壁菌门的丰度降低5.6 个百分点,疣微菌门(Verrucomicrobia)和浮霉菌门(Planctomycetes)作为新优势菌门出现,原优势菌门单糖菌门(Saccharibacteria)消失。QNC+EM1 处理相比QNC处理,变形菌门丰度增加15.1 个百分点,芽单胞菌门和酸杆菌门丰度降低10.7 个百分点和5.5 个百分点,原优势菌门疣微菌门、硝化螺旋菌门(Nitrospirae)和浮霉菌门消失。

图8 二氯喹啉酸污染及EM1修复土壤的细菌群落组成分析Fig.8 Analysis of bacterial community composition in soils with of quinclorac pollution and remediation by EM1
2.6 细菌群落Beta多样性对二氯喹啉酸污染及EM1修复的响应
由图9 可知,主成分1 和主成分2 分别占53.8%和21.8%,不同颜色的点代表不同的样本分组情况,横、纵坐标轴的刻度代表相对距离。其中,QNC 处理与CK 的离散距离较小,表明QNC 处理对土壤细菌群落结构的影响较小。QNC+EM1处理与QNC 处理离散距离增大,表明添加降解菌EM1对二氯喹啉酸污染土壤细菌群落结构的影响较大。

图9 二氯喹啉酸污染及EM1修复土壤的主成分分析Fig.9 Principal component analysis of remediation with quinclorac pollution and EM1 remediation soils
2.7 土壤细菌群落相互作用对二氯喹啉酸污染的响应
图10 为QNC 处理对土壤细菌群落相互作用的影响。不同颜色的点代表所属的门不同,点的大小代表种群丰度的大小。其中蓝色线代表负相关,红色线代表正相关,线的粗细代表相关性的大小。由图10 可以看出,相互作用主要发生在酸杆菌门、变形菌门、拟杆菌门、芽单胞菌门以及厚壁菌门之间,丰度最大的种群为变形菌门。各菌门之间总计有21 对作用关系,其中互为正相关关系的有13 对,互为负相关关系的有8 对。其中,变形菌门与较多的菌门存在相关关系,芽单胞菌门、厚壁菌门与变形菌门和酸杆菌门之间主要为正相关关系,但拟杆菌门与其他菌门之间为负相关关系。

图10 二氯喹啉酸污染对土壤细菌群落相互作用的影响Fig.10 Effect of quinclorac pollution on the interaction of soil bacterial community
由图11 可以看出,QNC+EM1 处理土壤细菌群落相互作用主要发生在酸杆菌门、变形菌门、拟杆菌门、芽单胞菌门以及厚壁菌门之间,丰度最大的种群为变形菌门。各菌门之间总计有16 对作用关系,互为正相关关系的有11 对,互为负相关关系的有5对,其中变形菌门与较多的菌门存在相关关系,芽单胞菌门、厚壁菌门与变形菌门和酸杆菌门之间主要为负相关关系,拟杆菌门与其他菌门为正相关关系。
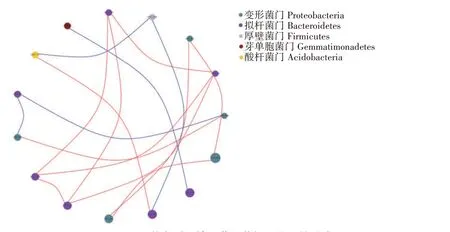
图11 EM1修复对土壤细菌群落相互作用的影响Fig.11 Effect of remediation by EM1 on the interaction of soil bacterial community
3 结论与讨论
通过研究二氯喹啉酸污染以及添加降解菌EM1 对土壤可培养微生物的数量、土壤酶活性和土壤细菌群落多样性的影响,探讨土壤微生物群落对二氯喹啉酸污染以及降解菌EM1的响应,为研究污染物的生态毒性机制提供理论数据。本研究发现,二氯喹啉酸污染和降解菌EM1 对土壤可培养微生物的数量、土壤酶活性和土壤细菌群落多样性均有不同程度的影响。
QNC 处理与CK 相比,培养15 d 时土壤细菌数量增加49.1%,培养25~30 d 时的细菌数量低于CK;除第30天之外,放线菌数量相比CK有所下降,培养结束时下降了18.5%;培养20 d时真菌数量最大,为5.6×104cfu/g,培养结束时相比CK 增加了25.3%。QNC+EM1 处理细菌数量在培养15 d 时达到最大,为1.7×107cfu/g,培养35 d 时相比QNC 处理增加15.6%;放线菌数量在培养结束时相比QNC 处理增加了29.4%;真菌数量在培养结束时下降14.1%。张妤等[8]的研究表明,高含量二氯喹啉酸对土壤微生物总量、细菌及真菌生物量有促进作用,低含量二氯喹啉酸对细菌生物量有一定的抑制作用。添加降解菌EM1 增加二氯喹啉酸污染土壤中细菌数量,提高土壤微生物总量,侧面反映出土壤二氯喹啉酸污染程度下降。
QNC 处理土壤脲酶活性在培养15 d 时达到最高,为134.1 mg/(g·d),培养结束时与CK 相比无明显差异;磷酸酶活性在培养0~15 d时升高,培养25~35 d 时酶活性略低于CK;蔗糖酶活性相比CK 无明显差异。QNC+EM1 处理相比QNC 处理,脲酶活性在培养结束时下降6.8%;磷酸酶活性增幅较大,培养25 d 时达到最大,为18.6 mg/(g·d),培养结束时相比QNC 处理提升149.7%;蔗糖酶活性在5~35 d时明显增加,培养35 d时达到最大,为69.1 mg/(g·d),相比QNC 处理提升199.9%。已有研究表明,土壤在二氯喹啉酸胁迫下,会导致脲酶活性升高,蔗糖酶活性下降[9‐10]。本研究添加降解菌EM1 后蔗糖酶活性提高,脲酶活性下降,表明添加降解菌EM1 缓解了土壤二氯喹啉酸胁迫,但不同研究得出土壤酶活性对同一污染物的响应程度并不一致[11]。因此,在今后研究中,应进一步探索土壤酶活性对不同土壤质地污染程度的响应。
QNC+EM1 处理二氯喹啉酸质量浓度在培养0~10 d 和培养15~35 d 时持续下降,相比QNC 处理在培养结束时下降了76.7%。表明添加降解菌EM1可促进土壤中二氯喹啉酸的降解。
QNC 处理与CK 相比,Chao1 指数和Shannon 指数均有不同程度的增加,土壤细菌较CK 而言分布更为均匀,且多样性增加。QNC+EM1 处理的Chao1指数和Shannon 指数较QNC 处理有所降低,原因可能是降解菌EM1 增强了土壤中降解二氯喹啉酸的细菌的竞争力,而不能降解二氯喹啉酸的细菌被抑制,造成群落多样性降低[12]。3 个处理中丰度最高的优势菌门均为变形菌门(Proteobacteria),已有研究认为变形菌门在土壤[13]、淡水[14]、大气[15]等环境中普遍存在,可能与碳利用有关[16]。变形菌门的生理学和形态学多样性强,能够适应多种复杂环境,相比其他微生物更具竞争优势[17]。在QNC 处理中出现了新的优势菌门[疣微菌门(Verrucomicrobia)和浮霉菌门(Planctomycetes)],原优势菌门单糖菌门(Saccharibacteria)消失;添加降解菌EM1 后,原优势菌门疣微菌门、硝化螺旋菌门(Nitrospirae)和浮霉菌门消失,表明添加降解菌EM1可明显影响土壤细菌群落结构。本研究中拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)始终作为优势菌门,丰度较大。已有研究表明,拟杆菌门对维持菌群平衡具有重要作用[18]。酸杆菌门作为土壤微生物的重要组成部分,在土壤的物质循环和生态环境的构建过程中起着非常重要的作用[19‐21]。土壤细菌群落多样性分析结果表明,3 个处理之间的土壤细菌群落多样性在Alpha 多样性、Beta 多样性、物种组成和群落结构相似度上均有差异,添加降解菌EM1前后的群落多样性指数差异更为明显,表明添加降解菌EM1使得土壤中的细菌分布更为不均。黄思琦[12]研究发现,二氯喹啉酸降解菌纤维单胞菌(Cellulosimicrobiumsp.)的添加可导致变形菌门丰度增高,这与本研究的结果相似,或许是因为降解菌EM1促进了变形菌门丰度的增加。主成分分析结果表明,添加降解菌EM1 明显改变了土壤细菌群落结构。通过网络互作图可知,降解菌EM1 使细菌之间相关关系数量减少。
综上,添加降解菌EM1 可有效修复二氯喹啉酸污染土壤,具有一定的应用前景。

