遮阴对地黄生长及生理特性的影响
刘春琰,黄 勇,郭 猛,张红瑞,周 艳,李贺敏
(河南农业大学农学院,河南 郑州 460000)
地黄为玄参科植物地黄(Rehmannia glutinosaL.)的新鲜或干燥块根[1],别名婆婆奶、地髓、小鸡喝酒等,是常用大宗中药材。地黄栽培历史悠久,是著名的四大怀药之一[2],河南焦作的温县、武陟等为其道地产区。现代药理学和中药化学研究表明,地黄的主要有效成分为环烯醚萜类、紫罗兰酮类、苯乙醇苷类、糖类及其他化合物[3‐4],具有增强免疫、抗糖尿病及其并发症、抗骨质疏松、抗炎、抗电离辐射等药理作用[5‐6]。随着人们医疗保健意识的增强,地黄的需求量逐年增加。
光是影响植物生长发育、生理代谢的重要生态因子之一,光照条件的改变会引起植物形态学、生理学上的一系列改变。有数据表明,华北平原全年太阳总辐射呈显著下降趋势,1961—2020 年的年太阳总辐射平均减少了14.3%[7],且近年来河南省夏季多发生连阴雨天气,造成寡照条件,严重影响作物生长发育。有研究表明,玉米在生育期内所受太阳辐射减少1 kJ/cm2,生物量会减少337.5 kg/hm2[8]。遮阴对植物各方面的影响成为科研人员的研究重点。地黄为喜光植物,光照不足对其生长发育影响较大。关于遮阴对地黄的影响已有研究,但主要集中在地黄遮阴后差异表达的基因方面[9‐10],有关遮阴对地黄生长发育、生理特性和有效成分含量影响的研究较少[11]。故设不同梯度遮阴处理,探究遮阴对地黄生长发育、生理特性以及有效成分含量等的影响,以期为地黄在弱光环境中的高效栽培提供参考。
1 材料和方法
1.1 试验材料
以河南省地黄主栽品种金九(河南省武陟县沁怀四大怀药研究所提供)作为试验材料,经河南农业大学李贺敏副教授鉴定,为玄参科植物地黄(Rehmannia glutinosaL.)的块根。种植前一天将块根分成3~4 cm 的小段,每段留3 个左右芽眼,用生石灰拌种,备用。
1.2 试验设计
试验于2020 年4—10 月在河南农业大学科教园区原阳基地(113°56´E、35°6´N)进行。试验地前茬撂荒,肥力中等,试验地块为砂质壤土,8 a内未种植过地黄。
试验设4个处理,分别为T1(正常光照,CK)、T2(20%遮阴)、T3(50%遮阴)、T4(80%遮阴)。遮阴处理选择市售不同遮光率的黑色遮阳网进行遮阴模拟(实际遮光率分别为22.5%、48.7%、82.3%)。小区面积12 m2(3 m×4 m),随机区组排列,重复3次。4 月中旬整地,小区内起垄单行种植,垄高15 cm、垄距20 cm,株距25 cm。4 月23 日种植,6 月16 日齐苗后遮阴,用竹竿搭建支架,遮阳网高50 cm,一般大田管理。
在地黄生长的叶部形态建成期取样2 次,取样日期分别为7 月11 日和8 月5 日;在根部形态建成期取样2次,取样日期为8月31日和9月25日;在地黄的生育后期取样1次,取样日期为10月20日。共取样5 次。各处理随机取样10 株,整株挖出,清除表面杂质,进行根部农艺性状和生理指标的测定。于生育后期(10 月20 日)取样进行地黄有效成分含量的测定。
1.3 指标测定及方法
1.3.1 根部农艺性状的测定 根条数:植株所有根的数量;根长:植株最长的3 条根长度平均值;根直径:植株最粗的3 条根直径平均值;块根数:直径超过0.5 cm 的根的数量;根鲜质量:取样后将植株表面的杂质清洗干净,待植株表面水分晾干后,称量地下部分鲜质量;根干质量:将植株地下部分切成0.5 cm 左右的小段,105 ℃下杀青30 min,然后在55 ℃下烘干称量。
1.3.2 生理指标的测定 生理指标测定所需样品于当天9:00—11:00 取样,块根挖出后用蒸馏水迅速冲洗干净,吸干表面水分,用锡箔纸包裹并标记,迅速转入液氮中,带回实验室后放入-80 ℃冰箱保存,备用。超氧化物歧化酶(SOD)活性使用氮蓝四唑法测定,过氧化物酶(POD)活性使用愈创木酚法测定,根系活力使用氯化三苯基四氮唑法测定,可溶性糖含量采用蒽酮乙酸乙酯法测定,可溶性蛋白含量采用考马斯亮蓝法测定,游离脯氨酸含量采用酸性茚三酮法测定。以上各指标的测定均参照王学奎[12]方法进行。
1.3.3 有效成分含量测定 地黄块根中有效成分含量参照张留记等[13]的方法采用高效液相法进行测定,高效液相色谱仪型号为Agilent Technologies 1260 InfinityⅡ,色谱柱为Dikma platisil(5 μm ODS,250 mm×4.6 mm),检测器为DAD 检测器。毛蕊花糖苷对照品购自北京融诚鑫德科技发展有限公司(CAS:61276-17-3);梓醇对照品购自北京融诚鑫德科技发展有限公司(CAS:2415-24-9);地黄苷D对照品购自上海源叶生物科技有限公司(CAS:81720-08-3)。对照品纯度均大于98%。
1.4 数据分析
采用Excel 2016 和SPSS 24.0 进行数据处理与作图。
2 结果与分析
2.1 遮阴对地黄根部生长发育的影响
各处理地黄根长、根直径、块根数和根条数在全生育期内均呈逐渐增加趋势(图1),均在10月20日达到最大。T2 处理的地黄根长较T1 处理增加,但差异不显著;根直径和块根数较T1 处理减少,根直径在7月11日和8月31日显著低于T1处理,块根数在9月25日显著低于T1处理;根条数仅在9月25日和10 月20 日显著低于T1,分别较T1 低16.67%、16.33%,其余时期与T1 无显著差异。T3 和T4 处理在不同生育时期均显著抑制地黄根长、根直径、块根数和根条数,抑制作用为T4>T3。10 月20 日,T3处理的根长、根直径、块根数和根条数分别较T1 降低22.07%、19.79%、16.22%、26.53%;T4 处理的根长、根直径、块根数和根条数分别较T1 降低24.83%、49.10%、51.35%、48.98%。
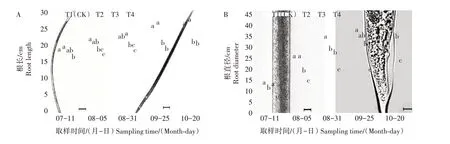
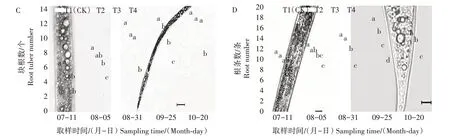
图1 遮阴对地黄根部生长发育的影响Fig.1 Effect of shading on root growth and development of R.glutinosa
2.2 遮阴对地黄根部物质积累的影响
全生育期内各处理地黄根鲜质量和干质量呈逐渐增长趋势(图2),均在10 月20 日达到最大。10月20 日,T1、T2、T3 和T4 处理的根鲜质量分别为604.94、454.69、327.83、29.62 g。3 个遮阴处理均显著抑制地黄根鲜质量和干质量,抑制作用为T4>T3>T2。10 月20 日,T4、T3 和T2 处理地黄根鲜质量分别较T1 处理降低95.10%、45.81%、24.84%,根干质量分别较T1 处理降低95.81%、50.09%、27.28%。遮阴使得地黄根鲜质量的快速增长期向后推迟,T1处理的根鲜质量在8 月5—31 日快速增长,期间增长135.33%;T2 处理在8 月31 日—9 月25 日快速增长,期间增长111.58%;T3处理和T4处理的根鲜质量无显著的快速增长期。
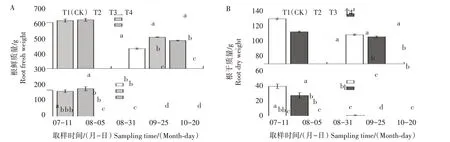
图2 遮阴对地黄根部物质积累的影响Fig.2 Effect of shading on material accumulation in roots of R.glutinosa
2.3 遮阴对地黄根部细胞渗透调节物质含量的影响
不同遮阴处理对地黄根部可溶性糖含量的影响不同(图3)。T3 和T4 处理在全生育期内均降低可溶性糖含量,T2处理在不同生育时期对可溶性糖含量的影响不同。7 月11 日,T2 处理显著提高地黄可溶性糖含量,较T1 处理提高7.59%;9 月25 日,T2处理显著降低可溶性糖含量,较T1 处理降低11.58%;其余时期与T1 处理无显著差异。全生育期内,T2处理提高地黄可溶性蛋白含量,但8月5日和10月20日与T1处理无显著差异;T3和T4处理的地黄可溶性蛋白含量仅在7月11日低于T1处理,其余时期均高于T1 处理,但T4 处理仅在10 月20 日与T1处理的差异达显著水平。7月11日,T2、T3、T4处理的游离脯氨酸含量显著低于T1 处理,分别较T1处理降低30.39%、35.63%、60.62%;8 月5 日、9 月25日和10 月20 日,T2、T3、T4 处理的游离脯氨酸含量均高于T1 处理;8 月31 日,T2 处理的地黄游离脯氨酸含量显著低于T1处理,T4处理显著高于其他3个处理,T3处理和T1处理无显著差异。
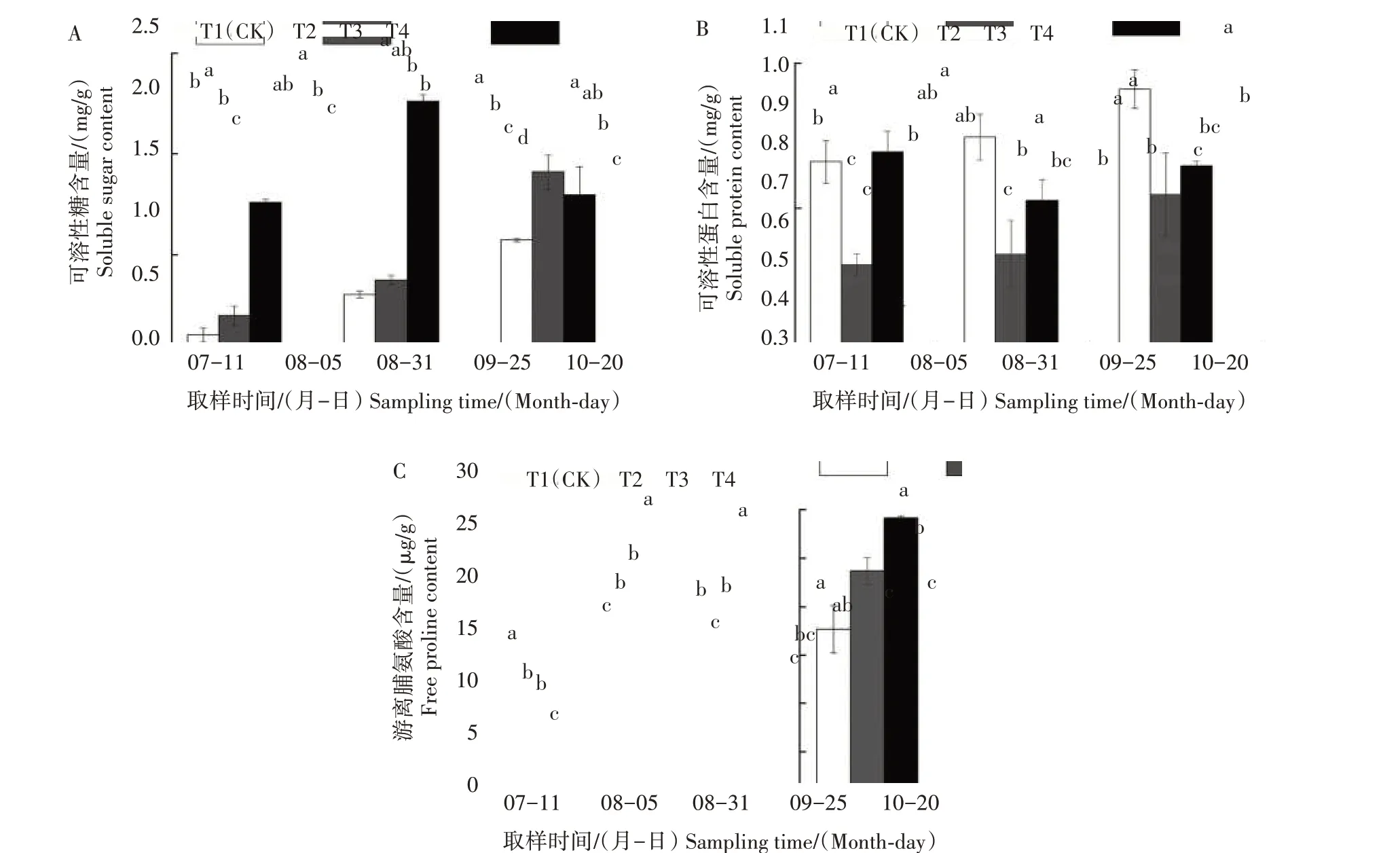
图3 遮阴对地黄根部细胞渗透调节物质含量的影响Fig.3 Effect of shading on osmoregulation substance content of R.glutinosa tuber cells
2.4 遮阴对地黄根部SOD、POD活性和根系活力的影响
遮阴对地黄SOD和POD活性的影响见图4。各处理SOD 活性变化趋势不同,T1、T2、T3 处理的地黄SOD 活性总体表现为上升趋势,而T4 处理表现为先上升后下降趋势。7 月11 日、8 月5 日和10 月20 日,遮阴抑制SOD 活性,8 月31 日和9 月25日,遮阴提高SOD 活性。T2 处理仅在9 月25 日提高POD活性,T4 处理仅在8 月31 日对POD 活性有提高作用,其余时期2 个遮阴处理均抑制POD 活性;T3 处理在9 月25 日对POD 活性提高不显著,在10 月20日显著提高POD 活性,其余时期均抑制POD 活性。全生育期内各处理地黄根系活力表现为先上升后下降趋势,8 月31 日各处理根系活力最高,分别为6.25、5.49、4.43、3.88 mg/(g·h)。遮阴抑制地黄根系活力,T2 处理的抑制作用最小,T4 处理的抑制作用最强。
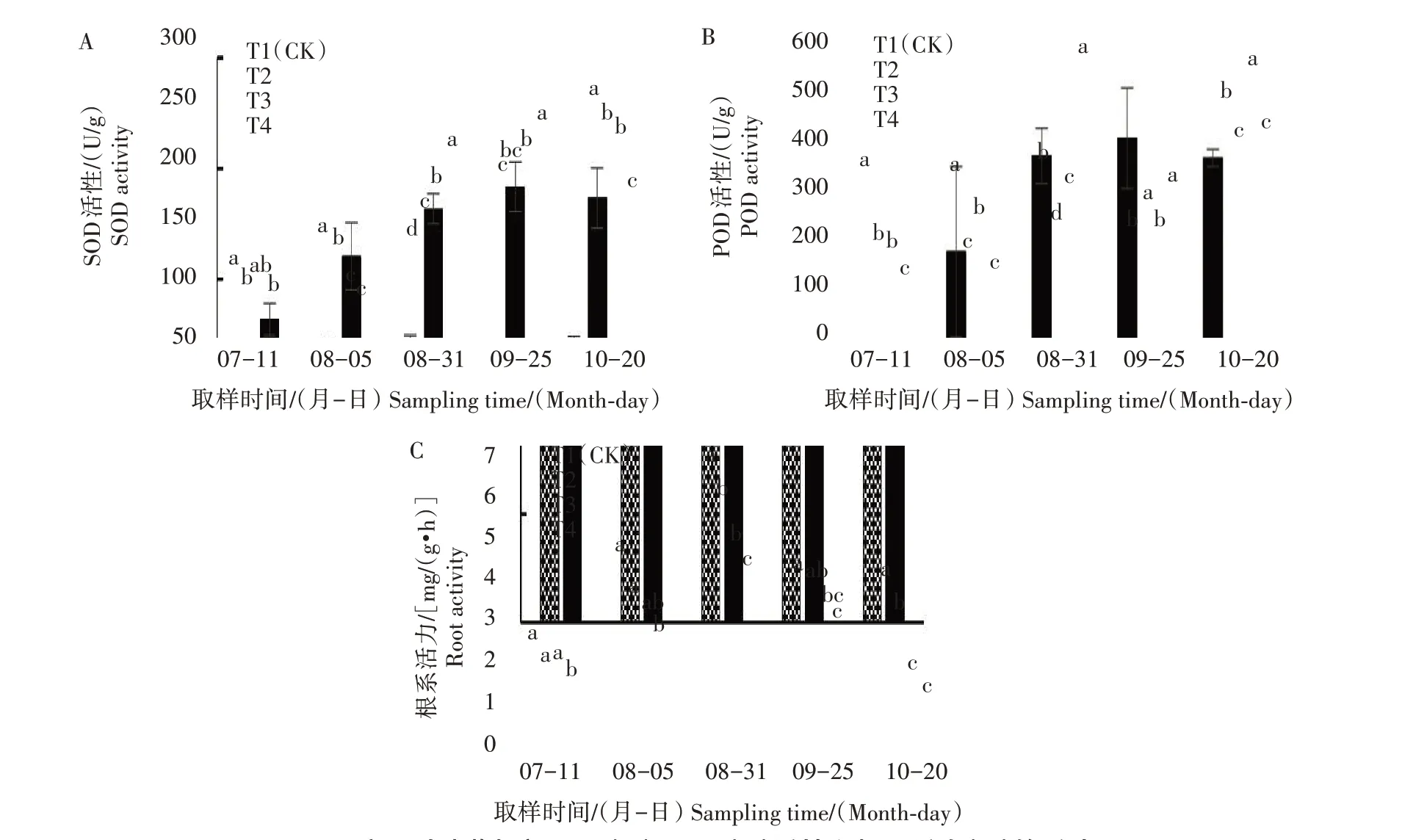
图4 遮阴对地黄根部SOD(A)、POD(B)活性和根系活力(C)的影响Fig.4 Effect of shading on SOD(A)、POD(B)activity and root activity(C)in R.glutinosa root tuber
2.5 遮阴对地黄有效成分含量的影响
参照张留记等[13]的方法,进行对照品溶液的配制和样品溶液的提取,并进行线性关系、精密度、稳定性、重复性、加样回收率的考察。毛蕊花糖苷、梓醇、地黄苷D 这3 种成分在检测范围内有良好的线性关系,其相关系数(r)分别为0.999 4、0.999 1、0.999 3,且稳定性、重复性和加样回收率均满足试验要求,仪器的精密度满足试验要求。
由图5 可知,不同遮阴处理对地黄块根中有效成分含量的影响不同。与T1 处理相比,T2 处理对地黄块根中梓醇含量无显著影响,T3 和T4 处理显著降低梓醇含量,分别较T1 处理降低22.02%、63.33%。遮阴抑制地黄块根中地黄苷D 含量,抑制作用为T4>T3>T2,T4、T3、T2 处理地黄苷D 含量较T1 处理分别降低38.70%、26.36%、7.69%,大多数处理间差异达显著水平。遮阴提高毛蕊花糖苷含量,遮阴度越高,提高幅度越大,T1 处理的毛蕊花糖苷含量为0.216%,T2、T3、T4 处理地黄毛蕊花糖苷含量分别较T1提高26.11%、37.47%、50.44%。
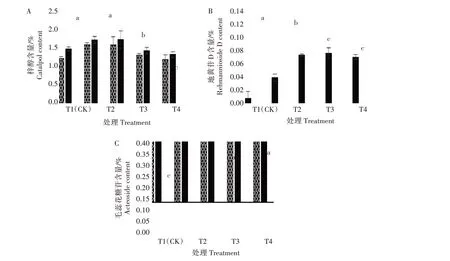
图5 遮阴对地黄块根中有效成分含量的影响Fig.5 Effect of shading on the content of effective components in R.glutinosa root tuber
3 结论与讨论
地黄块根既为贮藏器官也为收获部位,其生长发育和物质积累量直接决定经济效益。前人研究表明,遮阴条件下植物所接受的有效光辐射减少,光合作用降低,合成的有机物质量减少,最终导致贮藏器官物质积累量减少[14‐15]。本研究中,遮阴条件下地黄根干鲜质量降低,根部不能正常生长发育,导致其根长、根直径、块根数等均减少,和前人研究结果一致[16]。
可溶性糖、可溶性蛋白和游离脯氨酸是植物体内重要的细胞渗透调节物质,在逆境胁迫下三者协同作用,共同维持植物细胞渗透压稳定[17‐19]。本研究结果显示,遮阴条件下地黄体内可溶性糖含量降低,可溶性蛋白和游离脯氨酸含量增加,因为遮阴条件下地黄植株呼吸作用减弱,导致作为呼吸底物的可溶性糖含量降低;逆境胁迫下植物会增加体内游离脯氨酸含量,以减轻逆境胁迫对自身带来的伤害;遮阴条件下地黄可溶性蛋白含量增加,表明氮代谢对遮阴下地黄的渗透调节贡献比碳代谢更大,本研究结果支持前人结论[19‐20]。SOD 和POD 是植物体内重要的抗氧化酶,可以有效清除植物体内过量的活性氧并使活性氧含量在一定范围内保持平衡[21‐22]。本研究中,生育中期遮阴处理提高SOD 活性,但在生育后期遮阴处理抑制SOD 活性,因为在生育中期,遮阴处理对植物产生逆境胁迫,导致其体内SOD 活性升高,在生育后期,因遮阴延缓植物衰老,对照组地黄较遮阴地黄衰老明显,此时对SOD 活性起决定作用的因素是植物体衰老程度。本研究中,遮阴处理下POD 活性在不同生育时期的变化规律不一致,具体原因需进一步深入研究。
前人研究表明,逆境胁迫下植物次生代谢加强,次生代谢产物含量增加[23‐30]。本研究中,遮阴使得地黄块根中毛蕊花糖苷含量显著升高,80%遮阴下地黄块根中毛蕊花糖苷含量较CK 提高50.44%。王丰青等[11]的研究结果表明,遮阴逆境下地黄块根中毛蕊花糖苷含量较CK 显著升高,这与本研究所得结论一致。赵文吉等[31]的研究表明,遮阴降低独一味幼苗根部2种环烯醚萜苷类化合物的含量。本研究结果表明,遮阴条件下地黄块根中2 种环烯醚萜苷类化合物梓醇和地黄苷D 含量较CK 均下降,其中,梓醇含量在50%、80%遮阴下较CK 分别降低22.02%、63.33%,地黄苷D 含量在50%、80%遮阴下分别较CK 降低26.36%、38.70%,与赵文吉等[31]的研究结果一致。
综上,遮阴处理下地黄生理特性改变,根部生长发育受到抑制,品质变差,故生产上地黄应在光照充足的地块栽培,或尽量降低遮阴程度。

