MRI与CT在颈动脉狭窄及粥样硬化斑块诊断中的应用价值观察
林进添,万昆明
(广东医科大学附属东莞第一医院影像科 广东 东莞 523710)
缺血性脑血管疾病在临床具有较高发病率,多见于中老年群体,综合其病理特点分析,可见颈动脉粥样硬化是表示其疾病处于发展中的一大特征。究其原因主要有两方面,第一是颈动脉硬化斑块促使其患者管腔内膜增厚、脂质淤积、形成血栓或纤维增生等现象,造成占位效应而产生狭窄问题;第二是随着患者病情进展,其颈动脉粥样斑块稳定性出现变化,从硬斑块发展至软斑块,后者斑块有较高破裂风险,并促使溃疡、继发性血栓形成,导致颈动脉远端因为部分斑块、栓子脱落而造成堵塞,最终发展成缺血性脑卒中。如果不及时采取有效治疗来控制患者管腔内板块组织持续坏死情况,动脉粥样硬化则是其最终病理表现[1-2]。因此,临床表示缺血性脑血管疾病患者通常可见合并颈动脉粥样硬化、颈动脉狭窄症状,而两种病症相互影响下会导致其颈动脉分叉部位产生其他病理反应,随着病情进展而形成血栓,极易诱发急性卒中等危急病症,对其生命健康安全和生存质量造成极大威胁[3]。故早期诊断患者病情并尽早实施对症治疗,是改善其预后和提高生存质量的关键,因此,如何准确判断患者斑块的易损性、把握治疗时机、评估是否符合手术指征及制定手术方案,是当前影像科技术亟待解决的临床问题之一。现阶段,CT和MRI作为临床常用影像学检测技术,在各类疾病检出和鉴别中均有一定优劣势[4]。基于此,本次研究选取2021年1月—8月广东医科大学附属东莞第一医院收治的颈动脉狭窄、粥样硬化斑块患者71例,分析CT、MRI在其病情诊断和鉴别中的应用价值,结果如下所示。
1 资料与方法
1.1 一般资料
采用抽签模式选取2021年1月—8月广东医科大学附属东莞第一医院收治的颈动脉狭窄、粥样硬化斑块患者71例作为研究对象,所选患者均表示对研究知情且同意。患者男女比例为40:31;年龄51~75岁,平均年龄(63.11±5.69)岁;病程1~5个月,平均病程(2.42±0.12)个月。
纳入标准:①患者均经数字减影血管造影检测后,与缺血性脑血管疾病相关标准相符;②患者具有较高治疗依从性;③患者自述存在头晕、视物不清、耳鸣、肢体乏力、感觉障碍等症状[5]。排除标准:①合并精神障碍且存在先天性器质性疾病者;②合并凝血功能异常、肝肾功能障碍、恶性肿瘤者;③合并房颤、心源性梗塞、脑分水岭梗死者;④对造影剂存在过敏反应者。
1.2 方法
患者均进行CT、MRI检查,方法如下。
CT检查:选择联影(uCT 780 80排螺旋CT)进行检查,佩戴颈动脉专用线圈(Plaque Tim coils),对其颈部完成横断面CT扫描,然后将阈值设定为100 HU,扫描范围从主动脉弓到颅底水平,将层厚、间距设定为3 mm、1.5 mm,将扫描所获取数据传送至图像处理工作站后重建图像,并分析其颈动脉CTA原始图像。若CT检测信息获取不理想,可进行增强造影扫描,建立静脉通道后,取50 mL硫酸钡对比剂以3 mL/s速率完成静脉注射,等待30 s后开始对其进行增强扫描。
MRI检查:联影(uMR 780 3T)磁共振扫描仪来完成患者病情检出,采用T1WI、T2WI等扫描模式,将层厚、矩阵、TE、TR、FOV参数值分别设定为2.0 mm、256×256、50 ms、800 ~ 1 600 ms、12 cm×12 cm,行常规扫描后,取10 mL钆喷酸葡胺对比剂以1.6 mL/s流速完成静脉注射,将扫描翻转角改为20°,确保获取图像的清晰度。
1.3 观察指标
比较两种检测方法的影像质量、病情检出率和粥样硬化斑块鉴别情况。
①影像质量:比较两种检测方法所得图像质量,均划分为4个等级,I级:管壁结构无法显示;Ⅱ级:见脉管壁,但难以看清血管外壁;Ⅲ级:管壁结构可视清晰度较高,但难以看清血管外壁边缘;Ⅳ级:管壁结构具有较高清晰度。②粥样硬化斑块、颈动脉狭窄检出情况:记录不同检测方法的粥样硬化斑块、颈动脉狭窄检出例数,其中,粥样硬化斑块诊断标准为:血管内膜粗厚,颈动脉内膜厚度超过1.0 mm,局部血管可见斑块且较为明显。颈动脉狭窄诊断标准为:根据狭窄处的直径强比值进行评估,即局部最小残腔直径/局部远端动脉正常管腔直径×100%不低于30%,即可确诊狭窄。③粥样硬化斑块鉴别情况:比较两种检测方法关于粥样硬化斑块鉴别情况,包括钙化、纤维样、脂样、混合样四种形态。
1.4 统计学方法
2 结果
2.1 比较两种检测方法的影像质量
MRI检测所得图像质量与CT检测差异无统计学意义(P>0.05),见表1。
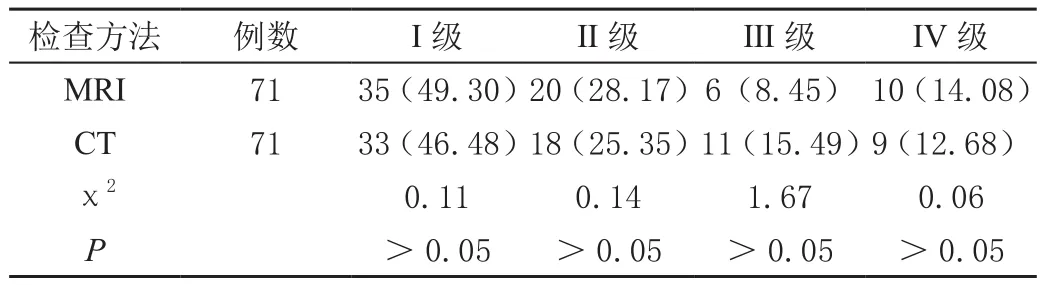
表1 比较两种检测方法的影像质量[n(%)]
2.2 比较两种检测方法的粥样硬化斑块、颈动脉狭窄检出率
MRI检测所得粥样硬化斑块和颈动脉狭窄检出率分别为97.18%、76.06%,与CT的95.77%、73.24%比较无显著差异(P>0.05),见表2。
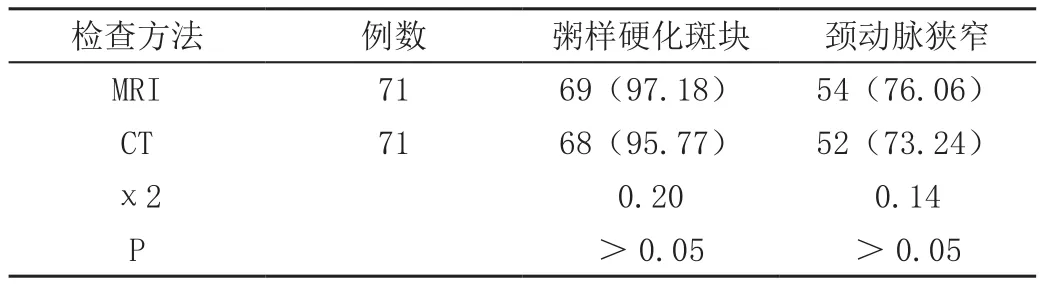
表2 比较两种检测方法的粥样硬化斑块、颈动脉狭窄检出率[n(%)]
2.3 比较两种检测方法关于粥样硬化斑块鉴别诊断准确率
MRI诊断粥样硬化斑块鉴别准确率为77.46%,显著高于CT诊断的53.52%(P<0.05),见表3。
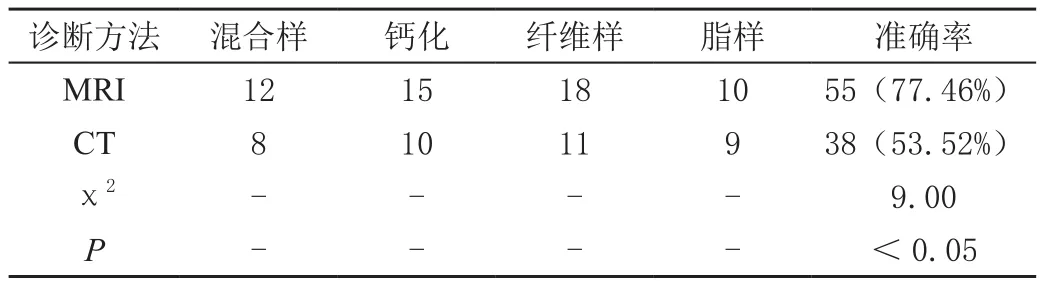
表3 比较两种检测方法关于粥样硬化斑块鉴别诊断准确率单位:例
3 讨论
脑卒中在脑血管疾病中不仅具有较高发病率,死亡率、复发率和致残率在临床上同样居高不下。其中,颈动脉狭窄及其粥样硬化斑块是造成缺血性脑卒中(cerebral ischemic stroke,CIS)的独立危险因素,究其原因,粥样硬化斑块主要是受患者机体诱发脂质代谢障碍后,促使动脉粥样硬化后出现斑块,与此同时,患者血糖、血压异常(偏高)等因素也可能导致其动脉出现病理变化。而血管狭窄,是指患者动脉壁内积聚大量中性脂质物质、复合糖类,导致组织出现病理性增生,进入病发,若不及时予以有效治疗,局部增生处将发展成病灶组织,促成斑块形成[6-7]。由此可见,颈动脉的粥样硬化斑块是诱发颈动脉狭窄的高危原因,且斑块样病变会阻滞患者颈动脉血运,加剧血管腔狭窄问题,也为其后期引发缺血性脑卒中和诱发其他血管病变埋下安全风险[8-9]。所以,提高此类脑血管疾病患者病症检出率和鉴别其斑块水平至关重要,为其后续有效治疗提供科学依据。
现阶段,临床针对粥样硬化斑块和颈动脉狭窄诊断,通常采取影像学技术来观察其血管病变和评估颈动脉狭窄、斑块稳定性,常用手段包括颈部血管超声、数字减影血管造影(digital subtraction angiography,DSA)、CT血管造影(computed tomography angiography,CTA),必要情况下会辅助部分血液生化标志物一同进行检测。众多影像检测技术中,颈动脉超声具备无创、操作简单、费用低等临床优势,是临床筛查脑血管疾病常用首选方法,但结果易受检测医生操作水平影响,检测缺乏客观性指标评估,多以主观因素来评估结果,很大程度会影响检查结果的精准性。DSA、CTA成像检查虽然能有效评估患者颈动脉狭窄及斑块稳定性,但是检测属于有创性操作,加上部分患者还存在造影剂过敏问题,一定程度上限制了技术的临床发展。因此,寻求其他新的检查手段并促进良性发展,来解决上述问题,是当前影像科和心脑血管临床亟待解决的医学问题之一[10]。考虑到多排螺旋CT、MRI都是目前临床常用检测技术之一,基于此,本次研究抽取71例于本院收治的缺血性脑血管疾病患者作为观察对象,均进行多排螺旋CT、MRI检测,结果显示两种检测方法的影像质量、粥样硬化斑块、颈动脉狭窄检出率对比差异无统计学意义(P>0.05),但MRI在粥样硬化斑块鉴别诊断中,准确率要显著高于多排螺旋CT诊断(P<0.05)。其中,CT检测具有较高空间辨识度,经对比剂注射后能清晰观察到管腔的狭窄程度,且患者血液状态不会影响到成像质量。可见CT影像可以准确诊断患者管腔狭窄程度,成像中可清晰显示其病变血管边缘,信号呈现明显衰竭趋势,增强造影后可发现少部分血管腔的病理变化[11-12]。虽然此类技术主要利用X线可穿透性、光电转换反应来精准捕捉到大病灶和显著病变,但若患者颈动脉狭窄处于早期病变,CT影像在病症检出仍有较大难度,且难以鉴别不同动脉粥样硬化形成的斑块性质。MRI检测的组织分辨率和空间分辨率均有较高水平,具有敏感度高、准确性高的应用优势,联合MRA原始横断图像和多序列图像能显著提高管腔狭窄程度的成像清晰度,有利于病症检出的同时在鉴别病情方面有一定应用价值[13]。因此,MRI在鉴别患者粥样硬化斑块性质时,通过直观清晰图像可清晰显示病灶位置,观察其内部解剖结构来分辨病灶类型。目前,颈动脉内膜剥脱术(carotid endarterectomy,CEA)、颈动脉支架置入术(carotid stenting,CAS)是治疗中重度颈动脉狭窄的有效方案,并有报道[14]表示,通常脆软斑块及合并出血、形成血栓通过手术剥离难度较低,但部分较坚硬的斑块就会相对于前者病理情况的手术剥离难度要大,且关于CAS的治疗目前仍有较多争议,具体手术效果仍需后期通过影像复查来进行进一步评估。MRI检测技术可以有效评估患者当前颈动脉斑块的稳定性,为其科学选择合理手术时机有重要意义,同时也为术者的术中操作提供了科学的影像参考,且在明确患者颈动脉粥样斑块后能根据其病情适当配合稳定斑块、抗氧化药物进行治疗,并针对部分容易诱发斑块破裂的高危因素予以对应防控措施,确保后续手术方案的安全进行。但此类技术劣势在于干扰因素较多,包括患者体型、线圈摆放、伪影等,都会对技术捕捉颈动脉狭窄问题造成一定负面影响,加上操作时间较长,对于机体条件较差、无法坚持长时间检查的老年患者而言,接受程度不高[15]。
综上所述,MRI与CT在颈动脉狭窄及粥样硬化斑块诊断中均有一定应用价值,两者检测图像质量及病症检出率大致相等,但MRI检测在鉴别硬化斑块的准确性要高于CT检测,值得推广。

