罗湖病毒(TiLV)RT-qPCR方法的建立
徐淑菲,朱黄鑫,曾韵颖,刘启霖,方成俊,林双庆,孔凡德*
(1.厦门海关技术中心,福建 厦门361026;2.东山海关综合技术服务中心,福建 漳州363401)
罗非鱼是很多发展中国家的主要食用蛋白质来源,也是许多渔民和养殖者的重要经济来源,是全球养殖产量最高的单一品种。罗非鱼养殖已成为保障全球粮食安全和满足人类营养需求的重要产业,从20世纪50年代开始,我国罗非鱼养殖已经形成苗种繁育、养殖生产、加工出口相对完整的产业链,成为全球最大的罗非鱼养殖国家。但是我国养殖罗非鱼主要以小养殖户为单位[1],高温高密度精养池塘经常发生大面积疾病。雷燕等[2]2017年报道了国内养殖罗非鱼首次检出罗湖病毒(Tilapia lake virus,TiLV),引起了国内相关部门的重视,但未见官方报道。
TiLV是2012年Eyngor M等[3]首次发现的危害罗非鱼的一种新型的RNA病毒,由10个独特的基因片段组成,直径55~75 nm,目前仍未确定其分类地位,但极有可能隶属于正黏病毒科,与流感病毒同属一科。2018年Senapin S等[4]从无明显临床症状、无死亡的成年罗非鱼和鱼苗中检测出TiLV,提示TiLV可能像传染性鲑贫血病毒(ISAV)一样存在着变异株。
国外已经在病毒的细胞培养、组织病理学、RT-PCR、nested RT-PCR、semi-nested RT-PCR、SYBR quantitative RT-PCR、原位杂交等检测技术方面进行了研究,并建立了相应的检测方法。因为分子生物学方法具有快速、灵敏、简便的特点,大多数国家都采用其对TiLV进行监测和诊断。现有检测TiLV的分子生物学方法大多是针对假设蛋白基因片段而建立,如Tsofack J K等[5]根据基因片段3(Genebank序列号KJ605629)建立了巢氏RT-PCR方法;Dong H T等[6]建立的半巢氏RT-PCR方法也是根据片段3建立的;Pitchaporn W等[7]建立的实时荧光定量RT-PCR(Reverse transcription-quantitative real-time PCR,RT-qPCR)方法根据片段3设计引物探针,GenBank序列号为KU751816.1、MF574205.1、MF582636.1、MF502419.1、KX631923.1;刘助红等[8]同样是根据基因片段3(Genebank序列号KJ605629)建立了RT-LAMP方法。TiLV基因片段3编码假设蛋白,基因片段1编码RNA聚合酶,目前已有大量关于基因片段3的研究论文,但通过基因片段1进行检测的研究论文很少。本研究根据TiLV基因片段1的保守序列设计3套特异性引物和探针,并探讨建立RT-qPCR方法的可行性,为进一步监控及预防TiLV提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 样品的采集和处理
采集罗非鱼成鱼的肝、脾、肾和脑组织,并于-80℃冻存备用。
1.1.2 主要试剂和仪器
主要试剂:MagSi Total RNA Kit,OMEGA公司产品,货号M7930-02;QuantiNova Probe RT-PCR Kit,QIAGEN公司产品,货号为208354,包括2×Probe RT-PCR Master Mix、QN Probe RT-Mix、RNase-free water。
主要仪器:荧光定量PCR仪(德国耶拿,型号qTOWER3G)、磁珠纯化系统(杭州奥盛,型号Auto-Pure32A)、台式冷冻离心机(Beckman公司,型号Allegra64R)。
1.1.3 引物
检测TiLV的RT-qPCR的引物和探针:
引物TiLV-qF:5’-CCCACTTACACAACGAGGAATGA-3’(5 μmol/L);
引物TiLV-qR:5’-GGTGGCAATCCCAAGTCAGTAG-3’(5 μmol/L);
探针TiLV-qP:VIC-CTCCCCACATGCCTG-MGB(5 μmol/L)。
1.1.4 扩增片段基因序列(97 bp)
扩增片段基因序:cccacttacacaacgaggaatgaggacttcctccccacatgcctgggagggaagactgtaattagctttcaatctctact gacttgggattgccacc。
合成的TiLV的标准质粒和慢病毒序列相同(976 bp),均包含该97 bp扩增片段基因序列。
1.1.5 反应体系
若无特殊说明,均按照表1反应体系进行试验。

表1 反应体系
1.1.6 反应条件
反应条件:反转录45℃ 20 min;预变性95℃ 5 min;扩增95℃ 15 s,退火延伸温度 1 min,40个循环。荧光收集设置在退火延伸时进行。若无特殊说明,均按照此反应条件进行试验。
1.1.7 核酸浓度
本文使用到的核酸浓度:TiLV质粒,5 ng/μL;TiLV慢病毒,25 ng/μL。
1.2 方法
1.2.1 RNA的提取
按照MagSi Total RNA Kit操作说明书进行RNA提取。
1.2.2 检测TiLV的RT-qPCR方法的建立及优化
1)检测TiLV的RT-qPCR的引物、探针的最佳浓度研究
将原始浓度为5 μmol/L的探针TiLV-qP、原始浓度为10 μmol/L的引物TiLV-qF和TiLV-qR,分别进行10倍梯度稀释。
A组:6个荧光定量PCR管中均加入使用浓度为5 μmol/L的探针TiLV-qP 1 μL(对应的终浓度0.25 μmol/L),A1~A6管分别加入使用浓度分别为10、5、2.5、1.25、0.625、0.312 5 μmol/L的引物TiLV-qF和TiLV-qR各1 μL(对应的终浓度分别为0.5、0.25、0.125、0.062 5、0.031 25、0.015 625 μmol/L);B组:6个荧光定量PCR管中均加入使用浓度为2.5 μmol/L 的探针TiLV-qP 1 μL(对应的终浓度为0.125 μmol/L),B1~B6管分别加入使用浓度分别为10、5、2.5、1.25、0.625、0.312 5 μmol/L的引物TiLV-qF和TiLV-qR各1 μL;C组:6个荧光定量PCR管中均加入使用浓度为1.25 μmol/L 的探针TiLV-qP 1μL(对应的终浓度为0.062 5 μmol/L),C1~C6管分别加入使用浓度分别为10、5、2.5、1.25、0.625、0.312 5 μmol/L的引物TiLV-qF和TiLV-qR各1 μL;D组:6个荧光定量PCR管中均加入使用浓度为0.625 μmol/L 的探针TiLV-qP 1 μL(对应的终浓度为0.031 25 μmol/L),D1~D6管分别加入使用浓度分别为10、5、2.5、1.25、0.625、0.312 5 μmol/L的引物TiLV-qF和TiLV-qR各1 μL(表2)。反应条件按照1.1.6进行。

表2 检测TiLV的RT-qPCR的引物探针最佳浓度各组分情况表
2)检测TiLV的RT-qPCR方法的最佳退火温度和重复性研究
将原始浓度为5 μg/mL的TiLV质粒进行10倍梯度稀释,依次为5×10-2~5×10-7μg/mL。除了模板外,其他按照优选的反应体系配制试剂,将按梯度稀释的TiLV质粒分装到6组(每组重复3次)共18个荧光PCR反应管中。
第1组至第6组的荧光PCR反应管分别加入5×10-2~5×10-7ng/μL梯度稀释的TiLV质粒各1 μL。第1~6组分别按照退火温度50、55、60、65、70℃进行RT-qPCR。反应条件:反转录45℃ 20 min;预变性95℃ 5 min;扩增95℃ 15 s,退火延伸温度分别为50、55、60、65、70℃1 min,40个循环。荧光收集设置在50、55、60、65、70℃退火延伸时进行。
1.2.3 绘制检测TiLV的RT-qPCR方法的标准曲线
除模板按照优选的反应体系配制试剂外,其余将原始浓度为5 μg/mL的TiLV质粒进行10倍梯度稀释,分别为5×10-1~5×10-6μg/mL,并分装到6组(每组重复4次)共24个荧光PCR反应管中,添加体积为1 μL。反应条件按照1.1.6(其中,退火延伸温度根据1.2.2试验获得)进行。最后绘制检测TiLV的RT-qPCR方法的标准曲线。
1.2.4 检测TiLV的RT-qPCR方法的灵敏度试验
除了模板按照优选的反应体系配制试剂外,其余将原始浓度为5 μg/mL的TiLV质粒进行10倍梯度稀释,分别为5×10-1~5×10-8μg/mL,平均分装到8个荧光PCR反应管中,添加体积为1 μL(TiLV质粒终浓度分别为2.5×10-2~2.5×10-9ng/μL)。反应条件按照1.1.6(其中,退火延伸温度根据1.2.2试验获得)进行。
1.2.5 检测TiLV的RT-qPCR方法的特异性试验
按照优选的反应体系(模板除外)配制试剂,平均分装到13个荧光PCR反应管中,第1~13管分别加入TiLV质粒、TiLV慢病毒、真鲷虹彩病毒(RSIV)、锦鲤疱疹病毒(KHV)、流行性造血器官坏死病毒(EHNV)、金鱼造血器官坏死病毒(GFHNV)、流行性溃疡综合征(EUS)、鲤春病毒血症病毒(SVCV)、传染性造血器官坏死病毒(IHNV)、传染性鲑鱼贫血病(ISA)、鲑鱼甲病毒(SAV)、病毒性出血性败血症(VHSV)、RNase-free water各1 μL。反应条件按照1.1.6(其中,退火延伸温度根据1.2.2试验获得)进行。
1.2.6 应用
将建立的检测TiLV的RT-qPCR方法应用于300份罗非鱼、石斑鱼等样品的TiLV的检测。罗非鱼临床样品从福建省养殖场采集,包括诏安县梅川双田水库养殖场、漳州市常山基祥水产养殖场、诏安县红坑水库养殖场、福建铭兴食品冷冻有限公司四都水库养殖场、三姑娘水库养殖场、岭下溪水库养殖场、石厝底水库养殖场、梅州水库养殖场。石斑鱼样品来自本实验室日常检疫留样。
2 结果与分析
2.1 检测TiLV的RT-qPCR方法的优化
优化结果见图1、2。正常Ct值的范围是15~35,本组试验结果表明,第A至D组分别对应图1-A至图1-D。图1-A的TiLV-qP终浓度为0.5 μmol/L时,扩增灵敏度最高,且Ct值在正常范围内,因此优选图1-A;A图中A1、A2 Ct值均为20.5,A3 Ct值为21.2,选择Ct值更小的A1、A2;扩增曲线A2的引物浓度更低,从节省试剂角度考虑,优选扩增曲线A2。因此最佳的引物TiLV-qF、TiLV-qR、探针TiLV-qP终浓度均为0.25 μmol/L(对应的使用浓度均为5 μmol/L)。

注:A~C的TiLV-qP终浓度分别为0.25、0.125、0.062 5、0.031 25 μmol/L(对应的使用浓度分别为5、2.5、1.25、0.625 μmol/L) ;A1~A6、B1~ B6、C1~C6、D1~ D6的 TiLV-qF/qR终浓度分别为0.5、0.25、0.125、0.062 5、0.031 25、0.015 625 μmol/L(对应的使用浓度分别为10、5、2.5、1.25、0.625、0.312 5 μmol/L)。
图2试验结果显示,退火温度55~60℃,同等核酸浓度扩增曲线Ct值基本一致,且重复性好;退火温度65~70℃,灵敏度降低。通常荧光PCR退火温度选择60℃,因此本RT-qPCR最佳退火温度选择60℃,且重复性好。
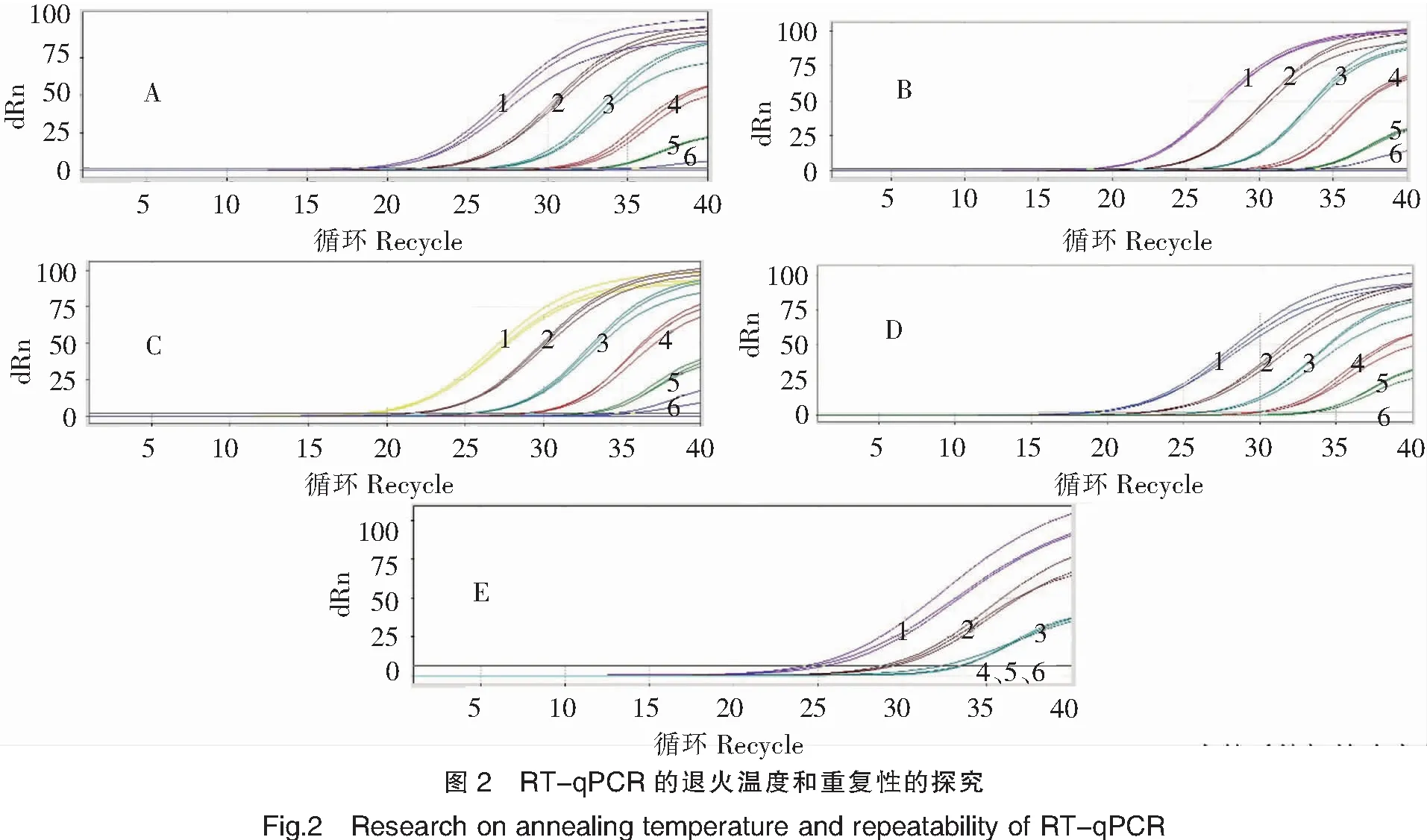
注:A~E的退火温度分别为50、55、60、65、70℃。1~6代表加入反应体系中的质粒初始浓度(5×10-1~5×10-6 ng/μL)。
2.2 检测TiLV的RT-qPCR方法的标准曲线
绘制的标准曲线结果见图3。图3显示R2为0.997 45,PCR扩增效率为0.91,扩增效果极好,说明此引物探针的设计和浓度比例以及反应条件均最佳,可用于样品中TiLV的绝对定量分析。

注:1~6的TiLV质粒终浓度分别为2.5×10-2~2.5×10-7 ng/μL(对应的质粒使用浓度为5×10-1~5×10-6 ng/μL)。
2.3 检测TiLV的RT-qPCR方法的灵敏度分析
灵敏度分析结果见图4。图4试验结果显示,本文建立的检测TiLV的RT-qPCR方法可检测至第7管,TiLV核酸终浓度为2.5×10-8ng/μL,灵敏度为2.5×10-8ng/μL。

注:1~8的TiLV质粒终浓度分别为2.5×10-2~2.5×10-9ng/μL(对应的使用浓度分别为5×10-1~5×10-8 ng/μL)。
2.4 检测TiLV的RT-qPCR方法的特异性分析
特异性结果见图5。试验结果显示本文建立的检测TiLV的RT-qPCR方法只能扩增出TiLV质粒和TiLV慢病毒,其他常见的水生动物病毒均无扩增曲线,说明该方法特异性好。
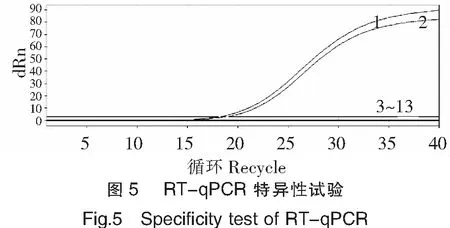
注:1.TiLV质粒;2.TiLV慢病毒;3.真鲷虹彩病毒(RSIV);4.锦鲤疱疹病毒(KHV);5.流行性造血器官坏死病毒(EHNV);6.金鱼造血器官坏死病毒(GFHNV);7.流行性溃疡综合征(EUS);8.鲤春病毒血症病毒(SVCV);9.传染性造血器官坏死病毒(IHNV);10.传染性鲑鱼贫血病(ISA);11.鲑鱼甲病毒(SAV);12.病毒性出血性败血症(VHSV);13.阴性对照。
2.5 检测TiLV的RT-qPCR方法的验证与应用
将本试验建立的检测TiLV的RT-qPCR方法应用于300份日常检测样品及水库样品的检测,结果均未检出TiLV。 并采用本团队建立的同时检测TiLV和病毒性神经坏死病毒(Viral nervous necrosis virus,VNNV)的双重RT-PCR方法和检测TiLV的RT-LAMP方法进行验证,显示三种方法对所有样品的检测结果均一致,均未检出TiLV。
3 讨论
3.1 TiLV基因分析
TiLV共10个基因片段,基因片段1编码RNA聚合酶,基因片段2~10编码假设蛋白,与以往的蛋白没有相似性,因此其功能不明确[7]。目前本研究团队从Genbank中查询到31个TiLV病毒毒株的基因片段1的序列,包括毒株TH-2013、TH-2014、TH-2015、TH-2016-CN、TH-2016-CU、TH-2017、TH-2018-K、TH-2018-N、TH-2019、BD-2017、BD-2017-181、BD-2019-E3、BD-2019-E1、WVL18053-01A、WVL19031-01A、WVL19054、CL、F3-4、TV1、TV2、TV3、TV4、TV5、TV6、TV7、Til-4-2011(基因片段1的GenBank登录号:NC_029926、KU751814)、NBC02、NBC03、NBC04、NBC06、EC-2012)。本文根据基因片段1的保守序列,设计3套引物和探针,并从中优选出引物和探针的最佳浓度。
3.2 国内TiLV监测情况
全国水产技术推广总站每年都进行TiLV的专项检测工作,海关系统也有TiLV的专项监测任务,本实验室参与了福建省水产技术推广总站采样和病毒检测工作,至今未检出一例,其他地区也未有报道。
本实验室自2017年就开始收集罗非鱼样品,至今已收集300多份,利用本文建立的RT-qPCR方法检测,结果均为阴性。但这并不能说该方法无效,综合文献报道及每年海关、水产技术推广站的监测结果,研究团队认为目前国内罗非鱼感染TiLV的可能性极低,但监控预防工作不可松懈。
4 结论
本文建立了检测TiLV的RT-qPCR方法,优化的20 μL反应体系包括:2×Probe RT-PCR Master Mix 10 μL,QN Probe RT-Mix 0.2 μL,5 μmol/L的引物TiLV-qF、TiLV-qR、探针TiLV-qP各1 μL,模板1 μL,补充RNase-free water至20 μL;优化的反应条件:反转录45℃ 20 min;预变性95℃ 5 min;扩增95℃ 15 s,60℃ 1 min,40个循环;荧光收集设置在60℃退火延伸时进行。该方法能够检测出TiLV质粒和TiLV慢病毒,对其他病毒无扩增条带,说明方法特异性好,灵敏度为2.5×10-8ng/μL。
——一道江苏高考题的奥秘解读和拓展

