脊髓CD11c+小胶质细胞在神经病理性疼痛中的最新功能研究进展
彭长庚, 富 研,2, 朱冯婷,3, 夏瑞龙, 夏 玮
(1. 同济大学医学院,同济大学附属上海第一康复医院,同济大学脑与脊髓研究中心,同济大学转化医学高等研究院,上海 200092; 2. 上海海洋大学水产与生命学院,上海 201306; 3. 大理大学基础医学院,大理 671000)
神经病理性疼痛是一种严重的慢性疼痛,影响约10%的人群。神经病理性疼痛的主要特征之一是机械痛觉敏感,其一线药物的疗效和有效率都有限。脊髓中小胶质细胞在外周神经损伤(peripheral nerve injury)诱导的神经病理性疼痛中起着重要而又相互矛盾的作用[1-2]:在外周神经损伤后24 h 可激活小胶质细胞,后者表达离子钙结合衔接分子1 (ionized calcium binding adapter molecule 1,IBA1)和C-X3-C趋化因子受体1(C-X3-C motif chemokine receptor 1,CX3CR1);在损伤48 h内诱导小胶质细胞增生,后者表达CD11b,而CD11b 是补体受体3(complement receptor 3,CR3)二聚体中的α 亚基。这些损伤早期(14 d 内)激活的和新生的小胶质细胞通过表达CX3CR1、P2X4、P2X7、P2Y12 和TLR4 等炎症相关受体,并分泌肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1b、IL-6、前列腺素E2(prostaglandin E2,PGE2)等促炎症因子和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF),对神经损伤后的神经病理性疼痛起促进作用。阻断小胶质细胞的激活或阻止小胶质细胞的增生都能缓解神经病理性疼痛,但前期的研究也发现小胶质细胞还分泌Resolvins、Lipoxins、Maresins 和Protectins 等可抑制/终止炎性反应的因子,从而缓解神经病理性疼痛[1-2]。
正是由于小胶质细胞具有双向调节炎症的两面性,使得临床药物研究的结果呈现不一致性,治疗效果不佳。比如,能抑制小胶质细胞激活的低剂量纳曲酮可减轻纤维肌肉疼痛症状[3],但同样可抑制小胶质细胞激活的米诺环素未能减缓神经病理性疼痛[4]。相反,Curtin 等[5]的研究发现口服米诺环素非但不能减少腕管综合征(一种神经病理性疼痛)患者在手部手术后的疼痛时间,甚至会延长创伤后应激障碍症状加重的患者的疼痛时间,这表明小胶质细胞在人类中也可能有促进疼痛缓解的功能。因此,厘清小胶质细胞缓解疼痛的功能对开发可能的相关镇痛药物至关重要。
1 CD11c+小胶质细胞亚群缓解疼痛功能的发现
2022 年4 月Science杂志发表Kohno 等[6]的研究报告显示,小鼠脊髓中被外周神经损伤激活的CD11c+(又称Itgax)小胶质细胞通过分泌胰岛素样生长因子-1(insulin-like growth factor 1,IGF-1)来缓解神经病理性疼痛和抑制疼痛的复发。
该研究首先利用Itgax-Venus转基因小鼠,发现外周神经损伤14 d 时,损伤同侧脊髓中出现增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)标记的CD11c+细胞,该细胞表达IBA1、CD11b 和HEX2b,不表达胶质纤维酸性蛋白(glial fibrillary acid protein,GFAP)(星形胶质细胞标志物)、APC(少突胶质细胞标志物)和NeuN(神经元标志物),从而确定这些细胞是小胶质细胞的一个亚群。然后用流式细胞仪分选发现,CD11c+/CD11b+小胶质细胞数目的峰值出现在损伤后的第14 天,而CD11c-/CD11b+小胶质细胞数目的峰值出现在第7 天。进一步分析发现,高表达CD11c(CD11chigh)的小胶质细胞数目从损伤后的第7 天显著增加,在第35 天时达峰值,在实验的最长时间点(第56天)还是维持在很高水平,这与神经病理性疼痛的缓解时程较吻合。
为验证CD11c+小胶质细胞能缓解神经病理性疼痛,该研究从外周神经损伤手术后第14 天开始连续每周注射一次白喉毒素至Itgax-DTR-EGFP转基因小鼠的鞘内,白喉毒素可以选择性杀死表达白喉毒素受体(diphtherial toxin receptor,DTR)的CD11c+细胞。机械疼痛阈值检测发现,注射PBS的Itgax-DTR-EGFP小鼠的神经病理性疼痛在损伤后第14天发展至最严重,从第3周开始逐步恢复,到第4周时机械疼痛阈值恢复至接近手术前的阈值;但注射白喉毒素清除CD11c+小胶质细胞后,Itgax-DTR-EGFP小鼠的神经病理性疼痛的恢复能力基本被消除。这项白喉毒素-DTR杀死特定细胞的转基因小鼠模型的实验证实了CD11c+小胶质细胞是主要缓解神经病理性疼痛的一类小胶质细胞亚群。
随后,该研究利用流式细胞分选-RNA 测序发现一些在外周神经损伤诱导的CD11c+小胶质细胞中差异表达的基因,从中选择了IGF1作为假定的关键的疼痛缓解因子。关于这一点,作者没有解释原因。笔者检索文献发现,2017年Wlodarczyk等[7]报告,与健康成年小鼠来源的或炎症激活的小胶质细胞相比,新生小鼠大脑中小胶质细胞具有独特的髓鞘和神经元表型,主要是CD11c+小胶质细胞亚群通过分泌IGF1促进神经元和胶质细胞的存活、迁移和分化,并促进髓鞘化。另外,研究已知新生几周内的小鼠小胶质细胞分泌抗炎因子如IL-10 等,能阻断外周神经损伤诱导神经病理性疼痛的发生[8]。这两篇研究文献应该是激发Kohno等[6]开展CD11c+小胶质细胞研究并聚焦于IGF1的线索,但可能担心创新性的评价受损而未引用并感激前人的成果。笔者认为,这可能是论文发表要求新颖性导致的一种畸形现象,因为基于新颖性的引用评价体系如果使用不当就会抹杀很多重要发现的研究者应得的声誉,也会阻碍相关成果后续转化研究的进展。
利用Itgax-Cre;Igf1flox/flox细胞特异性敲除小鼠,Kohno 等[6]证实在CD11c+小胶质细胞中敲除Igf1(即IGF1对应基因)也同样能消除小鼠神经病理性疼痛的恢复能力。为排除Itgax-Cre;Igf1flox/flox小鼠敲除了Igf1对神经系统发育的潜在影响,他们又构建了Cx3cr1CreERT2;Igf1flox/flox诱导型细胞特性敲除小鼠,结果显示在成年后注射他莫昔芬清除小胶质细胞中的IGF1也同样基本阻断了小鼠神经病理性疼痛的恢复能力。进一步研究发现,鞘内注射IGF1抗体或重组IGF1能阻断神经病理性疼痛的恢复能力,或短期抑制神经病理性疼痛。最后,Kohno 等[6]证明在外周神经损伤后第35 天神经病理性疼痛接近恢复时,诱导清除Itgax-DTR-EGFP小鼠的CD11c+小胶质细胞或诱导清除Cx3cr1CreERT2;Igf1flox/flox小鼠的CD11c+小胶质细胞中的IGF1,都能让小鼠重新出现机械痛觉敏感。
为了确认CD11c+小胶质细胞的活化是由C 纤维(C-fiber)还是A 纤维(A-fiber)的损伤引起,Kohno等[6]将 霍 乱 毒 素B 亚 基(Choleratoxin B subunit,CTB)或异凝集素B4(isolectin B4,IB4)结合的皂草素(CTB-Saporin、IB4-Saporin)注射至小鼠脚掌,分别损伤背根神经节中A纤维神经元(髓鞘包裹)和C-纤维神经元(无髓鞘包裹),发现只有损伤A纤维神经元能诱导出现CD11c+小胶质细胞,但外周损伤不诱导已存在的CD11c+小胶质细胞增生。并且通过原代细胞培养和椎管内注射纯化的髓磷脂碎片实验证实,CD11c+小胶质细胞是由小胶质细胞在吞噬髓磷脂碎片后诱导表达CD11c。
2 结果点评
Kohno 等[6]利用多个基因条件性敲除小鼠和诱导型细胞特异性敲除小鼠,发现被A 纤维感觉神经元损伤后释放的髓磷脂碎片激活的脊髓背角中小胶质细胞表达CD11c+,此类CD11c+小胶质细胞亚群通过分泌IGF1 来缓解外周神经损伤诱导的小鼠神经病理性疼痛,并持续抑制异常机械疼痛的复发(图1)。

图1 CD11c+小胶质细胞缓解神经病理性疼痛的作用机制示意图Figure 1 Schematic diagram of the mechanism by which CD11c+microglia relieve neuropathic pain
此发现指明脊髓内CD11c+小胶质细胞亚群是被外周神经损伤激活的具有抗神经痛的胶质细胞,表明开发选择性靶向CD11c+小胶质细胞、促进抗炎活性和(或)提高IGF1 表达及分泌能力的小分子,以及研发人诱导多能干细胞(human induced pluripotent stem cell-derived cardiomyocytes,hIPSC)来源的CD11c+小胶质细胞,有可能缓解临床上特定类型的外周神经损伤诱导的神经病理性疼痛。从该研究的结果看,IGF1可能是CD11c+小胶质细胞抑制疼痛的主要分子。但笔者深入分析该文中的差异表达基因(CD11c+小胶质细胞与CD11c-小胶质细胞相比)发现,CD11c+小胶质细胞中高表达的基因富集在细胞因子相关信号通路、趋化因子相关信号通路、生长因子结合信号通路和脂蛋白颗粒结合信号通路等潜在与炎性反应、疼痛相关的信号通路,低表达的基因主要富集在代谢相关的信号通路(图2,表1)。

表1 CD11c+小胶质细胞中高表达基因富集的潜在与疼痛相关的信号通路Table 1 Genes highly expressed in CD11c+microglia were enriched in pain-related signaling pathways
笔者进一步利用STRING数据库(https://cn.stringdb.org/)分析CD11c+小胶质细胞中高表达和低表达基因的相互作用网络,发现高表达的抑制疼痛的基因除Igf1之外,还有Sod2、Anax2和Adora1;高表达的促疼痛的基因有Ccl5、Cd14、Cybb、Dtnbp1、Lgals1、Mif、Osm、Ptger4、Ptgs2、Spp1、Tlr2 和Csf1;抗炎性反应的基因还有Il1rn、Lpl、Socs2 和Cd44;促炎性反应的基 因还 有Ccl22、Ccl5、Ccl6、Cd36、Csf1、Cxcl10、Cxcr4、Il1b、Mif、Osm、Pdgfa、Areg和Spp1;低表达的基因中Tlr9 是抑制疼痛的基因,没有促疼痛和与炎症相关的基因(图3)。从图2 和图3 可以看出,Sod2、Anax2 和Adora1 很可能也对CD11c+小胶质细胞抑制疼痛的功能有贡献。CD11c+小胶质细胞高表达一些促疼痛基因提示,CD11c+小胶质细胞可能还不是一个单一的亚群,可能存在一部分CD11c+小胶质细胞是促炎性反应和疼痛的,后续需要通过单细胞测序确认CD11c+小胶质细胞是否是单一的群体细胞类型。

图2 CD11c+小胶质细胞中高表达(A)和低表达(B)基因的富集信号通路Figure 2 Signaling pathways enriched for genes that were expressed highly(A)or lowly(B)in CD11c+microglia
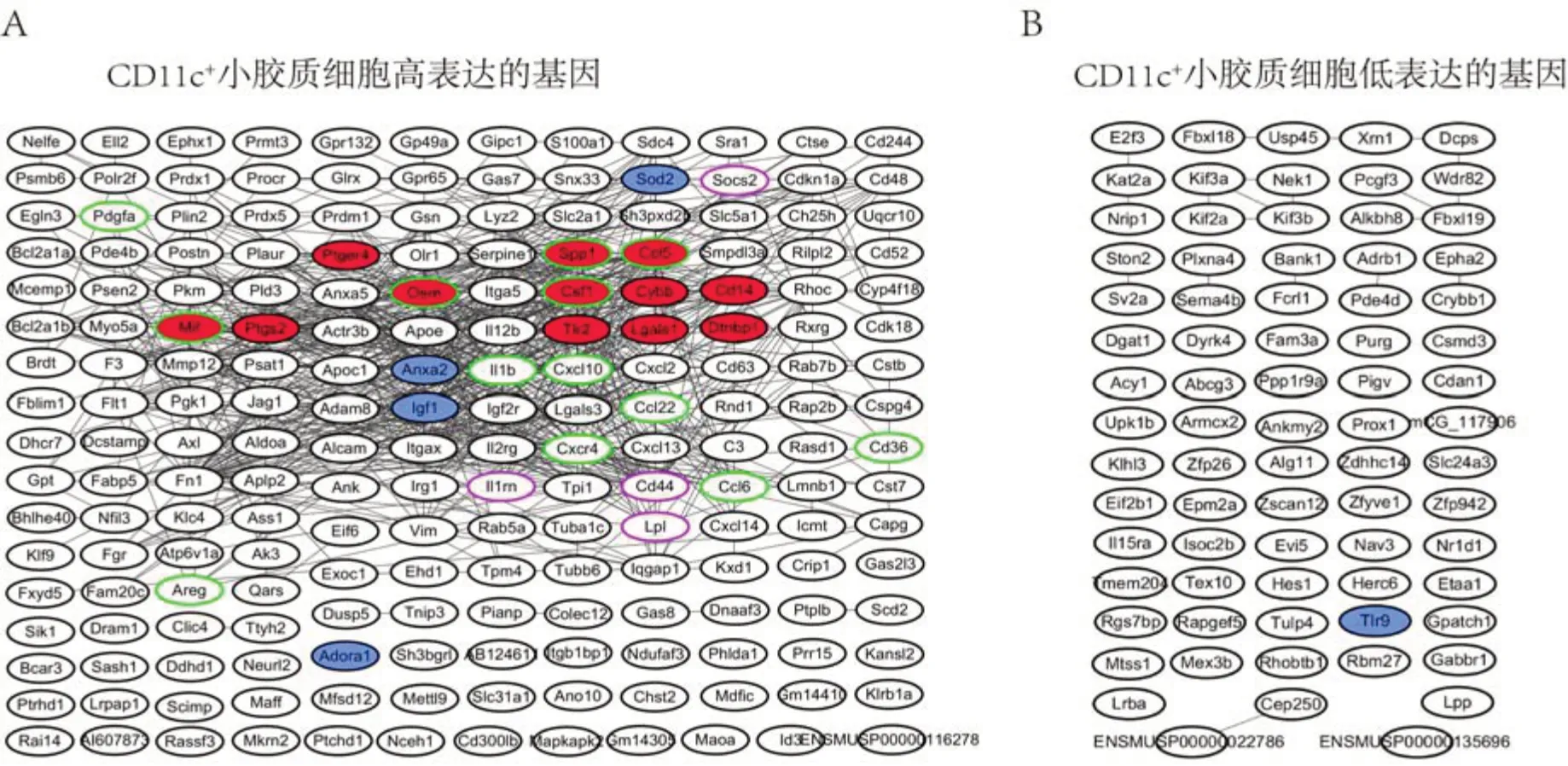
图3 CD11c+小胶质细胞中高表达的基因(196个)相互作用(A)和低表达的基因(75个)相互作用(B)Figure 3 Interaction of highly expressed genes(196)(A)and lowly expressed genes(75)(B)in CD11c+microglia
Kohno等[6]应用的Itgax-Venus和Itgax-DTR-EGFP转基因小鼠是由5 kb 的Itgax(即CD11c 对应基因)启动子驱动报告基因的表达,表明5 kb的Itgax启动子能非常好地控制外源基因在小鼠小胶质细胞中表达[9]。可以运用这5 kb 的Itgax启动子来构建Itgax-Igf1 敲入的小胶质细胞株(过表达IGF1),推测移植持续分泌IGF 的Itgax-Igf1 敲入的小胶质细胞株至鞘内会有与注射IGF1一样的缓解神经病理性疼痛的效果,而且缓解疼痛的有效时间更长(图4)。
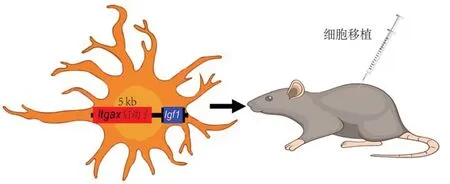
图4 Itgax-Igf1敲入的IGF1过表达的胶质细胞可用于镇痛研究Figure 4 Itgax-Igf1 knock-in glial cells with overexpressing IGF1 could be used for analgesic studies
3 研究展望
虽然Kohno 等[6]的发现给出了转化研究的方向,但还是需要进一步的研究来夯实CD11c+小胶质细胞和IGF1成为药物开发靶点的依据。比如需要:(1)检测其他的外周神经损伤小鼠模型中CD11c+小胶质细胞激活的数目,以及CD11c+小胶质细胞在缓解神经病理性疼痛中的功能大小,因为Tu 等[10]最新研究发现,椎间盘髓核压迫坐骨神经造成的神经病理性疼痛不依赖小胶质细胞;(2)确认CD11c+小胶质细胞是否也在大鼠、猴和人的脊髓中被外周神经损伤激活,并且是胶质细胞中主要的起抗炎镇痛的亚群;(3)确定临床的适应症是哪类神经病理性疼痛;(4)探明外周神经损伤引起的长期慢性神经病理性疼痛是否会让脑内疼痛传导、感知核团中出现CD11c+小胶质细胞;(5)检查健康的脑内是否存在CD11c+小胶质细胞,如果存在,那么利用小分子增强CD11c+小胶质细胞的功能时是否会对健康大脑产生不利影响,比如过度抑制脑内炎性反应而不能快速有效地消灭侵入大脑的病原体;(6)研究鞘内给予IGF1是否会对大脑的功能(如多巴胺神经元的功能)产生不良反应。
而且需要强调,外周神经损伤诱导的神经病理性疼痛不止有小胶质细胞参与,还有星形胶质细胞和直接传导疼痛信号的敏化了的外周和脊髓神经元参与,比如本研究团队发现选择性切断神经(spared nerve injury,SNI)会降低miR-96在小鼠背根神经节和脊髓背角的神经元中的表达,继而升高电压门控钠离子通道Nav1.7、Nav1.8 和Nav1.9 的表达,从而敏化外周和脊髓神经元,导致机械痛觉敏感[11]。因此,靶向CD11c+小胶质细胞的治疗药物应用于遗传背景复杂的患者,其有效率和镇痛效果需要谨慎估算。
另外,除了对疼痛治疗研究的启发外,Kohno等[6]的发现也提示CD11c+小胶质细胞和IGF1 可能抑制炎症相关的神经退行性疾病,如帕金森病、阿尔茨海默病、肌萎缩侧索硬化症的发展。这些均值得进一步研究探讨。
[作者贡献Author Contribution]
彭长庚检索文献、撰写和修改文稿;富研分析差异表达基因,制作图3 和修改文稿;朱冯婷制作图1 和修改文稿;夏瑞龙分析差异表达基因,制作图2及表1,修改文稿;夏玮制作图4和修改文稿。
[利益声明Declaration of Interest]
所有作者均声明本文不存在利益冲突。

