不同时程APP/PS1 模型小鼠嗅球病理和突触形态变化及美金刚干预作用
刘佳妮, 刘剑刚, 韦 云, 罗增刚, 李 浩, 王 怡, 李 琨
(1. 中国中医科学院西苑医院, 中国中医科学院老年病研究所, 北京 100091; 2. 中国中医科学院研究生院, 北京 100700; 3. 天津中医药大学,天津 301617; 4. 北京市中医管理局,北京 100053; 5. 北京开放大学,北京 100081)
阿尔茨海默病(Alzheimer's disease,AD)患者在淀粉样蛋白-β(amyloid beta,Aβ)斑块沉积和学习记忆障碍开始之前,往往会出现嗅觉功能障碍,其典型特征是识别气味的能力下降[1]。淀粉样前体蛋白(amyloid precursor protein,APP)/早老素1(presenilin 1,PS1)等双转基因模型AD 小鼠也表现出嗅觉受损[2]。嗅觉功能障碍被认为是AD的前驱症状,已被提议作为认知障碍的预测因素[3]。因此,针对嗅觉功能障碍的干预可能有助于延缓AD患者认知障碍病程的进展。然而目前嗅觉减退的神经机制在很大程度上是未知的。由于通常不会对嗅觉结构进行神经病理学分析[4],所以其临床特征与潜在病理学之间的关系尚不清楚,但有研究者提出AD 患者嗅觉障碍可能是由嗅球(olfactory bulb)、嗅觉上皮或嗅皮质受损引起[5]。
嗅球作为第一个处理嗅觉信息[6]、最早积累Aβ的大脑结构,其病理变化已被证实可以显示AD的早期神经退行性变化,便于早期发现、早期干预[7]。已知嗅觉功能障碍症状会随着年龄的增长而逐渐加重[8],同时伴随Aβ的沉积和扩散;嗅球也随着年龄的增长会对Aβ的影响变得更加敏感[9],更容易促进Aβ的积累和释放[10]。
盐酸美金刚(memantine hydrochloride,MEM)是首个经FDA批准应用于治疗中、重度AD的临床药物,具有调节谷氨酸活性的作用,属于N-甲基-D-天冬氨酸受体拮抗剂的代表药物[11]。多项研究表明,美金刚可以改善APPswe/PS1ΔE9 (APP/PS1)转基因小鼠模型的学习记忆能力[12-13]。然而,美金刚对AD 嗅觉系统的作用报告并不多见,尚不清楚美金刚是否能改善APP/PS1小鼠模型的嗅球病理变化。
为了初步评估不同时程APP/PS1 双转基因模型小鼠的空间记忆能力和嗅球病理变化,以及美金刚的治疗作用,本研究参考相关文献报告[14],选取6 月龄(成年期)和12月龄(中年期)的APP/PS1小鼠,比较美金刚对不同月龄APP/PS1 小鼠嗅球病理和突触形态的干预作用,为美金刚用于治疗AD嗅觉障碍提供初步的实验依据。
1 材料与方法
1.1 实验动物
SPF 级4 周龄雄性APP/PS1 双转基因小鼠40 只,4周龄雄性C57BL/6 小鼠20 只,体质量均为13~15 g,由北京华阜康生物科技股份有限公司提供[SCXK(京)2019-0008],动物质量合格证号为11401300070455。小鼠饲养于中国中医科学院西苑医院屏障环境实验动物室[SYXK (京) 2018-0018],室温控制在24~26 ℃,相对湿度为40%~70%。小鼠自由进食和饮水,每日光照和黑暗各12 h,待饲养到3月龄或9月龄后进入分组实验。实验过程中严格遵循实验动物3R 原则,按照国家科技部《关于善待实验动物的指导性意见》和北京市《实验动物福利伦理审查技术规范》的要求执行。本研究方案经过中国中医科学院西苑医院医学伦理委员会审查通过(伦理审批号为2018XLC012-2)。
1.2 主要试剂与仪器
MEM 片(H.Lundbeck A/S 丹麦灵北制药有限公司生产,进口药品注册证号为H20120268、H20130372)由中国中医科学院西苑医院药剂科提供;丙酮(批号20170411,进口分装)由国药集团化学试剂有限公司提供;Spon 812 包埋剂(批号ZB-S0060)购自美国SPI 公司;戊巴比妥钠(批号T860901,进口分装)由佛山市化工实验厂提供;甲醛溶液(批号C10561782)购自上海麦克林生化科技有限公司。ZS-001 型Morris水迷宫系统由北京众实迪创公司生产;H-7650型透射电镜由日立(日本)公司生产;BX43型光学显微镜由日本奥林巴斯公司生产;RM2245型半自动轮转式切片机、ASP200S型全自动脱水机、EG11型自动包埋机和EM UC6超薄切片机均由德国Leica公司生产。
1.3 动物模型和分组
APP/PS1双转基因小鼠常规饲养至3月龄时,根据数字表法随机分为6 月龄模型组(6-APP/PS1 组)、12月龄模型组(12-APP/PS1 组),以及使用药物干预APP/PS1 双转基因小鼠的6 月龄MEM 组(6-MEM 组)、12 月龄MEM 组(12-MEM 组)。另设空白对照组,即常规饲养至3 月龄时的C57BL/6 小鼠分为6 月龄C57 组(6-C57组)、12月龄C57组(12-C57组)。以上每组各10只。空白组和模型组均以等体积纯净水灌胃,MEM组每日以MEM 2.6 mg/kg水溶液灌胃给药。两组小鼠分别在3月龄和饲养至9月龄时开始灌胃给药,药液体积为0.1~0.2 mL/10 g,均灌胃3 个月,分别至6 月龄和12月龄时进行水迷宫行为学检测。
1.4 水迷宫法检测小鼠行为学变化
采用Morris 水迷宫评估小鼠的空间学习记忆能力[15]。Morris 水迷宫由一个直径1 m、高0.6 m的圆形水池组成,水位为35 cm,水温保持在23 ℃。添加脱脂奶粉使池水变得不透明。逃生平台位于水池的一个象限内,位于水面以下1 cm处。小鼠依次放置在其他3个不同象限的水池中,每只小鼠有90 s的时间爬上平台,并允许在平台上停留5 s,若小鼠找不到平台则引导其上到平台。通过每日4次、连续5 d的训练,小鼠获得了关于逃生平台位置的空间记忆。第5 天训练后24 h,移除平台,再让小鼠在池中游90 s,记录和分析小鼠在原平台位置的穿越次数(即穿台次数)、在目标平台象限的停留时间和路程(即目标象限时间、目标象限路程),以及总路程。
1.5 HE染色观察小鼠嗅球病理形态
在Morris水迷宫测试后次日,小鼠腹腔注射2%戊巴比妥钠(30 mg/kg 体质量)深度麻醉,低温下快速取出嗅球。每组随机取5 只小鼠的嗅球组织,用质量分数为4%的多聚甲醛溶液固定,常温下保存。组织浸泡后,包埋浸蜡,切片脱蜡,二甲苯浸洗3 次,每次15 min;100%、90%、80%和70%梯度乙醇脱苯,每次3 min;自来水冲洗3 min,去离子水漂洗3 min;苏木精染液染色10 min后水洗,盐酸乙醇分色,2 s后水洗;1% 伊红染液染色1 min,去离子水稍水洗;100%、90%、80%和70%梯度乙醇脱水,每次1 min;二甲苯透明3次,每次15 min;中性树胶封固后,每张切片分别于40 倍和200 倍光学显微镜下观察嗅球病理组织形态,并进行拍照,采用Image Pro Premier图像分析系统进行分析。
1.6 超薄切片染色观察小鼠嗅球超微形态
另5 只小鼠嗅球组织用2.5%戊二醛磷酸缓冲液固定,保存于4 ℃冰箱。使用振动切片机将嗅球冠状切成厚度约0.2 mm的切片,然后用4%戊二醛固定2 h以上,再将嗅球组织切片暴露于1%锇酸固定液2 h,用PBS 漂洗3 次(5 min/次),50%、70%、90%和100%梯度丙酮脱水(每次15 min),然后梯度浸透(丙酮和包埋剂比例依次为2∶1、1∶1、0∶1,各2 h),烤箱烘干(36~60 ℃,12~48 h)形成包埋块。用超薄切片机行70 nm 切片,附于铜网上,超薄切片分别用醋酸铀溶液和柠檬酸染液染色30 min,然后用透射电子显微镜观察嗅球中神经和突触的超微结构改变。
1.7 统计学方法
采用SPSS 23.0软件进行统计学分析。数据进行正态分布检验,符合正态分布的计量资料以±s表示。组间比较时采用单因素方差分析,方差齐时采用Tukey检验,方差不齐时采用Games-Howell 检验。不符合正态分布的计量资料以中位数(四分位数间距)表示,组间比较时使用非参数检验的Kruskal-WallisH检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同时程APP/PS1模型小鼠的空间记忆能力变化
连续5 d 训练小鼠记住逃生平台的位置后,对第6天小鼠空间探索实验的穿台次数、目标象限时间、目标象限路程和总路程进行分析。与6-C57 组比较,6-APP/PS1组的穿台次数减少(P<0.05),目标象限时间和路程缩短(P<0.05)。与12-C57 组比较,12-APP/PS1组小鼠穿台次数明显减少(P<0.05),目标象限时间和路程显著缩短(P<0.05)。与6-C57组比较,12-C57组小鼠穿台次数减少(P<0.05),目标象限时间和路程缩短(P<0.05)。与6-APP/PS1 比较,经过MEM(2.6 mg/kg)干预后,6-MEM 组穿台次数显著增加(P<0.05),目标象限时间和路程明显延长(P<0.05)。和12-APP/PS1比较,12-MEM组穿台次数增加(P<0.05),目标象限时间和路程明显延长(P<0.05)。总路程上,6-C57 组和6-APP/PS1 组无明显差异(P>0.05),而12-APP/PS1 组小鼠比12-C57 组显著缩短(P<0.05),其余各组无显著差异。实验结果表明,美金刚治疗改善了APP/PS1 小鼠的空间记忆能力。结果见图1A。
在空间探索实验中,C57 组小鼠通常采用趋向平台式的搜索方式,而APP/PS1 组则多采用随机式或边缘式的搜索策略,提示APP/PS1 组小鼠空间记忆能力出现损伤;MEM 干预后的APP/PS1 小鼠显示倾向使用趋向平台式的搜索方式,说明MEM能提高APP/PS1小鼠的空间记忆能力。结果见图1B。
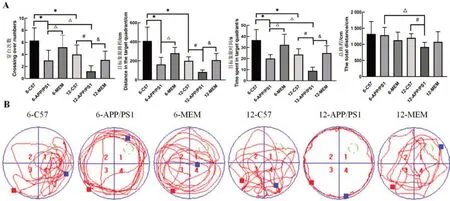
图1 Morris水迷宫实验评估各组小鼠的行为学变化Figure 1 Morris water maze test to evaluate the behavioral changes of mice in each group
2.2 不同时程APP/PS1 模型小鼠的嗅球病理变化
HE 染色后光学显微镜下观察结果(图2)显示,6-C57组小鼠的嗅球在低倍镜(×40)下呈卵圆形,结构完整清晰,内层可见大量神经元呈环状、层状排布,规则紧密,细胞核呈圆形,自外向内依次可观察到嗅神经层、小球层(glomerular layer)、外丛状层、僧帽细胞层、内丛状层和颗粒细胞层;高倍镜(×200)下可见小球层紧致,边界清楚,呈球形排列,每个突触小球周围的球周细胞(periglomerular cells)分布密集。外丛状层细胞深部可见僧帽细胞(mitral cells)胞体较大,胞质丰富。

图2 HE染色后光学显微镜观察各组小鼠的嗅球病理变化Figure 2 Pathological changes of the olfactory bulb in mice in each group observed by optical microscopy after hematoxylin-eosin staining
与6-C57 组相比,6-APP/PS1 组低倍镜(×40)下可见嗅球层状结构完整清晰,突触小球无明显变化;高倍镜(×200)下可见部分突触小球周围的球周细胞分布稀疏且数量稍减少,僧帽细胞萎缩且数量明显减少。
与6-APP/PS1 组相比,6-MEM 组低倍镜(×40)下可见嗅球形态较好,各细胞层结构较完整,小球层稍松散但均匀分布,呈球形结构,数量较多;高倍镜(×200)下可见球周细胞数量稍增多,僧帽细胞数量则明显增多。
与6-C57 组相比,12-C57 组低倍镜(×40)下可见嗅球形态出现轻度改变,各细胞层结构尚完整,小球层部分欠均匀分布,边界尚清楚;高倍镜(×200)下可见球周细胞稍减少,僧帽细胞密度下降。
与12-C57 组相比,12-APP/PS1 组的部分嗅球层结构缺失,小球层松散且数量变少;高倍镜(×200)下突触小球数量减少伴有结构不清,周围的球周细胞明显减少,僧帽细胞数量大幅减少。
与12-APP/PS1 组相比,12-MEM 组低倍镜(×40)下可见嗅球形态轻度变形,结构尚完整,小球层结构部分欠均匀分布,边界尚清楚;高倍镜(×200)下可见球周细胞和僧帽细胞数量稍增多。
统计分析各组小鼠嗅球中球周细胞和僧帽细胞的数量(图3),结果发现APP/PS1 小鼠6 月龄时嗅球病理形态与C57BL/6 小鼠无显著差异,僧帽细胞数量开始出现减少(P<0.05);12 月龄可观察到嗅球的球周细胞和僧帽细胞数量均显著减少(P<0.05)。与同龄的APP/PS1 小鼠相比,MEM 干预后,6 月龄时嗅球的僧帽细胞数量增加(P<0.05),而12 月龄时球周细胞及僧帽细胞数量无明显增加(P>0.05)。结果说明,MEM有助于缓解嗅球病理学损伤,且在早期干预效果更加明显。

图3 美金刚对球周细胞(A)和僧帽细胞(B)的影响Figure 3 Effects of memantine on periglomerular cells(A)and mitral cells(B)
2.3 不同时程APP/PS1 模型小鼠的嗅球神经超微结构改变
超薄切片染色后透射电子显微镜观察结果(图4A)显示,6-C57组小鼠嗅球组织神经细胞形态正常,呈椭圆形,结构清晰;细胞膜完整;核仁明显,大小基本正常;染色质分布较均匀,偶有染色质凝聚。6-APP/PS1 组小鼠嗅球神经元形态尚规则,少量胞体及细胞器肿胀;细胞核形态有改变,出现分叶;核膜凹陷形成核裂,染色质浓缩边集,部分核仁消失。6-MEM 组小鼠嗅球神经元形态得到改善,形态较为规则,细胞膜偶有不连续;细胞核较为完整,可见部分细胞存在核仁;染色质部分边集,分布尚均匀。
12-C57 组小鼠嗅球组织神经细胞形态基本正常,部分结构不清晰,细胞膜尚连续,染色质出现边集趋势,细胞内脂褐素增多。12-APP/PS1组小鼠神经细胞失去正常形态,出现广泛水肿、变性和坏死,形态不规则;细胞核形态明显改变,染色质高度凝聚,细胞核固缩、溶解或核仁消失。12-MEM 组小鼠嗅球组织神经细胞异常形态较多,胞体水肿,部分细胞核形态改变,染色质边集。
随着月龄增加,APP/PS1 小鼠的嗅球神经元变性程度逐渐加重,可见嗅球神经元形态不规则,尤其染色质会出现明显的凝聚边集现象。与APP/PS1 小鼠相比,MEM可使细胞形态更规则完整,染色质边集情况一定程度减轻,且6-MEM 比12-MEM 改善更加明显。结果说明,MEM 早期干预有助于改善APP/PS1 模型小鼠嗅球神经元超微结构的损伤。
2.4 不同时程APP/PS1 模型小鼠的嗅球突触超微结构改变
超薄切片染色后透射电子显微镜观察结果(图4B)显示,6-C57 组小鼠嗅球组织突触结构正常,可见大量对称性突触(抑制性突触)和非对称性突触(兴奋性突触),突触界面完整清晰,突触膜后致密物(postsynaptic density,PSD)较厚,突触前囊内有大量神经递质小泡,突触小泡膜结构清晰正常。与6-C57组相比,6-APP/PS1 组突触结构出现肿胀,突触界面损伤,PSD 厚度减小,对称性突触数量减少,突触小泡膜结构损伤。与6-APP/PS1 组相比,6-MEM 组突触形态有一定改善,突触界面较清晰,神经递质小泡较多,对称性突触数量增多。
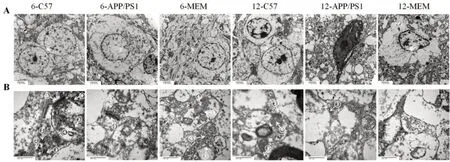
图4 超薄切片染色后透射电子显微镜观察各组小鼠嗅球神经(A,×7 000)和突触(B,×60 000)细胞超微结构Figure 4 Ultrastructure of the olfactory bulb nerve cells(A,×7 000)and synapses(B,×60 000)in each group observed by transmission electron microscope after ultrathin section staining
12-C57组小鼠嗅球组织突触数量略有减少,非对称性突触膜结构欠清晰,突触小泡数量减少。与12-C57 组相比,12-APP/PS1 组突触结构损害加重,形态不规则,突触体广泛肿胀、变性,镜下呈颗粒样,突触界面和突触小泡无法分辨。与12-APP/PS1 组相比,12-MEM 组突触改善不明显,仍有部分肿胀,突触界面不清晰,突触数量及突触小泡数量无明显增加。其中12-APP/PS1组以及12-MEM组由于突触体肿胀和镜下颗粒样变化,无法对突触、囊泡数量和PSD 厚度进行准确计数以及长度测量。
结果显示不同月龄的C57BL/6、APP/PS1小鼠以及MEM 干预后APP/PS1 小鼠的嗅球突触超微结构改变,表明在衰老过程中,APP/PS1 小鼠显示出比与其年龄匹配的C57BL/6 小鼠相对更显著的突触结构受损,而MEM可以改善这种突触损害,且早期干预的改善效果更明显。
3 讨论
AD是一种以进行性记忆缺陷和认知能力下降为特征的神经退行性疾病。针对AD的APP/PS1模型动物的认知缺陷在水迷宫测试中已经得到了证实[16],APP/PS1 小鼠空间记忆受损最早可在6 月龄时出现[17],12月龄时认知和行为缺陷明显[18],且记忆损害会在该模型的后续生命发展中持续存在[19]。本研究发现,与6-C57 组相比,12-C57 组小鼠的空间记忆能力有显著下降,与以往文献报告[20]相符。在6月龄时APP/PS1转基因小鼠的空间记忆障碍开始出现,在12月龄时小鼠空间记忆功能严重受损。既往研究表明,用美金刚治疗可以改善转基因AD小鼠模型的学习记忆缺陷以及突触神经传递[21],本研究给予APP/PS1小鼠美金刚灌胃治疗,证明美金刚可以恢复不同月龄APP/PS1 小鼠的空间记忆能力。此外,本研究初步阐述了美金刚可能对AD嗅觉结构改善有作用。
嗅觉减退是AD 常见的临床前驱症状[22],超过90%的AD 患者都会存在嗅觉功能障碍[23]。嗅觉功能障碍伴随着嗅觉结构的病理改变和细胞损伤,其中嗅球对AD病理学高度敏感,特别容易出现功能障碍,也是最早积累Aβ的大脑结构之一。Moriguchi等[24]研究显示,小鼠嗅球切除会引起认知缺陷,并降低海马中的胆碱能活性,说明嗅球与认知障碍密切相关。僧帽细胞是嗅球中最主要的投射神经元,在嗅觉信息的传递和加工中具有重要作用,而球周细胞会对僧帽细胞的电活动进行相关调控。本实验结果表明,6 月龄APP/PS1 小鼠嗅球内开始出现僧帽细胞数量下降,12月龄APP/PS1小鼠部分嗅球的神经细胞形态萎缩变形,尤其球周细胞和僧帽细胞数量显著减少。既往实验证实,APP/PS1 小鼠在6~10 月龄时出现严重的嗅觉缺陷[25];结合本研究结果推测,这可能与嗅球神经细胞萎缩变形以及球周细胞和僧帽细胞数量减少有关,而MEM 的早期干预可以改善APP/PS1 小鼠嗅球病理形态的变化,增加僧帽细胞数量,保护神经元结构的完整。
嗅球具有多种类型的神经递质,其中谷氨酸和γ-氨基丁酸等是最常见最重要的递质,这些神经递质的改变被认为是记忆障碍的主要原因之一[26]。僧帽细胞以谷氨酸作为神经递质[27],球周细胞以γ-氨基丁酸和多巴胺作为神经递质[28],其中谷氨酸是中枢神经系统中一种重要的兴奋性神经递质,通过特异性受体发挥作用,例如N-甲基-D-天冬氨酸受体。谷氨酸兴奋性毒性会引发神经元持续性去极化,造成神经功能异常,是AD进展的重要原因之一[29]。而MEM属于非竞争性N-甲基-D-天冬氨酸受体拮抗剂,可以阻断谷氨酸浓度病理性升高导致的神经元损伤[30],还可通过N-甲基-D-天冬氨酸受体减少不溶性Aβ含量,然后恢复AD动物模型中的谷氨酸稳态[31]。笔者推测MEM干预后嗅球内病理形态改善、僧帽细胞数量增加可能与其减轻了嗅球中Aβ的积累、减轻谷氨酸诱导的僧帽细胞损伤有关。
突触损伤是AD 病理生理学中的早期和关键事件,突触变化的可能后果就是学习和记忆功能受损[32]。与Aβ斑块、神经原纤维缠结或神经元丢失相比,突触损伤与AD患者中观察到的认知缺陷更相关[33]。目前AD突触研究大量集中在海马[34]、皮质等领域,极少涉及嗅球。有研究表明,6~7 月龄之后的APP/PS1 转基因AD模型小鼠嗅球的树突棘密度显著降低,突触小泡破损,PSD 厚度降低[35]。本研究发现,6 月龄APP/PS1小鼠突触结构出现肿胀,12 月龄小鼠的突触结构损伤更为严重,突触界面无法分辨,与以往文献报告结果相同。MEM 干预3 个月后可缓解APP/PS1 小鼠的突触损伤,早期(3月龄)较晚期(9月龄)时进行干预的改善效果更明显。异常的神经网络兴奋性是AD的一个普遍特征。Palop等[36]研究表明,中等水平的Aβ可以增强突触前活动及突触传递,而高水平的Aβ会降低谷氨酸能突触传递并最终导致突触丢失。另外,Wesson等[37]认为嗅球的早期神经元过度兴奋可能增强Aβ的突触后释放。因此,异常的神经网络兴奋性与Aβ的产生、释放之间形成了恶性循环,这种恶性循环可能加速AD 的发病。笔者推测美金刚在Aβ 低浓度阶段的早期(3月龄)干预降低了嗅球神经元的过度兴奋及其对Aβ的积累和传递,从而改善了6-APP/PS1组小鼠的突触结构。
认知障碍主要是由与年龄相关的神经病变累积驱动[38],同时自然老化过程也是影响嗅觉功能的主要因素之一[39]。有研究认为,嗅觉功能障碍已被确定为老年人5 年死亡率的最佳预测指标[40]。本研究观察到,与6-C57 相比,12-C57 的僧帽细胞密度下降,突触小泡数量减少,说明随月龄增加,C57BL/6 小鼠不仅会出现空间记忆能力的下降,嗅球也会出现超微结构的早期改变,提示老化是影响认知功能和嗅觉病理的重要因素。研究显示,APP/PS1转基因小鼠嗅球中Aβ负荷呈年龄依赖性增加[41],而嗅觉系统中Aβ 沉积物会促进啮齿类动物的AD 病理学改变[42]。本实验发现,与12-C57 相比,12-APP/PS1 小鼠的空间记忆能力有显著下降,球周细胞、僧帽细胞数量大幅减少,突触结构损害加重,突触体广泛肿胀、变性,说明APP/PS1 小鼠在衰老过程中比正常同龄小鼠更容易出现认知功能障碍和嗅球病理改变,而嗅觉系统的显著病理改变可能是加重空间学习记忆障碍的重要原因。
美金刚可以减少嗅球神经元的损伤,增加僧帽细胞数量,改善突触结构。根据既往研究推测,美金刚可能通过阻断谷氨酸浓度的升高、减少AD早期嗅球神经元过度活跃,减少脑内Aβ的产生和传播,从而改善空间记忆能力。未来本研究组将重点研究AD模型小鼠空间记忆与嗅球内部神经震荡、神经元活动的相关性,以此探讨美金刚在AD 嗅觉障碍临床应用中的潜在机制。此外,AD嗅觉缺陷是由于中枢还是外周嗅觉神经系统的功能障碍所引起,目前这一问题仍不明确。大脑皮层和边缘系统都有可能是AD嗅觉障碍的原因。美金刚对嗅觉投射的大脑皮层(颞叶)、边缘系统(杏仁核、海马和下丘脑)等其他嗅觉系统及认知功能的影响,也需要更多的基础实验和临床试验来明确。
综上所述,本实验初步观察了不同时程APP/PS1双转基因小鼠嗅球病理和超微结构的变化,发现美金刚早期干预可能是改善AD 嗅球病理改变的有效方法,但这一结果还需要进一步的研究加以证实。
【医学伦理声明Medical Ethics Statement】
本研究涉及的所有动物实验均已通过中国中医科学院西苑医院医学伦理委员会审查批准(No.2018XLC012-2)。所有实验过程均遵照实验动物相关法律法规条例要求进行。
All experimental animal protocols in this study were reviewed and approved by Medical Ethics Committee of Xiyuan Hospital, China Academy of Chinese Medical Sciences (Approval Letter No. 2018XLC012-2), and all experimental protocols were carried out following the guidelines such asAnimal Management Regulations(01/03/2017),Laboratory Animal: Guideline for Ethical Review of Animal Welfare(GB/T 35892—2018), ARRIVE 2.0, IGP 2012 and IAVE 2010.
[作者贡献Author Contribution]
刘佳妮负责具体的动物实验操作、数据统计与分析、文章撰写及修改;刘剑刚和韦云负责研究思路设计、实验课题申报、实验方案制定、部分实验操作、伦理委员会审批程序并提供文件信息,以及修改文章;罗增刚、李浩和王怡提供技术援助并负责论文审核及把关;李琨收集资料并辅助数据分析与核对。
[利益声明Declaration of Interest]
所有作者均声明本文不存在利益冲突。

