新型钠磷转运蛋白抑制剂DZ1462在5/6肾切除高磷血症模型大鼠中的药效研究
卢 晓, 张 林, 季 辉, 江善祥
(1. 南京农业大学动物医学院,南京 210095; 2. 迪哲医药股份有限公司,上海 201203)
大鼠和小鼠最常被用作人类疾病模型动物,这些动物与人类基因组同源性很高,易于操作,而且生命周期快,可短时间内得到治疗试验效果[1-3]。根据预期研究的目的,通过外科手术、药物灌注或环境改变的操作来诱导疾病动物模型是重要且必要的[4]。5/6肾切除动物模型因能够再现慢性肾病(chronic kidney disease, CKD)患者在临床中发生的代谢紊乱和骨病[5-6],已被用于研究肾脏疾病的发生机制、病理生理学及治疗策略等[7-10]。
CKD 患者的代谢废物(如磷酸盐等)无法通过泌尿系统排出体外,会累积并形成高磷血症[11],继而出现骨质疏松、软组织钙化,以及冠状动脉钙化等各种症状,给高磷血症患者带来巨大的痛苦和经济压力。肠道内90%以上的磷主动转运依靠钠磷转运蛋白(Na-phosphate transporter type 2b,NPT2b)。目前临床上治疗CKD 引起的高磷血症应用最广的是离子交换结合剂盐酸司维拉姆(Sevelamer),但是往往服药量大,容易产生严重的肠胃不良反应,并且价格昂贵,因此该药物的临床使用受到一定限制。至今,临床上尚没有通过抑制肠道内NPT2b转运蛋白来控制血磷的药物。
DZ1462作为迪哲医药股份有限公司新研发的针对NPT2b 转运蛋白的一种小分子抑制剂,预期能通过抑制NPT2b 蛋白的活性降低肠道内磷的转运效率,从而改善高磷血症。本研究首先采用5/6肾切除联合高磷饲料喂养的方法构建了大鼠高磷血症模型,然后在该模型上比较DZ1462 和Sevelamer 的药物治疗效果,以期为国产新药DZ1462应用于临床提供基础数据。
1 材料与方法
1.1 实验动物
SPF级Wistar大鼠购自北京维通利华实验动物有限公司[SCXK (京) 2021-0006;SCXK (京) 2012-0001],5~7周龄,雄性;经过检疫合格后,通过恒温运输车运送至上海,进入迪哲医药股份有限公司[SYXK(沪)2018-0015]的屏障设施内饲养,适应1周后开始实验。本研究经迪哲医药股份有限公司实验动物伦理委员会审查批准(IACUC No.1404-RDS-01),所有动物实验操作符合实验动物3R原则及国内外相关的实验动物福利伦理标准要求。
动物饲养环境的温度控制在20~26 ℃,相对湿度为40%~70%,相对外界大气压为30 Pa。正常的动物饲料为美国进口LabDiet颗粒饲料,动物饮用水为反渗透水,饲料容器及饮水瓶经高温高压灭菌冷却后使用。
1.2 主要试剂
舒泰50(货号为7WLEA)购于法国VIRBAC 公司;DZ1462 化合物(批号009)为迪哲医药股份有限公司实验室合成。特殊定制的高磷饲料(含1.2%磷)购自北京科奥协力饲料有限公司。Sevelamer(产品批号B4882B01)购自赛诺菲(杭州)制药有限公司。无机磷检测试剂盒(产品编号990-40091)购自绍兴市创烨生物科技有限公司。
1.3 5/6肾切除法构建CKD高磷血症大鼠模型
选取156 只大鼠,随机分为4 组:其中第Ⅰ组6只,设为正常对照,饲喂正常饲料且不手术;第Ⅱ组60只,经过5/6肾切除后饲喂正常饲料;第Ⅲ组60只,经过5/6 肾切除后饲喂高磷饲料;第Ⅳ组30 只,为假手术组,即只打开腹腔,不摘除肾脏,闭合伤口后饲喂高磷饲料。
5/6 肾切除手术过程:使用舒泰50(60 mg/kg)腹腔注射麻醉大鼠,同时肌内注射痛立定(4 mg/kg)进行术前止痛;背部肾区剃毛备皮,手术刀切开皮肤,钝性分离肌肉,将左侧肾脏暴露;缝线结扎肾脏的上下各1/3并切除,止血棉压迫止血;观察确认没有出血后,将剩余肾脏放回体内,闭合伤口,碘酒消毒伤口。1周以后进行二次手术,完整切除右侧肾脏。手术后饲喂10周以模拟患者肾脏损伤的过程。
1.4 动物模型对DZ1462 和Sevelamer 的药效学研究
1.4.1 给药方法
与正常对照Ⅰ组大鼠比较,血清磷水平增加>50%,是高磷血症大鼠模型建立成功的判定标准。最终有18只符合条件的高磷血症模型大鼠(从第Ⅲ组中挑选)入组进行药效实验,随机分3组,每组6只。G2(模型对照)组,不给予任何药物,饲喂正常饲料;G3组灌胃给予DZ1462 30 mg/kg(给药体积为10 mL/kg 体质量),每天3次,同时饲喂高磷饲料;G4组灌胃给予碳酸Sevelamer 250 mg/kg(给药体积为10 mL/kg 体质量),每天3 次,同时饲喂高磷饲料。连续用药3周(即21 d)。同时以第Ⅰ组大鼠继续作为正常对照,命名为G1 组。
1.4.2 临床观察
手术后和用药后(D0表示给药前的当天)均观察各组大鼠的精神状态、活动灵活性、体表被毛、采食量、体质量变化等一般情况,以及有无水肿、腹腔积液或瘫痪等病症。每天上下午各观察一次,每次观察时长约30 min。
1.4.3 血清磷含量检测每周采集各组大鼠的血清样本,即尾静脉采血后,3 000 r/min,离心5 min,取血清后常温运送至上海达安医学检测中心有限公司,使用无机磷测定试剂盒在室温下利用紫外比色法测定血清磷含量。血磷抑制率(%)=(5/6 肾切除手术后的血清磷含量-药物治疗后的血清磷含量)/(5/6 肾切除手术后的血清磷含量-正常对照组的血清磷含量)×100%。
1.4.4 肾脏病理学观察
各组动物造模10周后经二氧化碳安乐死,解剖获得肾脏肾盂部分,用体积分数为40%的甲醛溶液固定后,进行病理切片,切片厚度约4 μm。然后使用自动染色机进行HE染色,光学显微镜下观察肾脏组织病理学变化,拍照后用Aperio系统进行分析。
1.5 统计学处理
2 结果
2.1 建模过程中各组大鼠的临床表现
第Ⅰ组正常对照大鼠活动灵便,精神状态良好,毛色亮泽。第Ⅱ、Ⅲ、Ⅳ组大鼠精神状态较差,有不同程度的毛脱落现象,不喜活动,饮食量减少;其中第Ⅲ组(5/6 肾切除手术+高磷饲料喂养)比第Ⅱ组(5/6肾切除手术+正常饲料喂养)更严重。在第二次手术结束后观察10周,第Ⅱ、Ⅲ、Ⅳ组大鼠陆续出现死亡的情况,死亡大鼠存在腹腔积液和不同程度的水肿等现象;其中第Ⅱ组和第Ⅲ组的总体死亡率在第10周时分别为30%和40%,第Ⅳ组(假手术+高磷饲料喂养)则只有6%。第Ⅰ组大鼠没有出现死亡情况。第1、3、5、7、10周各组大鼠的死亡率见表1。

表1 各组大鼠在建模10周内的死亡率Table 1 Mortality of different group rats within 10 weeks after modeling
2.2 建模过程中各组大鼠的血清磷含量
与第Ⅰ组(不手术+正常饲料喂养的正常对照组)相比,第Ⅳ组(假手术+高磷饲料喂养)和第Ⅱ组(5/6 肾切除手术+正常饲料喂养)大鼠随着饲养时间延长,大鼠的血清磷水平呈逐步下降的趋势,而第Ⅲ组(5/6肾切除手术+高磷饲料喂养)的血清磷水平持续显著上升,第8 和第10 周时与对照组相比的差异均有极显著的统计学意义(P<0.01,图1)。
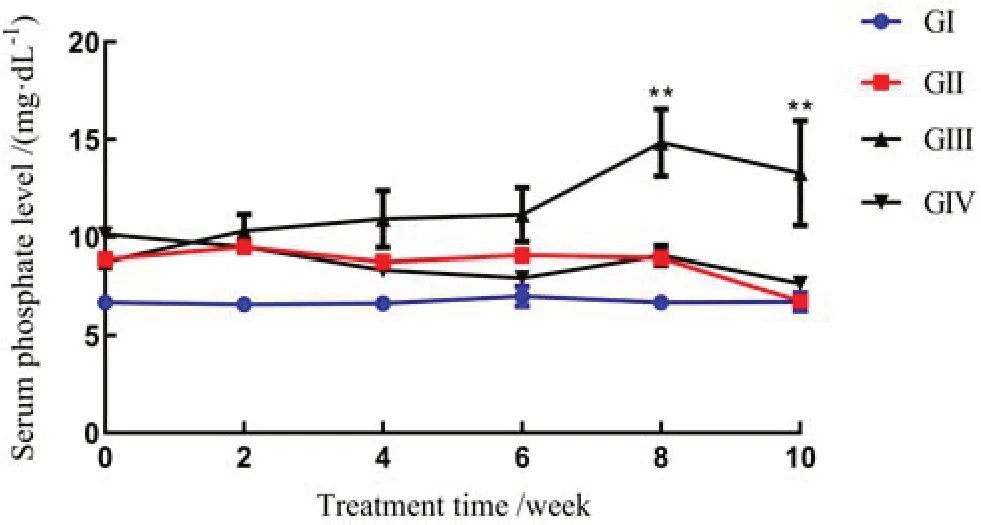
注:GⅠ,第Ⅰ组正常大鼠饲喂正常饲料;GⅡ,第Ⅱ组5/6肾切除大鼠饲喂正常饲料;GⅢ,第Ⅲ组5/6肾切除大鼠饲喂高磷饲料;GⅣ,第Ⅳ组假手术大鼠饲喂高磷饲料。★★表示第Ⅰ组和第Ⅲ组在第8周和第10周时血清磷含量差异有极显著的统计学意义(P<0.01)。Note:GⅠ,normal rats with a normal diet(groupⅠ);GⅡ,5/6 nephrectomy rats with a normal diet(group Ⅱ);G Ⅲ,5/6 nephrectomy rats with a high Pi diet(group Ⅲ);G Ⅳ,sham surgery rats with a high Pi diet(group Ⅳ). ★★Represent serum Pi has a highly significant difference between Group Ⅰand Group Ⅲat the 8th and 10th week(P <0.01).
图1 不同组别大鼠血清磷测试结果
Figure1 Serum phosphorus levels in different groups of rats
2.3 5/6肾切除高磷血症模型的病理组织学评估
HE染色观察各组大鼠的肾脏组织病理结果(图2)显示,与正常对照组(GI)大鼠相比,GIII 组(5/6 肾切除手术+高磷饲料)大鼠的剩余肾脏组织中有明显的肾小球硬化,肾小管萎缩、退化,间质炎症、纤维化和钙化等病理现象。其肾损伤情况与CKD 患者类似,可以作为CKD动物模型。
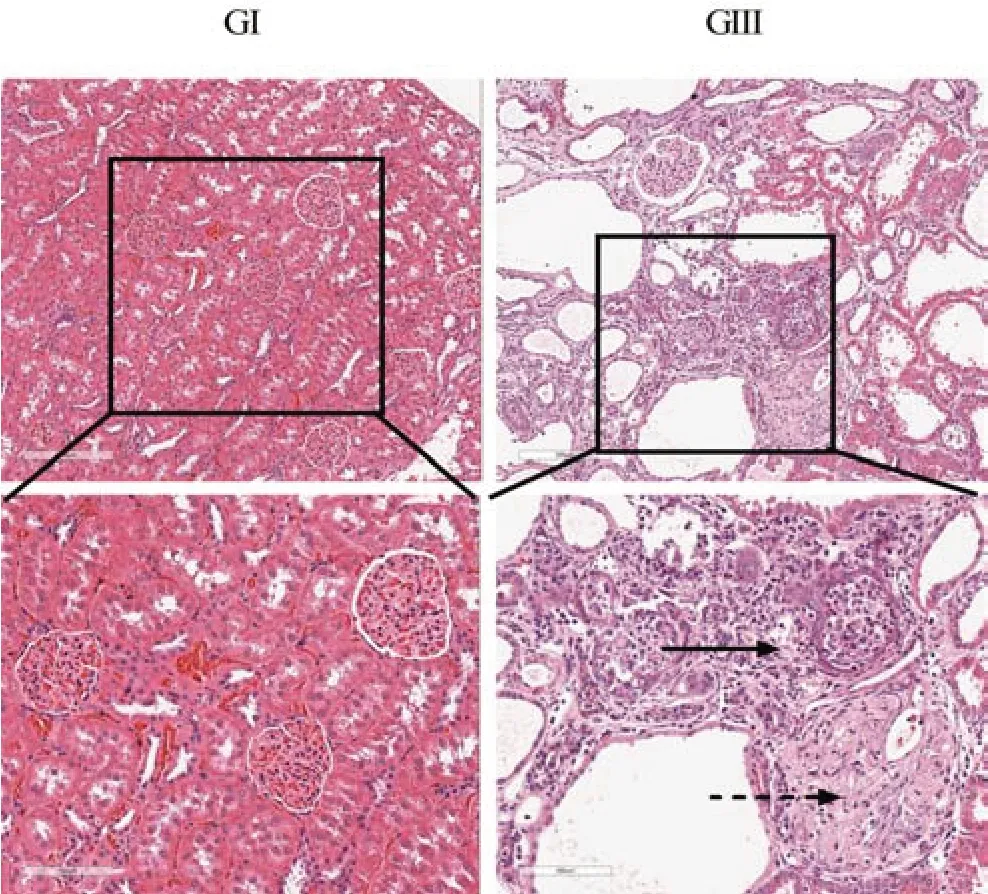
图2 5/6肾切除手术模型大鼠的肾脏组织病理评估(HE染色)Figure 2 Pathological evaluation of kidney tissue in 5/6 nephrectomy model rats(HE staining)
2.4 不同化合物处理后大鼠血清磷水平的比较
在药物治疗后的第7天、第14天和第21天,和未经药物处理的5/6 肾切除高磷血症模型对照组(G2)相比,DZ1462治疗组(G3)和Sevelamer治疗组(G4)大鼠的血清磷含量均有所降低,并且DZ1462的降磷效果优于市售药物Sevelamer;但DZ1462 给药组与Sevelamer 给药组相比,血清磷的绝对值差异尚无统计学意义(P>0.05,图3)。而在经DZ1462 和Sevelamer药物治疗后的第7、14、21 天时,DZ1462 给药组大鼠的血清磷抑制率分别为(65±27)%、(61±13)%、(44±16)%,Sevelamer 给药组大鼠的血清磷抑制率分别为(22±13)%、(47±15)%、(28±11)%,各时间点两组间差异均有统计学意义(P<0.05)。

图3 用药后不同组大鼠血清磷水平的比较Figure 3 Comparison of serum phosphorus levels among different groups of rats after drug treatment
3 讨论
利用5/6肾切除术建造动物模型已被广泛用于CKD的药理药效学研究[12-14],其机制主要是通过手术切除大部分肾脏,导致剩余的肾脏代偿性运转,肾小球过度劳作增生,且随着病情的进展,肾实质转变为失代偿期,病理表现为肾小管萎缩、肾小管间质纤维化、肾小球硬化和局灶性肥大,最终形成CKD。5/6肾切除术造模后动物的精神状态、饮食、体质量等方面下降明显,与人类CKD后期的临床症状非常相似[15-19]。本研究所建立的5/6肾切大鼠模型的肾脏病理结果与上述文献报告一致。
在动物品系选择上,Hamzaoui等[20]比较了2个品系小鼠129/Sv和C57BL/6JRj中利用5/6肾切术进行心血管和肾脏造模的结果,发现5/6肾切12周后,129/Sv和C57BL/6JRj 雄性小鼠的血浆肌酐水平均显著升高,但129/Sv 小鼠在多尿、肾脏组织学损害和蛋白尿增加方面比C57BL/6JRj小鼠表现更明显,提示5/6肾切对129/Sv 小鼠心血管和肾脏的影响比C57BL/6JRj 小鼠更明显。由此可见,不同品系小鼠的造模结果不同。本研究选择Wistar 大鼠,是因为大鼠手术操作比较容易,而且可以从尾静脉多次重复采集血样;相比而言,小鼠眼眶采血的量受限制,且眼眶多次采血不符合动物福利要求。
本实验造模时第Ⅱ和Ⅲ组大鼠经5/6 肾切手术后,分别饲喂正常饲料和高磷饲料。结果发现,第Ⅲ组大鼠在造模第8 周和第10 周时血清磷水平显著上升,出现典型的CKD症状及磷代谢紊乱;与正常对照组大鼠相比,5/6 肾切+高磷饲料建模大鼠出现了明显的肾小球硬化,肾小管萎缩、退化,间质炎症、纤维化和钙化现象,表明高磷饲料有助于5/6肾切模型的构建;这与以往文献报道[17,21-23]的结果基本一致,提示本实验成功构建了大鼠CKD模型,可以应用于后续DZ1462的药效学研究。本研究随后制定了入选药效研究的高磷血症模型动物标准,即与正常大鼠比较,血清磷含量增加大于50%。最终有18只大鼠被选择继续进行药效实验。
DZ1462是本实验室新合成的针对NPT2b的特异性小分子抑制剂。目前市面上尚没有针对NPT2b 靶点的药物。本实验目的是研究DZ1462能否通过调节体内血清磷水平,缓解CKD患者的钙磷代谢异常,改善肾功能,减轻临床症状。本研究利用5/6肾切高磷血症大鼠模型,对DZ1462 及临床上应用的阴离子树脂结合剂Sevelamer 的药效进行比较。结果表明,DZ1462(30 mg/kg)和Sevelamer(250 mg/kg)每天3 次口服给药21 d的治疗后大鼠血清磷含量均有所减少,且DZ1462的降磷效果优于Sevelamer,但两者的绝对值比较差异无统计学意义(P>0.05);进一步统计分析发现,两者的血清磷抑制率比较差异有统计学意义(P<0.05)。
目前全球范围内在研的针对NPT2b 的小分子抑制剂有日本Astella 公司的ASP3325 和Daiichi Sankyo 公司的DS2330b。两家公司公布的Ⅰ期临床试验结果表明,ASP3325 和DS2330b 均不能改善CKD 患者的高血磷状态[24-25],这与本研究结论有差异。根据已公布的数据推测,ASP3325 和DS2330b 这两个化合物治疗失败的原因可能是其作用靶点的特异性不够,同时药物暴露时间不足,两个化合物的体内暴露量也远超DZ1462,同时不同物种间磷的转运机制也可能有所不同,这些都是需要重点考虑的因素。总之,口服特异性小分子NPT2b 抑制剂治疗高磷血症的作用仍然难以确定,值得继续研究。
需要说明,本研究尚存在一定的局限性,包括没有测试更多的指标,如成纤维细胞生长因子23(fibroblast growth factor 23,FGF23),以及未进行心脏肥大、主动脉钙化、次生海绵体区的海绵骨分析等,未能判断DZ1462对大鼠心脏、组织钙化和骨质疏松等方面的影响。本课题组今后将在动物模型上检测更多的肾脏相关指标,并通过建立更有效的人源化动物模型来研究DZ1462对高磷血症的治疗效果。
综上所述,本研究利用大鼠5/6肾切手术联合饲喂高磷饲料的方式成功建立了高磷血症模型。使用该模型对DZ1462的药效学进行验证,同时与临床上应用广泛的Sevelamer进行了药效比较;结果表明,DZ1462对大鼠血清磷的抑制率显著高于Sevelamer,表明在大鼠5/6 肾切模型上,DZ1462 具有良好的降磷效果。本研究结果提示,DZ1462 作为一种全新的NPT2b 抑制剂,能够部分阻断肠道磷离子的吸收,有着与Sevelamer 完全不同的作用机制,有望成为高血磷症患者的另外一个用药选择。
[医学伦理声明Medical Ethics Statement]
本研究涉及的所有动物实验均已通过迪哲医药股份有限公司实验动物伦理委员会审查批准(IACUC No.1404-RDS-01)。所有实验过程均遵照实验动物相关法律法规条例要求进行。
All experimental animal protocols in this study were reviewed and approved by Experimental Animal Ethics Committee of Dizhe Pharmaceutical Co., Ltd. (IACUC No. 1404-RDS-01), and all experimental protocols were carried out following the guidelines such asAnimal Management Regulations(01/03/2017),Laboratory Animal:Guideline for Ethical Review of Animal Welfare(GB/T 35892—2018),ARRIVE 2.0,IGP 2012 and IAVE 2010.
[作者贡献Author Contribution]
卢晓参与并负责DZ1462 化合物的前临床研发项目中体内部分实验,并撰写论文;张林参与DZ1462 化合物体内部分实验及论文修改;季辉负责文章内容的校对和审核;江善祥指导整个实验研究及论文审核。
[利益声明]Declaration of Interest]
所有作者均声明本文不存在利益冲突。

