CASR/VDR/PTH1R 信号通路在含钙肾结石发生机制中的初步研究
李静玲,柯坤彬,王振丞,秦德强,李 颢
(昆明医科大学第一附属医院 泌尿外科,云南 昆明 650032)
高钙尿及低枸橼酸尿是含钙肾结石的最重要因素[1]。本课题前期研究发现CASR(钙敏受体)和VDR(维生素D 受体)基因多态性与含钙肾结石的形成相关[2-3]。另外有研究发现PTH 可与G 蛋白偶联受体PTH1R(重组人甲状旁腺激素1 受体)结合,通过P38α-MAPK 信号通路调节VDR 的水平[4]。但是既往研究CASR、VDR 和PTH1R 主要参与肿瘤等代谢性疾病之中[5-6],在尿石症中的研究主要集中在体外细胞实验及动物模型[7-8]。我们此次课题通过对肾结石患者(实验组)及肿瘤患者(对照组)正常肾髓质进行qPCR、WB 实验及免疫荧光实验,发现了CASR、VDR、PTH1R 基因在人体肾髓质中表达,且实验组CASR、VDR蛋白的表达水平显著高于对照组,实验组PTH1R蛋白的表达水平低于对照组。于是我们首次提出了CASR 和VDR 基因可能通过PTH1R 信号通路参与了人体内含钙肾结石的发生机制。
1 资料与方法
1.1 实验样本
选取2020 年9 月至2021 年10 月在昆明医科大学第一附属医院13 例单侧肾癌在手术时获得了新鲜的正常肾髓质10 mg 为对照组,15 例结石导致积水肾行单侧肾切除术时获得新鲜肾髓质10 mg 为实验组。这些患者除外结核、近期服用糖皮质激素或雄激素及甲状旁腺功能亢进等代谢性疾病患者,该研究符合赫尔辛基宣言的标准,所有研究对象均为自愿参加本次研究,并签署知情同意书,本研究承诺对研究对象的个人信息严格保密。笔者收集了患者的临床资料,包括:年龄、性别、肿瘤大小,结石大小及位置、结石成分分析结果(其中13 例为草酸钙肾结石,1 例为磷酸钙结石,1 例为碳酸磷灰石),影像学CT、B 超、ECT 等资料、诊断时的肾功能、Ca2+水平。
1.2 实验方法
1.2.1 实时荧光定量Q-PCR应用微量RNA 提取试剂盒(天根)提取实验组和对照组病人肾髓质的总RNA,使用分光光度法测定提取的RNA 的量和纯度,通过每个样品中使用2 µg RNA 进行逆转录成cDNA,使用SYBR qPCR Master Mix(Q712-02)测定CASR、VDR 的mRNA 表达水平。引物序列见表1。

表1 引物序列Tab.1 Primer sequence
1.2.2 蛋白质免疫印迹(western-blot)取积水肾肾髓质组织为实验组,肾肿瘤周边正常肾髓质组织样本为对照组,分别把组织剪成细小的碎片,持续液氮充分研磨组织至粉末状,按照每20 mg组织加入200 µL 高效RIPA 组织裂解液(Solarbio,4 ℃保存),按每1 mL RIPA 加入10 µL PMSF(-20 ℃保存),冰上裂解30 min,裂解后样品离心3 min(12 000 g),取上清,加4×上样缓冲液,煮沸10 min,待冷却后上样。配制10%的SDSPAGE 胶,按照maker、对照组、实验组进行上样,每孔上样15 µL 蛋白,5 U maker,电泳分离蛋白,转膜,5%脱脂牛奶封闭1 h 后,SDS-PAGE 加入相应的一抗鼠抗CaSR 抗体(Santacruz,1∶1 000)、一抗鼠抗;VDR(Proteintech,1∶5 000)、一抗兔抗;PTH1R(Santa SC-12722,1∶1 000)、一抗兔抗,均以GAPDH 作内参(abmart P30008M,1∶2 000)。均用TBST 洗涤3 次,每次10 min。加入相应二抗(CST 7074,CST 7076,1∶2 000),37℃孵育2 h,用TBST 洗膜3 次,每次10 min,用ECL 发光法检测目的条带的表达,用imagej win 64 软件分析内参,调整内参一致。抗体序列见表2。
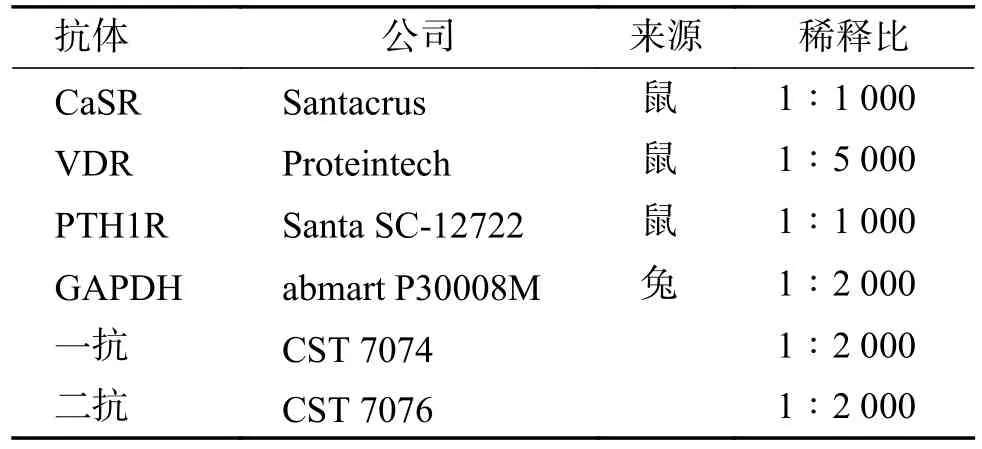
表2 抗体序列表Tab.2 Antibody sequence
1.2.3 免疫荧光免疫荧光从外科手术获得的福尔马林固定的石蜡包埋的组织样品用于免疫荧光。将5 µm 厚的切片安装在涂有聚赖氨酸包被的载玻片上,用二甲苯脱蜡,并通过梯度乙醇溶液再水化成蒸馏水。PBS 漂洗,抗原修复,将切片浸入pH=6.0 的柠檬酸盐缓冲液中,微波加热至沸腾,中档微波处理10 min,自然泠却。5%羊血清封闭,室温60 min。加合适浓度的一抗(CASR、VDR、PTH1R),4 ℃冰箱过夜。PBST 漂洗,加二抗山羊抗小鼠IgG H&L(Cy3 ®)于组织上进行标记,避光,37 ℃,1 h。PBST 漂洗,吸去多余的水分,每个组织上滴加50 µL 左右的抗淬灭封片剂(含DAPI)封片,使用丹吉尔全息扫描显微镜下观察,扫描。使用Case Viewer 软件进行分析。
1.3 统计学处理
用IBM SPSS Statistics 25 进行软件分析,CASR、VDR、PTH1R 的mRNA 的相对水平表示为平均标准偏差,通过非参数检验检测积水肾与肾肿瘤临近正常肾髓质间CASR、VDR 和PTH1R表达水平的差异性。为了评估CASR、VDR、PTH1R 表达及临床病理变量之间的关系,实验结果分为两组,上调和下调。当积水肾肾髓质组织中CASR mRNA 水平高于肾肿瘤临近正常肾髓质组织时,可认为CASR mRNA 表达在积水肾中上调,否认可认为下调。临床病理特征和CaSR、VDR、PTH1R 等基因表达之间的联系用非参数检验进行分析,P< 0.05 为差异有统计学意义。
2 结果
2.1 积水肾肾髓质组织中及肾肿瘤正常肾髓质组织
积水肾肾髓质组织中及肾肿瘤正常肾髓质组织中的CASR、VDR、PTH1R 等mRNA 表达,笔者使用了q-PCR 每个样本,绘制出qPCR 箱线。
CASR、VDR、PTH1R 等在肾髓质中表达的QPCR 差异性箱线图见图1。研究人群分为2 组,肾肿瘤患者为对照组,肾结石患者为实验组。q-PCR 结果提示CASR、PTH1R 基因 mRNA 在积水肾髓质及肾肿瘤正常髓质表达水平的差异无明显统计学意义(P> 0.05)。VDR 的mRNA 在积水肾髓质及肾肿瘤正常髓质表达水平的差异具有统计学意义(P< 0.05),见图1。

图1 CASR、VDR、PTH1R 的q-PCR 箱线图Fig.1 Q-PCR box plot of CASR,VDR,PTH1R
2.2 肾实体髓质组织中的CASR、VDR、和PTH1R 基因
笔者对每一个肾实体髓质组织中的CASR、VDR、和PTH1R 基因均进行了WB,其中CASR、VDR、PTH1R 均出现了目的蛋白条带的表达,见图2。
CASR、VDR、PTH1R 基因在积水肾髓质及肾肿瘤正常髓质蛋白质差异性表达的WB(Western Blot)。其中1,3,5=对照组(肾肿瘤正常肾髓质样本),2,4,6=实验组(积水肾肾髓质组织样本),GAPDH 为内参。可见实验组肾结石患者的CASR、VDR 基因的表达较对照组肾肿瘤患者上调,而PTH1R 基因表达下调,见图2。

图2 CASR、VDR、PTH1R 的蛋白质免疫印迹图Fig.2 Western blot of CASR,VDR,and PTH1R
2.3 CASR、VDR 和PTH1R 基因在肿瘤正常肾实体组织和积水肾实体组织中的表达
笔者的实验对CASR、VDR 和PTH1R 基因在肿瘤正常肾实体组织和积水肾实体组织中的表达做了免疫荧光标记,笔者的免疫荧光结果证实了CASR、VDR 和PTH1R 在肾实体髓质组织中均有表达,见图3。
CASR 基因表达的免疫荧光图3 显示,其中DAPI 核染为蓝色,红色为蛋白的阳性表达。可见CASR 基因在肾组织的髓质和皮质部的肾小管上皮细胞中均有表达,主要定位于肾小管上皮细胞胞质中。其中CARS 蛋白肾肿瘤患者髓质部和皮质部的表达差异不明显,而在积水肾组中髓质部的表达强度及表达量较皮质部的高,见图3。

图3 CASR 免疫荧光图(×400)Fig.3 Immunofluorescence images of CASR(×400)
VDR 基因表达的免疫荧光见图4,其中DAPI 核染为蓝色,红色为蛋白的阳性表达。VDR 主要定位于足细胞及肾近端小管,在肾肿瘤及肾积水患者皮质及髓质均有表达,且肾积水患者皮质髓质表达均高于肾肿瘤患者,见图4。

图4 VDR 免疫荧光图(×400)Fig.4 Immunofluorescence images of VDR(×400)
PTH1R 基因表达的免疫荧光图5 显示其中DAPI 核染为蓝色,红色为蛋白的阳性表达。PTH1R 主要位于肿瘤患者的远端小管,积水肾患者的近端小管,其中髓质表达高于皮质,且在髓质组织中呈现出逐渐递增的趋势,在皮质组织中呈现出逐渐递减的趋势。在肿瘤肾组织中皮质与髓质均为高表达,而在积水肾中可见髓质与皮质均为低表达,见图5。

图5 PTH1R 免疫荧光图(×400)Fig.5 Immunofluorescence images of PTH1R(×400)
3 讨论
在本研究中,笔者首次证实了CASR、VDR、PTH1R 基因在肾结石患者及肾肿瘤正常肾髓质组织的mRNA 及蛋白质表达水平。此外,通过WB(Western Blot)实验笔者证实了CASR、VDR 肾结石患者CASR、VDR 上调,PTH1R 下调,并通过免疫荧光标记进行了进一步验证。
CASR 基因是参与体内高钙尿代谢、VDR 基因是参与体内枸橼酸盐代谢的关键基因。CASR被证实能够通过络合钙抑制肾近端小管中二羧酸盐和柠檬酸盐的转运,从而降低含钙肾结石的发生发展过程,而尿液中羧酸盐和柠檬酸盐的增加会增加尿草酸钙的饱和度从而形成草酸钙结石[3]。VDR 影响NaDC1 的转运活性,导致肾近曲小管对枸橼酸的重吸收增加,进而导致高钙尿的发生[4]。CASR 和VDR 相关信号可以被不同的刺激因素激活或抑制,形成各自相关的信号通路,激活或抑制不同的转录因子、底物蛋白,介导不同的生物学功能效应。血清钙能刺激CASR 增加claudin-14 蛋白的表达,进而抑制claudin-16/claudin-19 结合形成的钙通道,从而减少细胞旁路中钙的重吸收[4]。PTH(甲状旁腺激素)和低磷血症能刺激VD 的活性形式1,25-二羟维生素D3 的生成,1,25-二羟维生素D3 通过血流入肠道内与VDR(维生素D 受体)结合,增加钙的吸收[9]。当体内血清钙上升时,CASR 被激活,增加PTH 分泌,后者又反过来作用于1,25-二羟维生素D3,导致钙磷的滤过负荷增加。而PTH增加钙的重吸收,磷的排泄,使血清钙升高,而后者又可抑制PTH 和1,25-二羟维生素D3 的合成[10]。
CASR、VDR 的mRNA 在肾结石积水患者中较肾肿瘤患者中趋于上调,相反,PTH1R 的mRNA 的表达趋于下调,我们使用WB 与免疫荧光亦证实了CASR、VDR 的上调及PTH1R 的下调。这与既往国内外研究基本一致。
CASR 可与配体钙结合后一方面可通过Gαi/o 的G 蛋白信赖性途径直接激活MAPK 和下调cAMP;另一方面可通过Gaq/11 途径,调控IP3 和DAG 释放信号,DAG 激活PKC 和Ras 后刺激P38-MAPK[17]。FGF23(成纤维细胞生长因子)通过磷酸化作用会抑制1α,25-dihydroxyvitamin-D 的合成,减少肠道对磷酸盐的吸收,进而减少体内磷酸钠盐的水平,从而调节VDR 和磷酸盐[18]。FGF-23 可以抑制MAPK/ ERK1/2 通路的信号转导并加速PTH(甲状旁腺激素)的分泌[19]。
既往研究已经证明了肾中CASR、VDR、PTH1R 等基因的表达,然而这些研究集中在CASR、VDR 与胃癌、结直肠癌、乳腺癌、前列腺癌、甲状腺癌等肿瘤代谢性疾病相关联[5,11-14]。另一方面侧重于研究CASR 依赖性抑制性支配的PTH 敏感性经细胞转运途径及细胞旁途径关联的钙离子重吸收及分泌[15-16]。已有研究证实 CASR、VDR 和PTH1R 在肾脏中定位表达,CASR 主要表达在近端小管刷状缘的顶端膜上[22],VDR 主要定位于足细胞及肾近端小管[23]。PTH1R 定位于肾小管S1 节段管腔表达[24]。然而它们使用的是HK-2 细胞以及大鼠等的肾组织,而不是人类组织,因此,笔者获得的关于人类的CASR、VDR、PTH1R 在肾中表达的数据是有限的。而在本课题研究中,q-PCR 中笔者的实验结果仅证实了VDR 的表达在实验组及对照组中的表达具有统计学差异,而CASR、PTH1R 基因的表达的差异性无统计学意义,这与我们的WB 跟免疫荧光实验结果稍有不同,我们的免疫荧光实验证实了CASR、VDR 在上述部位的表达,稍有不同的是笔者还证实了PTH1R 不仅表达在近端小管,亦表达在远端小管。笔者的WB 跟免疫荧光均证实了CASR、VDR 等在肾结石患者中高表达,而PTH1R 低表达,q-PCR 出现统计学无差异性的结果一方面可能与基因的转录后修饰及翻译有关[20-21],亦也可能由于我们的样本量较少,我们未来将在此方面作更深一步的探索性研究。
CaSR、VDR、PTH1R 在含钙肾结石进展过程中的确切功能机制尚不清楚。需要进一步的研究来揭示CaSR、VDR 表达参与含钙肾结石的机制。我们的实验研究有一定的局限性,在分析结果时应该综合权衡考虑。一方面由于样本数量相对较少,推断结果时可能有一定的统计学差异。另一方面,结石导致积水肾性肾切除的患者,临床上肾实质较薄,皮质髓质界限难以分清,而选取肾肿瘤患者的正常肾髓质为对照组而没有选择正常患者的肾髓质,可能会对实验结果产生一定的影响,主要是考虑到选取健康人的正常肾髓质有违伦理,所以可能存在实验上的不足。而且我们没有采取相关动物实验来确定CaSR、VDR、PTH1R 等基因在肾结石中的形成的机制。另外,疾病的遗传异质性、环境差异、激素在结石形成中的作用、种族特征、群体之间的差异性、对照组的选择、基因与环境的作用有可能是导致结果的不同,笔者应进行增加临床样本量、进一步的动物模型及相关实验信号通路研究论证,以确认积水肾样本中CaSR、VDR、PTH1R 等表达的临床病理特征。
——肾结石

