不同溶剂的枣叶中黄酮提取物分析及其抗氧化活性
高哲,张梁明慧,李喜悦,崔同*
河北农业大学食品科技学院(保定 071000)
枣叶为枣属植物的叶子,据《日华子本草》记载,枣叶性味温,无毒[1]。关于枣资源的开发利用主要集中在枣肉方面,没有针对枣叶进行有效的开发利用,使得枣叶这一珍贵的资源严重浪费。近年来的研究发现,枣叶中含有丰富的黄酮类化合物[2-4],具有清除自由基、抗氧化、镇静安神等多种药理功效[5-7]。郝红英等[8]采用响应面法超声波辅助提取新郑枣叶中总黄酮的工艺进行研究;Jin等[9]对枣叶粗提物的抗氧化活性开展研究,结果表明不只是枣果和酸枣仁具有抑制黄嘌呤氧化酶的活性和推电子能力,枣叶也具有类似的作用;Kim等[10]的研究表明,枣叶的水提物、70%乙醇提取物及80%甲醇提取物均表现出较强的清除ABTS+·和DPPH·的活性,其效果强于枣果;赵欣等[11]研究表明枣叶及枣芽的醇提物对DPPH自由基有显著的清除作用,它们的平均清除率分别为37.68%和34.14%,且各样品的清除率存在差异;蒋佳玲等[12]研究表明广枣叶总黄酮具有明显的抗心律失常、抗氧化、保护心肌缺血等作用,对改善心肌缺血再灌注损伤的疗效显著。然而更深入、系统的研究,如不同极性溶剂提取物的抗氧化活性比较等方面均尚未见报道。
实验室前期发现不同时期采收的枣叶黄酮的含量差异很大,因此试验以不同时期枣叶的乙醇提取物为原料,对其不同极性的提取物进行黄酮总含量和对ABTS+·、DPPH·自由基的清除作用测定,评价其抗氧化活性,为枣叶资源的开发利用及功能性食品的开发提供新的科学依据。
1 材料与方法
1.1 材料与仪器
枣叶嫩叶和枣叶老叶分别于2020年5月8日、2020年10月9日采自河北省沧县国家枣树良种繁育基地,品种为晋枣,采后自然风干,放置在真空干燥器中备用。
Agilent 1200型HPLC(由在线脱气机,四元输液泵,光电二极管阵列检测器及Agilent Chemstation色谱工作站组成)Agilent公司;CO-3010柱恒温控制箱(天津美瑞泰克科技有限公司);LC3000型制备型HPLC(北京创新通恒科技有限公司),配用SinoChrom ODS-BP C18色谱柱(300 mm×20 mm i.d.,10 μm);LC-MS系统(由Agilent 1200型LC、Agilent6310 型MS检测器组成,Agilent 公司);Avance III600 MHz型核磁共振仪(Bruker公司);TU-1810型紫外可见分光光度计(北京普析通用仪器有限责任公司);HH-2数显恒温水浴锅(国华电器有限公司);TB-215D微量分析天平(德国赛多利斯股份有限公司);RE-52CS型旋转蒸发器(上海亚荣生化仪器厂);ST-02A型多功能粉碎机(永康市帅通工具有限公司);FD-1B-50型冷冻干燥机(北京博医康实验仪器有限公司);SK5200H超声振动仪(上海波龙电子设备有限公司)。
1.2 试验方法
1.2.1 不同有机溶剂的枣叶提取
取枣叶嫩叶和老叶样品各900 g,用多功能粉碎机粉碎,加入9 L 80%乙醇,不定期搅拌,室温浸提8 h后将乙醇滤出,加入9 L 95%乙醇重复提取1次,合并乙醇提取液,用旋转蒸发器减压浓缩回收乙醇,得到绿色浸膏。向浸膏中加入适量的水混悬,依次用等体积的石油醚、乙酸乙酯、正丁醇提取5~6次,石油醚提取物、乙酸乙酯提取物、正丁醇提取物、水相提取物分别减压蒸干。其中,乙酸乙酯提取物、正丁醇提取物经制备型高效液相色谱反复分离纯化,得到化合物1,2,3和4。
1.2.2 黄酮标准曲线绘制
采用硝酸铝-亚硝酸钠显色法绘制标准曲线[13]。分别精密量取0,0.1,0.2,0.3,0.4和0.5 mL 1 mg/mL芦丁标准贮备溶液(甲醇为溶剂),置于10 mL容量瓶中,加入0.3 mL 10% NaNO2溶液,摇匀后静置6 min,加入0.3 mL 10% Al(NO3)3溶液,摇匀,放置6 min后加入4.0 mL 4% NaOH溶液,用甲醇稀释定容至10 mL,摇匀,放置15 min,以空白试剂为对照,在510 nm处测定各处理溶液的吸光度,以吸光度(A)为纵坐标,供试溶液中芦丁质量浓度(mg/mL)为横坐标,绘制标准曲线,所得回归方程为Y=12.44X-0.020 4,R2=0.999 1,定量分析范围为0.01~0.05 mg/mL。
1.2.3 总黄酮含量的测定
分别准确称取18.00 mg石油醚提取物、0.80 mg乙酸乙酯提取物,用甲醇溶解定容至10 mL,称取1.60 mg乙醇提取物、1.00 mg正丁醇提取物及18.00 mg水相提取物,用50%甲醇溶解后定容至10 mL。分别移取各提取物溶液1 mL替代芦丁标准液加入10 mL容量瓶中,其余步骤按照1.2.2所述方法操作,测其吸光度,以相应试剂为空白调零,代入回归方程计算出各提取物中的总黄酮含量。
1.2.4 清除DPPH·活性测定
按照文献方法[14-15],配制25 mg/L的DPPH·甲醇溶液(现用现配,避光放置),取上述DPPH·甲醇溶液3.9 mL加入具塞试管,向其中加入0.1 mL不同浓度的被测溶液,漩涡混匀,30 ℃水浴保温,在黑暗避光处反应40 min,于515 nm测定吸光度A,每个样品做3次重复,同时以0.1 mL甲醇代替被测溶液做空白试验。以BHT为阳性对照。根据式(1)计算DPPH·清除率。
DPPH·清除率=(1-A/A0)×100% (1)式中:A为样品溶液吸光度;A0为空白溶液吸光度。
分别以各样品的不同浓度与其对应的DPPH·自由基清除率作图。
1.2.5 清除ABTS+·活性测定
按照文献[16],称取一定量的ABTS自由基,以相应量的甲醇为溶剂,配制成7 mmol/L的贮备液;取5 mL ABTS贮备液和88 μL 140 mmol/L的过硫酸钾溶液混合,超声混匀,在室温、避光条件下静置过夜,形成ABTS+·贮备液,临用前将生成的ABTS+·自由基贮备液用甲醇稀释,使其在734 nm波长下的吸光度为0.70±0.02,即得到ABTS+·工作液,将其避光保存。
取4 mL ABTS+·工作液加入到具塞试管,向其中加入0.04 mL不同浓度的样品甲醇溶液,漩涡混匀,30 ℃水浴避光反应15 min[17],于734 nm下测定其吸光度A,每个样品平行3份。同时以0.04 mL甲醇代替样品甲醇溶液做空白试验。以BHT为阳性对照,根据式(2)计算ABTS+·清除率。
ABTS+·清除率=(1-A/A0)×100% (2)式中:A为样品溶液吸光度;A0为空白溶液吸光度。
分别以各样品的不同浓度与其对应的ABTS+·自由基清除率作图。
1.2.6 枣叶黄酮的LC-MS分析和核磁共振分析
将得到的化合物1~4溶解于甲醇中,配成质量浓度100 μg/mL的混和样液,用LC-MS联用仪进行分析。LC条件:色谱柱为Hypersil BDS C18(4.6 mm×250 mm,5 μm);柱温30 ℃;流动相A为500 μL/L甲酸水溶液,B为乙腈含500 μL/L甲酸。线性梯度洗脱程序:0 min,15% B;27 min,15% B;32 min,17% B;47 min,17% B;49 min,22% B;65 min,26% B;70 min,100% B;75 min,100% B;77 min,15% B;87 min,15% B;流速0.6 mL/min;检测波长360 nm;进样量5 μL。MS条件:ESI离子源,阴离子检测模式,喷雾器压力45 psi;干燥气体温度350 ℃,干燥气(N2)流速12 L/min;离子阱质量分析器扫描范围m/z=100~1 000。称取化合物1~4各20 mg,分别用氘代甲醇溶解,以四甲基硅为基准试剂,在核磁共振仪上进行氢谱(1H NMR)和全去偶碳谱(13C NMR)分析。
2 结果与分析
2.1 枣叶嫩叶和老叶不同溶剂提取结果
按照1.2.1所述方法对枣叶老叶和嫩叶进行处理,得到枣嫩叶的石油醚提取物75 g,乙酸乙酯提取物15 g,正丁醇提取物43 g;枣老叶的石油醚提取物68 g,乙酸乙酯提取物30 g,正丁醇提取物32 g。嫩叶中石油醚提取物含量较高,这些成分中含有很多皂苷类成分,是枣叶中重要的保健活性成分。另外,嫩叶的乙酸乙酯提取物与正丁醇提取物的比例接近1∶3,而老叶中两者比例约为1∶1。
2.2 不同极性溶剂提取物中总黄酮含量
按照1.2.3方法分别测定枣叶嫩叶和老叶中乙醇、石油醚、乙酸乙酯、正丁醇和水相部位的提取物总黄酮含量(见图1和图2)。老叶各提取物的含量略高于嫩叶。而不同溶剂的各种提取物中总黄酮的含量有较大差异,乙酸乙酯部位的总黄酮含量最高,分别达到232.5 mg/g(嫩叶)和282.3 mg/g(老叶),明显高于其他提取物;含量最低的均为石油醚相,分别为8.52 mg/g(嫩叶)、10.32 mg/g(老叶)。嫩叶总黄酮含量高低顺序为:乙酸乙酯提取物>乙醇提取物>正丁醇提取物>水相残留物>石油醚提取物;老叶总黄酮含量大小顺序为:乙酸乙酯提取物>正丁醇提取物>乙醇提取物>水相残余物>石油醚提取物。石油醚属于非极性有机溶剂,仅能提取出枣叶中少量的中等极性的黄酮类成分;水相中的黄酮含量也很低,则是由于使用不同极性的溶剂提取的过程中,乙酸乙酯和正丁醇这些具有中强极性的溶剂已经将绝大部分黄酮提取出去,只有极小一部分水溶性极好的黄酮类物质残留在水中[18]。
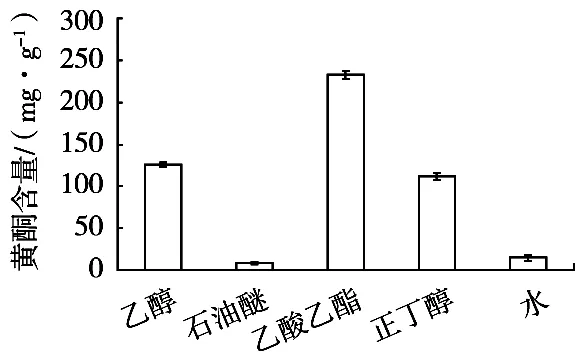
图1 枣叶嫩叶各提取物的总黄酮含量
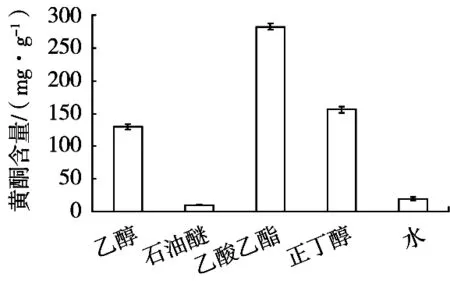
图2 枣叶老叶各提取物的总黄酮含量
2.3 不同极性溶剂提取物清除自由基结果
2.3.1 对DPPH·自由基的清除作用
枣叶各提取物在0.2~1.0 mg/mL质量浓度范围内清除DPPH·自由基活性的结果如图3(嫩叶)和图4(老叶)所示。枣叶不同极性提取物均对DPPH·自由基具有一定的清除能力,在0.2~1.0 mg/mL范围内,随着样品溶液质量浓度增加,清除率也随之增强,在同等质量浓度下,枣叶老叶比嫩叶表现出稍高的活性。其中,乙酸乙酯相表现出最高的活性,在乙酸乙酯相质量浓度1.0 mg/mL时清除率达到最大,嫩叶为75.15%,老叶为74.11%,其清除能力略低于阳性对照BHT;乙醇和正丁醇提取物的活性比较接近,而水相和石油醚相的能力均较弱。嫩叶对DPPH·清除能力大小顺序为:乙酸乙酯>乙醇>正丁醇>水>石油醚。老叶对DPPH·清除能力大小顺序为:乙酸乙酯>正丁醇>乙醇>水>石油醚。

图3 枣叶嫩叶不同提取物对DPPH·自由基清除率
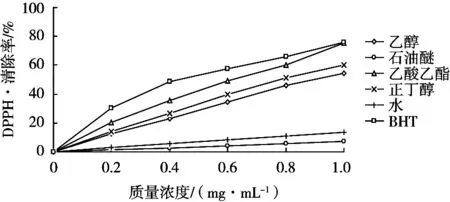
图4 枣叶老叶不同提取物对DPPH·自由基清除率
2.3.2 对ABTS+自由基的清除作用
枣叶各提取物在0.2~1.0 mg/mL质量浓度范围内清除ABTS+·自由基活性的结果如图5(嫩叶)和图6(老叶)所示。枣叶不同提取物对ABTS+·自由基均具有一定的清除能力,但从总体而言,其清除活性较DPPH·自由基(见图3和图4)偏弱。具体来看,其清除率随质量浓度升高而升高,且老叶各提取物比嫩叶表现出稍高的活性。其中,乙醇提取物在1.0 mg/mL时对ABTS+·自由基清除率为45.73%(嫩叶)和51.14%(老叶),但低于阳性对照BHT。嫩叶提取物对ABTS+·自由基的清除顺序为:乙醇>水>正丁醇>乙酸乙酯>石油醚。值得注意的是,嫩叶水相表现出较强的清除ABTS+·自由基能力,但其清除DPPH·自由基能力却很弱,这可能与不同极性提取物中含有的化合物的种类及不同清除自由基试验的作用机理有一定关系[19]。因而枣叶提取物的不同极性部位对不同类型的自由基表现出不同程度的清除作用。老叶提取物对ABTS+·自由基的清除顺序为:乙醇>正丁醇>乙酸乙酯>水>石油醚。
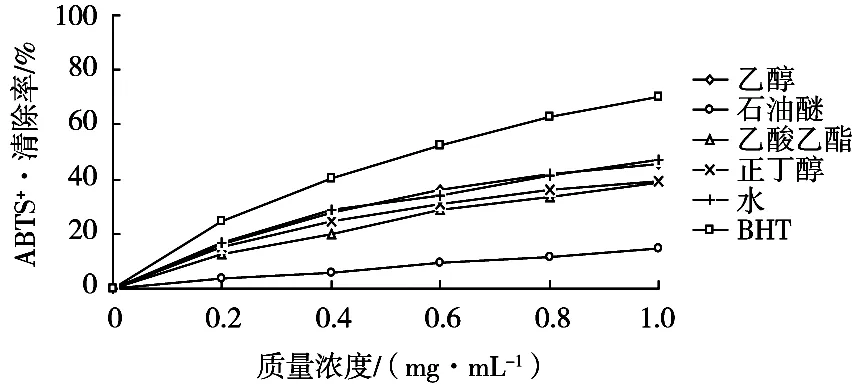
图5 枣叶嫩叶不同提取物对ABTS+·自由基清除率
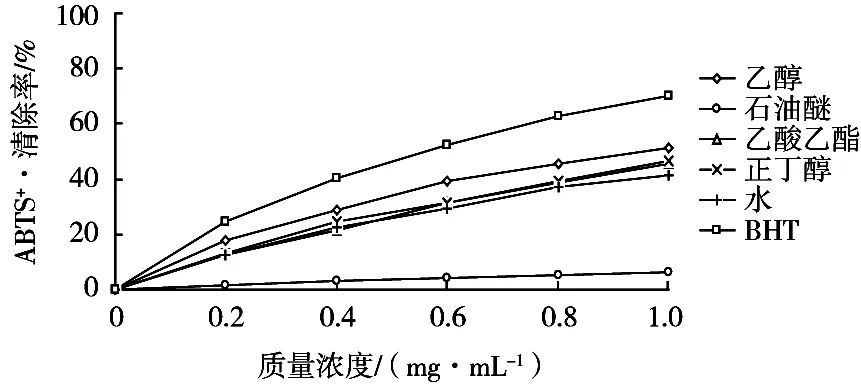
图6 枣叶老叶不同提取物对ABTS+·自由基清除率
2.4 清除ABTS+·与DPPH自由基能力的相关性分析
枣叶各提取物清除ABTS+·与DPPH·自由基能力的相关性如表1所示。由表1可以看出,无论是枣叶嫩叶还是老叶,其清除ABTS+·与DPPH·的能力并没有表现出显著相关性,差别较大,这可能与各抗氧化模型作用机理不同及枣叶中所含抗氧化活性物质的类型有关。

表1 枣叶嫩叶和老叶清除ABTS+·和DPPH·自由基能力的相关系数(r)
2.5 总黄酮含量与清除自由基能力的相关性分析
枣叶提取物总黄酮含量与清除自由基能力的相关性如表2所示。质量浓度0.6 mg/mL的各枣叶提取物中总黄酮含量与清除DPPH·自由基能力之间有很强的相关性,其中嫩叶总黄酮含量与DPPH·自由基清除能力间相关系数为0.996,达到相关性极显著水平(p<0.01),老叶对DPPH·自由基的清除能力的相关系数达到0.958,为显著相关(p<0.05),因此可以认为枣叶提取物中总黄酮含量的多少直接反映提取物清除DPPH·自由基能力的强弱。枣叶嫩叶和老叶中总黄酮含量与ABTS+·自由基清除能力的相关系数分别为0.389和0.540,显示不同极性的枣叶提取物中黄酮的含量虽然与其清除ABTS+·自由基的能力之间存在一定的正相关关系,但相关系数没有达到统计学的显著水平。

表2 枣叶各提取物清除自由基活性与总黄酮含量的相关性
2.6 化合物的结构鉴定
由2.2的结果表明,枣叶乙酸乙酯部位和正丁醇部位活性较强,因此选取乙酸乙酯和正丁醇部位进行分离制备,前期得到5种化合物[20],在这基础上分离到4种化合物,经鉴定分别为槲皮素鼠李糖-对羟基桂皮酰葡萄糖、3′,5′-间-C-β-D-吡喃葡萄糖基-4-O-香豆酰基根皮素、3′,5′-间-C-β-D-吡喃葡萄糖基根皮素、槲皮素-3-O-鼠李糖苷。
3 结论
采用不同溶剂提取枣叶,提取物中总黄酮含量差异较大,嫩叶和老叶各提取物中乙酸乙酯部位总黄酮含量均最高,明显高于其他提取物;在不同清除自由基体系中,各提取物均具有不同程度的清除自由基能力且与其质量浓度呈量效关系,但活性强弱顺序各不相同,枣叶乙酸乙酯部位清除DPPH·的能力最强,而枣叶乙醇提取物清除ABTS+·自由基的能力最强。枣叶总黄酮含量与清除DPPH·自由基间呈现显著相关性,而与清除ABTS+·自由基之间相关性较小。
槲皮素鼠李糖-对羟基桂皮酰葡萄糖、3′,5′-间-C-β-D-吡喃葡萄糖基-4-O-香豆酰基根皮素为在枣属植物中的新发现。

