低温下盐度对多毛型片状组合填料序批式生物膜反应器脱氮性能及胞外聚合物的影响
李姗姗,王浩业,闫多森,郭晴雯
(青岛农业大学 资源与环境学院,山东 青岛 266109)
近年来,我国沿海城市为缓解解水资源匮乏的局面,如直接利用海水冲厕[1]。海盐随冲厕水流入城市生活污水处理系统,盐度升高给生活污水的生物处理带来了困难。并且,我国大部分地区冬季气温较低,这使微生物脱氮处理效果进一步下降。因此,探究低温下盐度对污水生物处理系统性能的影响尤为重要。
序批式生物膜反应器(sequencing batch biofilm reactor,SBBR)是有效的生物处理新技术,具有序批式活性污泥法(sequencing batch reactor activated sludge process,SBR)与生物膜处理污水双重优点,对有机物和氮的去除性能优于SBR[2-3],且带有合适填料的SBBR系统有更好的生物处理效果[4]。如今,许多学者研究了常温下盐度对SBBR脱氮性能的影响。盐度会抑制SBBR硝化反硝化过程,且当盐度升高时,SBBR中氨氮的分解速率会下降,微生物的呼吸速率加快,更多的氧气会被用来抵挡不利的环境而不是物质的降解,细胞内盐分的积累减少了氧的利用率[5-9];并且盐度升高导致微生物发生质壁分离,破坏细胞膜和酶系统,使微生物的脱氮性能下降。同时,盐度也能影响微生物分泌胞外聚合物(extracellular polymeric substances,EPS)的含量和组分,使污泥疏水性下降,生物絮凝能力降低,进而影响微生物脱氮性能[10-12]。此外,温度也是影响微生物活性的重要因素。研究表明:低温下脱氮微生物优势菌的活性受到抑制,菌体体内细胞质的流动性会减弱,从而使物质传输、物质氧化等代谢过程受到抑制,干扰生物系统的氮素转换过程及脱氮行为[13-14]。目前关于低温条件下盐度对SBBR脱氮性能及EPS的影响还有待进一步研究。
本工作以SBBR为污水生物处理系统,研究了低温下盐度对多毛型片状组合填料SBBR脱氮性能、脱氮速率、生物毒性和胞外聚合物的影响,以期为低温下SBBR处理含盐生活污水提供可靠的理论依据。
1 实验部分
1.1 实验材料与仪器
活性污泥,城阳污水处理厂的二沉池;无水醋酸钠(CH3COONa),碳酸氢钠(Na HCO3),氯化铵(NH4Cl),磷酸二氢钾(KH2PO4),国药集团化学试剂有限公司;海水晶,江西盐通科技有限公司。
SBBR反应器,有效容积为2.0 L,高和内径分别为25 c m和11 c m,有机玻璃制成,换水比为1/2;磁力搅拌器,MS-S标准型磁力搅拌器,大龙兴创仪器(北京)股份公司;继电器,GND-1型,公牛集团股份有限公司;计量补液泵,2DS-2PU2型,上海新西山实业有限公司;曝气泵,SB-988型,中山市松宝电器有限公司;多毛型片状填料,直径为7.5 c m;智能空调,KFR-50L W/08 GAC13型,海尔智家股份有限公司;移液枪,北京海天友诚科技有限公司;温湿度计,9013型,得力集团有限公司;活性氧检测试剂盒,乳酸脱氢酶细胞毒性检测试剂盒,碧云天生物技术有限公司;紫外可见分光光度计,759S20012型,上海凌光技术有限公司;台式高速冷冻离心机,H2-16 KR型,湖南可成仪器设备有限公司;多功能智能消解仪,GL-25型,山东格林凯瑞精密仪器有限公司;便携式溶解氧仪,HACH HQ40d型,浙江赛德仪器设备有限公司。
1.2 实验步骤
1.2.1 实验装置
多毛型片状组合填料SBBR装置如图1所示。通过继电器和计量补液泵控制装置进出水。反应器底部两侧的砂芯曝气头通过曝气泵曝气,并在底部用磁力搅拌器搅拌。反应器中间固定4个直径为7.5 c m的多毛型片状填料。智能空调控制实验温度为15℃。
1.2.2 挂膜和启动
本实验接种的污泥来自城阳污水处理厂的二沉池,在不含盐的环境中进行驯化,驯化时间为一个月,使其具有稳定的去除有机物、氨氮的能力。利用模拟废水在SBBR反应器内进行挂膜。先将活性污泥加入到反应器内,曝气12 h,静置1 h,排出上清液和悬浮污泥,反复3次。此后按曝气10 h,静置1.5 h,排水、进水0.5 h的方式进行实验。观察反应器内填料的挂膜情况。用刀片刮下填料上的生物膜,将含有生物膜的溶液用滤膜过滤,在烘箱内烘干,烘干至恒重,两次质量差即为生物膜量。约15 d后填料上的生物膜量开始稳定,可以视为挂膜成功。
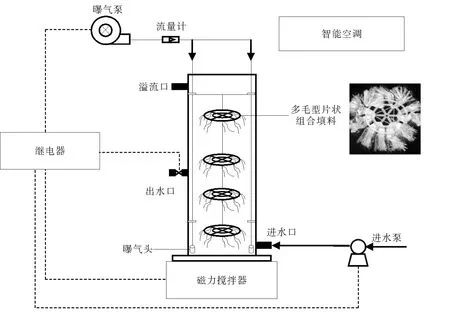
图1 多毛型片状组合填料SBBR装置图Fig.1 Schematic diagram of hairy type sheet composite packing SBBR
SBBR每天运行3个周期,每个周期8 h(进水阶段5 min,曝气阶段270 min,搅拌阶段150 min,沉淀阶段30 min,出水阶段5 min,闲置阶段20 min)。控制溶解氧浓度在好氧阶段高于2.0 mg·L-1,缺氧阶段低于0.5 mg·L-1。本实验采用逐渐增加盐度的方法对污泥进行驯化,按0.5%的浓度梯度依次提高盐度。每一盐度下驯化时间为15 d。同时,在实验连续运行期间对反应器进出水水质进行跟踪分析。
人工配制污水组成:化学需氧量COD和NH+4-N的浓度分别为400 mg·L-1和30 mg·L-1,CH3COONa:513 mg·L-1,Na HCO3:120 mg·L-1,NH4Cl:114 mg·L-1,KH2PO4:26 mg·L-1,海水晶按要求添加,1 kg淡水加1.2 g海水晶盐度提高1度。
1.3 分析方法
1.3.1 常规水质分析方法
COD、NH+4-N、NO-3-N、NO-2-N和混合液污泥浓度(mixed liquid suspended solids,简称MLSS)均采用《水和废水监测分析方法》(第4版)[15]国家标准方法测定。采用便携式溶氧仪测定溶解氧浓度(DO)。
1.3.2 生物膜比耗氧速率和脱氮速率测定
根据文献[16]方法,测定生物膜比耗氧速率(SOUR)、比氨氧化速率(SAOR)、比亚硝酸盐氧化速率(SNOR)、比硝酸盐还原速率(SNRR)和比硝酸盐还原速率(SNIRR)。
1.3.3 活性氧和乳酸脱氢酶的测定
活性氧(ROS)和乳酸脱氢酶(LDH)分别通过活性氧检测试剂盒和乳酸脱氢酶细胞毒性检测试剂盒测定。
1.3.4 胞外聚合物的提取和测定
EPS在细胞外的分布呈现为具有流变性的双层结构,内层紧密型EPS(TB-EPS),外层松散型EPS(LB-EPS)。对EPS采用热提取法。在搅拌阶段,取反应器污泥悬浮液40 mL,将其在4℃、4 000 g条件下离心15 min,弃去上清液,得到浓缩的活性污泥样品;向活性污泥样品中加入70℃的0.05%的NaCl溶液稀释至40 mL,并快速震荡1 min,然后在4℃,4 000 g条件下离心15 min,收集的上清液经过0.45μm醋酸纤维素膜过滤后,得到LBEPS;再用60℃的0.05%的Na Cl溶液将原溶液稀释至40 mL,并快速震荡1 min,置于60℃水浴30 min,然后在4℃,4 000 g条件下离心15 min,收集上清液,并用0.45μm醋酸纤维素膜过滤,即为TBEPS。蛋白质(PN)采用Folin-酚法测定[17],多糖(PS)采用蒽酮比色法测定[18]。
2 结果与讨论
2.1 低温下盐度对SBBR脱氮性能的影响
图2为低温(15℃)下盐度变化对SBBR脱氮性能的影响。当进水的盐度为0%时,SBBR对污水中COD和NH+4-N的平均去除率分别为90.58%±0.10%和98.55%±2.62%。当进水盐度0.5%时,在第15~25 d,COD和NH+4-N去除率显著下降,这是由于盐度抑制了微生物发挥作用[19-20]。随后反应器出水COD和NH+4-N去除率稳定90.19%和98.37%,这是由于驯化后微生物适应了盐度变化[21]。当进水盐度为1%时,COD和NH+4-N出水平均去除率分别为87.13%±4.21%和85.39%±9.28%,与盐度为0%相比分别降低了3.45%和13.16%。出水NO-2-N浓度由盐度为0%时的(0.02±0.02)mg·L-1升高到盐度为1.0%时的(3.56±1.42)mg·L-1,原因可能是硝化细菌比亚硝化细菌对盐更敏感,在盐度增加时,硝化细菌功能被完全抑制[22],导致NO-2-N向NO-3-N转化过程受到影响,此外,也有可能是因为硝化细菌对温度异常敏感有关。出水NO-3-N浓度在第一个盐度改变点时下降明显,这与系统中出现的耐盐反硝化细菌有关,反硝化细菌的耐盐性比硝化细菌更强[19],从而使NO-3-N快速转化为N2;但随着盐度的增加,NO-3-N浓度在0.21~2.14 mg·L-1范围内变化。

图2 低温下盐度变化对SBBR性能的影响Fig.2 Effect of salinity on t he perfor mance of SBBR at lo w temperat ure
2.2 低温下盐度对SBBR周期内COD和氮浓度的影响
图3为低温条件下,盐度对运行周期COD、NH+4-N、NO-2-N和NO-3-N在SBBR浓度的影响。周期共运行8 h,包括7个阶段。SBBR在Ⅱ阶段,进行反硝化过程,NO-3-N在硝酸盐还原菌的作用下被硝化还原为NO-2-N,在亚硝酸盐还原菌的作用下进一步被硝化还原成N2,从而促使NO-3-N和NO-2-N浓度下降。在反硝化过程中,反硝化的细菌可以利用各类有机底物(NO-3作为电子受体)来维持正常的新陈代谢,从而使促使COD的浓度大大减少。NH+4-N浓度在此阶段基本不发生变化。在Ⅲ阶段,主要是进行硝化,通过亚硝化细菌和硝化细菌的作用,使得NH+4-N被氧化为NO-2-N和NO-3-N,且从图3(c)和图3(d)看出,亚硝化细菌比硝化细菌具有更强的耐盐性,硝化细菌受盐度的影响较大。当进入水中的盐度逐渐增大至1.0%时,其出水的NO-3-N浓度大致在1.46 mg·L-1上下;而当其低于盐度0%时NO-3-N的出水浓度约为4.16 mg·L-1。这主要因为在此条件下,硝化过程中的NO-2-N的氧化作用被抑制,导致硝化过程末期结束时NO-3-N生成量大大减少,从而直接导致了出水的NO-3-N浓度降低。COD的浓度在第240 min基本达到了稳定,在Ⅳ阶段,COD的浓度略微有所下降,出水时COD的浓度与盐度分别在0%和1.0%的情况下基本相同,表明在此间的盐度区域内,盐度的变化和增加未必会直接影响SBBR对COD的消耗和去除作用。由图3(b)可知,不同盐度下SBBR内NH+4-N的浓度都在360 min时已经达到了稳定的状态,说明盐度的上升并没有显著地抑制SBBR对NH+4-N的去除作用。在Ⅳ阶段末期,NO-2-N的浓度由盐度为0%时的0.36 mg·L-1上升到盐度升高至1.0%时的3.71 mg·L-1,出水后NO-2-N的浓度显著升高,说明在此盐度范围内NO-2-N的氧化作用受到抑制。

图3 低温下盐度变化对SBBR周期内COD、NH+4-N、NO-2-N和NO-3-N浓度变化的影响Fig.3 Effect of salinity on the variation of COD,NH+4-N,NO-2-N and NO-3-N concentration during one cycle at low temperature
2.3 低温下盐度对生物膜SOUR及SBBR脱氮速率的影响
图4表示低温下盐度变化对生物膜SOUR及SBBR脱氮速率的影响。SOUR是评价微生物新陈代谢活性的一项重要指标[16],以1 g活性污泥1 h内消耗的溶解氧质量(mg)来表征。当进水盐度由0%增加到1.0%时,SOUR由(30.80±3.06)mg·(g·h)-1逐渐降低至(25.29±2.04)mg·(g·h)-1,且与进水盐度为0%时相比进水盐度为1.0%时的SOUR下降了17.89%,这是因为盐度的增加阻碍了微生物的正常繁衍,微生物的数量减少,使SOUR随盐度的升高而下降,并且微生物种群的变化也可能造成SOUR下降[16]。以1 g活性污泥内1 h内氧化的NO+4-N质量(mg)、氧化的NO-2-N质量(mg)、还原的NO-2-N质量(mg)、还原的NO-3-N质量(mg)分别表征SAOR、SNOR、SNIRR、SNRR。如图4(b),当污水中的盐度从0%逐渐地增加到1.0%时,SAOR由4.91 mg·(g·h)-1逐渐地减少至3.92 mg·(g·h)-1;SNOR从5.98 mg·(g·h)-1逐渐减少到4.71 mg·(g·h)-1。与盐度为0%时相比,进水盐度为1.0%时,SOUR和SNOR分别降了20.09%和21.27%,这说明进水盐度的增加阻碍了硝化细菌的正常生长繁殖,相比氨氧化细菌来讲,亚硝酸盐氧化细菌受到更明显的抑制。当进水的盐度分别为0.5%、1.0%时,SNRR与盐度为0%时分别降低了10.73%和19.01%,说明盐分对硝酸盐还原细菌的抑制作用随着其浓度的升高而增强。进水盐度由0%增加到0.5%时,SNIRR从11.30 mg·(g·h)-1降低至9.87 mg·(g·h)-1,说明盐度对SNIRR的抑制效应很小,这也证实了在SBBR工作周期中,亚硝化细菌较硝化细菌具有较强的耐盐性。当进水盐度为1.0%时,SNIRR减少到9.29 mg·(g·h)-1,说明低温下盐度的升高影响到了亚硝酸盐还原细菌,具体表现为对其的抑制作用,这也是导致NO-2-N积累的原因。
2.4 低温下盐度对SBBR生物膜的毒性
图5为低温下盐度对SBBR反应器中ROS生成量和LDH释放量的影响。

图4 低温下盐度变化对SOUR和脱氮速率的影响Fig.4 Effect of salinity on t he SOUR and nitrogen removal rates at low temperature

图5 低温下盐度对ROS生成量和LDH释放量的影响Fig.5 Effect of salinity on the production of ROS and the release of LDH at low temperature
ROS生成量和LDH释放量分别是评价生物细胞氧化应激程度水平以及评价生物细胞功能完整度的一个重要指标。在外部环境的刺激下,细胞ROS的产生可能会逐渐增加,ROS可能会通过与DNA和蛋白质的直接或间接相互作用对生物细胞器官造成一定的氧化和损伤;但是当生物细胞膜的完整性严重受损时,释放出来的LDH就会逐渐增加,因此可以通过测定其所产生的ROS量和所释放出来的LDH量的方法来准确评估盐度变化对于生物膜的毒性[23-24]。如图5所示,进水盐度为0.5%和1.0%时与盐度为0%时相比,ROS生成量分别增加了20.04%和46.16%。盐度的增加会增加ROS的产生,说明盐度可以打破细胞内氧化过程和抗氧化过程的平衡,从而对微生物生物膜造成氧化性损伤[25]。同样,LDH的释放量随着盐度的增加而增加,当进水盐度为1.0%时与盐度为0%时相比,LDH释放量增加了54.31%,说明盐度的增加对细胞膜产生了严重的损伤。可见,盐度的增加影响了ROS生成量和LDH的释放量,使SBBR生物膜微生物受到的毒性效应增强。
2.5 低温下盐度对胞外聚合物的影响
图6为低温下盐度对SBBR反应器中EPS、LB-EPS和TB-EPS含量的影响。在进水盐度为0%时SBBR活性污泥中EPS、LB-EPS和TB-EPS含量分别为44.20、9.71、34.49 mg·g-1。当SBBR中盐度升高为0.5%时,EPS、LB-EPS和TBEPS的含量与盐度为0%时相比无明显变化;随着系统运行时间的延长,生物膜活性污泥中EPS、LBEPS和TB-EPS含量分别增加至62.79、13.59和47.03 mg·g-1,与盐度为0%时相比,分别增加了42.06%、40.01%和36.34%。实验表明,盐度的增加,会促进SBBR生物膜产生更多的EPS、LB-EPS和TB-EPS。盐度能够改变微生物的新陈代谢[26],微生物通过分泌更多的EPS减少盐度对其自身的毒性。同时,EPS也可以增强生物膜的吸附再生能力,促进生物膜对阳离子的吸附[27]。但是,由于盐度的增大,微生物会分泌大量的EPS,过多的EPS会给生物膜带来污染,且有大量研究表明EPS是生物膜的主要污染物。大量的EPS使生物膜增厚,其内部微生物正常的呼吸作用受到抑制,从而影响比耗氧速率,进而对微生物的硝化过程产生影响,使脱氮性能和速率下降。

图6 低温下盐度对EPS、LB-EPS和TB-EPS含量的影响Fig.6 Effect of salinity on the concent of EPS,LB-EPS and TB-EPS at low temperature
图7为低温下,SBBR反应器中污泥LB-EPS和TB-EPS中PN和PS含量变化。在进水盐度为0%时,LB-EPS和TB-EPS中PN的含量分别为(7.06±0.66)mg·g-1和(23.90±1.06)mg·g-1,SBBR进水中加入盐后,当盐度为0.5%时,二者中PN的含量与盐度为0%时相比无明显变化;随盐度的继续增加PN含量逐渐上升,当盐度达到1.0%时,LB-EPS和TB-EPS中PN的含量与盐度为0%时相比分别上升了37.35%和39.31%。在盐度为0%时,LB-EPS和TB-EPS中PS的含量分别为(2.37±0.41)mg·g-1和(9.67±0.64)mg·g-1,随着盐度的增加LB-EPS和TB-EPS中PS的含量略微升高。SBBR中添加盐后,LB-EPS和TB-EPS中PN/PS分别由盐度为0%时的2.98和2.47 mg·g-1升高至盐度为1.0%时的3.30和2.75 mg·g-1。从结果可以看出,盐度可以促进生物膜活性污泥分泌更多的蛋白质和多糖,且蛋白质的增量高于多糖的增量,这可能是因为盐度增加导致细胞外渗透压增加所致。微生物为了维持正常的新陈代谢,会分泌大量的酶,调节自身生理代谢产物。此外,不能适应环境中盐分增加的微生物的解体,并分泌出微生物中的蛋白质、多糖等大分子物质[26],这也会导致EPS中PN和PS含量增加。
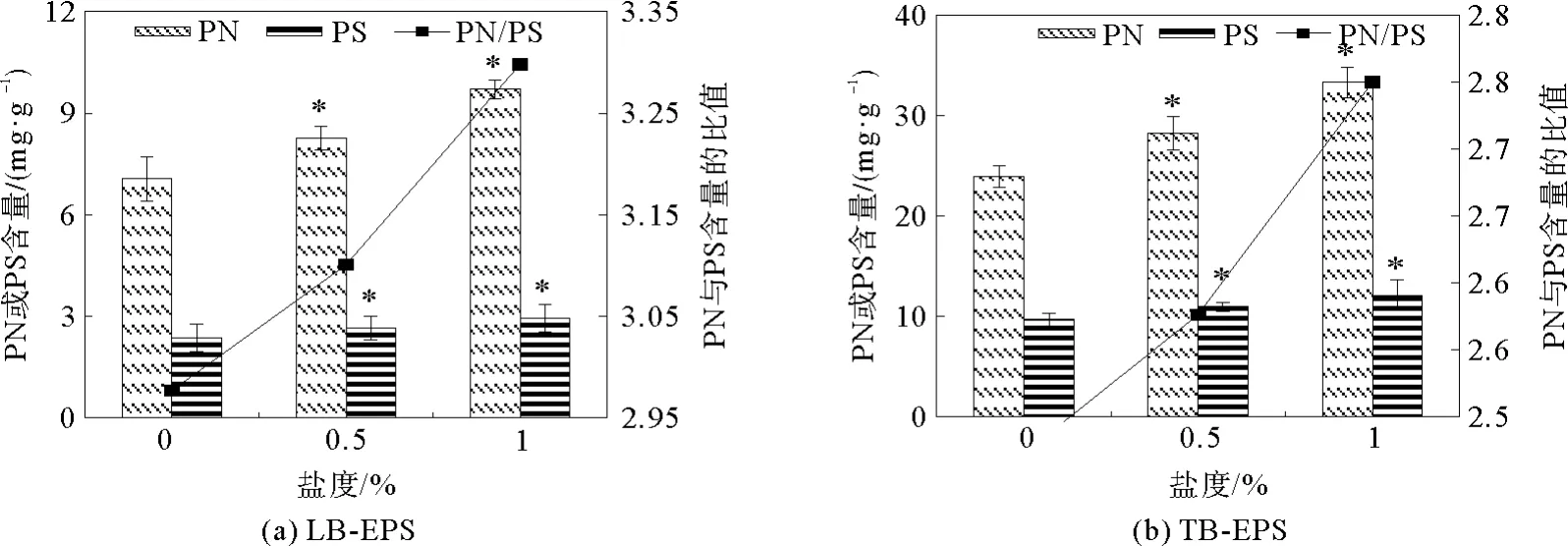
图7 低温不同盐度下LB-EPS和TB-EPS中PN和PS的变化Fig.7 Effect of salinity on the concent of PN and PS and PN/PSin LB-EPS and TB-EPS at low te mperature
3 结 论
1)在低温状态下(15℃),当盐度为1.0%时,出水COD与NH+4-N平均去除率分别比盐度为0%时降低了3.45%和13.16%。在盐度由0%增加至1.0%的过程中,出水NO-2-N浓度增大,而出水的NO-3-N浓度减小;生物膜的SOUR、SAOR、SNOR、SNRR和SNIRR逐渐降低,表明低温下盐度增加会导致系统比耗氧速率和脱氮速率下降。
2)与盐度为0%时相比,ROS生成量和LDH释放量升高,说明低温下盐度对生物膜具有一定的损伤。
3)低温下随着盐度的增加,系统污泥中EPS、LB-EPS、TB-EPS及LB-EPS、TB-EPS中的PN和PS的含量均升高。

