复方苦参注射液在乳腺癌术后辅助化疗患者中的应用
吕瑞
(河南省开封市肿瘤医院肿瘤内科 开封 475000)
乳腺癌(BC)是由多种致癌因子作用下,乳腺细胞丧失正常细胞特性,发生增殖失控所致。作为女性最常见的恶性肿瘤之一,BC发病率与致死率呈逐年上升趋势,对女性身心健康产生严重威胁[1~2]。目前针对BC多以手术为主要治疗手段,术后辅助化疗可进一步减轻肿瘤复发及癌细胞的转移风险,但非特异性化疗药物对正常细胞伤害较大,毒副作用明显。有研究表明,中医药可有效减轻BC术后化疗毒副反应并提高疗效[3~4]。基于此,本研究探索复方苦参注射液对BC术后化疗疗效的影响。现报道如下:
1 资料与方法
1.1 一般资料选取医院2017年4月至2019年4月收治的116例BC患者为研究对象,随机分为观察组与对照组,各58例。对照组均为女性;年龄34~67岁,平均(44.39±12.28)岁;临床肿瘤-淋巴结-血道转移(TNM)分期:Ⅰ期14例,ⅡA 22例,ⅡB 10例,ⅢA 6例,ⅢB 5例,ⅢC 1例;病理类型:浸润性导管癌47例,浸润性小叶癌1例,浸润性微乳头状癌6例,黏液癌4例。观察组均为女性;年龄32~65岁,平均(43.72±11.79)岁;临床TNM分期:Ⅰ期15例,ⅡA 19例,ⅡB 11例,ⅢA 8例,ⅢB 4例,ⅢC 1例;病理类型:浸润性导管癌45例,浸润性小叶癌2例,浸润性微乳头状癌7例,黏液癌4例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。BC诊断及分期参照《中国抗癌协会乳腺癌诊治指南与规范(2017年版)》[5]。纳入标准:年龄<70岁;经病理学检查验证后行BC改良根治术;TNM分期为Ⅰ~Ⅲ期,对术后化疗有一定耐受能力。排除标准:合并其他脏器系统功能障碍及免疫系统疾病;身体素质差,对化疗不耐受;妊娠或哺乳期;既往应用过放化疗治疗。本研究使用药物及治疗方法取得患者及家属知情同意,且经医院医学伦理委员会审核批准(批号:20170112)。
1.2 治疗方法对照组患者行氟尿嘧啶、表阿霉素及环磷酰胺(FEC)方案进行化疗,静脉滴注注射用异环磷酰胺(国药准字H20093079)500 mg/m2、氟尿嘧啶注射液(国药准字H22023469)500 mg/m2;注射用盐酸表柔比星(国药准字H19990280)80 mg/m2,每3周1次,为一个化疗周期,治疗6个周期,连续治疗18周;于化疗第1天、第2天给予地塞米松片(国药准字H44024618)口服,1片/次,2次/d,预防呕吐;化疗期间肌肉注射盐酸昂丹司琼注射液(国药准字H10970065)8 mg,2次/d,预防胃肠反应;化疗48 h后皮下注射重组人粒细胞刺激因子注射液(国药准字S19990049)200 IU,1次/d,注射7~14 d;化疗48 h后注射重组人白介素-11(国药准字S20030015)200 IU,1次/d,注射7~14 d。观察组患者在对照组基础上予静脉滴注复方苦参注射液(国药准字Z14021231)30 ml(经0.9%氯化钠注射液250 ml稀释后应用),于化疗前1 d开始,每日注射1次,1周中连续注射5 d,停药2 d,治疗18周。
1.3 检测方法(1)在化疗开始前1 d及末次化疗结束后1 d取空腹肘静脉血5 ml,枸橼酸钠抗凝处理,溶血法去红细胞后行细胞直接法免疫标记,置样本于BD FACSCalibur流式细胞仪中进行处理,分析记录CD3+、CD4+/CD8+比值及自然杀伤细胞(NK)阳性率。(2)使用常规镜检检查两组白细胞(WBC)、血小板(PLT)水平;使用酶联免疫吸附法检测白细胞介素-2(IL-2)、白细胞介素-6(IL-6)水平,所有检测均采用复管检测。
1.4 评估标准治疗18周后进行化疗效果评估[6]:完全缓解,患者淋巴结与局部病灶完全消除;部分缓解,淋巴结与局部病灶总体积减少>50%;稳定,淋巴结与局部病灶无显著变化;进展,淋巴结与局部病灶有增多现象。总有效=完全缓解+部分缓解。根据世界卫生组织(WHO)化疗毒副作用分级标准,将血液、消化、循环、神经系统反应分为0~4级。0级:各系统指标正常,且无呕吐、出血、皮肤指甲改变等异常反应;1级:各系统指标接近正常,呕吐、出血、皮肤指甲改变等异常反应不明显;2级:各系统指标明显异于正常水平,呕吐、出血、皮肤指甲改变等异常明显,但尚可忍受;3级:各系统指标显著异于正常水平,呕吐、出血、皮肤指甲改变等异常反应明显,需治疗;4级:各系统指标严重异于正常水平,需治疗并暂停化疗。
1.5 观察指标两组临床疗效;两组细胞亚群(CD3+、CD4+/CD8+、NK)水 平;两 组WBC、PLT、IL-2、IL-6水平;两组化疗毒副反应发生情况。
1.6 统计学方法采用SPSS19.0统计学软件分析处理数据,计量资料用(±s)表示,采用t检验;计数资料用%表示,采用χ2检验,等级资料实施秩和检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两组临床疗效比较观察组治疗总有效率明显高于对照组(P<0.05)。见表1。

表1 两组临床疗效比较[例(%)]
2.2 两组细胞亚群水平比较治疗18周后,两组CD3+、CD4+/CD8+、NK水平均较治疗前升高,且观察组高于对照组,但对照组CD3+水平较治疗前升高不明显,差异无统计学意义(P>0.05),观察组CD3+、CD4+/CD8+、NK水平均明显高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组细胞亚群水平比较( ±s)

表2 两组细胞亚群水平比较( ±s)
组别 时间 n CD3+(%) CD4+/CD8+ NK(%)观察组58 58对照组 治疗前治疗18周后 t P治疗前治疗18周后 t P 58 58 t 组间治疗18周后P组间治疗18周后 73.12±11.14 78.21±11.73 2.396 0.018 72.76±10.97 74.06±10.68 0.647 0.519 1.992 0.049 1.32±0.42 1.71±0.51 4.496 0.000 1.19±0.26 1.31±0.37 2.175 0.032 6.519 0.000 12.81±3.96 16.07±4.24 4.279 0.000 13.03±3.25 14.49±4.13 2.116 0.037 2.290 0.049
2.3 两 组WBC、PLT、IL-2、IL-6水 平 比 较治疗18周后,两组WBC、PLT、IL-6水平均较治疗前降低,观察组IL-6水平低于对照组,但WBC、PLT水平均高于对照组,两组IL-2水平均较治疗前显著升高,且观察组高于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组WBC、PLT、IL-2、IL-6水平比较( ±s)

表3 两组WBC、PLT、IL-2、IL-6水平比较( ±s)
注:与本组治疗前比较,*P<0.05。
组别 n WBC(×109/L)治疗前 治疗18周后PLT(×109/L)治疗前 治疗18周后IL-2(U/ml)治疗前 治疗18周后 IL-6(U/ml)治疗前 治疗18周后观察组对照组t P 58 58 7.51±3.11 7.48±3.09 0.052 0.959 5.32±1.23*3.49±1.19*8.143 0.000 172.27±21.59 169.43±21.08 0.717 0.475 147.48±17.33*128.82±16.79*5.889 0.000 4.34±0.68 4.29±0.65 0.405 0.686 8.12±1.42*5.89±1.17*9.230 0.000 90.47±12.85 91.08±13.67 0.003 0.997 37.49±8.97*50.88±10.51*7.380 0.000
2.4 两组化疗毒副反应发生情况比较治疗过程中,观察组化疗毒副反应发生率较对照组低(P<0.05)。见表4。
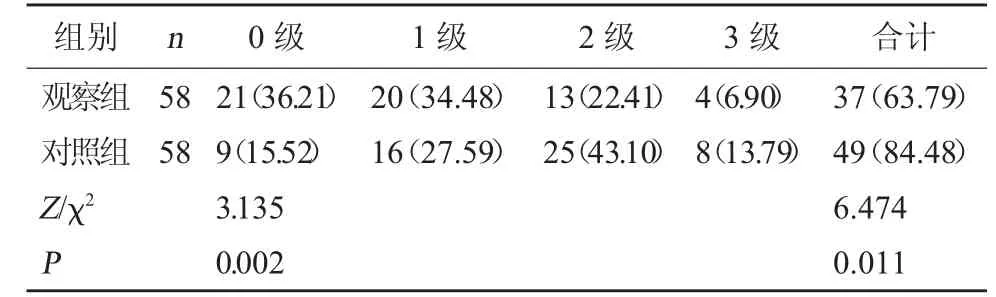
表4 两组化疗毒副反应发生情况比较[例(%)]
3 讨论
目前绝大多数BC患者术后均选择以辅助化疗为首的治疗方案,可清除术后残存病灶及降低远处转移风险,降低复发率,提高存活率。但由于化疗药物毒副作用明显,易导致机体免疫抑制,因而借助中医药攻补兼施理念进行治疗,旨在增强患者自身免疫反应,提高生存价值[7]。
BC术后辅助化疗采用FEC方案,其中环磷酰胺被肝脏或癌细胞中过量磷酰胺酶水解活化为氮芥类衍生物而起作用;氟尿嘧啶静脉注射后,药物可随体液循环,通过血脑屏障进入脑组织及脑部转移病灶,干扰蛋白质合成;表阿霉素为抗生素类抗肿瘤药,可干扰脱氧核糖核酸(DNA)转录过程,从而抑制DNA及核糖核酸(RNA)合成;FEC方案可清除肿瘤细胞及转移病灶,达到广谱抗肿瘤的目的,但可对患者产生毒副作用[8~9]。本研究结果显示,BC术后辅助化疗中加入复方苦参注射液,可明显提高治疗总有效率,并显著降低化疗毒副反应发生率,这表明复方苦参注射液在BC术后辅助化疗作用中效果更佳,能降低BC患者化疗毒副作用。探究其原因,复方苦参注射液本身可清除肿瘤细胞及转移病灶,有效分化肿瘤细胞,控制新生血管形成,且其清热解毒功效可在一定程度上避免化疗药物热邪、毒邪损害,维护正常细胞代谢与功能。近年来有研究表明,复方苦参注射液主要由苦参、山慈菇、何首乌、土茯苓等多种中药提取加工而成,具有清热解毒、消结止痛之功效,多用于癌肿、出血[10~11]。现代药理学研究证实苦参中主要有效成分苦参碱可通过影响端粒酶直接杀灭恶性肿瘤细胞,抑制新生血管形成,并诱导其正常分化为正常细胞,调控癌基因促进癌细胞凋亡[12],因此在化疗药物疗效基础上进一步增加对恶性肿瘤细胞的杀伤力,同时有一定减毒作用。
T淋巴细胞可控制肿瘤生长、转移,对肿瘤体积增长有抑制作用,并且能有效防止肿瘤扩散[13],CD3+、CD4+/CD8+、NK在体内水平明显增高时表明患者机体免疫反应能力增强,对抗肿瘤治疗有协同促进作用。本研究结果发现,复方苦参注射液在BC术后辅助化疗治疗18周后,两组CD3+、CD4+/CD8+及NK均升高,且观察组高于对照组,表明复方苦参注射液对提高BC患者免疫力方面具有重要意义。推测其原因,苦参碱可作为良好免疫调节剂,对肿瘤细胞分化进行正向诱导,显著提高细胞免疫功能,纠正T淋巴细胞亚群平衡[14]。
长期化疗会导致患者出现骨髓抑制,导致WBC、PLT水平下降,当患者WBC、PLT水平下降到一定值时,必须停止继续化疗,影响患者后续治疗效果。IL-2是一种辅助性T淋巴细胞产生的免疫调节因子,有促进T淋巴细胞增殖,增进T细胞杀伤力等作用[15]。IL-6为调节炎症反应的主要介质,常用来反映机体炎症反应强弱,当机体炎症反应较强时,IL-6水平也会相应升高。本研究结果发现,治疗18周后,两组WBC、PLT、IL-6水平均较治疗前有显著降低,但观察组WBC、PLT水平均高于对照组,IL-6水平低于对照组,两组IL-2水平均较治疗前有显著升高,且观察组高于对照组。这表明联合复方苦参注射液在BC术后辅助化疗能促进BC患者WBC与PLT的提升,同时能提高患者免疫功能,减轻机体受炎症损伤。推测其原因是,复方苦参注射液中的苦参碱有提升WBC、抗感染和抑制肿瘤细胞增长的作用,配合BC术后辅助化疗,能有效保护机体淋巴细胞、巨噬细胞等正常细胞,同时增强T淋巴细胞、B淋巴细胞的免疫功能。
综上所述,复方苦参注射液联合化疗对BC术后疗效显著,且可有效提高患者自身免疫系统反应,降低化疗药物带来的毒副反应,值得临床广泛应用。

