车辆乘员主动脉钝性损伤仿真分析*
童 芳,李 雄,兰凤崇,陈吉清
(1.华南理工大学机械与汽车工程学院,广州 510640;2.华南理工大学,广东省汽车工程重点实验室,广州 510640)
前言
在交通事故中,乘员和行人的胸部易受到钝性冲击,从而引发主动脉钝性破裂。胸主动脉的破裂部位常见于升主动脉和主动脉弓内侧的峡部。统计数据显示,主动脉破裂的患者中,71%为驾驶员,23%为前排乘客。其中对驾驶员而言,其胸部与转向盘的碰撞是导致其主动脉破裂的重要原因。乘员的胸主动脉钝性破裂是继脑损伤后的第二大死亡原因,故深入认识主动脉钝性破裂机理,对于提高车辆安全性、减少事故中的人员伤亡和财产损失均具有重要意义。
影响主动脉钝性破裂的因素有很多,主要分为两个方面:机械类因素和血流动力学因素。机械类因素指的是主动脉壁在拉伸或挤压等作用力下产生破裂。如Bertrand 等对尸体进行原位拉伸实验表明,主动脉根部相对于降主动脉的位移能导致峡部的典型破裂特征。Baqu等利用尸体做正面冲击实验,发现了心脏和主动脉的加速度差是导致主动脉拉伸和破裂的主要因素。此外,Crass 等和Lee等发现胸部钝性冲击下,前胸壁将直接挤压升主动脉,同样可能导致主动脉峡部产生“骨夹”现象导致破裂。血流动力学的因素是指主动脉和心脏内的血液在外力作用下产生变化的流场,并反作用于血管壁,增加主动脉破裂的风险。目前,针对主动脉钝性破裂中血流作用的研究较少,且大部分是根据医疗和尸检数据做出的推断。一些研究者在尸体实验中对样本的心脏和主动脉进行生理盐水的填充,以模拟人体的血流响应。然而,血液对主动脉钝性破裂的影响仍缺乏定量分析研究。
人体生物力学建模和仿真是研究乘员钝性损伤的重要方法。目前的人体生物力学模型,如Ford公司的人体模型、丰田汽车的人体模型(total human model for safety,THUMS)、华南理工大学的中国五十百分位人体模型(Chinese human body model,CHUBM)和全球人体生物力学模型联盟(global human body models consortium,GHBMC),均在人体损伤领域取得了重要成果。然而,以上人体模型基本不考虑主动脉和心脏的血液动力学。一些研究者采用弹性固体单元模拟主动脉内的血液,但这种方法也无法表达血液的流体特征,以及血液在左心室和主动脉间流动的现象。
为更深入地考虑血流对主动脉钝性破裂的影响,本文首先在前期建立的精细化心脏与主动脉有限元模型内,利用Abaqus 中的流体腔功能对心腔和血管内填充血液。在主动脉瓣上设置了流体交换接触,以模拟碰撞引起的左心室对主动脉的血液输出。在另一例仿真中关闭主动脉瓣的流体交换接触,以对比分析碰撞过程中左心室对主动脉的血液输出量及其对主动脉钝性损伤的影响。此外,本文还分析了最易导致主动脉破裂的部件转向盘在不同倾斜角度下与驾驶员胸部进行碰撞时驾驶员心脏血输出量和主动脉响应差异,为汽车转向机构的安全设计提供参考。
1 血液与心脏和主动脉的耦合模型
1.1 心脏和主动脉有限元模型
前期对中国第50 百分位尺寸的志愿者进行数据断层扫描,利用得到的医学影像数据建立了精细化的心脏和主动脉模型,如图1 所示。模型包括左右心室心房,主动脉、肺动脉等主要血管,以及瓣膜等心血管系统的重要结构。血管、瓣膜和房室内壁采用壳单元模拟,心肌采用实体单元模拟,整个模型包含56 947个单元和16 037个节点。将心脏有限元模型与乘员模型进行装配,进行了不同冲击速度下的碰撞仿真,并与实验结果进行对比,验证了模型的有效性。
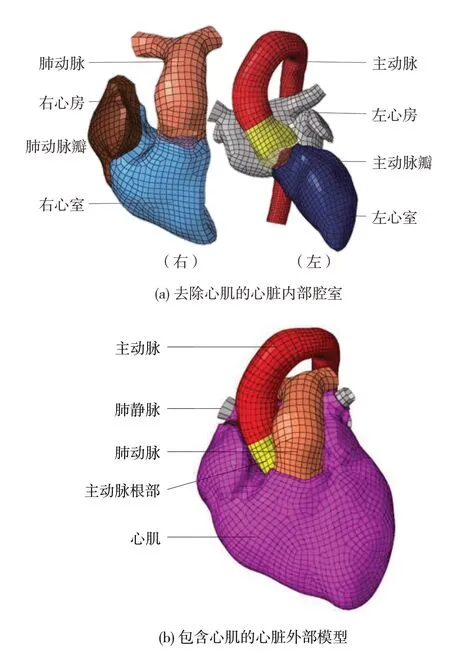
图1 心脏和主动脉有限元模型
1.2 左心室和主动脉内血流填充
心脏和主动脉内部腔体的结构复杂,将其划分成高质量的流体网格十分困难。此外,当胸部受到冲击时,心腔和主动脉内的流体域边界均会发生剧烈变化,导致流体网格畸变,加大计算的不稳定性。Abaqus 提供一种流体腔算法,能更高效而稳定地计算一个充满均匀流体的腔体,受到外部载荷作用时,其内部流体与结构之间的相互作用如图2 所示。虽然心脏和主动脉中血液的物理场存在梯度变化,但在主动脉损伤分析中更关注的是流体的整体压力变化对组织应力应变的影响。故研究主动脉冲击损伤时,可采用流体腔的方式进行血液的填充。
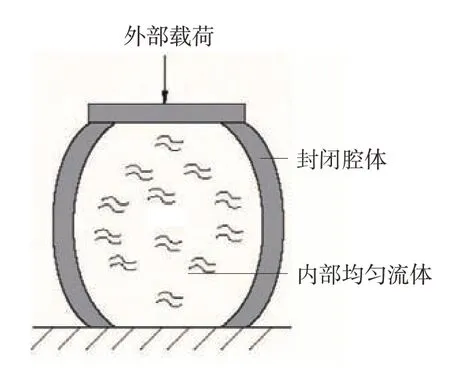
图2 一个流体腔示意图
Abaqus 中提供两种方法描述腔体中流体的性质:气动模型是基于理想气体方程来计算气体体积、压力和温度之间的关系,用于描述可压缩流体;水力模型是利用体积模量来描述几乎不可压缩流体的压力与体积的关系:

式中:表示流体的初始体积;Δ表示流体体积的变化;表示流体压力;表示流体的体积模量。血液是一种几乎不可压缩的流体,故采用水力模型来描述其性质,体积模量设置为2 200 MPa。在Abaqus CAE 的接触模块中,将心脏的4 个腔室和主动脉内利用流体腔功能填充血液,初始生理血压设为80 mmHg。
Abaqus 中的流体腔功能在计算过程中并不直接考虑腔体内流体的惯性。但在乘员冲击仿真中研究主动脉钝性损伤,填充主动脉的血液惯性不可忽略。因此在每个腔体表面添加质量点以模拟血液的惯性作用。其中,质量点的总质量应等于腔体内流体的质量。另外,质量点的分布也应符合腔体内流体惯性对结构产生的影响。本研究中流体充满每一个流体腔,故流体腔边界的质量点可根据流体总质量均匀分布,如图3所示。

图3 质量点的分布
1.3 主动脉瓣间血液流动性的模拟
主动脉瓣是连接左心室和主动脉的单向阀门。当心脏受到冲击产生压缩变形时会通过主动脉瓣向主动脉内输送血液,导致主动脉内的血压进一步升高,增大主动脉破裂风险。故本研究在主动脉瓣上设置了流体交换功能,如图4 所示。当左心室内血压大于主动脉时,血液可以从左心室流入主动脉;当左心室内血压小于主动脉时,血液不在主动脉瓣间流动。血液通过主动脉瓣的流率由瓣膜两侧的实时压力差来决定,图5 显示了左心室和主动脉内不同压力差时,血液通过主动脉瓣的流率变化。
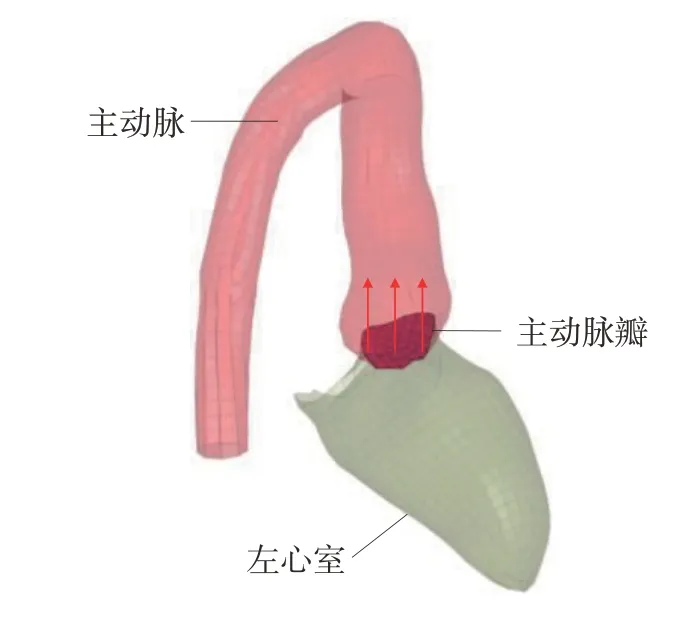
图4 瓣膜的血液单向通过性
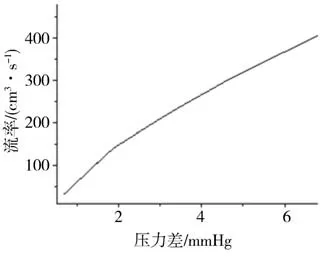
图5 瓣膜两侧血液流率与压差的关系
2 乘员胸部正面冲击仿真
将开发的心脏和主动脉模型与团队前期开发的中国第50 百分位人体模型进行装配。微调两肺与心脏的接触面,在保证解剖学结构合理的情况下防止节点与网格的穿透,如图6 所示。主动脉根部与心脏和左心室内壁通过共节点的方式连接以保证计算的稳定性。乘员的主动脉损伤约有71.4%都是在正面碰撞中由转向盘撞击导致的。设计了3 组驾驶员正面冲击转向盘的仿真,以研究转向盘安装角度对驾驶员主动脉钝性破裂的影响。仿真中驾驶员以6.8 m/s的初速度正面撞击转向盘,转向盘中心的高度在驾驶员胸部第4到第5根肋骨之间,转向柱与水平方向的夹角分别为30°、45°和60°,如图7 所示。此外,为研究冲击导致左心室向主动脉的血液输出量对主动脉内血压和损伤的影响,设置一组仿真关闭主动脉瓣的血液流通,以进行对比分析。具体仿真条件如表1所示。
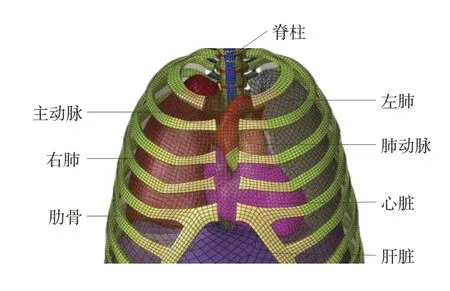
图6 心脏与胸腔模型的装配
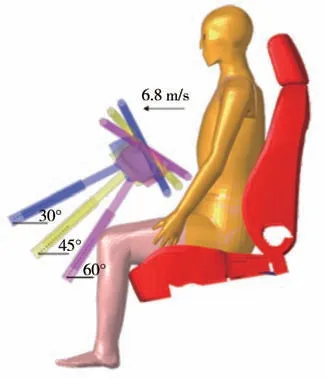
图7 仿真边界条件
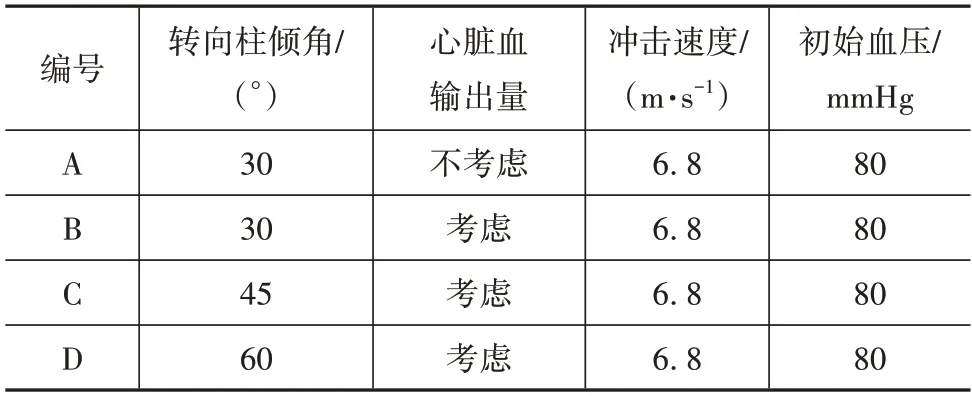
表1 仿真边界条件
3 仿真结果与分析
4 种仿真工况下,由冲击引起的心脏血液输出量对比如图8 所示。由图可见,当设置了主动脉瓣的单向流动时,碰撞过程中血液会从左心室流向主动脉。驾驶员与不同倾角的转向盘碰撞时,心脏血输出量随时间的变化趋势相似:在碰撞后的前20 ms内,心脏和主动脉均未产生变形而没有发生流体交换;在20~40 ms 区间内,心脏开始受到前胸壁的挤压,血流以变化的速率从左心室流入主动脉;在40~60 ms 区间内基本没有血液流出;60 ms 之后存在少量血液流进主动脉直到仿真结束。从数值上看,转向盘倾角为30°时心脏血的输出总量最大,达到3.09 g。随着转向盘倾角的增大,血输出量逐渐减少。转向盘倾角为45°和60°时,心脏血输出总量分别为2.5和1.3 g。
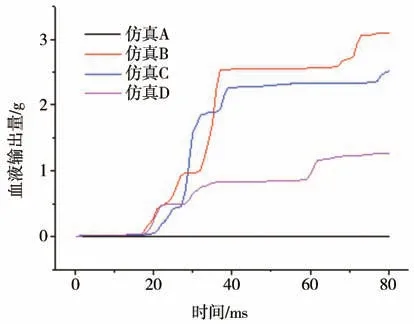
图8 碰撞过程中左心室血液输出量
接着分析心脏血输出量对左心室和主动脉内血压、主动脉最大应力的影响。图9 为碰撞过程中仿真工况A 和B 左心室的压力随时间变化曲线。可以看出,两条曲线在变化趋势上相似,但由于仿真B 中部分血液流入主动脉,导致总体的压力小于仿真A。仿真A 的左心室压力在36 和72 ms 达到两个峰值,分别为70.9 和60.8 kPa。仿真B 的左心室压力在36 和71 ms达到两个峰值,分别为57.0 和37.4 kPa。左心室压力的第1 个峰值是由碰撞初期前胸壁对心脏的直接挤压造成的。随着碰撞过程的继续,转向盘下轮缘压迫腹部,导致腹部的上升运动,联合胸骨和脊柱共同对心脏产生挤压作用,引起左心室压力的第2个峰值。
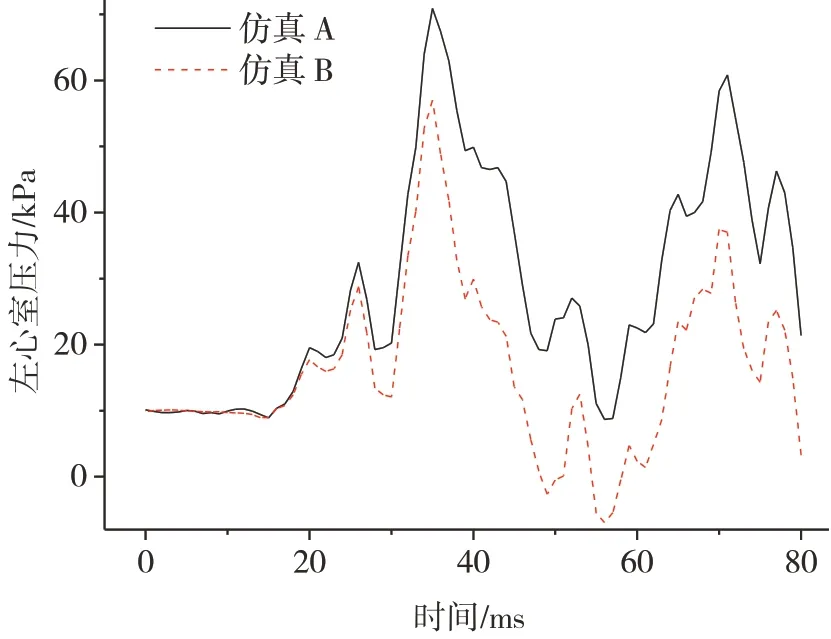
图9 心脏血输出量对左心室压力的影响
图10对比了仿真A和仿真B中主动脉内的血压变化。由图可见,两条曲线不仅变化趋势较为相似,峰值也都发生在42 ms 且数值相差不大。仿真A 的峰值为59.3 kPa,仿真B 的峰值为60.3 kPa。主动脉内血压的波动比左心室更频率。这是因为主动脉壁比左心室壁薄,在周围结构力的作用下更易产生变形-复原的过程。仿真B在40 ms之后的压力波动明显小于仿真A,这可能是由于额外的血液流入主动脉后,增加了主动脉的结构稳定性。
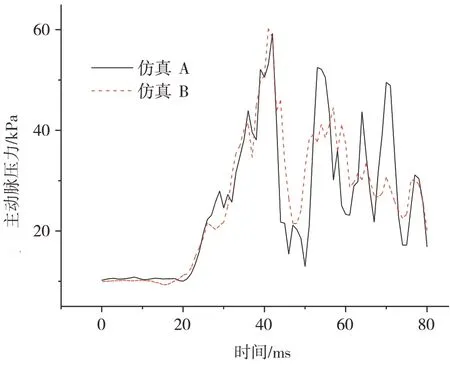
图10 心脏血输出量对主动脉压力的影响
仿真A 中主动脉应力云图如图11 所示。其最大应力发生在碰撞后的39 ms,为2 329 kPa。较大的应力主要集中在主动脉弓内侧的峡部。主动脉峡部的破裂是临床上主动脉钝性损伤的典型特征,是由前胸壁和脊柱的共同挤压导致主动脉弓过度弯曲所致。仿真B 中主动脉应力云图如图12 所示,最大应力为2 417 kPa,同样发生在碰撞后的39 ms。较大的应力除分布在峡部还产生在升主动脉处。许多案例中升主动脉的破裂也是常见现象,多见于胸腔正面碰撞时,胸骨直接冲击主动脉从而引起局部大变形。
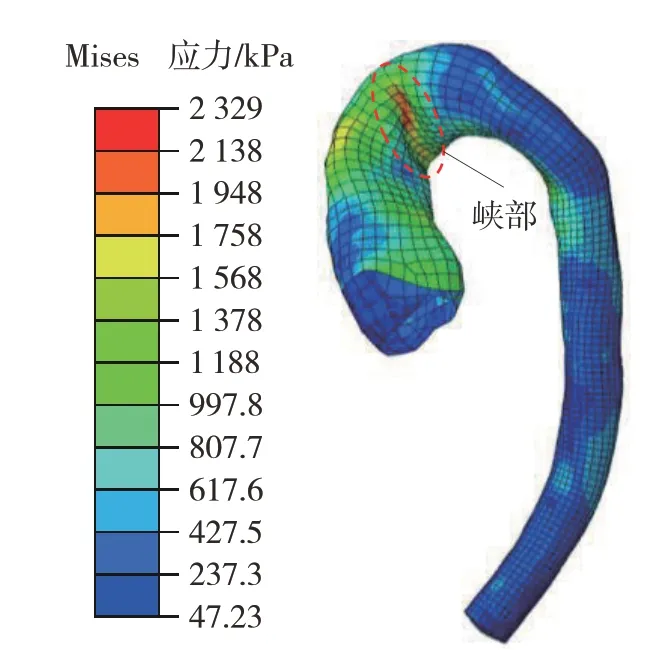
图11 仿真A中主动脉应力云图
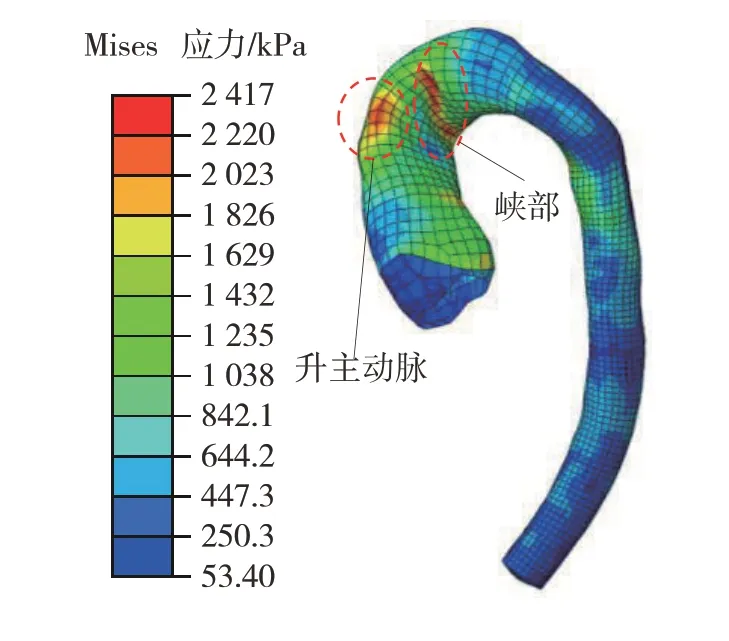
图12 仿真B中主动脉应力云图
对比分析仿真A 和仿真B 的结果,发现胸部正面碰撞过程中有少量血液从左心室流向主动脉,降低左心室内的血压。主动脉内增加的血液并不能明显增大其内部血压,但能改善血管内血压的波动情况。增加主动脉瓣的流体交换功能后,主动脉的最大应力增大了3.8%。由此可见,碰撞过程中左心室对主动脉的额外输出量不能明显影响主动脉损伤,主动脉内压力的变化和最大应力主要是主动脉自身的变形所引起。
转向盘是正面碰撞中导致心脏和主动脉损伤的主要部件。为研究转向盘倾角对主动脉钝性损伤的影响,对比分析仿真B、C、D 的结果。仿真C 的主动脉应力云图如图13 所示,其最大应力发生在碰撞后的32 ms,仅为1 284 kPa。较大的应力同样集中分布在峡部,是由前胸壁的挤压所引起的。对比仿真B 可发现,当转向盘倾角为45°时,主动脉上的最大应力较倾角为30°时减小了46.9%。
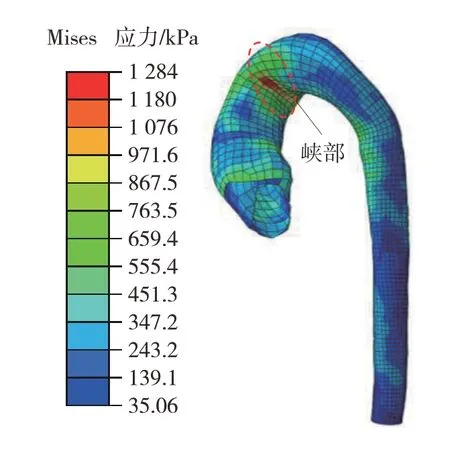
图13 仿真C中主动脉应力云图
图14 展示两种转向盘倾角下驾驶员的运动响应。可以看出,当倾角为30°时,转向盘上轮缘完全限制了胸腔和心脏向前的运动趋势,故连接心脏的主动脉根部的运动也几乎停止,如图14(a)所示。然而主动脉和脊柱在惯性作用下仍向前运动,导致主动脉弓内侧的峡部受到挤压,产生局部大变形。当倾角为45°时,转向盘上轮缘的高度降低,且盘面与胸部的夹角增大。此时转向盘仅能减缓心脏前移的运动趋势,并不能完全限制其位移,如图14(b)所示。降主动脉与主动脉根部之间的相对位移减小,使峡部受到的挤压和局部变形减小。
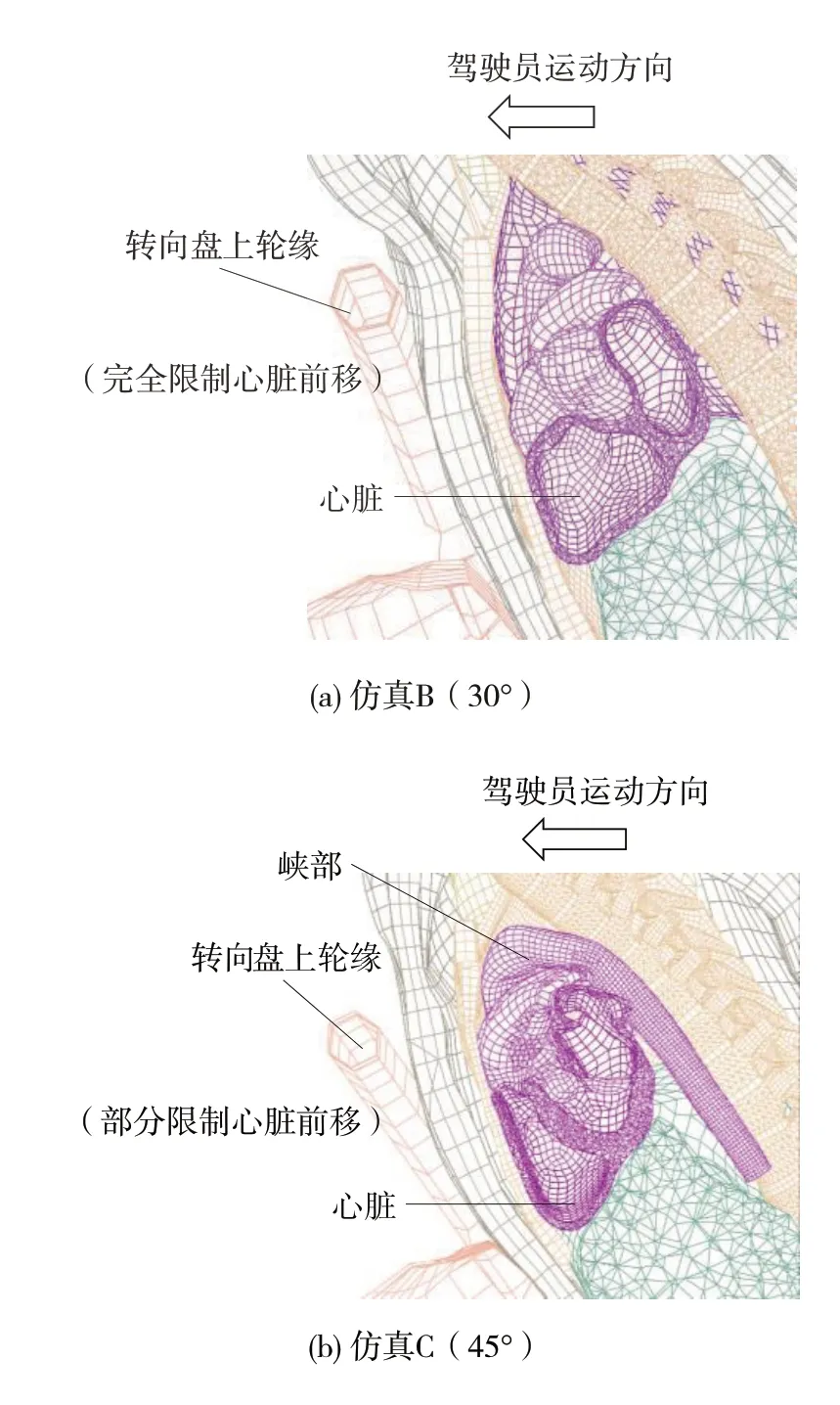
图14 驾驶员碰撞过程中的运动响应
仿真D 中主动脉的应力分布如图15 所示。与前面的仿真结果不同,仿真D的较大应力主要集中在峡部靠近降主动脉的位置,最大应力为1 375 kPa。当转向盘倾角为60°时,转向盘仅有下轮缘能够直接与驾驶员发生碰撞,如图16 所示。下轮缘直接作用于驾驶员的腹部,胸腔内心脏向前的运动没有受到限制。同时,主动脉根部也跟随心脏向前移动。然而降主动脉通过血管韧带连接在脊柱上,限制了其向前的位移。降主动脉近端在相对位移的拉扯下产生最大应力。
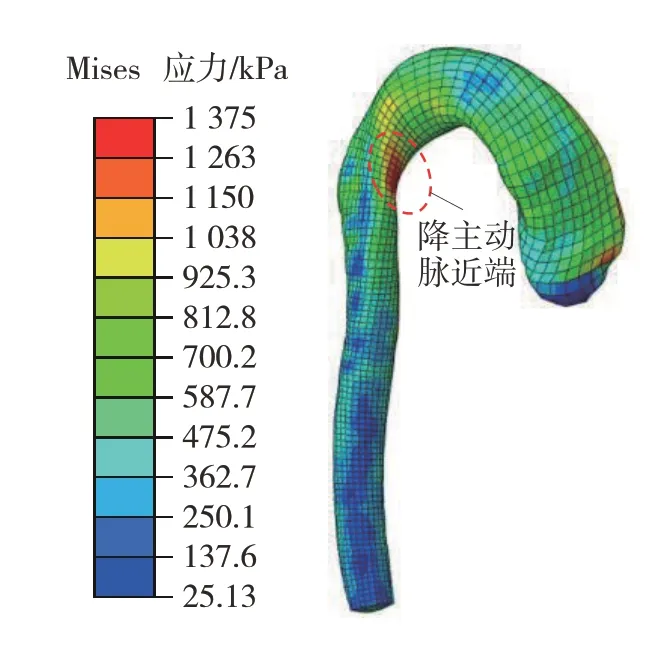
图15 仿真D中主动脉应力云图
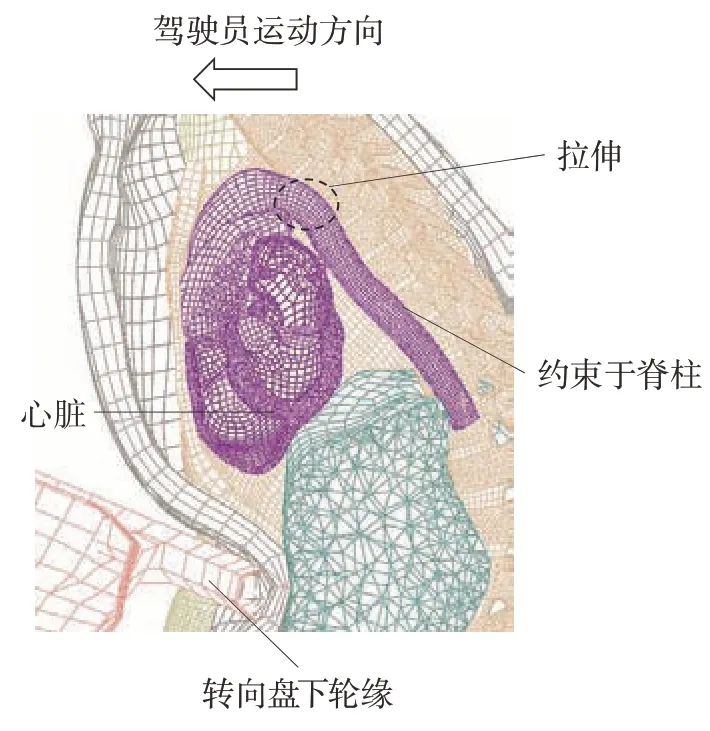
图16 仿真D(60°)中驾驶员运动响应
为更直观地描述不同碰撞工况下主动脉峡部的破裂机理,图17 示出主动脉根部与降主动脉的相对位移随时间的变化曲线。从图中可以看出,碰撞过程中主动脉峡部的破裂是由拉伸还是挤压所造成的。当相对位移大于0 时表示主动脉根部和降主动脉的距离增大,当相对位移小于0 时表示减小。由图17 可见,当转向盘倾斜角度为60°时,主动脉峡部多处于拉伸状态,主动脉根部与降主动脉的相对位移可达28 mm,引起峡部的拉伸破裂。当转向盘倾斜角度为30°和45°时,主动脉峡部多处于受压状态。其中转向盘倾斜角度为45°时,根部和降主动脉相对位移不大。此工况下主动脉在32 ms 产生最大应力,可知最大应力是由胸腔前后壁挤压造成的。当转向盘倾角为30°时,胸腔前后径发生更严重的压缩,使主动脉根部与降主动脉的距离更近,挤压峡部使其产生破裂。
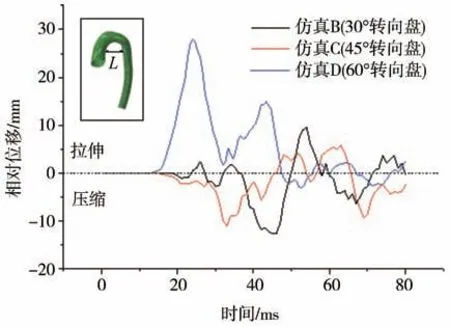
图17 主动脉根部与降主动脉的距离变化
4 结论
建立精细化的血液-主动脉流固耦合模型,并与乘员模型进行装配,以进行不同血流条件和工况下对转向盘的碰撞仿真,得到以下结论。
(1)乘员胸部在正面冲击下,心脏受到挤压的过程中会通过主动脉瓣向主动脉内输出血液而降低左心室内所能达到的血压峰值,并减缓主动脉内血压的波动。但输出的血液对主动脉的最大应力影响较小,Mises 应力仅增加3.8%。
(2)驾驶员与不同倾角的转向盘发生碰撞时,主动脉损伤响应存在区别。当转向盘倾角为30°时,主动脉上的应力最大,为2 417 kPa。当转向盘倾角为45°时,主动脉上的应力最小,为1 284 kPa。主动脉的最大应力均发生在升主动脉和主动脉峡部。
(3)驾驶员与不同倾角的转向盘发生碰撞时,主动脉损伤机理存在区别。当转向盘倾角为30°和45°时,主动脉的最大应力是由前胸壁的挤压导致;当转向盘倾角为60°时,主动脉的最大应力是由其根部和降主动脉的相对拉伸所致。
本文中建立的血液-心脏主动脉耦合模型能够考虑乘员受到冲击时,心脏及主动脉内血压变化和血液流动,更真实地反映碰撞过程。与转向盘的碰撞仿真研究结果也能为汽车转向机构的安全设计提供参考。

