黄嘌呤氧化酶肽类抑制剂的研究进展
袁 禛,程述震,吴 迪,林泽鑫,杜 明,*
(1.大连工业大学食品学院,国家海洋食品工程技术研究中心,辽宁 大连 116034;2.大连工业大学,海洋食品精深加工省部共建协同创新中心,辽宁 大连 116034;3.中国农业大学食品科学与营养工程学院,北京 100083)
随着生活水平的日益提高,人们饮食结构发生改变,各个国家痛风发病率也明显升高,痛风已成为我国仅次于糖尿病的第二大代谢类疾病。Chen Yuzhu等统计表明,我国痛风患病率农村高于城市,沿海高于内陆,但内陆高寒地区高于其他地区。据报道,我国男性痛风的发病率高于女性,男性30岁和女性50岁是发病的危险年龄。痛风是由于嘌呤类物质代谢增加或尿酸排泄异常引起的一种反复发作的炎症性疾病。痛风与高尿酸血症是同一疾病的不同病程时期,高尿酸血症是一个先决条件,临床上,男性血尿酸水平大于7.0 mg/dL、女性血尿酸水平大于6.0 mg/dL即可确诊为高尿酸血症。高尿酸血症是痛风发作的第一个病程时期,只有一部分高尿酸血症患者发展为痛风,痛风的患病率远低于高尿酸血症的患病率,原因目前尚不清楚。
目前痛风尚无法彻底根治,对患者的治疗主要是控制血尿酸水平和急性关节炎发作,预防尿酸盐沉积,防止痛风石形成及肾功能损害。现有痛风药物如别嘌呤醇、苯溴马隆、秋水仙碱等,有很多副作用。有研究证明,黄酮类、酚酸类、萜类、生物碱类等化合物具有良好的降尿酸作用,但是天然活性物质的提取成本极高,限制了其工业化应用。蛋白来源的小分子降尿酸肽具有制备成本低、安全性高、易吸收、高活性、稳定性和特异性等特点,已引起研究者的关注。一些肽不仅在体外具有黄嘌呤氧化酶(xanthine oxidase,XO)抑制活性,在体内也被发现具有降尿酸的活性。所以开发食品来源的、新型的、低毒副作用的降尿酸活性物质具有重要的意义。虽然活性肽已成为降尿酸研究领域的热点,但鲜见关于此方面的研究,目前国内外有关降尿酸活性的研究聚焦于XO抑制剂的筛选。
1 黄嘌呤氧化酶概述
新鲜牛奶中含有一种物质,可使加入醛类的美兰或靛蓝溶液褪色,这种物质被命名为沙尔丁格酶(Shardinger enzyme),也就是后来发现的XO。XO是嘌呤代谢中的关键酶,广泛存在于各种生物体中,哺乳动物的XO不仅大量存在于肝脏,而且也大量存在于肺、乳腺、肾脏、肠道等具有血管内皮细胞的器官。
XO结构和功能研究中的XO大多是从牛乳中分离出来的,尽管也对人、禽和细菌来源的XO进行了表征,但是研究发现所有这些来源的酶氧化还原中心的结构都相同。XO是一种底物非专一性的羟化酶,主要功能是催化次黄嘌呤氧化为黄嘌呤,再进一步催化黄嘌呤氧化生成尿酸,其底物包括嘌呤、嘧啶、蝶呤、芳杂环和某些醛类等。体内的黄嘌呤转化成尿酸的过程中,钼中心首先得到2个电子,由正六价降低至正四价,经两个铁硫中心(2Fe-2S)中心传递,然后通过黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)将电子传给NAD或氧分子,将其转化成NADH或O。此外,XO还在小肠吸收铁离子和肝脏转运铁的过程中发挥重要作用。不同来源的XO均为分子质量为300 kDa的蛋白质,由两个相同的亚基组成,每一个亚基全长1 333~1 358个氨基酸,具体数目依不同物种而定。图1A所示为XO中的1个亚基,图1B红色透明圆球所示为XO的活性位点及抑制剂作用区域,每个亚基有3个结构域(图1C):1个钼辅因子(molybdopterin,Mo-pt);两个铁硫中心(2Fe-2S)和1个FAD,3个部分几乎呈线性排列。其中包含Mo-pt的钼蝶呤中心是XO催化的关键位点,它通过两个S原子与蝶呤相连,以Mo=O中的O为顶点形成一个四面锥体的结构。氨基酸残基Glu802、Arg880、Glu1261(牛乳XO的氨基酸顺序)是促进催化反应的关键残基。黄嘌呤氧化酶抑制剂(xanthine oxidase inhibitor,XOI)一般与钼蝶呤中心的催化活性位点结合,可逆或不可逆地抑制XO活力,防止底物发生羟化反应,减少尿酸生成,降低血清中尿酸的浓度,达到治疗高尿酸的效果。XOI通过抑制XO活性减少尿酸的生成,进而降低血清中尿酸的浓度。
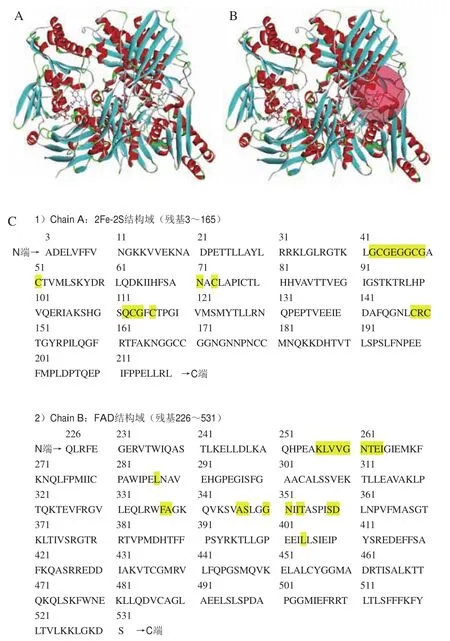

图1 XO的结构及氨基酸序列Fig.1 Structure and amino acid sequence of XO
2 黄嘌呤氧化酶混合肽类抑制剂
目前研究发现的XO混合肽类抑制剂原料分为乳类、牲畜类、海产品类3种,其中以海产品类研究居多。表1列出了XO混合肽类抑制剂的原料、酶解用酶及抑制效果。刘丹等发现乳清蛋白粉酶解物具有显著的降尿酸活性;张瑞雪等发现富含鹅肌肽的鸡胸肉酶解物能有效降低尿酸水平,缓解小鼠的急性高尿酸血症;赵谋明等研究发现6.4 mg/mL(以氮计)秋刀鱼酶解物的XO抑制率达到(39.24f0.01)%;邹琳等研究发现8.8 mg/mL(以氮计)鲣鱼背腹肉酶解物的XO抑制率为62.26%;刘洋使用不同种类单酶和复合酶酶解海洋鱼,其中复合酶获得的酶解物体外XO抑制率最高,为39.24%;吉薇等研究发现扁舵鲣鱼低聚肽能抑制XO的活力,减少尿酸的生成和尿酸盐晶体的沉积。

表1 XO混合肽类抑制剂的来源与活性Table 1 Sources and activity of mixed peptide inhibitors of XO
3 黄嘌呤氧化酶单一肽类抑制剂
为了确定混合肽类抑制剂中发挥作用的肽,研究者们通常要将混合肽进行分离纯化,质谱鉴定得到肽序列,固相合成后对其进行研究。图2展示了肽类抑制剂酶解、分离纯化的通用步骤和技术,表2列举了近年来已经发现的XO单一肽类抑制剂及其抑制效果,由于不同研究体系对应的阳性对照别嘌呤醇的半抑制浓度(half maximal inhibitory concentration,IC)不同,故将不同文献中别嘌呤醇的IC值也列出。
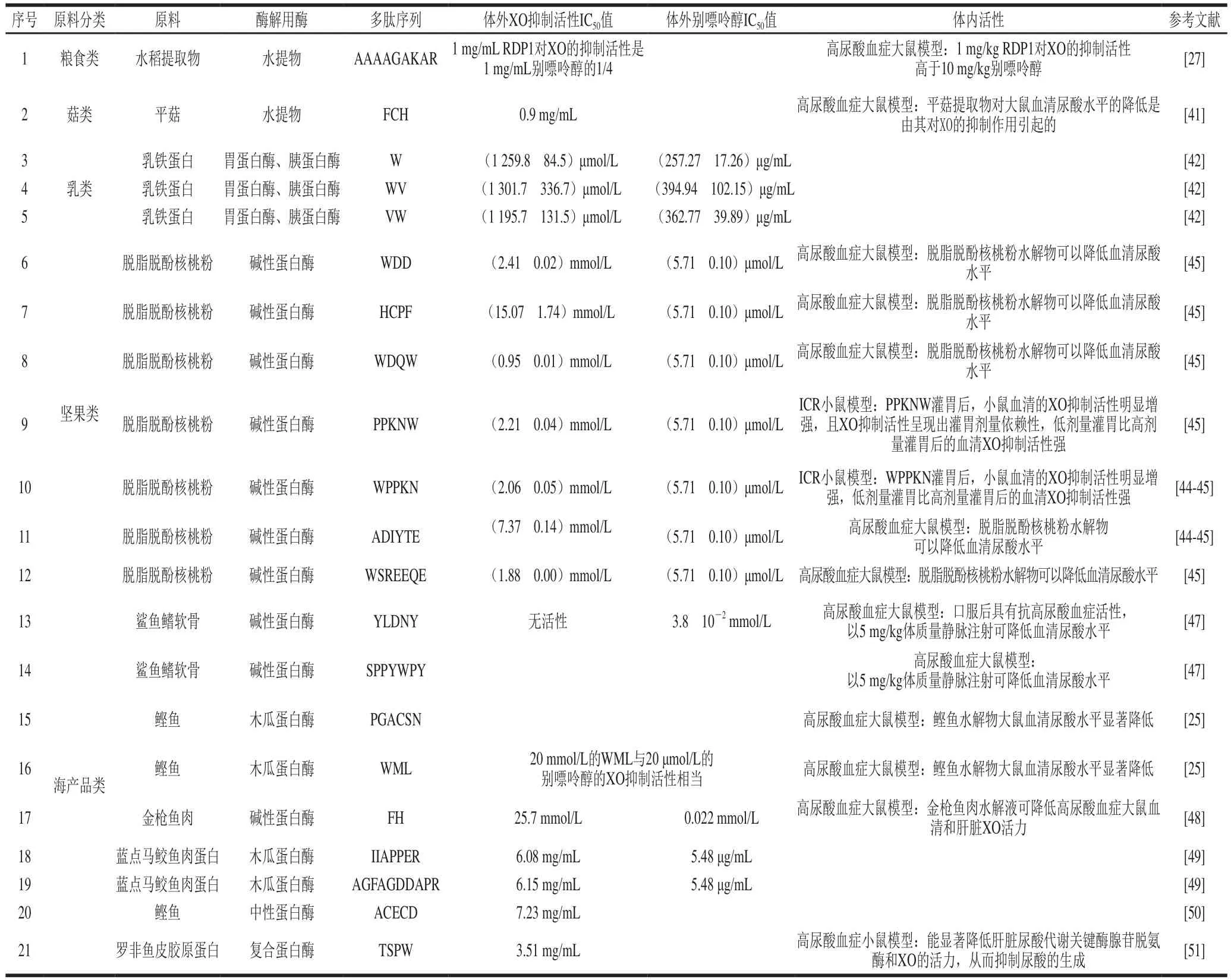
表2 XO单一肽类抑制剂及其对XO的抑制效果Table 2 Single-peptide inhibitors of XO and their XO-inhibitory effects
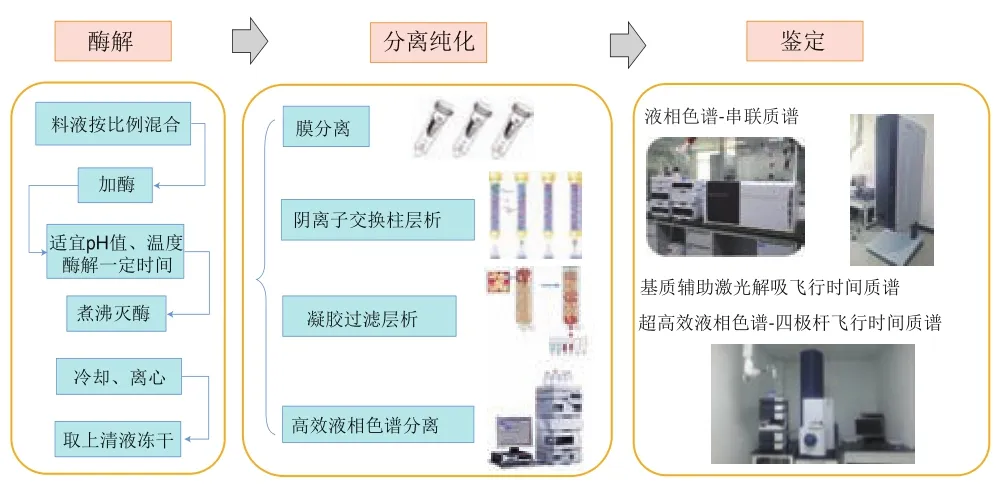
图2 肽类抑制剂制备的通用步骤Fig.2 General steps for the preparation of peptide inhibitors
Liu Naixin等将制得的水稻提取物用Sephadex G-50凝胶过滤柱纯化后,进行两轮高效液相色谱分离,得单一肽AAAAGAKAR(RDP1);进一步体外研究表明1 mg/mL RDP1对XO有明显的抑制作用,是1 mg/mL别嘌呤醇抑制作用的1/4,高尿酸血症大鼠模型也证明了1 mg/kg RDP1对XO的抑制活性高于10 mg/kg别嘌呤醇。Jang等以平菇为原料制得提取物,通过Sephadex G-50凝胶色谱层析、超滤、C固相萃取色谱和反相高效液相色谱等方法纯化得单一肽FCH,FCH的IC值为0.9 mg/mL。Nongonierma等研究发现在不同的乳蛋白底物中,只有乳铁蛋白水解液表现出XO抑制作用。研究的12种二肽中,只有含Trp的肽Val-Trp及其反肽Trp-Val具有XO抑制活性,且XO抑制率分别为(37.2f2.2)%、(36.7f11.2)%。Nongonierma等还发现除Trp外,其他氨基酸均不能抑制XO。黎青勇等将脱脂脱酚核桃蛋白酶解物用Sephadex G-15凝胶色谱层析和反相高效液相色谱法分离纯化后,采用超高压液相色谱-高分辨质谱联用共解析出7种核桃蛋白肽片段:WDD、HCPF、WDQW、PPKNW、WPPKN、ADIYTE和WSREEQE;其对XO的IC值分别为(2.41f0.02)、(15.07f1.74)、(0.95f0.01)、(2.21f0.04)、(2.06f0.05)、(7.37f0.14)、(1.88f0.00)mmol/L。Murota等以鲨鱼鳍软骨为原料进行酶解,在酶解产物中鉴定出两条肽YLDNY和SPPYWPY,这两条肽在体外时并没有XO抑制活性,但一些来源于YLDNY的二肽或三肽如Asp-Asn却表现出体外XO抑制活性。这可能是肽在消化吸收的过程中分解成更小的肽段,从而发挥XO抑制活性或诱导了内源性XO抑制剂的活性,这些片段肽的IC值是别嘌呤醇的13~23 倍。Li Yujuan等以鲣鱼糜蛋白为原料,用木瓜蛋白酶酶解得水解产物。用离子交换色谱法、凝胶过滤色谱法纯化具有强XO抑制活性的组分,通过液相色谱电喷雾电离串联质谱鉴定出两条抑制活性随浓度的增加而增加的多肽PGACSN、WML。He Weiwei等用碱性蛋白酶水解得金枪鱼肉得酶解物,用Sephadex G-15分离乙醇可溶组分后,进一步利用超高效液相色谱进行分离,通过质谱鉴定出13 条肽,其中FH对XO的抑制率最高,IC值为25.7 mmol/L。宋敏杰通过固定化XO的磁性颗粒,采用配体垂钓的方法从蓝点马鲛鱼肉蛋白水解物中获得能够与XO相互作用的配体,发现IIAPPER和AGFAGDDAPR这两段序列都具有一定的XO抑制效果,IC值分别为6.08 mg/mL和6.15 mg/mL。Zhong Hao等以鲣鱼为原料用中性蛋白酶酶解得酶解液,超滤收集600~1 000 Da部分后,通过基质辅助激光解吸
串联飞行时间质谱分析鉴定得到五肽ACECD,发现其具有较强的XO抑制活性且其IC值为7.23 mg/mL。盛周煌以罗非鱼皮胶原蛋白为原料用复合蛋白酶酶解后,通过超滤、离子交换柱层析、Sephadex G-25凝胶过滤、反相高效液相色谱分离纯化,液相色谱-串联质谱鉴定得到TSPW,IC值为3.51 mg/mL。
4 黄嘌呤氧化酶肽类抑制剂的活性机制
研究者们通常使用分子对接的方法来说明XO肽类抑制剂的活性机制,表3列出并对比了文献中叙述的单一肽类抑制剂和本综述中这些肽与XO(PBD ID:1FIQ)对接时使用的分子对接软件、使用酶的PDB ID及抑制机制。Nongonierma等将所有20种氨基酸和400种二肽与XO进行对接,结果表明,XO与Trp或含有Trp的二肽之间的对接涉及到与XO中至少6个疏水氨基酸残基的相互作用。AAAAGAKAR占据了XO的药物活性腔之一的Mo-pt结构域,Glu232作为黄嘌呤与XO相互作用的结合位点之一,在该反应中起重要作用。WPPKN进入疏水通道,阻碍了黄嘌呤和XO的相互作用。而ADIYTE位于B链表面,阻止了底物进入疏水通道。ADIYTE由于与Mo-pt结构域的相互作用较弱,因此ADIYTE对XO的抑制作用不如WPPKN。Li Qingyong等将20个氨基酸、400个二肽和8 000个三肽进行了分子对接,结果表明:Trp是混合型抑制类型,Trp与XO的关键残基Glu802、Leu873、Ser876、Arg880、Phe914、Phe1 009、Thr1 010、Val1 011、Leu1 014、Ala1 078、Ala1 079和Mos3 004有活性相互作用,包括氢键、疏水相互作用和范德华力,W和别嘌呤醇(降尿酸药物)与XO的相互作用方式类似;PPKNW的XO抑制作用为非竞争性抑制类型,PPKNW与残基Phe649、Leu712、His875、Glu879、Phe883、Pro1 012、Phe1 013、Tyr1 140、Phe1 142和Glu1 143有相互作用,包括氢键、疏水相互作用和范德华力;WDQW的XO抑制作用为混合型抑制类型,WDQW与关键残基Glu802、Leu873、Ser876、Arg880、Phe914、Phe1 009、Thr1 010、Val1 011、Leu1 014、Ala1 078、Ala1 079和Mos3 004相互作用。PGACSN的氨基酸残基与XO的关键残基Glu802、Arg880、Glu1 261之间存在氢键和吸引电荷;而WML则主要通过疏水相互作用进入疏水通道,然后在Leu和Asn768之间只观察到一个氢键(2.036 Å),在Trp和Mos3 004活性位点之间形成一个π-硫键。FH与XO中的Ser876、Thr1 010之间存在两个氢键,与Phe914有π-π堆积的相互作用。IIAPPER整条序列无法对接成功,而去掉两端任意1个氨基酸之后的序列IIAPPE及IAPPER却能对接成功,由于XO活性口袋接近蛋白表面,而不在内部,因此有理由猜测该活性肽并非完全进入活性口袋,而是有一部分留在活性口袋外侧,阻止了底物进入活性中心,同样达到了抑制酶活的效果。ACECD能插入到XO中含Mo原子的活性中心,并且通过氢键、疏水作用力和范德华力等与活性中心周围的氨基酸残基产生相互作用,ACECD可能与底物黄嘌呤之间存在竞争同一结合位点的现象。
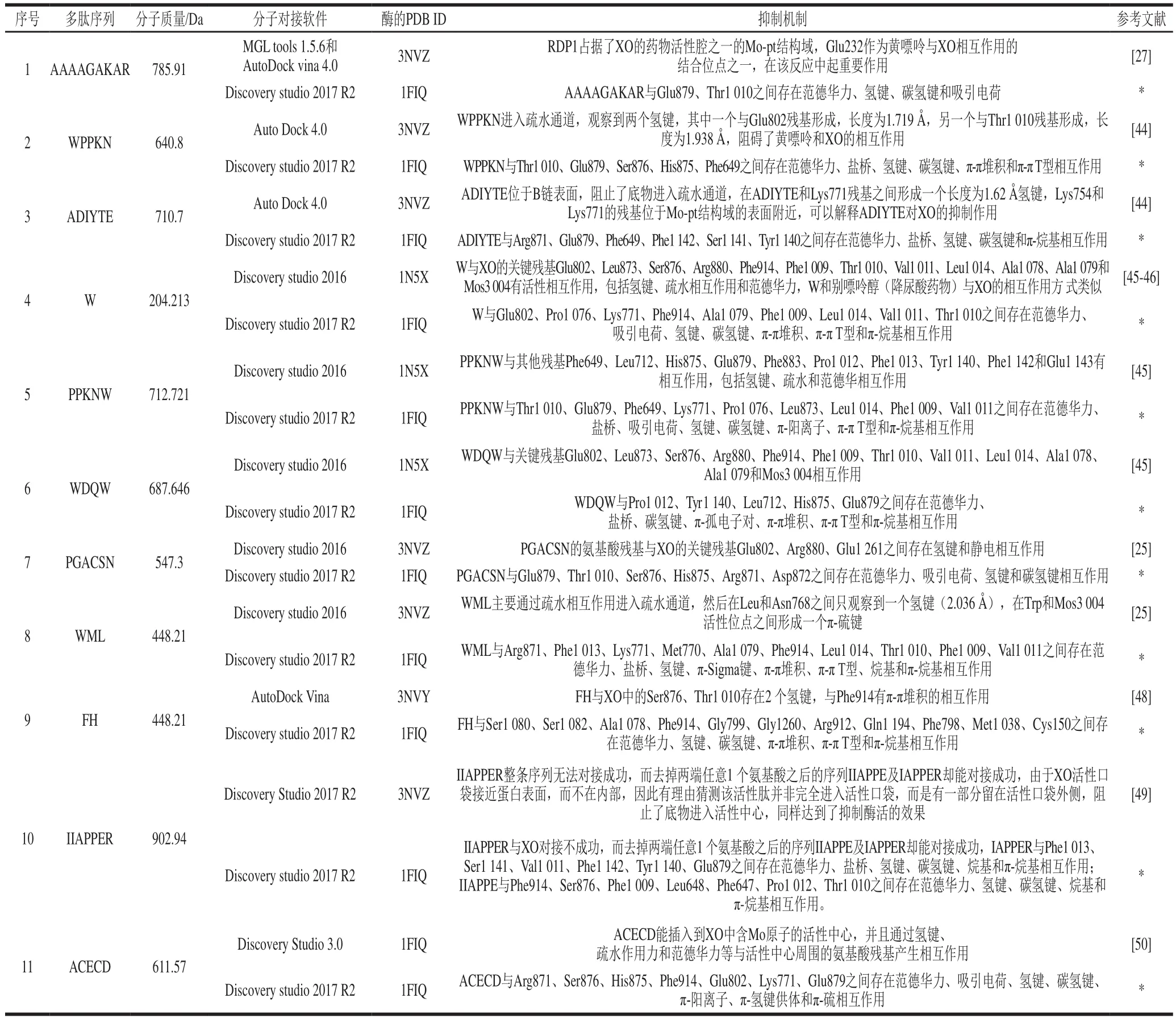
表3 XO抑制肽抑制机制Table 3 Mechanism of action of XO inhibitory peptides
为了更好地表现分子对接结果,本文将相关研究中已知抑制肽的序列AAAAGAKAR、WPPKN、ADIYTE、W、PPKNW、WDQW、PGACSN、WML、FH、IIAPPER(IAPPER、IIAPPE)、ACECD与XO(PBD ID:1FIQ)进行对接,酶的对接位点如图1B所示,对接结果如图3所示。从图中可以看出,AAAAGAKAR与Glu879、Thr1 010之间存在范德华力、氢键、碳氢键和吸引电荷。WPPKN与Thr1 010、Glu879、Ser876、His875、Phe649之间存在范德华力、盐桥、氢键、碳氢键、π-π堆积和π-π T型相互作用。ADIYTE与Arg871、Glu879、Phe649、Phe1 142、Ser1 141、Tyr1 140之间存在范德华力、盐桥、氢键、碳氢键和π-烷基相互作用。W与Glu802、Pro1076、Lys771、Phe914、Ala1 079、Phe1 009、Leu1 014、Val1 011、Thr1 010之间存在范德华力、吸引电荷、氢键、碳氢键、π-π堆积、π-π T型和π-烷基相互作用。PPKNW与Thr1 010、Glu879、Phe649、Lys771、Pro1 076、Leu873、Leu1 014、Phe1 009、Val1 011之间存在范德华力、盐桥、吸引电荷、氢键、碳氢键、π-阳离子、π-π T型和π-烷基相互作用。WDQW与Pro1 012、Tyr1 140、Leu712、His875、Glu879之间存在范德华力、盐桥、碳氢键、π-孤电子对、π-π堆积、π-π T型和π-烷基相互作用。PGACSN与Glu879、Thr1 010、Ser876、His875、Arg871、Asp872之间存在范德华力、吸引电荷、氢键和碳氢键相互作用。WML与Arg871、Phe1 013、Lys771、Met770、Ala1 079、Phe914、Leu1 014、Thr1 010、Phe1 009、Val1 011之间存在范德华力、盐桥、氢键、π-Sigma键、π-π堆积、π-π T型、烷基和π-烷基相互作用。FH与Ser1 080、Ser1 082、Ala1 078、Phe914、Gly799、Gly1 260、Arg912、Gln1 194、Phe798、Met1 038、Cys150之间存在范德华力、氢键、碳氢键、π-π堆积、π-π T型和π-烷基相互作用。IIAPPER与XO对接不成功,而去掉两端任意1个氨基酸之后的序列IAPPER及IIAPPE却能对接成功,IAPPER与Phe1 013、Ser1 141、Val1 011、Phe1 142、Tyr1 140、Glu879之间存在范德华力、盐桥、氢键、碳氢键、烷基和π-烷基相互作用。IIAPPE与Phe914、Ser876、Phe1 009、Leu648、Phe647、Pro1 012、Thr1 010之间存在范德华力、氢键、碳氢键、烷基和π-烷基相互作用。ACECD与Arg871、Ser876、His875、Phe914、Glu802、Lys771、Glu879之间存在范德华力、吸引电荷、氢键、碳氢键、π-阳离子、π-氢键供体和π-硫相互作用。从对接结果可以推测出,较小分子的肽可以进入疏水通道,进入活性中心,从而阻碍底物的进入而达到抑制酶活的效果,较大分子的肽段对接在疏水通道表面入口处,阻断底物进入活性中心,达到抑制酶活的效果。
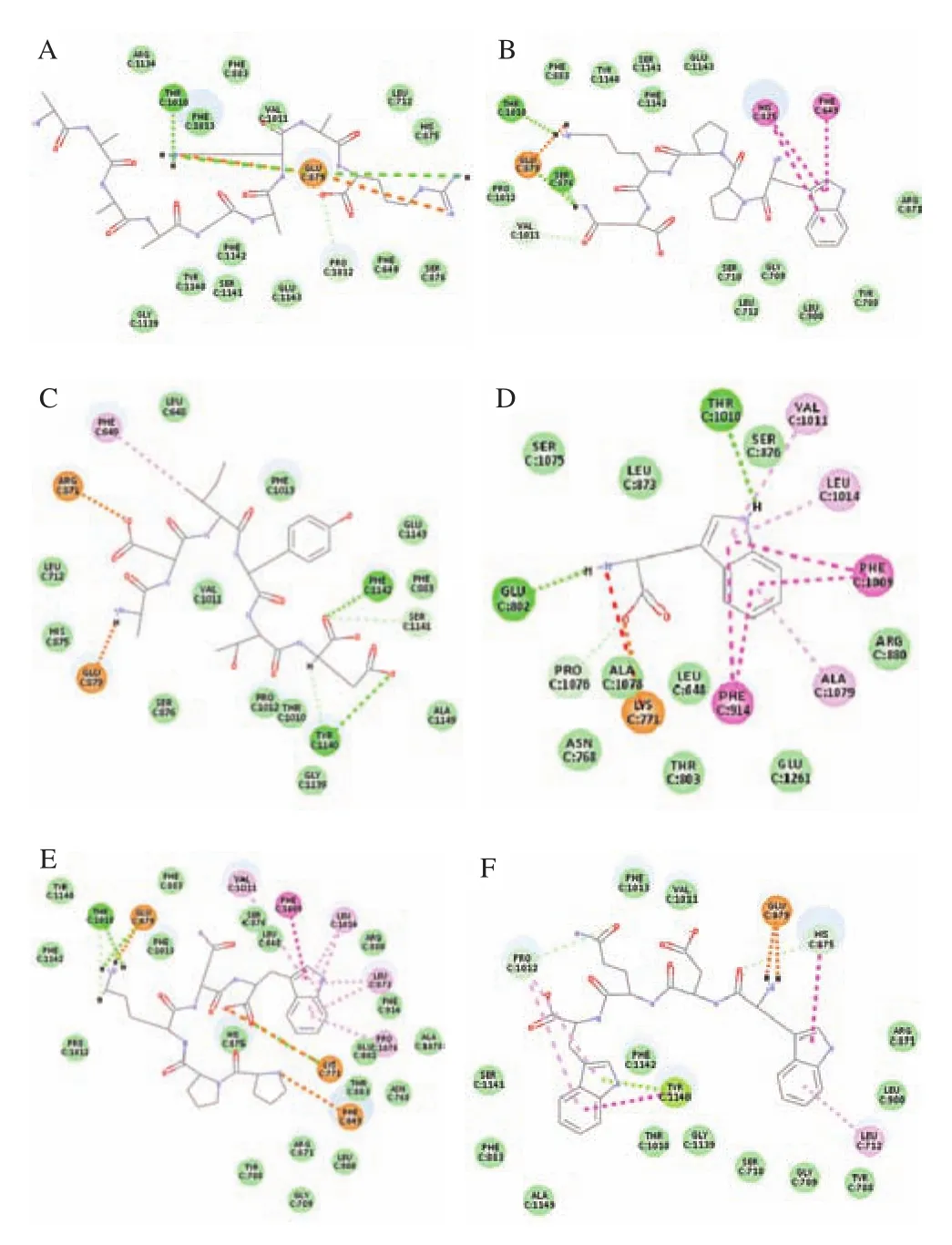
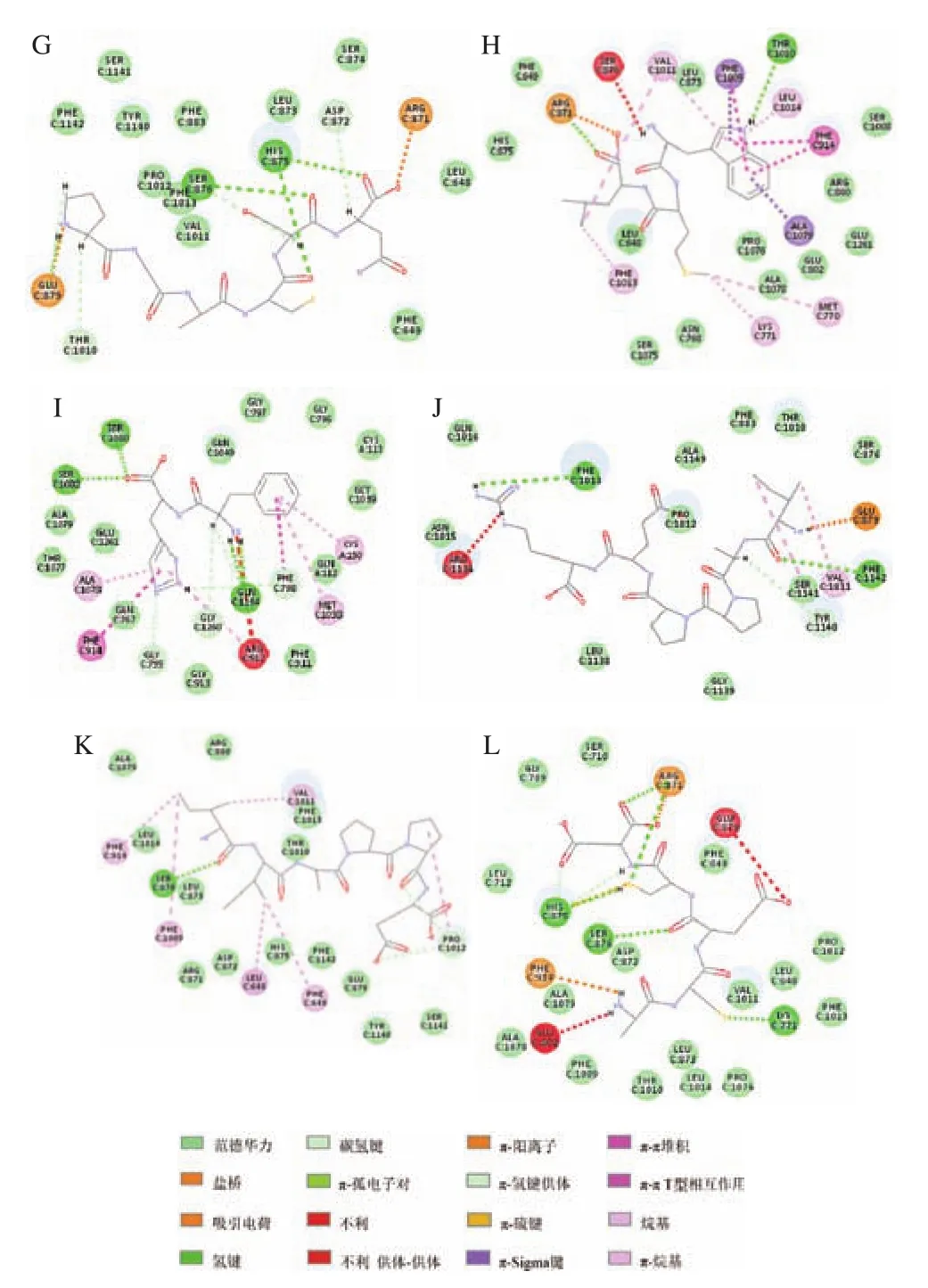
图3 1FIQ与AAAAGAKAR(A)、WPPKN(B)、ADIYTE(C)、W(D)、PPKNW(E)、WDQW(F)、PGACSN(G)、WML(H)、FH(I)、IAPPER(J)、IIAPPE(K)、ACECD(L)分子对接结果Fig.3 Molecular docking results of 1FIQ with AAAAGAKAR (A),WPPKN (B), ADIYTE (C), W (D), PPKNW (E), WDQW (F), PGACSN (G),WML (H), FH (I), IAPPER (J), IIAPPE (K) and ACECD (L)
5 黄嘌呤氧化酶肽类抑制剂的结构特性
研究XO肽类抑制剂的结构特性可为研究者发现此类抑制剂提供一定的思路。Kubomura等实验结果表明,含有肌肽及鹅肌肽的鲤鱼提取物能够降低血尿酸水平。而肌肽及鹅肌肽是否通过抑制XO活力来发挥降尿酸作用尚不明确。邹琳等实验结果表明,肌肽、鹅肌肽含量与XO抑制活性不存在明显的量效关系,其认为肌肽或鹅肌肽是通过其他机制达到了降尿酸的目的。Li Yujuan等发现中性或弱碱性肽比酸性肽更容易成为有效的XO抑制剂。Li Qingyong等发现含有Trp的肽具有相对较高的XO抑制活性,且Trp的位置对肽的XO抑制活性有一定的影响,Trp残基数量的增加能有效提高含Trp肽的XO抑制活性。Nongonierma等的研究也表明含Trp的多肽对XO的抑制作用主要归因于Trp残基。除Trp外,其他氨基酸均不能抑制XO活性。He Weiwei等发现含Trp的肽有显著的XO抑制活性。含Phe的肽比含Trp的肽具有更强的XO抑制活性。由于XO的活性中心由一个疏水囊组成,是XO抑制剂发挥抑制作用的重要区域。因此,含有较多疏水氨基酸的部分可能更容易进入XO活性中心的疏水区。除此之外,He Weiwei等还发现碱性氨基酸对含有Phe二肽的XO抑制活性起到关键作用,包含Phe和碱性氨基酸的二肽具有更强的XO抑制活性。邹琳等认为酶解液中发挥XO抑制活性的物质主要是小分子的肽段。黎青勇的分子对接结果表明,芳香族氨基酸(包括Trp、Tyr、Phe和His)具有较高的Vina分数,预测这类氨基酸能促使多肽具有较高的XO抑制活性;总体上,芳香族的氨基酸残基在N端位置有利于多肽具有较高的Vina分数,芳香族的氨基酸残基在中间位置却不利于多肽Vina分数的提高,从而预测不能有效抑制XO的催化活性。综上所述,小分子、疏水性(含芳香族氨基酸)、中性或弱碱性、芳香族的氨基酸残基在N端位置的多肽可能具有更高的XO抑制活性。
6 结 语
现有痛风药物有很多副作用。天然活性物质的提取成本极高,限制了其工业化应用,开发食品来源的、新型的、低毒副作用的降尿酸活性物质具有重要的意义。根据其结构共性,研究者在开发一种新的XO肽类抑制剂时可着重分离纯化小分子、疏水性、中性或弱碱性多肽,这样更容易得到XO抑制率高的肽段。因此,研究此类抑制剂的结构共性,可为研究者发现新的XO肽类抑制剂提供方向。这类抑制剂摆脱了药物有副作用的缺点,更加安全健康,可作为保健食品提供给消费者。目前XO肽类抑制剂的筛选与制备多使用分离纯化的方法,且大多停留在实验室研究阶段。基于生物信息学,QSAR及分子对接等方法的筛选与制备可以为大幅度提高生产效率提供技术支撑,这些新方法可给研究者提供新的研究思路,这也将是未来的研究热点之一;同时,通过动物模型和细胞模型准确解析XO肽类抑制剂的构效关系及活性机制,这对于功能性食品的开发具有重要意义;另外,XO肽类抑制剂在产品开发中应用时,苦味控制、水溶性提高、活性保持等关键技术有待进一步研究,这些方面也将是研究的热点。

