烤牛肉中碳点与消化蛋白酶相互作用机制
柳康静,宋玉昆,王海涛,乔凤至,侯 率,谭明乾*
(大连工业大学食品学院,食品交叉科学研究院,国家海洋食品工程技术研究中心,海洋食品精深加工协同创新中心,辽宁 大连 116034)
纳米粒子具有较小的体积、较高的比表面积,被广泛应用于食品安全评价、食品加工、食品包装和营养输送等各个领域。纳米粒子可以通过皮肤、呼吸道和胃肠道进入富含生物大分子的组织液、淋巴和血液中,因此它们不可避免地会与体液内蛋白质、脂类、多糖等生物大分子发生相互作用。
烤牛肉味道鲜美,深受人们喜爱。研究人员在烤牛肉中发现了由加工诱导产生的内源性碳点(carbon dots,CDs)。烤牛肉被食用后,其中的CDs首先在口腔中与唾液发生短暂的相互作用后,通过食道进入pH值为2~3的胃部,胃内为强酸性环境,含有胃蛋白酶等消化酶,牛肉CDs的存在会与胃中的胃蛋白酶发生相互作用。随后,CDs通过幽门括约肌进入pH值为6~7的小肠,同样会与肠道胰蛋白酶发生相互作用。有研究表明外源性纳米粒子可以与消化蛋白酶发生相互作用,进而影响酶活性,Sun Yujing等报道了纳米二氧化钛与胃蛋白酶在模拟胃液中的相互作用,随着纳米粒子浓度的增加,胃蛋白酶的固有荧光被猝灭,吸收峰减弱,表明二氧化钛纳米粒子可以与胃蛋白酶发生相互作用,导致芳香族氨基酸残基微环境发生变化。Wang Yihui等的研究证明聚苯乙烯纳米粒子可以与3种消化酶(胃蛋白酶、-淀粉酶和胰蛋白酶)发生相互作用,热力学实验结果显示相互作用主要由范德华力和氢键驱动。然而,目前对于食品加工过程产生的内源性纳米粒子与消化蛋白酶的相互作用及其对人类健康的直接和间接影响仍然知之甚少。
本研究首先从280 ℃条件下的烤牛肉中分离出CDs,利用透射电子显微镜观察CDs的形貌和粒径,通过体外模拟消化实验研究烤牛肉CDs进入模拟人体口腔、胃和小肠内的消化过程;然后利用荧光光谱和同步荧光光谱探究烤牛肉CDs与消化酶之间相互作用的荧光猝灭机制,接着通过紫外-可见光谱和荧光寿命分析进一步验证烤牛肉CDs与消化酶相互作用的荧光猝灭机制,再利用傅里叶变换红外光谱、Zeta电位和荧光热力学分析研究烤牛肉CDs与消化酶的作用方式;最后通过酶活力测定和酪蛋白水解度分析探究CDs对消化酶活性的影响,以期为阐明CDs与消化蛋白酶的结合机制提供参考。
1 材料与方法
1.1 材料与试剂
牛肉 大连甘井子区仟和农贸市场;胃蛋白酶和胰蛋白酶 美国Sigma公司;人工唾液、胃液和小肠液上海源业生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
UV230II半制备高效液相色谱仪 大连依利特分析仪器有限公司;JEM-2100透射电子显微镜 日本电子株式会社;J-1500圆二色光谱仪 日本分光株式会社;F-2700荧光分光光度计 日本日立有限公司;Lambda 35紫外-可见光谱仪、Frontier傅里叶变换红外光谱仪美国珀金埃尔默股份有限公司;FLS980稳态/瞬态荧光光谱仪 英国爱丁堡仪器公司;DT-1202纳米激光粒度电位分析仪 美国分散科技公司。
1.3 方法
1.3.1 烤牛肉CDs的制备
烤牛肉中CDs的制备方法参考本课题组前期研究方法进行了改进。取新鲜牛肉500 g,切碎制成牛肉饼放入烤箱,280 ℃烘烤30 min,待烤牛肉降至室温后,浸泡于1 000 mL乙醇中,利用磁力搅拌12 h,过滤除沉淀,滤液在60 ℃、60 r/min条件下蒸发除乙醇,再用50 mL超纯水重溶。然后使用150 mL三氯甲烷充分振荡,萃取3 次脱脂,收集上层水相部分10 000 r/min离心10 min后,使用旋转蒸发仪蒸发浓缩至10 mL。浓缩液过0.22 μm的滤膜后使用半制备ODS-BP色谱柱纯化,以10%甲醇-水溶液作为流动相,流速18 mL/min,荧光检测器激发波长为380 nm,发射波长为400 nm,收集洗脱液,蒸发浓缩后冷冻干燥,得到烤牛肉CDs粉末,于-20 ℃储存备用,采用透射电子显微镜对CDs的形貌和粒径分布进行观察和分析,加速电压为60 kV,放大倍数为300 000 倍,通过Image J 软件计算CDs粒径。
1.3.2 体外模拟消化分析
参考本课题组前期报道,配制1h10mol/L烤牛肉CDs溶液,取3 mL样品溶液加至3 mL人工唾液中,使用1 mol/L NaOH溶液调节pH值至6.0,37 ℃恒温水浴振荡5 min,然后向样品-唾液混合液中加入7.5 mL人工胃液,使用1 mol/L HCl溶液调节pH值至2.0,37 ℃恒温水浴振荡2 h,最后向样品-唾液-胃液混合液中加入11.25 mL人工小肠液,使用1 mol/L NaOH溶液调节pH值至7.0,37 ℃恒温水浴振荡2 h。对照组向混合液中加同体积去离子水,分别测定上述各样品组溶液荧光强度。荧光猝灭率按式(1)计算。

1.3.3 荧光光谱分析
分别配制1h10mol/L胃蛋白酶和胰蛋白酶溶液,加入不同浓度的CDs溶液混合,使CDs的终浓度分别为0、2h10、4h10、6h10、8h10、10h10、12h10mol/L,在25 ℃、激发波长为280 nm的条件下进行荧光光谱扫描,测定消化蛋白酶的荧光强度。根据Stern-Volmer方程(式(2))计算相互作用的猝灭常数。

式中:和分别为无CDs和有CDs时消化蛋白酶的荧光强度;为Stern-Volmer猝灭常数;[]为CDs的浓度/(mol/L);为双分子猝灭速率常数,生物分子的最大扩散速率常数为2h10mol/(Lgs);为在无猝灭剂情况下消化蛋白酶的平均荧光寿命,取生物大分子的值,为10 ns。
1.3.4 同步荧光光谱分析
扫描激发波长为265~280 nm时斯托克斯位移(Δ)每移动15 nm对应的发射光谱,分析酪氨酸残基所处微环境的变化,同样扫描激发波长为220~280 nm时Δ每移动60 nm对应的发射光谱,考察色氨酸残基所处微环境的变化。
1.3.5 紫外-可见吸收光谱分析
采用紫外-可见吸收光谱仪对溶液紫外-可见吸收光谱进行扫描,使用去离子水校零,扫描波段设置为200~700 nm。
1.3.6 荧光寿命分析
采用稳态/瞬态荧光光谱仪对溶液荧光寿命进行测定,激光光源发射波长320 nm,使用多指数运算拟合并通过式(3)计算CDs的荧光寿命()。

式中:τ为时间分辨衰变寿命/ns;A为τ的贡献百分比/%。
1.3.7 傅里叶变换红外光谱分析
将溴化钾(KBr)放入马弗炉中加热4 h(350 ℃),移至干燥皿中备用。称取100 mg KBr于研钵中充分研磨,放入压片机下压3 min(20 MPa),扫描作为空白背景,取1 mg样品粉末和100 mg KBr充分混合,重复上述操作压片,扫描得到样品傅里叶红外光谱。
1.3.8 烤牛肉CDs与消化蛋白酶相互作用的Zeta电位分析
配制浓度为1h10mol/L的胃蛋白酶和胰蛋白酶溶液,加入CDs使其终浓度分别为0、1h10、1h10、1h10mol/L和1h10mol/L,采用纳米激光粒度电位分析仪对CDs与消化蛋白酶相互作用前后的Zeta电位进行测定。
1.3.9 烤牛肉CDs与消化蛋白酶相互作用的热力学分析
采用式(4)计算结合常数()和结合位点数(),截距代表lg,斜率代表。

式中:为CDs与消化蛋白酶相互作用的荧光强度;[]为CDs的浓度/(mol/L)。
若在研究温度范围内焓变(Δ)保持不变,则根据范特霍夫方程(式(5))可以计算出焓变(Δ)和熵变(Δ)。

式中:为理想气体常数/(J/(molgK));为温度/K。
通过Δ和Δ计算出不同温度下样品的吉布斯自由能(Δ)(式(6))。

1.3.10 烤牛肉CDs与消化蛋白酶相互作用的圆二色光谱分析
配制浓度为1h10mol/L的胃蛋白酶和胰蛋白酶溶液,加入CDs使其终浓度分别为0、1h10、1h10、1h10mol/L,在室温下记录胃蛋白酶和胰蛋白酶的信号强度,通过Yang’s方程计算胃蛋白酶和胰蛋白酶的二级结构相对含量。
1.3.11 烤牛肉CDs与消化蛋白酶相互作用的酶活力分析
配制浓度为1h10mol/L的胃蛋白酶和胰蛋白酶溶液,分别加入不同浓度CDs,使CDs终浓度分别为0(对照)、1h10、1h10、1h10mol/L和1h10mol/L,37 ℃水浴5 min,分别使用胃蛋白酶和胰蛋白酶活力试剂盒对酶活力进行测定。
1.3.12 烤牛肉CDs与消化蛋白酶相互作用对酪蛋白水解度的影响分析
消化蛋白酶与CDs相互作用对酪蛋白水解度的影响实验参照Cao Xiaoqiong等的方法,以酪蛋白在体外消化过程中的水解度来评价消化蛋白酶与CDs相互作用对酶活力的影响。
1.4 数据处理与分析
用平均值±标准差表示实验数据,显著性分析使用SPSS 19.0软件中单因素方差分析法进行(以<0.05表示差异显著),使用Origin 8.5软件作图。
2 结果与分析
2.1 烤牛肉CDs的形貌和粒径
从280 ℃下烤制30 min的牛肉中分离纯化出CDs,通过透射电子显微镜观察CDs的形貌和粒径,如图1A所示,CDs呈球形,分散性良好,粒径在1.5~4.0 nm范围内呈正态分布(图1B),平均粒径为(2.70±0.06)nm,与之前的研究结果相似。

图1 CDs的透射电子显微镜图像(A)和粒径分布直方图(B)Fig.1 Transmission electron microscope image of CDs (A) and size distribution of CDs (B)
2.2 烤牛肉CDs的体外模拟消化分析结果
烤牛肉被食用后,CDs会伴随烤牛肉进入消化系统,因此探究烤牛肉CDs的消化过程对于阐明其在体内的分布情况非常有意义。图2A为模拟消化步骤示意图,使用人工唾液、胃液和肠液分别模拟CDs进入人体后在口腔、胃和小肠内的消化过程。如图2B所示,向CDs溶液中加入人工唾液,37 ℃孵育5 min后,与对照组相比,荧光强度仅下降(0.36±0.65)%,说明唾液对CDs影响很小。继续向混合液中加入人工胃液,调节pH值至2.0后37 ℃孵育2 h,此时酸性环境使唾液失活,CDs仅受人工胃液的影响,与对照组相比,荧光强度下降了(25.03±0.94)%,说明胃液对CDs的荧光强度有显著的抑制作用。最后,加入人工肠液并调pH值至7.0后37 ℃孵育2 h,荧光强度下降了(6.29±0.46)%,荧光强度稍有恢复,可能是由pH值的变化或消化液对CDs表面官能团的消化作用引起的。Wang Yihui等对雪花啤酒中的CDs进行了体外模拟消化研究,结果显示CDs的荧光强度在人工唾液中猝灭7.7%,胃液中猝灭65.2%,肠液中猝灭4.6%,消化后仍可见荧光信号。

图2 CDs体外模拟消化过程的示意图(A)和模拟唾液、胃液和肠液的消化过程对CDs荧光强度的影响(B)Fig.2 Schematic diagram of in vitro digestion procedure of CDs (A)and effect of simulated saliva juice, gastric juice and small intestinal juice on the fluorescence intensity of CDs (B)
2.3 烤牛肉CDs的荧光光谱分析结果
从上述体外模拟消化实验结果可以看出,胃液和肠液对CDs的荧光强度影响最大,胃蛋白酶和胰蛋白酶是食物消化过程中不可或缺的消化蛋白酶,故对CDs与两种蛋白酶的相互作用进行荧光光谱分析。如图3A、C所示,向胃蛋白酶和胰蛋白酶溶液中加入CDs后,胃蛋白酶和胰蛋白酶的固有荧光被猝灭,随着CDs浓度的增加(0~12.0h10mol/L),二者的荧光强度呈现浓度依赖性降低;图3B和图3D分别为CDs对胃蛋白酶和胰蛋白酶的Stern-Volmer方程曲线,可见曲线存在较好的线性关系,说明在此条件下有且仅有一种猝灭机制。一般来说,分子间相互作用的荧光猝灭机制主要包括静态猝灭和动态猝灭。静态猝灭是由荧光团和猝灭剂之间相互作用形成非荧光基态络合物所引起,动态猝灭则由激发态寿命期间荧光团与猝灭剂之间产生的碰撞所引起。通常情况下,一般认为当双分子猝灭速率常数远大于生物分子的最大扩散速率常数(2h10mol/(Lgs))时,即为静态猝灭。通过计算得出CDs与胰蛋白酶和胃蛋白酶相互作用的双分子猝灭速率常数分别为2.0h10mol/(Lgs)和1.99h10mol/(Lgs),大于生物分子的最大扩散速率常数,因此CDs与胰蛋白酶和胃蛋白酶之间相互作用的猝灭方式为静态猝灭。

图3 CDs对胃蛋白酶(A)和胰蛋白酶(C)的荧光猝灭光谱图以及对胃蛋白酶(B)和胰蛋白酶(D)的Stern-Volmer方程线性关系Fig.3 Fluorescence quenching spectra of pepsin (A) and trypsin (C) byCDs and Stern-Volmer curves of CDs versus pepsin (B) and trypsin (D)
2.4 烤牛肉CDs的同步荧光光谱分析结果
同步荧光光谱是一种通过控制激发波长和发射波长之间保持固定的波长间隔来探究荧光基团发色团周围分子微环境变化的技术。胃蛋白酶和胰蛋白酶结构中色氨酸和酪氨酸残基是主要的内在荧光团,图4为不同浓度的CDs与胃蛋白酶、胰蛋白酶相互作用在固定波长间隔分别为Δ=15 nm和Δ=60 nm的同步荧光光谱。如图4A、C所示,随着CDs浓度的增加,胃蛋白酶和胰蛋白酶的荧光强度呈现浓度依赖性降低,发射峰位置未出现变化,说明CDs与胃蛋白酶和胰蛋白酶的相互作用对色氨酸残基周围的微环境几乎没有影响;如图4B和图4D所示,随着CDs浓度的增加,发射峰位置略有红移,说明CDs的引入会使胃蛋白酶和胰蛋白酶酪氨酸残基周围的疏水性降低。结果与Sun Yujing等对食品级二氧化钛纳米粒子与胃蛋白酶在模拟胃液中相互作用的同步荧光光谱分析结果一致,二氧化钛纳米粒子的加入使胃蛋白酶荧光强度显著降低,固定波长间隔为Δ=60 nm时,最大发射波长从274 nm轻微移动到276 nm,酪氨酸残基周围的疏水性降低。


图4 CDs对胃蛋白酶在Δλ=60 nm(A)、Δλ=15 nm(B)和胰蛋白酶Δλ=60 nm(C)、Δλ=15 nm(D)下同步荧光光谱的影响Fig.4 Effect of different concentrations of CDs on the synchronous fluorescence spectra of pepsin at Δλ = 60 nm (A) and Δλ = 15 nm (B), and trypsin at Δλ = 60 nm (C) and Δλ = 15 nm (D)
2.5 烤牛肉CDs的紫外-可见光谱和荧光寿命分析结果
如图5A所示,胃蛋白酶-CDs复合物与胃蛋白酶吸收光谱不一致,无重叠,证明CDs与胃蛋白酶之间的猝灭方式为静态猝灭,与Stern-Volmer方程得出的结论一致。在图5B中可以观察到同样的结果,胰蛋白酶-CDs复合物与胰蛋白酶吸收光谱不一致,因此猝灭方式也为静态猝灭。如图5C和图5D所示,采用时间分辨荧光光谱法测定胃蛋白酶、胃蛋白酶-CDs复合物、胰蛋白酶和胰蛋白酶-CDs复合物的荧光寿命,胃蛋白酶与CDs相互作用前后荧光寿命分别为3.95 ns和4.09 ns,胰蛋白酶与CDs相互作用前后荧光寿命分别为4.05和4.71 ns,荧光寿命变化不明显,进一步证明CDs与胃蛋白酶和胰蛋白酶相互作用的猝灭机制为静态猝灭。
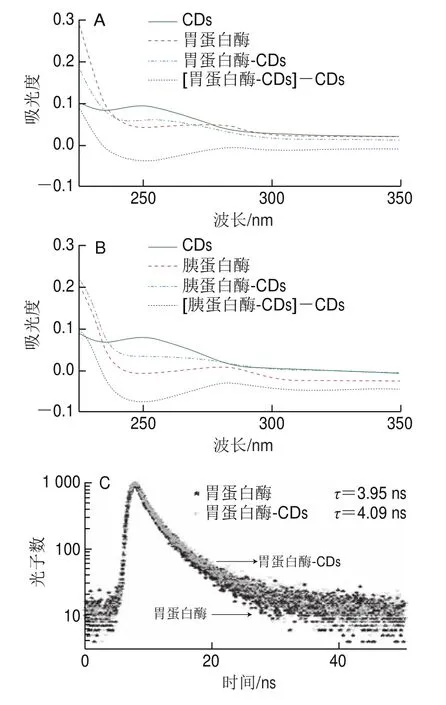

图5 CDs与胃蛋白酶(A)和胰蛋白酶(B)相互作用的紫外-可见光谱图以及与胃蛋白酶(C)和胰蛋白酶(D)相互作用的荧光寿命图谱Fig.5 UV-Vis absorption spectra of pepsin (A) and trypsin (B)interacting with CDs, and fluorescence lifetime decay curves of pepsin (C)and trypsin (D) interacting with CDs
2.6 烤牛肉CDs的傅里叶变换红外光谱和Zeta电位分析结果
图6A和图6B分别为CDs与胃蛋白酶和胰蛋白酶相互作用的傅里叶变换红外光谱图,3 338~3 380 cm附近的吸收峰归因于—OH或—NH伸缩振动,2 904~2 931 cm附近的吸收峰为—CH和—CH振动所引起,1 668 cm附近的峰是由酰胺I带C=O振动引起的,1 519 cm附近的峰归因于酰胺II带的NüH振动,酰胺III带CüN基团吸收峰位于1 247~1 334 cm附近。在CDs与胃蛋白酶相互作用后,C=O峰从1 785 cm移动到1 766 cm,CüN峰从1 247 cm移动1 230 cm,而CDs与胰蛋白酶相互作用在1 601 cm处出现了新的特征峰,吸收带的转移和新特征峰的出现说明CDs与胃蛋白酶和胰蛋白酶相互作用是通过表面络合吸附或静电相互作用实现的。
通过监测暴露于不同浓度CDs与胃蛋白酶和胰蛋白酶相互作用后的Zeta电位变化可以确定二者相互作用后表面电荷的变化。如图6C、D所示,随着CDs浓度从0增加到1.0h10mol/L,胃蛋白酶体系的Zeta电位从(-13.39±0.29)mV增加到(-7.09±1.41)mV,胰蛋白酶体系的Zeta电位从(-12.44±0.58)mV增加到(-8.90±0.59)mV,实验结果表明CDs与胃蛋白酶和胰蛋白酶相互作用使Zeta电位增加,Gunawan等报道,表面电荷是影响蛋白质与CDs结合的关键决定因素之一;因此,推测静电相互作用参与了CDs与消化蛋白酶的结合。


图6 CDs与胃蛋白酶(A)和胰蛋白酶(B)相互作用的傅里叶变换红外光谱以及与胃蛋白酶(C)和胰蛋白酶(D)相互作用的Zeta电位Fig.6 FTIR spectra of pepsin (A) and trypsin (B) interacting with CDs and zeta potential of pepsin (C) and trypsin (D) interacting with CDs
2.7 烤牛肉CDs与消化蛋白酶相互作用的热力学分析结果
图7A和图7B分别为烤牛肉CDs与胃蛋白酶和胰蛋白酶相互作用相对荧光强度与CDs浓度的双对数关系曲线,通过截距计算出结合常数(),斜率代表结合位点数(),图7C和图7D分别为通过的自然对数和温度的倒数作出的范特霍夫曲线,其中通过斜率计算出相互作用中的焓变(Δ),通过截距计算出熵变(Δ),如表1和表2所示,通过计算可得出吉布斯自由能(Δ)。当温度从298 K增加到318 K时,CDs与胃蛋白酶相互作用的从7.08h10L/mol增加至7.49h10L/mol,与胰蛋白酶相互作用的从1.59h10L/mol增加至7.18h10L/mol,说明温度的升高有利于CDs与胃蛋白酶和胰蛋白酶相互作用的稳定性;胃蛋白酶体系下分别从0.83增加到1.06,胰蛋白酶体系下从0.69增加到1.03,说明随着温度的升高亲和力逐渐增加,Δ和Δ均为正值,计算出Δ为负值,说明CDs与胃蛋白酶和胰蛋白酶结合均主要由疏水相互作用介导的,这与Chakraborty等研究的血红蛋白与碳量子点结合的驱动力结果一致,此外,研究表明热加工三文鱼的CDs与胃蛋白酶的相互作用中氢键为主要驱动力,与胰蛋白酶的相互作用主要由静电和疏水相互作用介导。可以推断,相互作用的驱动力类型主要取决于CDs和蛋白质的性质。

图7 CDs与胃蛋白酶(A)和胰蛋白酶(B)相互作用的lg((F0-F)/F)与lg[Q]之间的线性关系以及CDs与胃蛋白酶(C)和胰蛋白酶(D)相互作用的范特霍夫曲线-结合常数的自然对数与温度倒数的线性关系Fig.7 Linear relationship between lg((F0−F)/F) and lg[Q] for interaction of pepsin (A) and trypsin (B) with CDs, and van’t Hoff plot of natural logarithm of equilibrium constant versus inverse temperature for interaction of pepsin (C) and trypsin (D) with CDs

表1 胃蛋白酶与CDs疏水相互作用热力学参数Table 1 Thermodynamic parameters for interaction of trypsin with CDs

表2 胰蛋白酶与CDs疏水相互作用热力学参数Table 2 Thermodynamic parameters for interaction of trypsin with CDs
2.8 烤牛肉CDs与消化蛋白酶相互作用的圆二色光谱分析结果
圆二色光谱法是一种研究稀溶液中蛋白质构象的方法,研究蛋白质二级结构的变化有利于更好地探究蛋白质与生物分子相互作用。图8A为不同浓度CDs对胃蛋白酶圆二色光谱的影响,胃蛋白酶在大约200 nm波长处存在强负峰,说明胃蛋白酶二级结构中主要由-折叠构象组成,以无序结构为主。随着CDs浓度的增加,出峰位置未发生变化,但圆二色光谱信号强度逐渐降低。使用分析软件对胃蛋白酶的二级结构进行分析(图8C),随着CDs浓度的增加(1h10~1h??mol/L),-折叠相对含量从(51.20±1.84)%减小到(50.76±0.57)%,-转角相对含量从(7.56±1.67)%增加到(8.60±1.37)%,这说明CDs与胃蛋白酶的结合会导致胃蛋白酶二级结构的变化。图8B为不同浓度CDs对胰蛋白酶圆二色光谱的影响,胰蛋白酶208 nm和222 nm波长处有两个负峰,这是典型的-螺旋n-π*和π-π*结构。随着CDs浓度的增加(1h10~1h10mol/L),出峰位置出现略微红移,圆二色光谱信号强度逐渐降低。使用分析软件对胰蛋白酶的二级结构进行分析(图8D),-螺旋相对含量从(13.70±1.01)%减小到(11.00±0.69)%,-折叠相对含量从(25.93±2.96)%增加到(31.83±0.46)%,-转角相对含量从(19.63±1.73)%减小到(17.60±0.35)%,说明CDs与胰蛋白酶的结合会导致胰蛋白酶二级结构的变化。Zhao Xingchen等研究表明,在与碳纳米管相互作用时,-糜蛋白酶的二级结构发生轻微的改变,-螺旋含量降低约3%,-折叠含量增加约7%。Wang Yihui等发现与淀粉纳米粒子相互作用后,胃蛋白酶-折叠含量略有增加,淀粉纳米粒子改变了胃蛋白酶的二级结构,导致肽的部分展开。


图8 CDs与胃蛋白酶(A)和胰蛋白酶(B)相互作用的圆二色光谱图以及胃蛋白酶(C)和胰蛋白酶(D)的α-螺旋、β-折叠和β-转角变化情况Fig.8 Circular dichroism spectra of pepsin (A) and trypsin (B)interacting with CDs and α-helix, β-sheet and β-turn of pepsin-CDs (C)and trypsin-CDs (D)
2.9 烤牛肉CDs与消化蛋白酶相互作用的酶活力分析结果
蛋白质二级结构的变化可能会使其生物活性和功能也随之改变。以单一胃蛋白酶和胰蛋白酶的酶活力作为对照,随着CDs浓度从0增加到1.0h10mol/L,胃蛋白酶和胰蛋白酶的相对活力均呈现浓度依赖性减小,胃蛋白酶相对活力从100%降低到(61.11±7.36)%(图9A),胰蛋白酶相对活力从100%降低到(51.28±3.62)%(图9B),结果表明,CDs对胃蛋白酶和胰蛋白酶的活力均有一定影响,CDs浓度越大,影响越显著。Sun Yujing等研究表明随着二氧化钛纳米粒子浓度的增加,胃蛋白酶活性逐渐降低。Zhang Rui等发现炭黑与溶菌酶和超氧化物歧化酶相互作用可以改变酶的二级结构,导致酶活性降低。综上,CDs与消化蛋白酶相互作用后酶活力的降低与消化蛋白酶的二级结构改变相关。

图9 不同浓度CDs对胃蛋白酶(A)和胰蛋白酶(B)相对活力的影响Fig.9 Activities of pepsin (A) and trypsin (B) in different concentrations of CDs
2.10 烤牛肉CDs与消化蛋白酶相互作用对酪蛋白水解度的影响
由图10A可知,随着时间的推移,酪蛋白在胃液中逐渐被水解,当在体系中加入CDs后,酪蛋白的水解度明显减小,说明胃蛋白酶-CDs复合物的形成可以降低消化蛋白酶活力进而抑制酪蛋白的水解;从图10B中也可以看出同样的结果,说明胰蛋白酶-CDs复合物的形成同样可以降低消化蛋白酶活力。人胃肠道中不同种类的消化蛋白酶对蛋白质链中氨基酸之间的肽键具有不同的亲和力,胃蛋白酶会裂解芳香氨基酸旁边的肽键,而胰蛋白酶会裂解碱性氨基酸旁边的键,因此,CDs与消化蛋白酶的相互作用可能改变了消化酶裂解相应键的性质,从而改变了它们对酪蛋白水解的敏感性。

图10 CDs对胃液(A)和肠液(B)中酪蛋白水解度的影响Fig.10 Influence of CDs on hydrolysis degree of casein in simulated gastric fluid (A) and small intestine fluid (B)
3 结 论
本研究结果表明,烤牛肉CDs以静态猝灭的方式猝灭胃蛋白酶和胰蛋白酶的固有荧光,酪氨酸参与了二者的相互作用,红外光谱和Zeta电位的分析结果进一步证明了二者的相互作用,CDs与胃蛋白酶和胰蛋白酶结合方式均为静电或疏水相互作用,并且结合后会影响其二级结构,从而降低胃蛋白酶和胰蛋白酶的活力。探索CDs与蛋白质的相互作用对于预测蛋白质对CDs的吸附和CDs在胃肠道系统中的行为具有重要意义,本研究结果为内源性CDs与消化蛋白酶相互作用提供了实验依据,为评估CDs的安全性提供了参考。

