幽门螺杆菌阳性萎缩性胃炎大鼠生物信息分析及安胃汤影响的研究
徐杉 周瑞东 龚纯 蒙毅 张帆 郑景辉 唐友明 朱永苹










摘要 目的:基于生物醫学大数据筛选幽门螺杆菌(Hp)相关性慢性萎缩性胃炎的关键基因,探索其发病机制及安胃汤对其的影响。方法:从数据库Gene Expression Omnibus(GEO)下载Hp相关性慢性萎缩性胃炎相关芯片数据,利用GEO2R软件筛选出Hp相关性慢性萎缩性胃炎差异基因,进行生物信息学分析,根据蛋白参与通路数量确定核心蛋白,建立Hp阳性慢性萎缩性胃炎大鼠模型,用PCR和蛋白质印迹法(Western Blotting)进行检测并观察安胃汤对其表达的影响。结果:经过检索分析GSE13873和GSE27411系列芯片数据被纳入,取2个芯片交集的20个差异基因进行生物信息学分析,发现载脂蛋白A1、CD36、囊性纤维化穿膜传导调节蛋白(CFTR)可能是信号通路的核心蛋白。Western Blotting及PCR结果显示Hp相关性慢性萎缩性胃炎大鼠胃组织中,CD36蛋白表达下调(P<0.05),载脂蛋白A1和CFTR蛋白表达上调(P<0.05);与模型组比较,实验观察高剂量组、实验观察中剂量组和实验观察低剂量组胃组织中CD36蛋白表达上调,载脂蛋白A1和CFTR表达下调(P<0.05),其与Hp相关性慢性萎缩性胃炎发病关系密切。结论:通过对GEO中Hp相关性慢性萎缩性胃炎芯片生物信息学分析结合Western Blotting及PCR进一步的验证发现载脂蛋白A1、CD36、CFTR作为信号通路的核心蛋白实验结果与生物信息学分析结果一致。
关键词 慢性萎缩性胃炎;幽门螺旋杆菌;生物信息学;基因芯片;安胃汤;载脂蛋白A1;CD36;囊性纤维化穿膜传导调节蛋白
Bioinformatics Analysis of Helicobacter pylori-Positive Rats with Atrophic Gastritis and the Effect of Anwei Decoction
XU Shan1,2,ZHOU Ruidong1,GONG Chun1,MENG Yi1,ZHANG Fan1,ZHENG Jinghui1,TANG Youming3,ZHU Yongping3
(1 Guangxi University of Chinese Medicine,Nanning 530200,China; 2 Affiliated Hospital of Traditional Chinese Medicine of Hubei Public Security University, Jingzhou 434300,China; 3 Department of Gastroenterology,Ruikang Hospital,Guangxi University of Chinese Medicine,Nanning 530011,China)
Abstract Objective:To screen key genes of Helicobacter pylori(Hp)-related chronic atrophic gastritis based on biomedical big data and explore its pathogenesis and the influence of Anwei Decoction.Methods:The chip data of Hp-related chronic atrophic gastritis were downloaded from Gene Expression Omnibus(GEO),and the differential genes of HP-related chronic atrophic gastritis were screened out by GEO2R.Bioinformatics analysis was conducted,and the core proteins were determined according to the number of protein-participating pathways.The Hp(+) chronic atrophic gastritis model was induced in rats.PCR and Western blot were used to detect the effect of Anwei Decoction on the expression.Results:After retrieval and analysis of GSE13873 and GSE27411 series chip data,20 common differential genes of the two chips were taken for bioinformatics analysis,and the results showed that apolipoprotein A1(APOA1),CD36,and cystic fibrosis transmembrane conductance regulator(CFTR) might be the core proteins of the signaling pathway.Western blot and PCR results showed that the expression of CD36 protein was down-regulated(P<0.05),and the expression of APOA1 and CFTR was up-regulated(P<0.05) in the gastric tissues of rats with HP-related chronic atrophic gastritis.Compared with the model group,the high-,medium-and low-dose Anwei Decoction groups showed up-regulated expression of CD36 and down-regulated expression of APOA1 and CFTR(P<0.05),which was closely related to the incidence of HP-related chronic atrophic gastritis.Conclusion:As revealed by the bioinformatics analysis of HP-related chronic atrophic gastritis in GEO microarray and verification by Western blot and PCR,the experimental results of APOA1,CD36,and CFTR as the core proteins of the signaling pathway were consistent with the results of bioinformatics analysis.
Keywords Chronic atrophic gastritis; Helicobacter pylori; Bioinformatics; Gene chip; Anwei Decoction; APOA1; CD36; Cystic fibrosis transmembrane conductance regulator
中图分类号:R256;R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.10.006
慢性萎缩性胃炎(Chronic Atrophic Gastritis,CAG)是由于胃黏膜萎缩变薄,胃腺体减少,导致胃酸及胃蛋白酶分泌减少的慢性病变[1]。近年的研究数据显示,全球大多数国家幽门螺旋杆菌(Helicobacter Pylori,Hp)感染率仍较高,约有33%成年人存在Hp感染[2]。由中华医学会消化内镜学分会进行的一项横断面调查显示,CAG是我国最常见的一种慢性胃炎[3]。CAG病因与吸烟、酗酒、药物及Hp感染等因素有关,Hp是主要危险因素,可促进CAG患者胃黏膜癌变[4]。根除Hp可减少胃黏膜炎症、组织学损害的进展、消化性溃疡的复发,以及患胃癌的风险[5]。安胃汤为全国名老中医林沛湘教授的经验方,寒热并用,活血行气,畅通气机,治疗慢性胃溃疡疗效确切[6-7]。本研究利用高通量基因表达数据库(Gene Expression Omnibus,GEO)中的基因芯片数据对,挖掘Hp感染CAG芯片数据的基础上进行了分子生物学验证。
1 材料与方法
1.1 材料
1.1.1 数据资料来源 生物信息学资料来源从GEO(https://www.ncbi.nlm.nih.gov/geo/)数据库中检索所有与Hp阳性相关的CAG芯片数据。物种限定为哺乳动物,同时分组中含有Hp阳性的CAG与Hp阳性正常胃黏膜进行比较的表达谱的数据系列。
1.1.2 动物 SD雄性大鼠,4周龄,体质量(100±20)g,72只,无特定病原体(Specific Pathogen Free,SPF)级,购于湖南莱克景达实验动物有限公司,实施地点在广西中医药大学实验动物中心,动物使用许可证号(SYXK桂2019-0001)。分笼饲养于广西中医药大学实验动物中心,环境为室温18~25 ℃、相对湿度50%~60%、人工12 h昼/夜循环照明。隔日更换垫料、清洗笼舍,大鼠自由摄食及饮水。动物福利伦理委员会批准(伦理审批号:DW20190310-045)。
1.1.3 Hp菌株 采用悉尼标准菌株(SSI),含有细胞毒素相关基因(CagA+)和空泡细胞毒素(VavA+)(美国MTCC公司,美国,菌株编号:ATCC43504)。将Hp接种于琼脂培养基(OXOID公司,美国,货号:CM0331),配成650 mL培养液,加30 mL脱纤维羊血,高压灭菌,在微需氧的环境(二氧化碳体积分数0.10,氧气体积分数0.05,氮气体积分数0.85)下37 ℃培养3 d备用。
1.1.4 药物 安胃汤:半夏13 g、黄连5 g、干姜5 g、乌药7 g、丹参15 g、百合20 g、白芍20 g、薏苡仁10 g、炙甘草5 g,饮片购自广西中医药大学附属瑞康医院门诊中药房。将以上药物饮片煎汁至1 g/mL备用,参照《药理实验方法学》[8]中人和动物体表面积比值剂量表,给药剂量按照体质量60 kg成人剂量的6.17倍计算为10.3 g/kg,作为中剂量,以正常剂量的0.5倍及2倍作为安胃汤低、高剂量,按以上3种剂量对滤液进行剂量调整。阿莫西林250 mg/粒(珠海联邦制药股份有限公司中山分公司,批号:9C050103),甲硝唑200 mg/片[远大医药(中国)有限公司,批号:190322],吲哚美辛25 mg/粒(山西云鹏制药有限公司,批号:D190101),碳酸氢钠片[上海玉瑞生物科技(安阳)有限公司,批号:181111],脱氧胆酸钠(北京索莱宝生物有限公司,货号:SLBZ6975),氨水(成都市科龙化工试剂厂,货号:2016040501)。
1.1.5 试剂与仪器 兔抗CD36抗体(abcam公司,英国,批号:GR243753-3);兔抗载脂蛋白A1抗体(abcam公司,英国,批號:GR3253377-4);兔抗囊性纤维化穿膜传导调节蛋白(Cystic Fibrosis Transmembrane Conductance Regulator,CFTR)抗体(abcam公司,英国,批号:GR3208838-1);兔抗GAPDH抗体(武汉三鹰生物技术有限公司,批号:00078427);特超敏ECL化学发光即用型底物(南京诺唯赞生物科技有限公司,批号:7E341E9);BCA蛋白定量试剂盒(南京诺唯赞生物科技有限公司,批号:14G08A460);SYBR qPCR Master Mix(南京诺唯赞生物科技有限公司,批号:7E092H6)、RT Super Mix for qPCR(南京诺唯赞生物科技有限公司,批号:7E020C6)、RNA-easy TM Isolation Reagent(南京诺唯赞生物科技有限公司,批号:7E303H9)均购自南京诺唯赞生物科技有限公司;胃幽门螺杆菌快速检测试纸(广州贝思奇诊断试剂有限公司,批号:201904136)。全波长多功能酶标仪(Tecan公司,瑞士,型号:Infinite M200 PRO);水平、垂直电泳、转膜装置(Bio-Rad公司,美国,型号:PROTEANi12IEF);Bio-RadImage-Lab凝胶成像分析系统(Bio-Rad公司,美国,型号:Chemidoc CD touch);荧光定量PCR仪(Roche公司,瑞士,型号:罗氏Light cycler 96)。
1.2 方法
1.2.1 生物信息学分析 通过GEO2R分析系统分析不同组织中基因的差异表达,通过在线交集分析软件(http://bioinformatics.psb.ugent.be/webtools/Venn/)荟萃查找相关3个芯片中相互共有的差异基因,通过David(https://david.ncifcrf.gov/)进行基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号转导通路分析,通过STRING10.0(http://www.string-db.org/)进行蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络分析[9]。
1.2.2 分组与模型制备 大鼠适应性喂养1周后,按照随机数字表法进行分组,正常对照组10只,造模组50只。参照唐旭东等[10]模型制备方法,予以2%阿莫西林+2.5%甲硝唑混合液灌胃3 d,6.6 mL/kg,1次/d;再以2%吲哚美辛溶液灌胃2 d,3.3 mL/kg,1次/d;最后以20%碳酸氢钠溶液灌胃,6.6 mL/kg,15 min后灌胃Hp菌悬液1 mL/次,浓度1×1012CFU/L,隔日1次,共6次。灌胃前后禁食12 h及4 h;Hp种植完成后正常饲养28 d再给予0.83%脱氧胆酸钠和0.05%氨水代替饮用水交替饮用,饥饱失常饮食,持续8周。模型成功标准:苏木精-伊红(Hematoxylin and Eosin,HE)染色病理检测大鼠胃黏膜固有层腺体减少并萎缩,快速尿素酶试验检测Hp阳性提示造模成功。造模成功后对造模大鼠按照随机数字表法分为实验观察高剂量组、实验观察中剂量组、实验观察低剂量组、模型对照组、阴性对照组,每组10只。
1.2.3 干预方法 实验观察高剂量组(安胃汤浓度20.6 g/kg)、实验观察中剂量组(安胃汤浓度10.3 g/kg)、实验观察低剂量组(安胃汤浓度5.15 g/kg)、模型对照组(常规饲养)、阴性对照组(等量生理盐水)共5组。灌胃干预4周,干预结束后予以麻醉处死取材。
1.2.4 检测指标与方法 1)快速尿素酶法检测Hp感染:将造模大鼠胃黏膜组织放入快速尿素酶检测的反应区域,以及大鼠胃黏膜组织细菌培养72 h,再行同样方法检测,5 min内观察反应区域颜色变化情况,试剂颜色由黄色转变为红色说明检测结果为阳性,提示Hp感染。2)蛋白质印迹法(Western Blotting)检测大鼠胃黏膜组织相关蛋白的表达:取冲洗后胃组织50 mg,加入RIPA(含蛋白酶和磷酸酶抑制剂),冰上研磨30 min,4 ℃、12 000×g離心15 min。取上清液,BCA法测定蛋白浓度,将各组浓度调至一致,加入上样缓冲液,100 ℃变性5 min。电泳(80 V,20 min,120 V,45 min),转膜(4 ℃,300 MA恒流,60 min),5%BSA室温封闭15 min,加入一抗CD36(1∶5 000)、CFTR(1∶5 000)、载脂蛋白A1(1∶5 000)4 ℃孵育过夜,TBST洗膜3次,每次10 min,加入二抗IgG(1∶10 000),室温摇床孵育1 h,TBST洗膜3次,每次10 min,最后用ECL化学发光剂显色,Bio-RadImage-Lab凝胶成像分析系统成像拍照,采用Image J软件进行分析。3)实时定量PCR(Real-time quantitative PCR)法检测大鼠胃黏膜组织相关mRNA的表达:使用RNA-easy TM Isolation Reagent试剂盒提取胃组织Total RNA,紫外分光光度计测RNA含量及纯度。每组计算1 μgRNA逆转录为cDNA。稀释后取5 μLcDNA进行Real-time quantitative PCR,以GAPDH为内参,反应体系20 μL。扩增条件为:95 ℃ 120 s;95 ℃ 15 s 55 ℃ 15 s 72 ℃ 60 s;95 ℃ 15 s 60 ℃ 60 s 95 ℃ 15 s;37 ℃ 30 s,40个循环。计算Ct值,以2-△△Ct计算目的基因的表达水平。
1.3 统计学方法 所有数据采用Graphpad Prism软件进行处理与分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD检验。以P<0.05为差异有统计学意义。
2 结果
2.1 生物信息学分析结果
2.1.1 芯片数据基本信息 检索发现GEO数据库中有19个系列与CAG相关,经筛选分析,有2个系列符合纳入要求,分别是GSE27411和GSE13873,其中GSE27411又分为胃窦组织和胃体黏膜两部分2组数据集分别有20 589个、45 101个有效基因探针。见表1。
2.1.2 分析的差异基因 结合2个GEO数据库芯片序列的2个系列的3组数据运用GEO2R分析系统,分析了基因在不同组织中的差异表达,GSE27411共筛选出2 981个差异基因,其中1 316个上调基因、1 665个下调基因;GSE13873共筛选出2 435个差异基因,其中1 002个上调基因、1 433个下调基因。并对3组数据进行了荟萃分析查找相互交集的差异基因,最终筛选到20个候选基因,其中3组芯片共表达的差异基因3个:APOA1、CLCA1和GPA33;芯片GSE27411(胃窦组织)和芯片GSE1387共表达差异基因有12个:AQP4、ATP4B、CFTR、CKB、CLDN2、CLDN7、CLPS、CD37、GAST、KCNE2、LPL、REG3G。芯片GSE27411(胃体黏膜)和芯片GSE13873共表达差异基因有5个:C3、CD36、CXCL13、LTF、UBD。见表2,图1~2。
2.1.3 差异基因GO富集分析
2.1.3.1 差异蛋白基因生物过程(Biological Processes,BP)分析 对本实验获得的20种差异表达蛋白基因进行BP分析发现,这些蛋白主要参与9种生物学过程,生物过程分析差异蛋白主要涉及胆固醇内流、三酰甘油分解代谢过程、免疫应答、胆固醇生物合成过程、磷脂代谢过程等。见表3。
2.1.3.2 差异蛋白基因细胞组分(Cellular Component,CC)分析 对本实验获得的20种差异表达蛋白基因进行分析发现,这些蛋白包含了5种细胞组分,均是细胞外区域或空间及脂蛋白成分。见表4。
2.1.3.3 差异蛋白基因分子功能(Molecular Function,MF)分析 对本实验获得的20种差异表达蛋白进行MF分析发现,差异蛋白参与了2类分子途径,分别是肝素结合、受体结合。见表5。
2.1.4 差异基因KEGG通路分析 结果发现差异“关键基因”主要分布在8条信号转导通路上。见表6。这些通路主要是和细胞的增殖、分化及胃酸、胆汁、胰腺的分泌,脂肪的消化和吸收有关。其中CD36基因分布在5条通路上,分别为脂肪的消化和吸收、PPAR通路、AMPK通路、吞噬体、造血细胞谱系。CFTR基因分布在4条通路上,分别为胃酸、胰液、膽汁的分泌、AMPK通路。载脂蛋白A1分布在2条信号转导通路上,分别为脂肪消化吸收和PPAR通路。见表6,图3。以上3个因子参与通路数量最多,故确定其为病理环节重要的“关键基因”。对信号转导通路分析发现PPAR通路和AMPK通路在细胞的分化中具有重要作用,故确定为主要的信号转导通路。这些基因和通路,在幽门螺旋杆菌感染导致CAG发病的过程中彼此有协同作用,都得到分子生物学验证。
2.1.5 差异PPI网络分析 交集后的20个差异基因共涉及20个节点,10条边。其中载脂蛋白A1、CD36、CFTR存在相互作用关系,并为PPI网络的中心节点。见图4。
2.2 分子生物学实验验证结果
2.2.1 Hp相关性CAG模型制备情况 快速尿素酶试验结果显示:造模组大鼠胃黏膜细菌培养后检测及直接检测试剂由黄色变为红色,说明试验结果为阳性,提示Hp感染成功。见图5。病理检测结果发现,造模组大鼠胃黏膜组织可见中性粒细胞、淋巴细胞浸润,固有腺体部分减少并萎缩,符合CAG的表现。见图6。
2.2.2 载脂蛋白A1、CD36、CFTRmRNA在CAG大鼠胃组织中的表达 实时定量PCR结果中显示:与正常对照组比较,模型对照组CD36表达下调(P<0.05),载脂蛋白A1和CFTR表达上调(P<0.05)。CD36和阴性对照组比较,在实验观察高剂量组、实验观察中剂量组和实验观察低剂量组胃组织中表达上调(P<0.05)。载脂蛋白A1和阴性对照组比较,在实验观察高剂量组、实验观察中剂量组和实验观察低剂量组表达下调(P<0.05)。与实验观察低剂量组比较,实验观察高剂量组表达下调(P<0.05)。CFTR和阴性对照组比较,在实验观察高剂量组、实验观察中剂量组和实验观察低剂量组表达下调(P<0.05)。见图7。
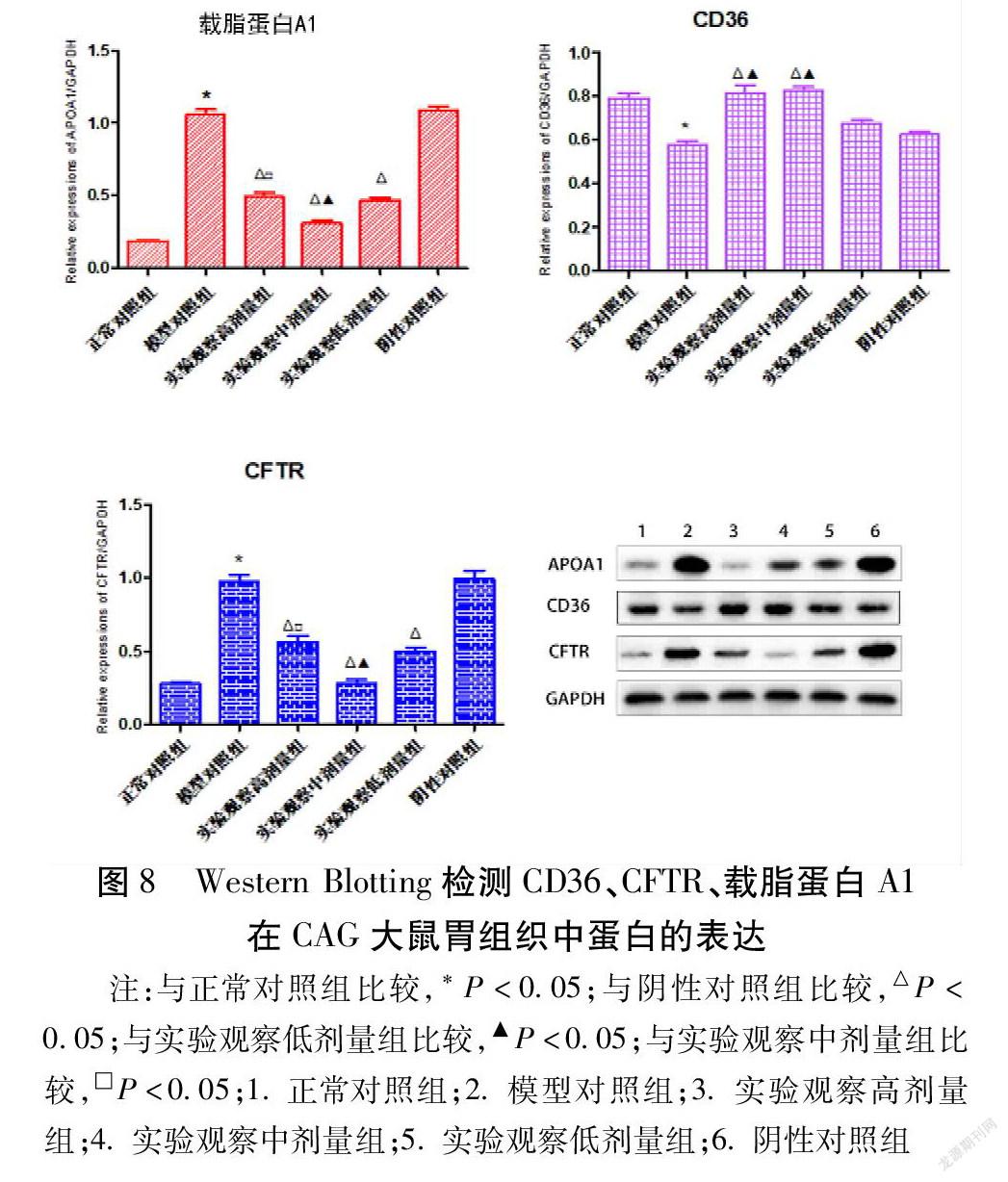
2.2.3 载脂蛋白A1、CD36、CFTR蛋白在CAG大鼠胃组织中的表达 与正常对照组比较,模型对照组CD36表达下调(P<0.05),载脂蛋白A1和CFTR表达上调(P<0.05)。CD36和阴性对照组比较,在实验观察高剂量组、实验观察中剂量组胃组织中表达上调(P<0.05)。与实验观察低剂量组比较,实验观察高、中剂量组表达上调(P<0.05)。载脂蛋白A1和阴性对照组比较,在实验观察高剂量组、实验观察中剂量组和实验观察低剂量组表达下调(P<0.05)。与实验观察中剂量组比较,实验观察高剂量组表达上调(P<0.05)。CFTR和阴性对照组比较,在实验观察高剂量组、实验观察中剂量组和实验观察低剂量组表达下调(P<0.05)。与实验观察中剂量组比较,实验观察高剂量组表达上调(P<0.05)。见图8。
3 讨论
CAG疾病常常反复发作,迁延难愈,在中医学中属于“胃脘痛”“痞证”等范畴,与肝脾密切有关[11]。安胃汤是已故名老中医林沛湘教授长期治疗慢性胃病总结的经验方。由《伤寒论》中“半夏泻心汤”加减而来,制定了“顺五脏、安胃腑”的治疗方法。本方中以制半夏为君药,具有“燥胃湿,益脾胃气,散结”之用;《伤寒论》中半夏用量为半升,参照仝小林等[12]研究中的换算单位约为48 g,在治疗萎缩性胃炎时临床常用剂量为10~15 g[13],故本方中半夏的用量为13 g。白芍柔肝健脾止痛,配以乌药疏肝解郁止痛,薏苡仁健脾除湿;少佐黄连泻火解毒,干姜温中逐寒,寒热同施,辛开苦降;丹参;凉血祛瘀,配合百合、炙甘草,则养津护胃,酸甘化阴以生津液。本方组方严谨,疏肝理脾,平调寒热,祛湿化瘀,主治寒热错杂、痰瘀内结之证。方中半夏具有抑制胃酸分泌、止吐、抗消化性溃疡、保护胃黏膜的现代药理学作用[14];丹参为调理血分要药,具有“一味丹参,功同四物”的美誉,周庆华和王红梅[15]研究显示丹参能够通过抑制胃酸分泌对胃黏膜损伤具有保护作用。临床研究都证实安胃汤加味治疗CAG具有较好的临床疗效,能有效改善患者的中医证候[16-17]。本研究的动物实验结果也显示,安胃汤干预治疗能有效改善CAG,能够改善CD36、CFTR、载脂蛋白A1在CAG胃组织中的表达。
本研究通过GEO数据库究筛选得到CAG差异表达的基因有20个,在对这20个差异表达基因的生物信息学分析过程中发现,这些差异表达的基因参与了多个生物过程,主要分布在8条信号通路上,根据参与通路的多少确定CD36、CFTR、载脂蛋白A1为CAG疾病关键靶点。经检索发现目前未见有人对其进行相关研究报道,故本研究通过动物实验进一步对其验证,探索其发病机制及安胃汤对其的影响,为CAG治疗提供新的思路。
CD36作为B类清道夫受体,在脂质摄取、免疫学识别、炎症、分子黏附和细胞凋亡中起关键作用,它广泛存在于血小板、单核细胞、脂肪细胞、血管内皮细胞、小胶质细胞中,通过与多种配体相结合,从而介导先天性免疫和炎症等不同的生物过程。本研究预测出CD36主要存在于脂肪的消化吸收、PPAR信号通路、AMPK信号通路、吞噬体中。Wu等[18]研究发现AMP活化蛋白激酶可通过上调CD36的表达,促进胃肠道长链脂肪酸的摄取,而细胞长链脂肪酸摄取是调节细胞能量稳态的关键生理过程。Chen等[19]研究发现,巨噬细胞中氧化的LDL/CD36信号将脂肪酸代谢失调与线粒体的氧化应激联系在一起,从而驱动慢性炎症。Farokhzadian等[20]也发现S100A12-CD36通过与晚期糖基化终产物和Toll样受体4结合可促进细胞和免疫途径改变炎症。过氧化物酶体增殖物激活受体γ也被认为是调控CD36表达的关键因子,Febbraio等[21]研究发现,在过氧化物酶体增殖物激活受体γ缺失的细胞中,CD36的表达相应下调。CD36在脂肪酸代谢活跃的组织中具有很高的表达量,例如心脏、脂肪、小肠及肌肉组织等,而在无利用脂肪酸能力的肝细胞中表达极低[22]。王毅群等[23]研究显示胞质内的CD36转运脂肪酸的能力与AMPK信号通路有关。本研究显示,与正常对照组比较,模型组大鼠胃组织中CD36的表达下调,并具有显著性差异。本研究的预测结果和试验结果均提示,CD36可能为CAG的关键靶点。与阴性对照组比较,实验观察组(安胃汤干预组)高、中、低剂量组中胃组织CD36蛋白表达上调,并具有显著性差异。实验结果提示,安胃汤能通过对CD36的调节改善CAG,其机制可能与CD36调节脂肪的消化吸收、PPAR信号通路、AMPK信号通路有关。
CFTR是一种囊性纤维化跨膜传导调节因子,属于ATP门控性氯离子通道,表达于气道、消化道及生殖道上皮细胞顶部质膜中,主要功能是参与膜内外氯离子运输,可影响消化道、呼吸道等上皮功能[24]。本研究预测出CFTR是CAG的关键靶标,动物实验结果显示,与正常对照组比较,模型组大鼠胃组织中CFTR上调,与阴性对照组比较,实验观察组(安胃汤干预组)高、中、低剂量组中胃组织CFTR蛋白表达下调,并具有显著性差异。本研究预测出CFTR在CAG中的表达主要与胃酸分泌物、AMPK信号通路、胆汁分泌物有关。Zhang等[25]研究发现,予以CFTR基因敲除后的细胞可明显减少白细胞介素-8、白细胞介素-1β、白细胞介素-6、白细胞介素-10和肿瘤坏死因子-α等炎症介质表达。Wen等[26]研究发现Hp感染会损害十二指肠黏膜碳酸氢盐转运蛋白CFTR和SLC26A6的表达和功能活性。Liu等[27]研究显示,胃癌患者CFTR和CA199浓度有统计学意义的关联,且组合的CFTR、CA199和CEA作为胃癌诊断标志物产ROC曲线下面积0.875,具有较高诊断价值。综上所述,CFTR是可能是CAG的关键靶标,并具有较高的价值。
载脂蛋白A1是血浆脂蛋白部分,是高密度脂蛋白的主要蛋白组成,可以有效阻止T淋巴细胞和巨噬细胞之间的相互作用,抑制炎症介质的产生,从而改善炎症的“瀑布效应”[28]。本研究显示载脂蛋白A1可能是CAG的关键靶点主要分布在脂肪的消化吸收、PPAR信号通路上。动物试验结果显示,与正常对照组比较,模型组大鼠胃组织中载脂蛋白A1的表达上调,并具有显著性差异;与阴性对照组比较,实验观察组(安胃汤干预组)高、中、低剂量组中胃组织CFTR蛋白表达下调,并具有显著性差异。载脂蛋白A1的表达对于CAG的脂肪的消化吸收具有重要作用。载脂蛋白A1的表达对于消化系统常见疾病也具有重要的意义。Stoye等[29]发现载脂蛋白A1的表达水平可改变阿尔茨海默病大鼠的胃肠道功能。周扬和田亚平[30]研究发现载脂蛋白A1在胃癌和不典型增生的鉴别诊断中有着重要的意义。高艳红等[31]研究显示胃癌组和结直肠癌组血清载脂蛋白A1水平显著低于正常对照组(P<0.01),结果提示载脂蛋白A1可能在肿瘤发展过程中有某种重要作用。载脂蛋白A1可能是胃癌新的潜在生物标志物,联合检测其他蛋白可能会提高胃癌诊断的特异度及灵敏度。综上所述,载脂蛋白A1可能是CAG疾病的关键靶点,并与脂肪的消化吸收有重要作用。
综上所述,本研究将生物芯片大数据,结合生物信息学分析,从一个整体的层面上发现载脂蛋白A1、CD36、CFTR是CAG发病的关键靶点和作用机制,并通过动物实验进行了验证,发现CD36在CAG胃组织中表达下调,载脂蛋白A1和CFTR的表达上调。并与胃酸分泌、脂肪的消化吸收、PPAR信号通路、AMPK信號通路有关。安胃汤干预能够显著改善CAG大鼠胃组织中CD36、载脂蛋白A1和CFTR的表达。作为CAG的核心蛋白,是否也作为其他药物靶点值得进一步去研究。
本研究为单中心大鼠的小样本研究也存在不足。亟待进行多中心、大样本的临床研究。
参考文献
[1]Marques-Silva L,Areia M,Elvas L,et al.Prevalence of gastric precancerous conditions:a systematic review and meta-analysis[J].Eur J Gastroenterol Hepatol,2014,26(4):378-387.
[2]罗晓明,宋仙平,秦威,等.幽门螺杆菌的感染现状和诊断治疗进展[J].江苏预防医学,2019,30(6):646-649.
[3]Du Y,Bai Y,Xie P,et al.Chronic gastritis in China:a national multi-center survey[J].BMC Gastroenterol,2014,14:21.
[4]留甜甜,宋亚刚,田硕,等.基于中西医临床病症特点的慢性萎缩性胃炎动物模型分析[J].中国中药杂志,2021,46(4):777-781.
[5]Sugano K,TackJ,KuipersEJ,et al; Kyoto global consensus report on Helicobacter pylori gastritis[J].Gut,2015,64(9):1353-1367.
[6]吴承芳.安胃汤联合四联疗法治疗幽门螺杆菌相关性胃炎寒热错杂证的临床观察[D].南宁:广西中医药大学,2019.
[7]廖冬燕,朱永苹,张学宁,等.安胃汤治疗慢性萎缩性胃炎疗效与安全性观察[J].广西中医药,2015,38(1):12-15.
[8]魏伟,吴希美,李远见.药理实验方法学[M].4版.北京:人民卫生出版社,2010:71.
[9]世界中医药学会联合会.网络药理学评价方法指南[J].世界中医药,2021,16(4):527-532.
[10]唐旭东,张翠萍,张琪,等.改良式Hp感染萎缩性胃炎大鼠模型的建立[J].青岛大学医学院学报,2012,48(3):247-249,252.
[11]刘赓,张声生.调肝理脾法治疗慢性萎缩性胃炎[J].世界中医药,2015,10(5):695-698.
[12]仝小林,吴义春,穆兰澄,等.经方大剂量探索[J].上海中医药杂志,2010,44(1):18-21.
[13]王晓燕.半夏泻心汤常用剂量与经方本源剂量的比较[J].河南中医,2011,31(9):958-961.
[14]纪万里,王婷婷,安叡,等.基于定量蛋白质组学技术探究半夏泻心汤对慢性胃炎大鼠影响的作用机制[J].中国实验方剂学杂志,2021,27(9):1-8.
[15]周庆华,王红梅.丹参对胃黏膜损伤的保护作用[J].中国现代医学杂志,2008,18(5):582-585.
[16]刘晨萍,李毅平.安胃汤加味治疗脾虚血瘀型慢性萎缩性胃炎的疗效及对患者血液流变学的影响[J].上海中医药大学学报,2019,33(1):28-31.
[17]朱健敏.安胃湯加味治疗慢性萎缩性胃炎胃阴亏虚证的临床研究[D].南宁:广西中医药大学,2018.
[18]Wu W,Wang S,Liu Q,et al.AMPK facilitates intestinal long-chain fatty acid uptake by manipulating CD36 expression and translocation[J].FASEB J,2020,34(4):4852-4869.
[19]Chen Y,Yang M,Huang W,et al.Mitochondrial Metabolic Reprogramming by CD36 Signaling Drives Macrophage Inflammatory Responses[J].Circ Res,2019,125(12):1087-1102.
[20]Farokhzadian J,Mangolian Shahrbabaki P,Bagheri V.S100A12-CD36 axis:A novel player in the pathogenesis of atherosclerosis?[J].Cytokine,2019,122:154104.
[21]Febbraio M,Hajjar DP,Silverstein RL.CD36:a class B scavenger receptor involved in angiogenesis,atherrosclerosis.inflammation,and lipid metabolism[J].J Clin Invest,2001,108(6):785-791.
[22]Febbraio M,Guy E,Coburn C,et al.The impact of overexpression and deficiency of fatty acid translocase(FAT)/CD36[J].Mol Cell Biochem,2002,239(1-2):193-197.
[23]王毅群,董怡,涂治才,等.吡啶羧酸铬通过AMPK信号通路促进3T3-L1脂肪细胞脂肪酸转位酶CD36的转位[J].中国临床药学杂志,2011,20(4):193-197.
[24]Linsdell P.Cystic fibrosis transmembrane conductance regulator(CFTR):Making an ion channel out of an active transporter structure[J].Channels(Austin),2018,12(1):284-290.
[25]Zhang S,Shrestha CL,Wisniewski BL,et al.Consequences of CRISPR-Cas9-Mediated CFTR Knockout in Human Macrophages[J].Front Immunol,2020,11:1871.
[26]Wen G,Jin H,Deng S,et al.Effects of Helicobacter pylori Infection on the Expressions and Functional Activities of Human Duodenal Mucosal Bicarbonate Transport Proteins[J].Helicobacter,2016,21(6):536-547.
[27]Liu H,Wu W,Liu Y,et al.Predictive value of cystic fibrosis transmembrane conductance regulator(CFTR) in the diagnosis of gastric cancer[J].Clin Invest Med,2014,37(4):E226-232.
[28]Wu J,Wang Y,Li H,et al.Serum apolipoprotein B-to-apolipoprotein A1 ratio is independently associated with disease severity in patients with acute pancreatitis.[J].Sci Rep,2019,9(1):7764.
[29]Stoye NM,Dos Santos Guilherme M,Endres K.Alzheimer′s disease in the gut-Major changes in the gut of 5xFAD model mice with ApoA1 as potential key player[J].FASEB J,2020,34(9):11883-11899.
[30]周扬,田亚平.血清学指标联合筛查对胃癌诊断的临床意义[J].标记免疫分析与临床,2014,21(5):520-524.
[31]高艳红,张妍,田亚平,等.不同类型肿瘤患者的血脂水平分析[J].标记免疫分析与临床,2010,17(5):277-280.
(2021-05-19收稿 本文编辑:吴珊,徐颖)

