基于网络药理学及分子对接探讨半夏-藿香抗新型冠状病毒肺炎作用机制
滕龙飞 陈佳丽 王镓 周庆伟


摘要 目的:基于網络药理学筛选半夏-藿香药对治疗新型冠状病毒肺炎(COVID-19)的潜在活性成分、核心靶点、信号通路。方法:通过中药系统药理学数据库与分析平台(TCMSP)筛选半夏-藿香药对活性成分和靶点,与GeneCards、NCBI数据库中COVID-19基因集相互映射获取关键靶点,同时通过STRING数据库和Cytoscape 3.6.1软件构建关键靶点相互作用网络。利用DAVID数据库进行基因本体(GO)-生物过程(BP)及KEGG通路富集分析,获得分子对接证据支持。结果:半夏-藿香药对有效活性成分24个,关键靶点45个,共富集出生物过程、细胞组分和分子功能条目443条,通路103条。分子对接结果显示在半夏-藿香药对中,与3CLpro结合最好的是β-谷甾醇;与血管紧张素转换酶2结合最好的为槲皮素。结论:半夏-藿香药对关键化合物可能从结构上作用于严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2)入侵及从多成分多靶点多通路抑制细胞因子风暴,广谱抗病毒、抑菌及免疫调节,干预网状激活系统起到治疗作用。
关键词 半夏-藿香药对;网络药理学;新型冠状病毒肺炎;分子对接
Mechanism of Pinelliae Rhizoma-pogostemonis Herba Against COVID-19 Based on Network Pharmacology and Molecular Docking
TENG Longfei1,CHEN Jiali1,WANG Jia1,ZHOU Qingwei2
(1 Henan University of Chinese Medicine,Zhengzhou 450046,China; 2 The First Affiliated Hospital of Henan University of Chinese Medicine,Zhengzhou 450000,China)
Abstract Objective:To screen the potential active components,core targets,and signaling pathways of Pinelliae Rhizoma-Pogostemonis Herba for the treatment of Coronavirus Disease 2019(COVID-19) based on network pharmacology.Methods:The active components and targets of Pinelliae Rhizoma-Pogostemonis Herba were screened out by the Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform(TCMSP),and the key targets were obtained by mutual mapping with COVID-19 gene sets in GeneCards and NCBI.Meanwhile,the key target interaction network was constructed by STRING and Cytoscape 3.6.1.Enrichment analysis of Gene Ontology(GO)-biological process(BP) and KEGG pathways was performed using DAVID,which was supported by molecular docking evidence.Results:There were 24 active components and 45 key targets of Pinelliae Rhizoma-Pogostemonis Herba,443 entries of biological processes,cellular components,and molecular functions,and 103 pathways.Molecular docking results showed that in Pinelliae Rhizoma-Pogostemonis Herba,β-sitosterol and quercetin showed best binding to 3CLpro and angiotensin-converting enzyme 2(ACE2),respectively.Conclusion:The key compounds of Pinelliae Rhizoma-Pogostemonis Herba may structurally act on the invasion of the severe acute respiratory syndrome(SARS)-CoV-2 and inhibit cytokine storm from multiple components,multiple targets,and multiple pathways.Pinelliae Rhizoma-Pogostemonis Herba exert the therapeutic role by virtue of broad-spectrum antiviral,antibacterial,immunomodulatory effects and intervening in the reticular activation system.
Keywords Pinelliae Rhizoma-Pogostemonis Herba; Network pharmacology; COVID-19; Molecular docking328914AB-F61E-4124-8E19-47EC583A36D2
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.10.002
新型冠狀病毒肺炎(Corona Virus Disease 2019,COVID-19),是由严重急性呼吸系统综合征冠状病毒2(Severe Acute Respiratory Syndrome Coronavirus 2,SARS-CoV-2)感染导致的急性呼吸道传染疾病[1]。其主要通过飞沫、密切接触及粪口传播,临床症状以发热、干咳或咳痰、呼吸困难为主,可伴恶心、乏力和腹泻等症状,病情进展可能促使急性呼吸窘迫综合征、呼吸衰竭、凝血障碍、甚至休克等严重并发症的产生[2],中位潜伏期为4 d[3]。目前针对新冠病毒尚无特效药,寻找安全、有效的治疗药物是当前研究工作的关键[4]。
COVID-19属中医“疫病”范畴,病因为感受“疫戾”之气;中医治疗COVID-19,在用药归经上,肺、胃、脾3经的使用频率最高,“温邪上受,首先犯肺”,疫戾之气从口鼻而入[5],肺开窍于鼻,脾开窍于口,疫戾之邪遂客于肺,传于脾胃[6]。COVID-19处方中的核心药物组合半夏-藿香药对共出现32次,排在核心药对第4位[7]。藿香芳香化湿,半夏燥湿化痰,降逆止呕,二药配伍即可调气治肺,亦可祛湿醒脾,在最新版诊疗方案中均可见二者配伍。
1 材料与方法
1.1 筛选半夏-藿香药对的有效成分及靶基因 以“半夏”“藿香”为关键词,以口服生物利用度(Oral Bioavailability,OB)≥30%,类药性(Drug Likeness,DL)≥0.18为条件,通过中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)查找半夏-藿香药对的化学成分及对应靶蛋白。通过UniProt数据筛选出物种为“Homo sapiens”的靶点蛋白用基因表示,最终得到潜在成分的基因靶点。
1.2 获取疾病基因 基于NCBI、GeneCards平台,以“Novel Coronavirus Pneumonia”为检索词,筛选COVID-19相关基因。
1.3 半夏-藿香药对作用靶点预测 通过Venny2.1平台,将半夏-藿香靶点与COVID-19靶点相映射。
1.4 构建“药物-成分-靶点”网络 利用Cytoscape 3.6.1构建网络。在网络中,节点(Node)代表(半夏-藿香)、药物活性成分、关键靶基因。边(Edge)代表(半夏-藿香)与对应活性成分、活性成分与靶基因相互作用关系。
1.5 构建蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络 将映射后的靶点蛋白导入STRING数据库,设置高置信度,利用Cytoscape 3.6.1构建PPI网络,获取拓扑参数。
1.6 基因富集分析 运用DAVID6.8富集分析交集基因所涉及的基因本体(Gene Ontology,GO)富集分析-生物过程(Biological Process,BP)和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,并利用R语言可视化。
1.7 分子对接 为了支撑预测的可靠性,进行分子对接。通过PDB数据库下载SARS-CoV-2靶点蛋白血管紧张素转换酶(Angiotensin-converting Enzyme,ACE)2(PDB ID:1r42)、3CLpro(PDB ID:6lu7)分子结构,利用Pymol软件删除水和配体,通过AutoDock软件加氢后保存成pdbqt文件,通过ZINC15(http://zinc.docking.org/)获取临床常用抗病毒药Ribasphere(ZINC1035331)作为对照,利用Autodock Vina把ACE2、3CLpro受体与关键成分小分子配体进行分子对接,筛选结合能最低的结构为最优结构。
2 结果
2.1 半夏-藿香药对治疗COVID-19潜在靶标 根据筛选条件得到半夏-藿香活性化合物共24个。见表1。删除重复后共预测靶标200个;其中半夏有效成分13个,预测靶点86个;藿香有效成分11个,预测靶点164个。
2.2 获取COVID-19潜在基因 剔除重复基因,共获得潜在基因259个。
2.3 半夏-藿香治疗COVID-19靶点预测 映射共得到45个交集靶点。见图1。
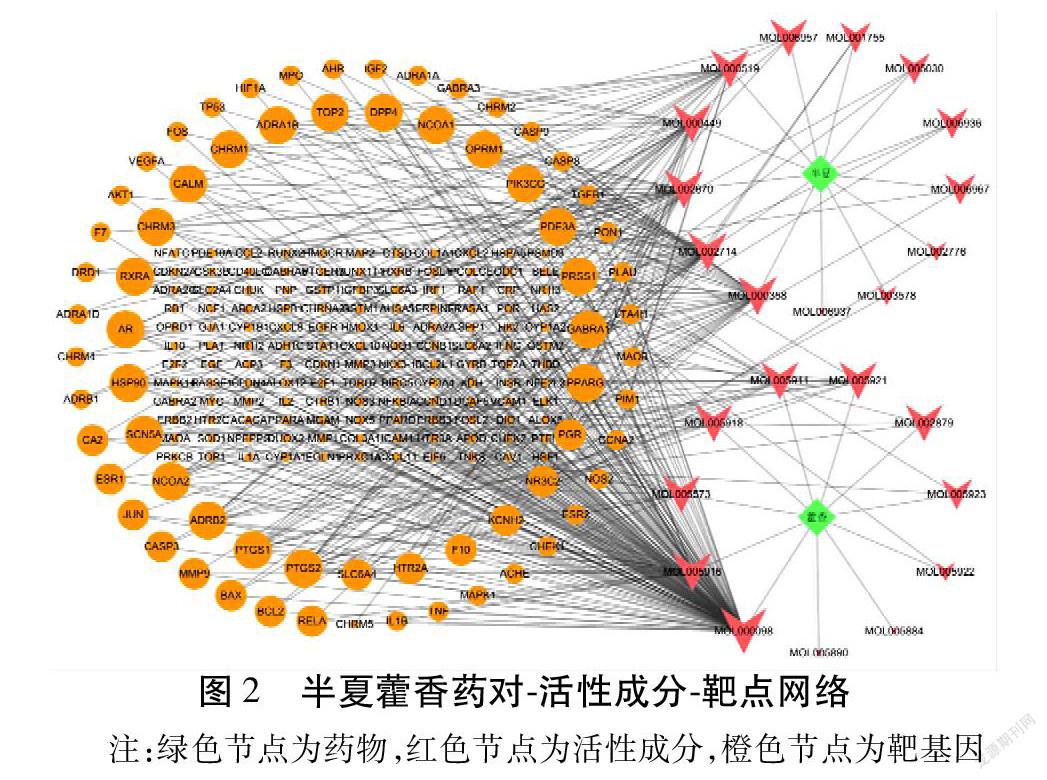
2.4 构建“药物-成分-靶点”网络 共筛选出半夏-藿香药对24个活性化合物和200个靶点。见图2。其中,根据“Degree”值大小排名前8个化合物包括Quercetin(槲皮素)、Beta-sitosterol(β-谷甾醇)、Baicalein(黄芩素)、Irisolidone(鸢尾酮)、Cavidine(卡维丁)、Stigmasterol(豆甾醇)、Coniferin(松柏苷)、Genkwanin(芫花素),其中“Degree”值最大的为槲皮素,其涉及靶点最多,说明其作用效果可能最显著。
2.5 构建PPI网络 PPI网络共涉及45个节点、302条边,节点Degree值>13.4(均值)的核心靶蛋白共20个。见图3。其中节点大小代表度值,边粗细代表连接评分,Degree值越大代表其作用越关键,其可能是半夏-藿香药对治疗COVID-19的关键靶蛋白。通过PPI网络分析得知TNF、IL-6、IL-1β、MAPK1、TP53、RELA、IL-10、CXCL8、CCL2、MAPK14等靶点是半夏-藿香药对治疗COVID-19的主要作用靶点。328914AB-F61E-4124-8E19-47EC583A36D2
2.6 基因富集分析 共富集出生物学过程、细胞组分和分子功能条目443条。以P<0.01为筛选条件,获得GO-BP过程361条,KEGG通路103条。选取排名前20的GO-BP条目及KEGG通路绘制气泡图。见图4。其中涉及炎症反应、细胞对脂多糖的反应、对药物的反应、RNA聚合酶Ⅱ启动子转录的正调控、免疫反应、凋亡过程、转录的正调控DNA模板、凋亡过程的负调控、核因子κB活性的正调控、一氧化氮生物合成过程的正调控、对抗生素的反应等生物学过程,在甲型流感、百日咳、结核、癌症、疟疾等通路富集较集中。
2.7 半夏-藿香药对核心成分的分子对接验证 半夏-藿香药对治疗COVID-19的关键靶点主要集中在槲皮素、β-谷甾醇、黄芩素、芫花素,故选取其作进行分子对接以验证预测结果。一般认为结合能越低构象越稳定,分子对接结果显示,槲皮素、β-谷甾醇、黄芩素、芫花素均能较好地与ACE2、3CLpro结合,结合能均小于抗病毒药Ribasphere。见表2。与ACE2结合最好的为槲皮素(结合能为-7.8 kcal/mol)(1 kcal=4.184 kJ)。见图5 A-C。与3CLpro结合最好的是β-谷甾醇(结合能为-7.5 kcal/mol)。見图5D-F。
3 讨论
目前新冠病毒尚无特效药,我国中西医结合防治COVID-19取得了一定成绩,目前疫情已基本控制,在新型冠状病毒肺炎诊疗方案(试行第七版)中在各个治疗时期始终注重祛湿,而半夏-藿香药对又贯穿始终,均可见二者配伍。本研究利用网络药理及分子对接从痰湿角度探寻半夏-藿香药对治疗COVID-19的潜在机制,共筛选出半夏-藿香药对24个活性化合物和200个靶点。其中,根据“Degree”值大小排名前8个化合物包括Quercetin(槲皮素)、Beta-sitosterol(β-谷甾醇)、Baicalein(黄芩素)、Irisolidone(鸢尾酮)、Cavidine(卡维丁)、Stigmasterol(豆甾醇)、Coniferin(松柏苷)、Genkwanin(芫花素),其中“Degree”值最大的为槲皮素,说明其作用效果最显著。有研究表明槲皮素具有抗炎抑菌、抗病毒、抗氧化的药理活性[8],可以抑制中东呼吸综合征-冠状病毒(Middle East Respiratory Syndrome-coronavirus,MERS-CoV)3C样蛋白酶的活性[9]。β-谷甾醇具有良好的抗氧化、抗炎、免疫调节等药理活性[10]。有研究显示,β-谷甾醇可防止肺组织组织病理学中的气道炎症[11]。豆甾醇属植物甾醇,具有抗炎退热、降胆固醇、抗癌作用[12]。黄芩素具有抗病毒、抗炎、抗补体的作用[13]。卡维丁可通过抑制炎症介质肿瘤坏死因子-α和白细胞介素-6的产生以及核因子κB信号通路的激活,预防和治疗急性肺损伤等肺炎性疾病[14]。鸢尾酮是一种异黄酮代谢物,具有抗病毒作用,研究发现鸢尾酮通过抑制人胶质细胞中TATA(T胸腺嘧啶,A腺嘌呤)框Sp1-Ⅱ的结合来抑制JC病毒的基因表达[15]。芫花素对目前在中国和欧洲流行的高毒力非洲猪瘟病毒分离株显示出有效的抗病毒活性,强调了其作为抗病毒药物候选开发的价值[16]。
半夏-藿香药对的靶点类型众多,筛选出核心靶点共20个。通过PPI网络分析得知肿瘤坏死因子、白细胞介素6、白细胞介素1β、促分裂原活化蛋白激酶1、肿瘤蛋白P53、RELA、白细胞介素10、趋化因子C-X-C基序配体(Chemokine(C-X-C Motif)Lligand,CXCL)8、CC趋化因配体(CC Chemokine Ligand,CCL)2、促分裂原活化蛋白激酶14等靶点是半夏-藿香药对治疗COVID-19的主要作用靶点。COVID-19与严重急性呼吸综合征和MERS-CoV感染都由β-冠状病毒引起[17]。早期研究表明,严重急性呼吸综合征患者血清中炎症介质白细胞介素1β,白细胞介素6,白细胞介素12,γ干扰素,诱导蛋白10和单核细胞趋化蛋白(Monocyte Chemoattractant Protein,MCP)1的含量增加。感染MERS-CoV病毒促使机体炎症介质γ干扰素、肿瘤坏死因子α、白细胞介素15、白细胞介素17的含量增多。而COVID-19患者体内炎症介质白细胞介素1β、γ干扰素、诱导蛋白10、MCP1增多,可能是Th1细胞反应的原因[18]。半夏-藿香药对中肿瘤坏死因子、白细胞介素6、白细胞介素1β、CXCL8炎症介质与白细胞介素10抗炎因子相互作用,可能是抑制中性粒细胞趋化蛋白发生细胞因子风暴,进而引起急性呼吸窘迫综合征的重要靶点[19-20]。促分裂原活化蛋白激酶1和促分裂原活化蛋白激酶14是丝裂原活化蛋白激酶家族成员,它们可在氧化应激、病毒感染的应激下被激活[21]。CCL2在促炎性刺激(如白细胞介素-8、肿瘤坏死因子-α)或病毒等病理性条件下形成,通过促炎反应和免疫应答等反应可以促使免疫细胞到达感染部位[22]。
半夏-藿香药对治疗COVID-19靶点GO生物过程富集涉及炎症反应、免疫反应、凋亡过程、核因子κB转录因子活性的正调控、一氧化氮生物合成过程的正调控、对抗生素的反应等,这些生物过程在半夏-藿香药对治疗新型冠状病毒肺炎中起到了关键作用。通过KEGG富集分析可知,半夏-藿香药对主要活性成分靶点涉及参与甲型流感、百日咳、结核、癌症、疟疾等途径,参与肿瘤坏死因子、Toll样受体、缺氧诱导因子-1、核苷酸结合寡聚化结构域(Nucleotide Binding Oligomerization Domain,NOD)样受体(NOD-like Receptor,NLR)等信号通路作用于COVID-19。人体免疫系统激活后,T细胞分化释放白细胞介素6、白细胞介素1β、肿瘤坏死因子等炎症介质参与免疫过程[23]。有研究发现抑制缺氧诱导因子-1α可以降低肿瘤坏死因子-α和白细胞介素的表达,表明缺氧诱导因子-1α在炎症介质的分泌起关键作用[24]。各种Toll样受体参可调节病毒复制,进而影响病毒的发病[25]。328914AB-F61E-4124-8E19-47EC583A36D2
综上所述,半夏-藿香药对治疗COVID-19可能的有效成分是槲皮素、β-谷甾醇、黄芩素、芫花素等,可能通过上述多靶点、多通路,从结构上作用于SARS-CoV-2入侵,抑制细胞因子风暴,共同参与抗病毒、抑菌、免疫调节,干预肾素-血管紧张素系统起到治疗作用。本研究具有一定局限性,有待实验进一步验证。
参考文献
[1]颜铭江,董一鸿,贾香恩,等.新型冠状病毒肺炎的疫情趋势预测[J].病毒学报,2020,36(4):560-569.
[2]国家卫生健康委员会办公厅,国家中医药管理局办公室.新型冠状病毒感染的肺炎诊疗方案(试行第七版)[J].全科医学临床与教育,2020,18(2):100-105.
[3]Guan WJ,Ni ZY,Hu Y,et al.Clinical characteristics of coronavirus disease 2019 in China[J].N Engl J Med,2020,382(18):1708-1720.
[4]姚开涛,刘明瑜,李欣,等.中药连花清瘟治疗新型冠状病毒肺炎的回顾性临床分析[J].中国实验方剂学杂志,2020,26(11):8-12.
[5]杨道文,李得民,晁恩祥,等.关于新型冠状病毒肺炎中医病因病机的思考[J].中医杂志,2020,61(7):557-560.
[6]刘成海,王宇.温病学理论指导下的新型冠状病毒肺炎诊治刍议[J].上海中医药杂志,2020,54(3):5-8.
[7]张伟健,郭绍举,姜小艳,等.基于数据挖掘探索中医治疗新型冠状病毒肺炎的组方规律并验案分析一则[J].世界科学技术-中医药现代化,2020,22(3):629-635.
[8]Zakaryan H,Arabyan E,Oo A,et al.Flavonoids:promising natural compounds against viral infections[J].Arch Virol,2017,162(9):2539-2551.
[9]Jo S,Kim H,Kim S,et al.Characteristics of flavonoids as potent MERS-CoV 3C-like protease inhibitors[J].Chem Biol Drug Des,2019,94(6):2023-2030.
[10]刘威良,姬昱,黄艾祥.β-谷甾醇的研究及开发进展[J].农产品加工(上半月),2019,18(1):77-79,82.
[11]Mahajan SG,Mehta AA.Suppression of ovalbumin-induced Th2-driven airway inflammation by β-sitosterol in a guinea pig model of asthma[J].Eur J Pharmacol,2011,650(1):458-464.
[12]左春山,刘大勇,徐启杰,等.植物甾醇的结构与功能的研究进展[J].河南科技(上半月),2013,38(17):211-213.
[13]Zhi HJ,Zhu HY,Zhang YY,et al.In vivo effect of quantified flavonoids-enriched extract of Scutellaria baicalensis root on acute lung injury induced by influenza A virus[J].Phytomedicine,2019,57:105-116.
[14]Niu X,Liu F,Li W,et al.Cavidine Ameliorates Lipopolysaccharide-Induced Acute Lung Injury via NF-κB Signaling Pathway in vivo and in vitro[J].Inflammation,2017,40(4):1111-1122.
[15]Kim SY,Kim DH,Hyun JW,et al.Irisolidone,an isoflavone metabolite,represses JC virus gene expression via inhibition of Sp1 binding in human glial cells[J].Biochem Biophys Res Commun,2006,344(1):3-8.
[16]Hakobyan A,Arabyan E,Kotsinyan A,et al.Inhibition of African swine fever virus infection by genkwanin[J].Antiviral Res,2019,167:78-82.
[17]Chang L,Yan Y,Wang L.Coronavirus Disease 2019:Coronaviruses and Blood Safety[J].Transfus Med Rev,2020,34(2):75-80.
[18]Huang C,Wang Y,Li X,et al.Clinical features of patients infected with 2019 novel coronavirus in Wuhan,China[J].Lancet,2020,395(10223):497-506.
[19]張艳丽,蒋澄宇.细胞因子风暴:急性呼吸窘迫综合征中的主宰生命之手[J].生命科学,2015,27(5):554-557.
[20]杨戈,王冰.中医学与“COVID-19”细胞因子风暴的关系及其中医药治疗[J].中国老年学杂志,2020,40(7):1565-1568.
[21]Panteva M,Korkaya H,Jameel S.Hepatitis viruses and the MAPK pathway:is this a survival strategy?[J].Virus Res,2003,92(2):131-140.
[22]Qian BZ,Li JF,Zhang H,et al.CCL2 recruits inflammatory monocytes to facilitate breast-tumour metastasis[J].Nature,2011,475(7355):222-225.
[23]Weinmann AS.Regulatory mechanisms that control T-follicular helper and T-helper 1 cell flexibility[J].Immunol Cell Biol,2014,92(1):34-39.
[24]Guo X,Zhu Z,Zhang W,et al.Nuclear translocation of HIF-1α induced by influenza A(H1N1) infection is critical to the production of proinflammatory cytokines[J].Emerg Microbes Infect,2017,6(5):e39.
[25]Lester SN,Li K.Toll-like receptors in antiviral innate immunity[J].J Mol Biol,2014,426(6):1246-1264.
(2020-08-15收稿 本文编辑:魏庆双)328914AB-F61E-4124-8E19-47EC583A36D2

