炙甘草汤对大鼠心房肌细胞L型钙电流及其动力学特征的影响
郭晟 周承志 杨波 王腾 陈玉婷


摘要 目的:研究炙甘草湯对大鼠心房肌细胞L型钙电流(ICa-L)及其动力学特征的影响。方法:选取24只大鼠随机分为空白对照组和炙甘草汤低剂量组(1.125 g/mL)、中剂量组(2.25 g/mL)、高剂量组(4.5 g/mL),每组6只。3组药物组大鼠分别按各自浓度给予相同体积的炙甘草汤药液灌胃,对照组大鼠予以等体积生理盐水灌胃。给药1周后利用酶解法对4组大鼠心房肌细胞进行急性分离,用全细胞膜片钳技术记录4组心房肌细胞ICa-L并比较I-V曲线,选取中剂量组与对照组的心房肌细胞比较ICa-L通道的动力学特征。结果:与对照组比较,炙甘草汤低、中、高剂量组的大鼠心房肌细胞ICa-L均发生不同程度的抑制效果,I-V曲线均上移。观察比较中剂量药物组与对照组的ICa-L通道动力学特征,发现2组细胞的激活曲线和半数激活电压,差异无统计学意义(P>0.05),但中剂量药物组细胞的稳态失活曲线发生向右偏移,半数失活电压V1/2升高(P<0.05),失活后恢复曲线向下偏移,时间常数(τ)延长(P<0.01)。结论:炙甘草汤能够抑制大鼠心房肌细胞L型钙电流,减慢心房细胞钙通道失活速度,延长失活后恢复的时间,从而起到减慢心率的作用,这可能是炙甘草汤临床上治疗房性心律失常的作用机制。
关键词 炙甘草汤;心房肌细胞;L型钙电流;动力学特征;膜片钳技术
Effects of Zhigancao Decoction on L-type Calcium Current and Kinetics Characteristics of Atrial Myocytes in Rats
GUO Sheng1,ZHOU Chengzhi2,YANG Bo1,WANG Teng3,CHEN Yuting3
(1 Hubei University of Chinese Medicine,Wuhan 430061,China; 2 Hubei Provincial Hospital of TCM/Affiliated Hospital of Hubei University of Chinese Medicine,Wuhan 430061,China; 3 Cardiovascular Research Institute of Wuhan University,Wuhan 430060,China)
Abstract Objective:To investigate the effects of Zhigancao Decoction on L-type calcium current(ICa-L) and the kinetics characteristics of atrial myocytes in rats.Methods:Twenty-four rats were randomly divided into a control group and low-dose(1.125 g/mL),medium-dose(2.25 g/mL),and high-dose(4.5 g/mL) Zhigancao Decoction groups,with six rats in each group.The rats in the Zhigancao Decoction groups were treated correspondingly by gavage,and those in the control group received an equal volume of normal saline.One week after the administration,atrial myocytes in the four groups were acutely isolated by enzymatic hydrolysis.The ICa-L of atrial myocytes in the four groups was recorded by the whole-cell patch clamp technique and the I-V curves were compared.The kinetics characteristics of ICa-L channels of atrial myocytes were compared between the medium-dose Zhigancao Decoction group and the control group.Results:Compared with the control group,the Zhigancao Decoction groups showed inhibited ICa-L of atrial myocytes and upward-shifted I-V curves.As revealed by the comparison of kinetics characteristics of ICa-L channels between the medium-dose Zhigancao Decoction group and the control group,the differences in the activation curve and half activation voltage of cells between the two groups were not significant(P>0.05),but in the middle-dose Zhigancao Decoction group,the homeostatic inactivation curve shifted to the right,and the half-deactivation voltage V1/2 was increased(P<0.05).Additionally,the curve of recovery after inactivation shifted downward,and the time constant(τ) was prolonged(P<0.01).Conclusion:Zhigancao Decoction can inhibit the ICa-L of atrial myocytes in rats,delay the inactivation speed of calcium channels in atrial myocytes,and prolong the recovery time after inactivation,thereby achieving the effect of slowing down the heart rate.It may be the mechanism of Zhigancao Decoction in the clinical treatment of atrial arrhythmia.
Keywords Zhigancao Decoction; Atrial myocytes; L-type calcium current; Kinetics characteristics; Patch clamp technique
中图分类号:R289.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.10.007
房性心律失常是臨床上常见的一种心律失常类型,其中房性早搏是形成心房颤动的最主要诱因之一[1]。严重的心房颤动则往往是心源性猝死的重要原因[2]。它的器质性病变主要是由于心房内血流动力学负荷的激增导致心房牵张所致[3]。而电生理学机制则十分复杂,包括心房重构、肾素-血管紧张素-醛固酮系统和自主神经系统表达功能异常、炎症介质释放和氧化应激等,其中心房的电重构是触发和维持心律失常的重要因素[4]。根据其临床发病特点,中医将其归于“心悸”“怔忡”等范畴,随着现代药理学研究的发展,运用中药治疗心律失常的疗效及安全性得到了广泛肯定。
炙甘草汤乃医圣张仲景《伤寒论》中所记载的名方,有益气养血、滋阴复脉之功,现代医家将其广泛应用于治疗各种快速型心律失常。近年来已有不少实验通过研究心肌细胞膜通道活性来探索各类心律失常的发病机制,而中药复方能够通过对离子通道及受体靶点的相关作用,引起膜电流的改变,从而起到纠正或预防心律失常的作用[5-6]。此前已有不少研究报道了炙甘草汤对动物心室肌细胞各种离子电流的相关作用[7-8],本实验采用膜片钳技术,研究炙甘草汤对大鼠心房肌细胞L型钙电流(L-type Calcium Current,ICa-L)及其动力学特征的影响,探讨炙甘草汤治疗房性快速型心律失常的作用机制,旨在为中医药预防和治疗心律失常提供基础实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 选取无特定病原体(Specific Pathogen Free,SPF)级SD大鼠24只,8周龄,体质量180~220 g,雌雄不拘,购自武汉市新洲区万千佳禾实验动物养殖场[合格证号:SCXK(鄂)2015-0018],所有动物均在武汉大学人民医院实验动物中心SPF级环境下(光照12 h/d、温度18~22 ℃、良好通风),以常规饲料和无菌自来水适应性饲养1周后开始给药进行实验。本动物实验研究全程在武汉大学人民医院医学伦理学委员会指导原则下进行(伦理审批号:WSRM20171224)。
1.1.2 药物 炙甘草汤按《伤寒论》原方比例:炙甘草12 g,生姜、桂枝各9 g,人参、阿胶各6 g,生地黄48 g,麦冬、火麻仁各l0 g,大枣10枚(25 g)。均购自湖北省中医院中药房,并在湖北省中医院中药制剂室以传统工艺煎煮,浓缩、过滤后制成1.125 g/mL、2.25 g/mL、4.5 g/mL的药液,密封后4 ℃储藏备用。
1.1.3 试剂与仪器 本实验中胶原酶Ⅱ(批号:C2674)、蛋白酶E(批号:T4455-10KU)、小牛血清蛋白(Bovine Serun Albumin,BSA)(批号:A8806)、4-羟乙基哌嗪乙磺酸[4-(2-Hydroxyethyl)-1-Piperazineethanesulfonic Acid,HEPES](批号:H3375-250G)、乙二醇双四乙酸[Ethylene Glycol-bis(beta-aminoethyl Ether)-N-Tetraacetic Acid,EGTA](批号:E3389)、氯化铯(CsCl)(批号:C3309)、三磷酸腺苷镁(MgATP)(批号:A9187)、三磷酸腺苷二钠(ATP-Na2)(批号:A1852)和戊巴比妥钠(批号:57-33-0),均购自美国Sigma公司,肝素钠注射液(江苏万邦生化医药股份有限公司,批号:H32020612),其余药品均为国产分析纯试剂。微电极拉制仪(Sutter Instrument公司,美国,型号:MODEL P-97),倒置显微镜(Olympus公司,日本,型号:IX70-122),膜片钳放大器(HEKA公司,德国,型号:EPC-9),Langendorff离体心脏灌流装置(ADInstruments公司,澳大利亚,型号:MI.176)。
正常Tyrode液组成:NaCl 135 mmol/L、KCl 5.4 mmol/L、MgCl2 1.0 mmol/L、CaCl2 1.8 mmol/L、NaH2PO4 0.33 mmol/L、HEPES 10.0 mmol/L、葡萄糖(Glucose) 10.0 mmol/L。恒温水浴箱加热至37 ℃,将NaOH溶液pH值调至7.35。无钙Tyrode液:正常Tyrode液不加CaCl2,恒温水浴箱加热至37 ℃,将NaOH溶液pH值调至7.35。
心肌细胞保存液:300 mL上述无钙Tyrode中加入300 mg BSA。灌流液:100 mL上述无钙Tyrode液中加入20 mg EGTA。
ICa-L电极外液:含0.1 mmol/L的BaCl2的正常Tyrode液,恒温水浴箱加热至37 ℃,将NaOH溶液pH值调至7.38~7.40。
ICa-L电极内液:CsCl 120 mmol/L、CaCl2 1.0 mmol/L、MgCl2 5.0 mmol/L、Na2ATP 5.0 mmol/L、EGTA 11.0 mmol/L、HEPES 10.0 mmol/L、Glucose 11.0 mmol/L,将CsOH的pH值调至7.3。离心管(EP)分装后-20 ℃储存备用。
1.2 方法
1.2.1 分组与模型制备 将24只SD大鼠按照随机数字表法分为4组,每组6只。分别为炙甘草汤低剂量组(给予1.125 g/mL炙甘草汤药液灌胃)、中剂量组(给予2.25 g/mL炙甘草汤药液灌胃)和高剂量组(给予4.5 g/mL炙甘草汤药液灌胃)和对照组(给予等体积生理盐水灌胃)。
1.2.2 给药剂量 大鼠给药剂量按成人(70 kg)与大鼠体表面积换算:炙甘草汤给药为其等效剂量的6.3倍(炙甘草汤70 kg成人1日给药量为135 g生药,因此大鼠等效剂量为135 g/70 kg×6.3=12.15 g生药,换算成体积为5.4 mL的炙甘草汤药液),对照组予以等体积生理盐水灌胃。连续给药7 d,分早晚2次灌胃,每次给药2.7 mL,末次给药1.5 h后开始进行心房肌细胞急性分离实验。
1.2.3 检测指标与方法
1.2.3.1 心房肌细胞的急性分离 大鼠称重后,腹腔注射肝素钠200 U/kg,10 min后腹腔注射戊巴比妥钠30 mg/kg,麻醉完全后开胸迅速取出心脏,于心脏根部保留主动脉1~2 cm剪下心肺,立即放入预冷的氧饱和无钙Tyrode液中清洗、修剪,去除肺及其他残留组织,将主动脉固定插于改良后的离体心脏灌流装置的套管上,用线于主动脉第一分支下系紧,灌流过程持续通氧,先以37 ℃纯氧饱和的上述灌流液将心脏中残余的血细胞冲洗干净,再用含0.5 mg/mL BSA、0.15 mg/mL胶原酶Ⅱ、0.05 mg/L蛋白酶E的无钙Tyrode液进行循环灌流消化。消化过程中分别在加酶前、加酶后、结束消化前各加入20 mmol/L的CaCl2,60 μL/次,消化至心脏表面液体滴落变黏稠,心脏明显胀大蓬松时停止消化,剪下心脏于心肌细胞保存液中清洗,剪取心房组织块放于含细胞保存液的烧杯中,用眼科剪将组织充分剪碎,用磁力搅拌机搅拌均匀,加细胞保存液至50 mL制成细胞悬液,37 ℃水浴通氧孵育,静置5 min后将上清液倒入另一烧杯中得到第1杯心房细胞悬液,再次剪碎沉淀的组织块,加保存液至50 mL,37 ℃水浴通氧孵育、静置,以相同方法获得第2杯、第3杯心房细胞悬液,然后3杯细胞悬液每隔10 min分别加入20 mmol/L的CaCl2复钙3次,第1次、第2次600 μL,第3次800 μL,室温下保存备用。
1.2.3.2 全细胞膜片钳记录 首先运用微电极拉制仪将硬质玻璃毛坯4步拉制成记录微电极,使充灌电极内液后的入水阻抗为2~5 MΩ。用滴管吸取1~2 mL心房细胞悬液滴于倒置显微镜载物台的灌流槽内,待心房肌细胞沉底贴壁后以100%氧饱和的电极外液充分灌流。选取横纹清晰、边缘锐利、细胞状态良好的心房肌细胞作为实验细胞。补偿液接电位后调节三维操作仪,使电极尖端接触选取的心房细胞表面,稍加负压待封接阻抗达1 GΩ以上时,补偿快电容施加负压吸破细胞膜形成全细胞记录模式,补偿并记录慢电容和串联电阻,以降低瞬时充放电电流和钳制电位误差。在不同的钳制电位下测量心房肌细胞ICa-L的动力学特征,每组记录8个细胞。膜片钳放大器连接计算机,运用Pulse+pulsefit 8.80软件对信号进行发放和采集,信号采样后存入电脑后供后期分析。
1.2.3.3 ICa-L的记录 形成全细胞模式后,将钳制电位调至-40 mV时,细胞膜上钠离子通道和T型钙离子通道会失活,而电极内液中的KCl被CsCl代替,钾离子通道也被阻断,可记录到较为纯净的ICa-L。记录ICa-L的方式为:输入指令电压-50 mV到+60 mV,阶跃10 mV,钳制时间300 ms的程序,选取电流幅值稳定的区间记录给药物各组和对照组心房肌细胞ICa-L的动力学变化。
炙甘草汤对ICa-L的I-V曲线及峰值电流密度的影响:以各刺激脉冲下的钳制电位作为横坐标,对应的电流密度(pA/pF)作为纵坐标绘制I-V曲线。
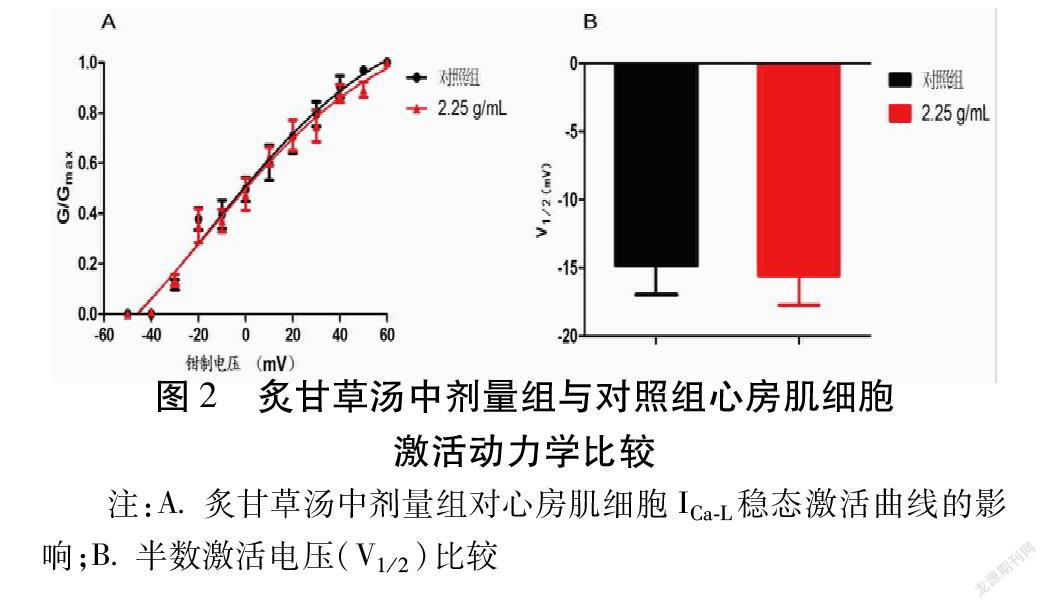
炙甘草汤对大鼠心房肌细胞ICa-L稳态激活曲线的影响:将各钳制电位下记录的激活电流以Boltzmann方程G/Gmax=1/[1+exp(Vm-V1/2)/k]进行拟合(Vm为膜电位,V1/2为半数激活电压,k为曲线倾斜系数)。
炙甘草汤对ICa-L稳态失活曲线的影响:保持钳制电位-50 mV,采用双频脉冲刺激法,予以阶跃10 mV的系列脉冲至+60 mV,总时程300 ms,在每个脉冲后銜接一个固定去极化脉冲至+60 mV,衔接脉冲的持续时间为50 ms,测量出各钳制电位下的ICa-L失活电流,根据Boltzmann方程I/Imax=I/[1+exp(VT-V1/2/k)]进行拟合(V1/2为半数失活电压,k为曲线倾斜系数)。
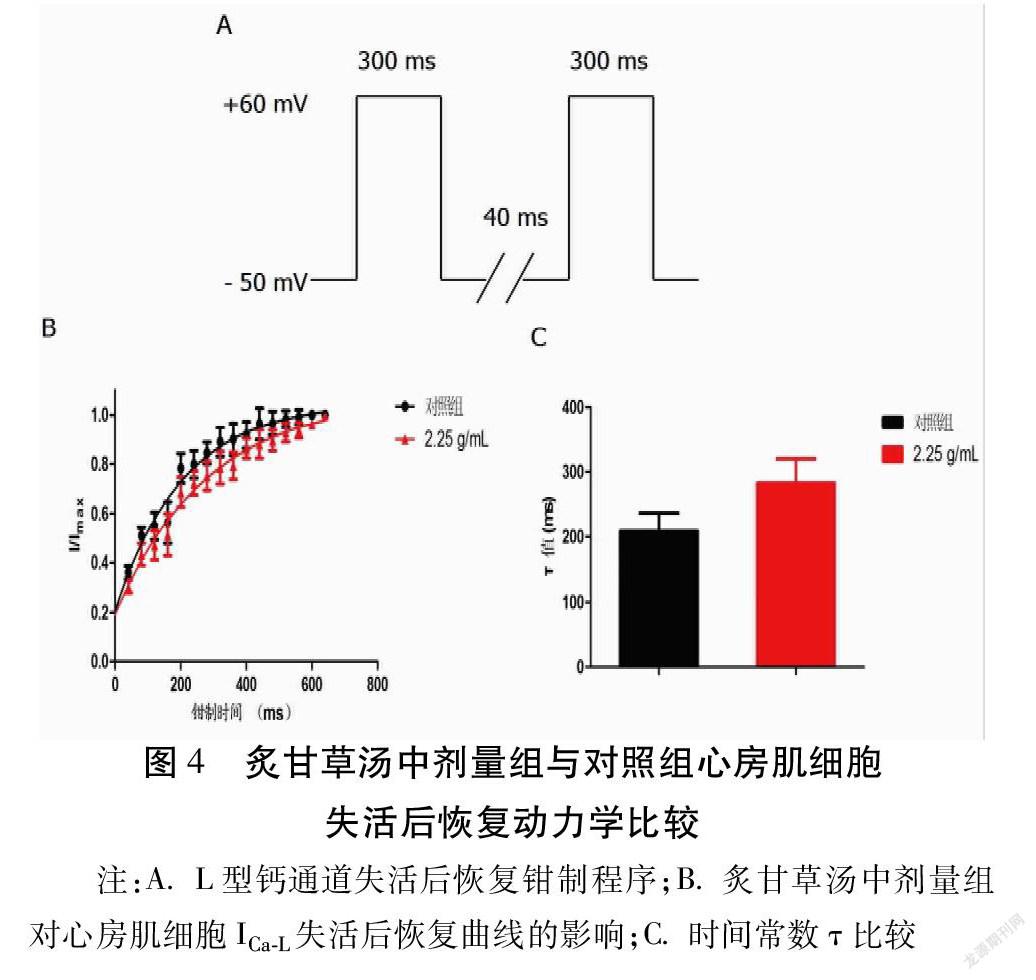
炙甘草汤对ICa-L失活后恢复曲线的影响:保持钳制电位-50 mV,采用双频脉冲刺激法,给予去极化至+60 mV,刺激时间300 ms,第1个脉冲回到-50 mV间隔40 ms后予以第2个除极脉冲,2次脉冲间的间隔时间逐渐增加,每次增加40 ms,记录共16次脉冲。测量相对应的失活后恢复ICa-L并进行单指数方程拟合:I(%)=A+Bexp(-t/τ),求出失活后恢复曲线中时间常数(τ)进行统计学分析。
1.3 统计学方法 采用SPSS 22.0统计软件对数据进行分析,应用Patch软件测量、处理曲线得到原始数据,GraphPad Prism5.0软件结合Oringin8.0软件对数据进行曲线拟合,计量资料均以均数±标准差(±s)表示,计量资料组间比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 炙甘草汤对ICa-L的I-V曲线及峰值电流密度的影响 各组心房肌细胞的ICa-L在-30 mV左右开始激活,在10 mV左右到达峰值。在各钳制电压下,给药3组的电流密度均较对照组有不同程度的减小,I-V曲线均发生上移,对照组ICa-L峰值电流密度为(-11.57±2.67)pA/pF,炙甘草汤低、中、高剂量组的ICa-L峰值密度分别降至(-10.17±2.78)pA/pF(P<0.05)、(-6.97±2.45)pA/pF(P<0.01)、(-7.31±2.09)pA/pF(P<0.01)。见图1。其中炙甘草汤中剂量组与炙甘草高剂量汤组的ICa-L峰值电流密度比较差异无统计学意义(P>0.05)。选取炙甘草汤中剂量组心房肌细胞与对照组比较ICa-L通道的动力学特性。见图1。
2.2 炙甘草汤对大鼠心房肌细胞ICa-L通道动力学特性的影响
2.2.1 炙甘草湯对大鼠心房肌细胞ICa-L稳态激活曲线的影响 结果显示炙甘草汤中剂量组对大鼠心房肌细胞的ICa-L稳态激活曲线的影响,药物组曲线未发生明显偏移,其中对照组和炙甘草汤中剂量组V1/2分别为(-14.83±2.15)mV和(-15.57±2.16)mV,2组比较差异无统计学意义(P>0.05)。炙甘草汤对ICa-L的激活曲线无显著影响。见图2。
2.2.2 炙甘草汤对ICa-L稳态失活曲线的影响 结果显示炙甘草汤中剂量组的稳态失活曲线向右发生偏移。见图3。其中对照组V1/2为(-20.29±5.82)mV,炙甘草汤中剂量组V1/2为(-14.78±5.77)mV,差异有统计学意义(P<0.05);曲线倾斜系数k由对照组的19.45±4.18增加至21.57±4.95,差异有统计学意义(P<0.05)。
2.2.3 炙甘草汤对ICa-L失活后恢复曲线的影响 结果显示炙甘草汤中剂量组使失活后恢复曲线发生向下偏移。见图4。其中对照组τ值为(208.5±28.6)ms,炙甘草汤中剂量组τ值为(282.8±37.0)ms,差异有统计学意义(P<0.01)。炙甘草汤能够延长大鼠心房肌细胞L型钙通道失活后恢复时间。
3 讨论
心房肌细胞膜上各种离子通道的开放与失活可影响心脏电活动和机械活动,其中L型钙通道作为一种激活缓慢、持续时间较长的电压依赖性通道,其电流的改变能够调节心肌细胞平台期兴奋收缩偶联功能[9]。当心肌细胞的钙离子循环发生紊乱时,往往会触发早后除极从而导致折返性心律失常的发生[10]。临床上Ⅳ类抗心律失常药物正是通过抑制ICa-L来缓解心肌细胞Ca2+超载,减少迟后除极,从而达到减慢心率的效果。
临床研究显示,炙甘草汤不仅在治疗各种中医证型的心律失常时疗效显著[11-12],还可使持续性心房颤动达到转窦复律而不出现血栓的效果[13]。动物实验研究显示,炙甘草汤可通过延长心室肌场电位时程进而逆转心房颤动诱发的家兔心肌纤维化[14-15]。同时炙甘草汤对心肌缺血再灌注损伤诱发的室性心动过速和心室颤动可起减轻或预防作用[16]。近年来有关应用血清药理学方法结合膜片钳技术研究炙甘草汤对家兔心肌细胞各离子通道的实验已证实炙甘草汤对心室肌细胞ICa-L具有浓度依赖性的抑制作用[17]。同时在体实验研究表明,炙甘草汤对家兔快速心房起搏导致的电重构有抑制和转复效果[18]。
在以往研究的基础上,本实验主要应用全细胞膜片钳技术观察炙甘草汤对大鼠心房肌细胞ICa-L及其动力学特征的影响。实验结果表明,低、中、高剂量的炙甘草汤对正常大鼠心房肌细胞ICa-L均具有抑制作用,均可使I-V曲线上移。而中剂量与高剂量比较对ICa-L峰值密度的影响并无明显差异,这可能是由于中剂量的炙甘草汤是成人临床等效剂量经体表面积1∶1换算得来,并且高剂量的炙甘草汤药液因过分浓稠在喂养过程中吸收欠佳的缘故,因此选取中剂量炙甘草汤药物组与对照组比较心房肌细胞L型钙通道的动力学特征。研究发现L型钙通道失活速度减慢及失活后恢复时间延长。由于心房肌细胞膜表面钙离子内流受到抑制时能够避免诱发钙离子超载和震荡,而钙通道动力学特征的改变会明显影响动作电位的形状,使心房肌细胞动作电位平台期延长,心肌收缩力下降,从而减慢心率,这可能也是炙甘草汤治疗临床上房性快速型心律失常的重要作用机制。
参考文献
[1]Vincenti A,Brambilla R,Fumagalli MG,et al.Onset mechanism of paroxysmal atrial fibrillation detected by ambulatory Holter monitoring[J].Europace,2006,8(3):204-210.
[2]Al-Khatib SM,Stevenson WG,Ackerman MJ,et al.2017 AHA/ACC/HRS Guideline for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death:A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society[J].Circulation,2018,138(13):e272-e391.
[3]Scardigli M,Cannazzaro S,Coppini R,et al.Arrhythmia susceptibility in a rat model of acute atrial dilation[J].Prog Biophys Mol Biol,2020,154:21-29.
[4]黄从新,张澍,黄德嘉,等.心房颤动:目前的认识和治疗建议-2018[J].中国心脏起搏与心电生理杂志,2018,32(4):315-368.
[5]郭雄,李妙玲,刘兴隆,等.附子含药血清对大鼠心室肌细胞L型钙通道的影响[J].中国实验方剂学杂志,2015,21(11):111-115.
[6]邢作英,王永霞,朱明军,等.交泰丸及其组分含药血清对豚鼠心室肌细胞钠通道的影响[J].中国中西医结合杂志,2019,39(8):983-987.
[7]王清秀,杨淑红,王腾,等.炙甘草汤含药血清对家兔心室肌细胞瞬时外向钾电流的抑制作用[J].微循环学杂志,2006,16(4):19-23,84,86.
[8]周承志,吴成云,杨波,等.炙甘草汤对正常家兔心室肌电生理特性的影响[J].湖北中医药大学学报,2015,17(2):22-23.
[9]王世强,杨华乾.心肌细胞兴奋收缩耦联的分子机制[J].中国科学:生命科学,2013,43(10):833-841.
[10]谌晶晶,王丹丹,黄从新.钙循环紊乱与心力衰竭后心律失常[J].中国心脏起搏与心电生理杂志,2017,31(3):264-266.
[11]王永成,马度芳,李晓.炙甘草汤对心律失常气阴两虚证患者心率变异性及炎症因子的影响[J].中国实验方剂学杂志,2017,23(11):165-170.
[12]陶诗怡,张瑾,于林童,等.中西医结合治疗原发性高血压并发心房颤动有效性和安全性的Meta分析[J].中草药,2021,52(20):6336-6343.
[13]熊兴江.基于现代病理生理及CCU急危重症病例的炙甘草汤方证溯源及其复律、转窦、止血、升血小板、补虚临床运用[J].中国中药杂志,2019,44(18):3842-3860.
[14]Sun J,Wugeti N,Mahemuti A.Reversal effect of Zhigancao decoction on myocardial fibrosis in a rapid pacing-induced atrial fibrillation model in New Zealand rabbits[J].J Int Med Res,2019,47(2):884-892.
[15]Sun J,Lu Y,Yan H,et al.Application of the myocardial tissue/silicon substrate microelectrode array technology on detecting the effection of Zhigancao Decoction medicated serum on cardiac electrophysiology[J].Int J Clin Exp Med,2015,8(2):2017-2023.
[16]鄭旭颖,麻春杰,陈永真,等.基于PI3K/Akt/mTOR信号通路探讨炙甘草汤抗大鼠MIRI致室速和室颤的作用机制[J].中国实验方剂学杂志,2020,26(17):1-8.
[17]周承志,张道亮,王腾,等.炙甘草汤含药血清对兔心肌细胞钙电流的影响[J].北京中医药大学学报,2007,30(7):468-471.
[18]周承志,吴成云,杨波,等.炙甘草汤对快速起搏心房电重构的影响[J].中国中医急症,2014,23(9):1607-1609.
(2020-10-27收稿 本文编辑:张雄杰)

