夹脊电针调节自噬流促进大鼠脊髓损伤修复
田洪昭,尹洪娜,马育轩,张文钊△
(1.黑龙江省中医药科学院,黑龙江 哈尔滨 150036;2.黑龙江中医药大学,黑龙江 哈尔滨 150040; 3.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001)
脊髓损伤(SCI)是多种原因引起脊髓结构、功能的损害,导致感觉、运动或自主神经功能障碍的疾病,其影响着患者的身体、心理和社交能力[1]。SCI后由于短期内需要高水准的急症护理和长期治疗相关继发性并发症,所以需要大量的医疗保健资源,给患者、家庭及社会带来了沉重的经济负担[2]。
夹脊电针是中医的一种治疗方法。其治疗脊髓损伤无论是在临床,还是在基础实验中都具有良好的效果,影响机制众多[3-6]。
而自噬(Autophagy)机制被认为是脊髓损伤的治疗靶点之一。自噬(Autophagy)是一个降解细胞蛋白和细胞器的细胞内的系统,自噬可分为三大类:大自噬、小自噬和分子伴侣介导的自噬(Chaperone-mediated autophagy,CMA)。在这3种途径中,以形成独特的双膜细胞器自噬体为特征的大自噬(以下简称自噬)研究最为广泛,自噬是一种保守的细胞生存途径,它分解受损的蛋白质和细胞器以维持体内平衡,是一种潜在的营养来源。细胞的胞质内容物被自噬体隔离,最终传递到溶酶体进行降解[7]。自噬可以用两种不同的方法来监测[8]:①直接观察自噬相关结构;②蛋白质和细胞器的自噬/溶酶体依赖降解的定量。对自噬结构在一定时间点的静态分析常常导致不准确的解释。为了准确估计自噬活性,必须确定自噬流,即自噬降解量。本研究旨在研究夹脊电针对自噬流的影响,明确其治疗脊髓损伤的机制。
1 实验方法
1.1 实验动物
48只清洁级Sprague Dawley雌性大鼠,购自黑龙江中医药大学实验动物中心,10周龄左右,体质量220~250 g,安置于黑龙江中医药大学针灸临床神经生物学重点实验室动物房,适应性喂养7 d,保持室内温度和湿度相对恒定,12 h光照/黑暗循环,大鼠自由进食饮水,动物使用和护理规程符合国家卫生研究院制定的《实验动物使用和护理指南》。
1.2 实验材料及仪器
苏木素染色液(北京Biotopped);LC3B Rabbit PolyClonal antibody、p62 Rabbit PolyClonal antibody(美国proteintech);PV-6001兔二步法试剂盒(兔聚合物法检测系统)(北京中杉金桥);beta-Actin Mouse MonoClonal antibody、HRP-Goat-Anti-Rabbit IgG(H+L)、HRP-Goat-Anti-Mouse IgG(H+L)(美国proteintech);二磷酸氯喹(美国 Sigma);Impactor M-Ⅲ型脊髓打击器(美国)、Micro Plus型脉冲电针仪(美国);封闭用山羊血清(北京中杉金桥)、RM2235石蜡切片机(德国Leica)、miniPRO4迷你垂直电泳仪(北京WIX)、湿式转印仪(北京WIX);Micro Plus型脉冲电针仪(BioMedical Life Systems,Inc,Vista,CA,USA)。
1.3 模型建立
应用NYU Impactor M-Ⅲ打击器制作Allen’s模型,大鼠在术前10 h禁食,用10 %水合氯醛(3.0 mL/kg),腹腔注射,麻醉SD大鼠,并置于俯卧位,固定四肢。触碰背部棘突圆钝点,为椎体T10,消毒后沿脊柱方向做一个约5 cm的背中部纵向切口。剥离椎旁肌并压迫止血,暴露椎体T9~11,小心夹碎椎板并去除,暴露完好硬脊膜。用NYU Impactor M-Ⅲ打击器进行撞击,参数如下:一根重10 g(底部直径2.5 mm)的冲击棒,落差为50 mm,损伤能量为50 g·cm,造成相对严重损伤[9-10]。
造模成功的标志:当打击棒接触到脊髓时,与探针形成回路后发出警笛声,此时软件提示无错误,电脑描记撞击过程呈抛物线样曲线。同时大鼠有摇尾反射或(和)双下肢及躯体回缩扑动,立即移除冲击棒,观察到脊髓组织红肿、充血,标志撞击成功。打击完成后,在切口部位局部敷以抗生素(阿莫西林)[11]。缝合后将大鼠置于单笼,采用灯照保暖措施,每天早晚各1次辅助排尿,直至排尿反射恢复。
1.4 实验分组及干预
1.4.1 假手术组(Sham) 只行椎板摘除,不进行打击损伤。
1.4.2 模型组(Model) 椎板摘除后进行打击损伤。
1.4.3 电针组(EA) 椎板摘除后进行打击损伤。损伤后6 h进行夹脊电针治疗。操作方法:选取T10上、下棘突间隙旁开7 mm以内处取穴。常规消毒后,用毫针向脊柱方向刺入,使针尖触及椎板。采用电针仪正极连接上端针柄,负极连接同侧下端针柄。选取参数:①脉冲波形:连续脉冲波形;②脉冲重复频率:100 Hz;③电流输出强度:以背部肌肉出现轻微抽动为度(约1 mA)。持续30 min,1日1次。
1.4.4 电针+抑制剂组(EA+CQ) 椎板摘除后进行打击损伤,损伤后6 h进行夹脊电针治疗,同时腹腔注射抑制剂CQ (C6628),注射剂量为50 mg/kg/d,直至处死大鼠。
以上4组每日同时捆绑操作。
Sham组、Model组和EA组每日注射与CQ相同剂量的生理盐水。
1.5 指标检测
采用Basso-Beattie-Bresnahan (BBB)评分量表[12]对脊髓损伤大鼠的后肢功能恢复进行评价。分数越高,运动功能越好。各组大鼠按照SCI后3 d、7 d进行动态评估,将大鼠放于开放视野场地自由移动5 min,由两名研究人员采用盲法进行评分,取平均值进行计算。
评分后给大鼠注射过量的10 %的水合氯醛腹腔注射,等待完全麻醉后,将大鼠俯卧位放置,快速断头处死,将脊髓组织在冰袋上快速取出并放入4 %多聚甲醛中和液氮中备用。采用免疫组化和WB法检测大鼠脊髓组织LC3、P62的表达。
1.6 统计学处理
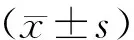
2 实验结果
2.1 BBB评分结果
Sham组3 d和7 d两个时间点评分均为21分,表示没有运动障碍。Model组术后各个时间点评分显著低于Sham组(P<0.01),说明有明显的运动障碍。EA组在3 d和7 d时间点评分均高于Model组,比较差异均有统计学意义(P<0.05或P<0.01)。而注射抑制剂CQ后EA+CQ组在3d和7d评分均低于EA组,比较差异有统计学意义(P<0.01),说明CQ可以部分消除夹脊电针的治疗作用。见表1。
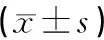
表1 各组大鼠BBB评分结果
2.2 IHC检测结果
2.2.1 IHC检测大鼠脊髓组织LC3的平均光密度值 LC3棕黄色阳性标记主要表达于神经元和胶质细胞的胞浆中,术后3 d和7 d时间点,Model组LC3平均光密度值显著高于Sham组,差异具有统计学意义(P<0.01),EA组治疗后LC3平均光密度值升高,在3 d和7 d时间点与Model组比较,差异具有统计学意义(P<0.05或P<0.01),而注射抑制剂CQ后EA+CQ组各个时间点平均光密度值均高于EA组,差异有统计学意义(P<0.05)。见表2、图1。

表2 各组大鼠LC3平均光密度值 (IOD/Area)
结果说明脊髓损伤后LC3的表达量升高,这可能与溶酶体功能缺陷导致自噬体降解减弱有关。而夹脊电针有促进LC3表达的作用,增加自噬体的形成。而在夹脊电针治疗的基础上注射溶酶体抑制剂CQ可加剧LC3表达,导致自噬体的过量堆积。
2.2.2 IHC检测大鼠脊髓组织P62的平均光密度值 P62棕黄色阳性标记主要表达于神经元和胶质细胞的胞浆中,在术后3 d和7 d时间点,Model组P62的平均光密度值明显高于Sham组,差异具有统计学意义(P<0.01)。EA组治疗后在3 d和7 d时间点P62平均光密度值均低于Model组,差异比较有统计学意义(P<0.05),而注射抑制剂CQ后EA+CQ组平均光密度值升高,在3d和7d时间点,与EA组比较差异有统计学意义(P<0.01)。见表3、图2。

表3 各组大鼠P62平均光密度值 (IOD/Area)
说明脊髓损伤后自噬降解底物P62的表达量升高,夹脊电针有降低P62表达的作用,促进自噬体降解并加快自噬流。而在夹脊电针治疗的基础上注射抑制剂CQ可加剧P62表达,堵塞了自噬流。
Westernblot检测各组大鼠脊髓组织LC3-Ⅱ蛋白表达情况 术后3 d和7 d时间点,Model组LC3-Ⅱ蛋白表达量相对于Sham组明显升高,差异具有统计学意义(P<0.01)。而经过EA组治疗后,继续升高LC3-Ⅱ蛋白的表达量,在3 d和7 d时间点,与Model组比较,差异具有统计学意义(P<0.01)。而注射抑制剂CQ后EA+CQ组LC3-Ⅱ蛋白继续升高,在3 d和7 d时间点,与EA组比较差异有统计学意义(P<0.05)。 见图3、表4。
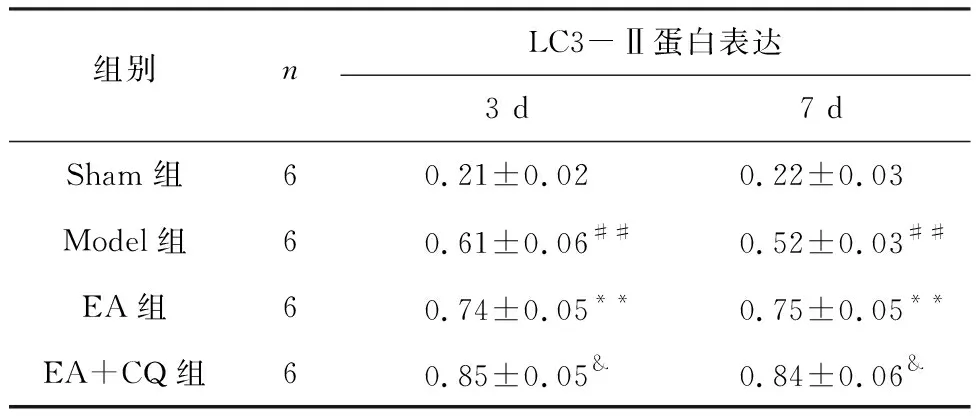
表4 各组大鼠LC3-Ⅱ相对蛋白表达情况(LC3-Ⅱ/β-actin)
以上结果说明脊髓损后LC3-Ⅱ蛋白表达升高,自噬体增多,可能因自噬流堵塞导致,而夹脊电针治疗后继续升高LC3-Ⅱ蛋白表达量,可能与促进自噬体的生成有关。在夹脊电针的基础上注射抑制剂CQ,导致LC3-Ⅱ蛋白表达量继续升高,自噬体大量堆积。
3 讨论
近年来,越来越多的研究关注自噬在中枢神经系统损伤中的作用,自噬作为一种重要而保守的溶酶体降解途径,被认为参与了许多生理与病理过程,并通过对受损蛋白和细胞器的处理和能量再利用或生产,在维持细胞内平衡方面发挥着重要作用,前期课题组证明夹脊电针促进自噬而抑制神经细胞凋亡,从而促进大鼠后肢功能的恢复。另一方面,一些研究人员在报告中提出,抑制自噬可以发挥神经保护作用[13-14]。而自噬在SCI中的作用似乎存在争议。该争议与自噬流有关,自噬流是一个动态过程,包括自噬体的形成、传递和降解。单独自噬体的增多并不能证明自噬的增强,可能由于自噬体降解的减少或随着自噬体形成增加而不能降解,发生自噬体的积累,从而抑制了自噬流。自噬的有益或有害功能可能取决于中枢神经系统损伤后自噬流的诱导或抑制,通畅的自噬流通常导致细胞保护,而受阻的自噬流导致细胞死亡。因此,调节自噬流可能有利于SCI的治疗。LC3是目前使用最广泛的自噬体标记物,因为LC3-Ⅱ的表达水平反映了自噬体和自噬相关结构的数量。p62/SQSTM1也被认为是自噬流的标志物,P62是一种衔接蛋白,可将泛素化的底物导向自噬体。由于P62随着自噬与其底物一起降解,当自噬流加快时,P62蛋白水平降低。相反,自噬流的减少导致P62蛋白积累,p62的水平代表自噬体的降解速率。
而溶酶体功能在促进自噬流方面起到重要作用。而抑制溶酶体功能后,即晚期自噬,导致自噬体不能被顺利降解而堆积,LC3和P62的含量增高。自噬体可以作为组装坏死复合物的支架[15-20],进一步介导细胞破裂死亡,属于“自噬性细胞死亡”的范畴。晚期抑制剂巴弗洛霉素A1(bafilomycin A1)对溶酶体降解的抑制作用导致LC3-Ⅱ和p62的积累,晚期抑制剂还有E64d和胃蛋白酶抑制剂[21],体内实验使用溶酶体抑制剂氯喹(Chloroquine,CQ)较多[22-26]。
夹脊电针是针刺效应和电场作用的双重结合。针刺治疗时采用局部选穴,在损伤节段上下取夹脊穴,夹脊穴与督脉和膀胱经并行,督脉是阳脉之海,总督一身之阳气,督脉受阻,阳气不达四末。而膀胱经与督脉毗邻,所以脊髓损伤也会造成膀胱经受阻,经气不能从头走足,再次加重下肢阳气供应的缺乏。而夹脊穴针刺可以通行两经脉道,扶督脉之阳气,助膀胱经经气,促进两经经脉畅通。吴永刚等[27]研究认为损伤2~8 h针刺治疗脊髓损伤可明显促进脊髓血流量的增加,所以早期针刺对大鼠脊髓损伤有治疗作用。外加电场在细胞实验中已经证明可以加速细胞迁移,调节细胞增殖,指导细胞分裂的方向,影响细胞的形状和方向,在脊髓损伤中外加电场可以诱导血管内皮细胞分化和血管生成,促进神经生长和神经元迁移,加速轴突在神经修复部位的萌发,上调运动神经元中的神经营养因子的表达等,所以电刺激在临床上已被广泛用于改善脊髓和神经肌肉损伤后的功能预后[3]。
本实验应用BBB量表进行评分并记录。最初,行为功能,特别是运动功能都是通过修改Tarlov和Klinger开发的评分量表来评估的[28]。Basso、Beattie和Bresnahan[9]开发了一种有效的、扩展的和明确的评定量表(BBB量表)来对各个实验室的运动结果测量进行标准化,BBB量表是通过使用俄亥俄州立大学(OSU)或纽约大学(NYU)设计并制造的可控电磁打击装置,可造成较多数量大鼠脊髓损伤,并对脊髓损伤大鼠康复模式进行评估而制定的。实验研究此量表可以区分应用NYU装置在不同高度打击大鼠T10部位造成神经系统损伤结果的差异。并且行为学结果得分与组织学损伤高度相关。根据观察到的运动恢复模式,确定胸椎SCI评分类别,并对其进行定义和排序。BBB量表为研究人员提供了一种有效的鉴别和预测运动恢复的方法,因此也能够评估脊髓损伤后功能的治疗。结果显示治疗3 d和7 d时,夹脊电针BBB评分优于模型组,说明夹脊电针可以治疗脊髓损伤并改善大鼠行为学评分。而给予抑制剂CQ后消除了部分夹脊电针的治疗作用。
应用IHC法和Western blot法检测到LC3和P62主要表达于神经元和胶质细胞的胞浆中,术后3 d和7 d时间点,LC3、LC3-Ⅱ和P62平均光密度值明显高于Sham组,差异具有统计学意义(P<0.01),证明自噬流的堵塞,可能因为溶酶体在打击后失去融合和降解自噬体功能所致。EA组治疗后LC3、LC3-Ⅱ平均光密度值在各个时间点均高于Model组,差异具有统计学意义(P<0.05),而P62平均光密度值均低于Model组,差异具有统计学意义(P<0.05),说明电针治疗后可促进LC3、LC3-Ⅱ的升高、降低P62的表达,加快了自噬流。其治疗机制可能与增加自噬体的生成和改善溶酶体功能有关。而注射抑制剂CQ后EA+CQ组3 d和7 d时间点LC3、LC3-Ⅱ和P62平均光密度值升高,与EA组比较各个时间点,差异具有统计学意义(P<0.05)。说明CQ有部分消除夹脊电针促进自噬流的作用。
综上所述,本研究结果揭示了夹脊电针通过恢复神经元通畅的自噬流,最终改善SD大鼠急性脊髓损伤后肢运动功能的新机制。因此,这些结果有助于更深入地了解夹脊电针的神经保护作用。

