抗菌肽CC34 的氨基酸从头替换设计及优化肽的生物活性检测
张宇,姜宁
(黑龙江八一农垦大学动物科技学院,大庆 163319)
抗生素是20 世纪的伟大发明之一,在疾病防治和畜牧业发展中曾发挥极大作用。但是很多问题接踵而至:滥用抗生素导致超级致病菌出现、畜产品中抗生素药物残留、未被动物体吸收的抗生素随粪尿排出污染环境等。相关报道屡见不鲜,2017 年3 月,“獭兔养殖中存在滥用抗生素类兽药的问题”在国际消费者权益日被曝光[1];CCTV-4 中文国际频道也曾报道“印度每年有5.8 万儿童死于滥用抗生素产生的耐药性”[2]。2019 年7 月,农业农村部第194 号公告颁布,明确指出自2020 年元旦起,抗生素在饲料中被全面禁用,维护动物源食品安全和公共卫生安全[3]。为此,绿色、高效、安全的替抗产品的研发已成必然,而抗菌肽可在动物机体发挥先天性免疫作用,成为了抗生素替代品研究的热点[4-9]。
研究发现抗菌肽的生物学活性与其分子质量、所带电荷量、两亲性及二级结构等理化参数相关。常俊朋等[10]以抗菌肽SAMP1 为模板利用疏水性氨基酸替换和氨基酸序列的重新排列方式优化设计出抗菌性提高但溶血性和毒性降低的抗菌肽SAMP1-A4。梁东升等[11]根据两亲性、正电性和α 螺旋结构对抗菌肽reuterin 6 进行改造设计,得到的抗菌肽AT-7 具有非完美两亲性和高疏水性,对黏性放线菌和变异链球菌等最小抑菌浓度极显著降低,杀菌作用迅速。刘志新等[12]通过对猪源抗菌肽PMAP-23 氨基酸序列进行位点替换,得到对部分菌种抑菌性高、热稳定性好、治疗指数高的新肽PMAP-23LR。彭建等[13]通过截短Cec4 的肽序列、氨基酸替换的方式得到最小抑菌浓度比原肽下降一倍的Cec4-4。研究以林蛙抗菌肽Chensirin 和家蝇抗菌肽Cec Md 的杂交肽CC34 为模板,通过氨基酸从头替换的方式对肽序列进行改变,对替换后的抗菌肽序列做生物信息学预测分析,选取四条抗菌肽序列进行化学合成,利用圆二色谱分析合成的抗菌肽的二级结构,并鉴定抑菌活性,检测最小抑菌浓度、杀菌浓度和溶血率,为抗菌肽的利用和开发提供理论数据基础。
1 材料与方法
1.1 材料
1.1.1 应用的生物信息学软件
APD 数 据 库、EMBOSS-Pepstats、NNPREDICT、ProtParam、HydroMCalc、BLAST 和螺旋轮检测软件。
1.1.2 试验菌株与红细胞
大肠杆菌(Escherichia coli ATCC29522)、鸡沙门氏菌(Salmonella gullinarum)、铜绿假单胞菌(Pseudomonas aeruginosa ATCC9027)、产气肠杆菌(Enterobacter aerogenes ATCC13048)、金黄色葡萄球菌(Staphylococcus aureus ATCC43300)、停乳链球菌(Stepeocuccos dysgalactiae equisimilis ATCC13813)、粪链球菌(Streptococcus faecium ATCC29212)均为黑龙江八一农垦大学动物营养研究所保存。红细胞为鸡血、绵羊血和成年男性血液离心得到。
1.1.3 试剂与仪器设备
LB 培养基、PBS 缓冲液、Triton-100 购于上海沪峥生物科技有限公司;SDS(十二烷基硫酸钠)和TFE(50%三氟乙醇)购于美国Sigma 公司产品。
超净工作台(上海浦东仪器厂)、-80 ℃超低温冰箱(New Brunswick scientific 公司)、台式低温冷冻高速离心机(美国Sigma-Amresco 公司)、蒸汽压力锅(上海力辰科技有限公司)、DRP-9271 型电热恒温培养箱(上海森信实验仪器有限公司)、酶标仪(赛默MK3)、PHS-3C 型精密pH 计(上海雷磁仪器厂)、LC-10A 高效液相色谱仪(日本岛津)等。
1.2 试验方法
1.2.1 抗菌肽CC34 的从头替换设计
抗菌肽CC34 的氨基酸序列为GWLKKIGKKIERVGQHTRDAILPILSLIGGLLGK,利用脯氨酸、甘氨酸、组氨酸、亮氨酸、缬氨酸、丙氨酸、赖氨酸、精氨酸这8 种氨基分别从第一位开始依次进行替换,再将这些氨基酸随机两两组合替换第11 位和第19 位氨基酸。将替换后的氨基酸序列输入生物信息学软件,对分子量、电荷数、亲疏水残基数、理论等电点、平均亲疏水值、脂肪族指数、不稳定指数、二级结构、两亲性和电荷分布等进行预测,筛选理化参数较好的抗菌肽送至上海吉尔生化有限公司进行合成。
1.2.2 圆二色谱(CD)分析
参照常俊朋等[10]利用圆二色光谱测定蛋白质二级结构的方法,分别将合成的待测抗菌肽溶于15 mmol·L-1PBS 缓冲溶液(pH=7.4)、50%三氟乙醇(TFE)和25 mmol·L-1十二烷基硫酸钠(SDS)中,在温度为25 ℃、波长范围为190~250 nm 额条件下,以100 nm·min-1的速度进行扫描得到光谱。
1.2.3 抑菌活性鉴定
利用纸片浸润液扩散的方法对合成的抗菌肽进行抑菌活性的初步鉴定。将菌液分别均匀涂布在不同的固体培养基上,待菌液风干后将滤纸片均匀的贴于培养基上并轻压按实,取15 μL 各待鉴定抗菌肽依次滴加到滤纸片上,37 ℃恒温过夜培养,测量抑菌圈的大小。试验进行多次重复,应用SPSS 22.0 对测定的数据做单因素方差分析。
1.2.4 最小抑菌浓度测定
在菌液培养至对数期时用LB 液体培养基校正浓度(OD625≈0.09-0.14)。在96 孔板的每一排第1~10 孔均加PBS 缓冲液50 μL,第11 孔加菌液50 μL作为阳性对照,第12 孔加LB 培养液50 μL 作为阴性无菌对照。采用备比稀释法,在第1 孔加入50 μL 544 μM 的抗菌肽,混匀后吸取50 μL 至第2 孔,重复操作至第10 孔,加样完毕后密封减少液体挥发,37 ℃孵育过夜后使用酶标仪测光吸收值(OD492),光吸收值忽然变大的前一孔浓度对应的是最小抑菌浓度。
1.2.5 杀菌浓度测定
将各抗菌肽最小抑菌浓度之前的每个孔内的液体各吸取50 μL 均匀的涂布在LB 固体培养基上,37 ℃过夜培养,未长出菌落的培养基对应浓度为杀菌浓度。但考虑抗菌肽作用浓度梯度过大会影响测定杀菌浓度的准确性,所以取浓度为272 μM 的抗菌肽50 μL 加入25 μL 菌液至96 孔板第1 孔,此时抗菌肽浓度为181 μM,再进行备比稀释至第9 孔,此时抗菌肽的工作浓度依次为181、120、81、53、35、24、16、11、7.3 μM。重复过夜培养步骤,确定杀菌浓度。
1.2.6 抗菌肽溶血性测定
试验采取的绵羊血和鸡血来自于黑龙江八一农垦大学动物房的健康实验动物,人血来自于成年健康男性。取血液各5 mL,1 500 g 离心5 min,弃血清,收集红细胞,重复离心洗涤3 次制成2%的红细胞悬浮液。在96 孔板每行的第1~10 孔分别加入50 μL 悬液,再在第1 孔加入50 μL 浓度为544 μM 的抗菌肽,充分混匀后吸取50 μL 加至第2 孔,依此重复至第10 孔,将第10 孔移出50 μL 混合液弃掉。第11 孔加入红细胞悬液和PBS 各25 μL 混匀作为阴性对照,第12 孔加红细胞悬液和Triton-100 各25 μL 混匀作为阳性对照。37 ℃孵育2 h 后在570 nm 下测吸光值。

2 结果与分析
2.1 抗菌肽CC34 的从头替换设计筛选结果
通过氨基酸从头替换共得到328 个抗菌肽序列,综合各个参数意义选取其中四条。通常肽链中氨基酸数小于30 且分子量较小越小越易穿膜[13],四种新肽相对分子质量均小于原肽;在一定范围内,等电点和静电荷量越高抗菌肽的抑菌作用越强;总平均疏水值是肽序列中所有氨基酸残基的亲疏水值加和除以残基的总数所得比值,负值越大越亲水,相反正值越大越疏水,由结果可知CC34PA 和CC34PL 的疏水性较强,预测这两种肽与细胞膜的结合能力较强;脂肪族系数越大、不稳定指数越小的抗菌肽稳定性越高,预测四种优化肽的稳定性均优于原肽;α 螺旋占二级结构的百分比与抗菌性和溶血性呈正相关[14]。筛选出的四条抗菌肽命名为CC34K11、CC34P11、CC34PA、CC34PL,分别是赖氨酸和脯氨酸替代CC34的第抗菌肽11 位氨基酸、脯氨酸和丙氨酸/亮氨酸分别替代第11 位和第19 位氨基酸,氨基酸序列详见表2。

表1 优化肽的生物学参数Table 1 Optimize the biological parameters of peptide
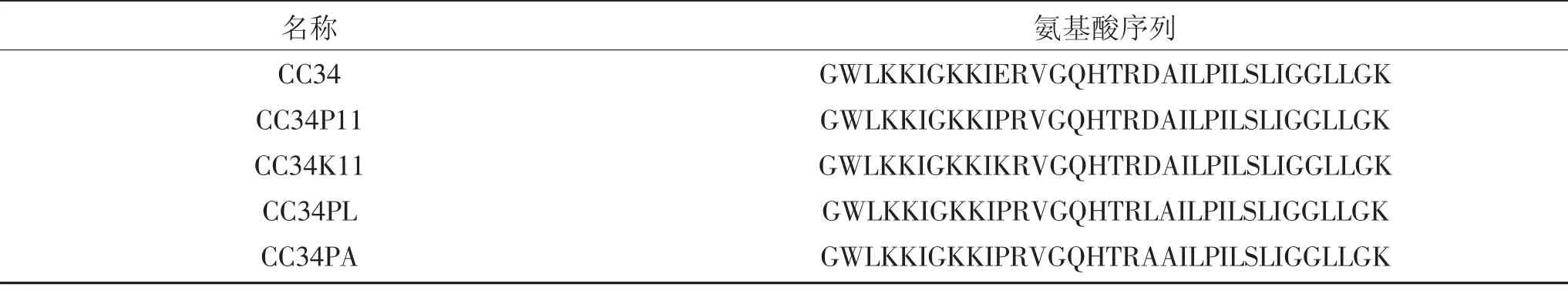
表2 选用合成的抗菌肽Table 2 Selection of synthetic antimicrobial peptides
2.2 两亲性预测结果与分析
抗菌肽的螺旋结构预测分析如图1 所示,圆形表示亲水性残基,红色代表亲水性最强的氨基酸,红色越浅则亲水性越低;菱形表示疏水性残基,绿色代表疏水性最强的氨基酸,绿色越浅氨基酸的疏水性越低;黄色表示的氨基酸疏水性为零。三角形表示氨基酸残基带负电,五边形表示氨基酸残基带正电,浅蓝色表示氨基酸残基可能带电。由图可知各抗菌肽所含的亲、疏水性氨基酸个数和带电荷的氨基酸个数,CC34K11、CC34P11、CC34PA 和CC34PL 肽序列中的疏水性氨基酸基本分布于螺旋轮的一侧,比CC34 更能表现出阳离子性和两亲性,但也并非是完美两亲性。
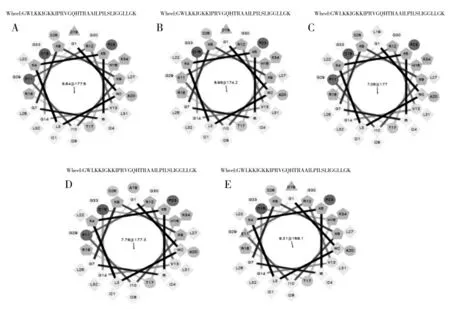
图1 抗菌肽的螺旋结构预测Fig.1 Analysis of structure of antibacterial peptides
抗菌肽的亲水性图如图2 所示,在0 点的下方表现为疏水性且越远离0 点越疏水,相反在0 点的上方则表现为亲水性且越远离0 点越亲水。五种肽均具有两亲性,和螺旋轮预测结果一致。亲水图曲线变化趋势类似,通过比较极值点亲水性绝对值发现,CC34K11 疏水性较强。抗菌肽CC34、CC34K11 和CC34P11 在前20 个氨基酸位点表现为疏水,后14个氨基酸表现为亲水;CC34PA 在前19 个氨基酸位点表现为疏水性,后15 个氨基酸位点表示为亲水性;CC34PL 在前17 个氨基酸位点表现为疏水性,后17 个氨基酸位点表示为亲水性。由此可预测,两亲性最好的为CC34PL,而CC34、CC34K11 和CC34P11的疏水性相对较强。
图2 抗菌肽的亲水性图Fig.2 The hydropathy plot of antimicrobial peptides
2.3 抗菌肽的二级结构测定结果与分析
五种抗菌肽在SDS 和TFE 两种环境中的CD 光谱在195 nm 处出现一个特征性的正峰,在208 和222 nm 处分别两个特征性的负峰,足以表明抗菌肽在PBS 环境中均呈现无规则卷曲,而在细胞膜模拟(SDS 和TFE)的环境下表现出典型的α-螺旋结构特征。CC34PA 的负峰强度最强,CC34PL 次之,表明α-螺旋比例含量增加;CC34P11 负峰强度较弱,表明α-螺旋比例含量是最低的。从测定结果可推断,抗菌肽CC34K11、CC34P11、CC34PA、CC34PL 与 母 体 肽CC34 同样以α-螺旋为主要的二级结构。
2.4 抑菌活性鉴定
由图4 可知,五种抗菌肽对大肠杆菌、铜绿假单胞菌、鸡沙门氏菌、金黄色葡萄球菌、产气肠杆菌、粪链球菌、停乳链球菌均有抑制效果,这说明对常见的革兰氏阳性菌和阴性菌均有一定的作用。

图4 抗菌肽对细菌的抑菌效应Fig.4 Antibacterial peptide bacteriostatic effect of bacteria
比较抑菌圈直径大小可得出如下结论:四种进行氨基酸替换的肽对大肠杆菌的抑制效果均极显著高于CC34(P<0.01),且CC34K11 和CC34PA 的作用极显著强于CC34PL 和CC34P11(P<0.01);CC34PL和CC34K11 对鸡沙门氏菌的作用显著强于CC34(P<0.05);CC34PA 和CC34P11 对铜绿假单胞菌的作用显著强于CC34(P<0.05)、对产气肠杆菌的作用极显著强于CC34(P<0.01);除CC34PA,其他三种肽对对金黄色葡萄球菌的作用均显著强于CC34(P<0.05);CC34P11 和CC34PL 对停乳链球菌的作用显著强于CC34(P<0.05);四种肽中,只有CC34PL 对粪链球菌的作用显著强于CC34(P<0.05)。

图3 抗菌肽的CD 光谱Fig.3 CD spectrum of antimicrobial peptide CC34
2.5 最小抑菌浓度的结果与分析
分析最小抑菌浓度测定结果可知:CC34K11 和CC34PA 对大肠杆菌有较强的抑制作用;CC34K11 和CC34PL 对鸡沙门氏菌有较强的抑制作用;CC34P11和CC34PA 对铜绿假单胞菌有较强的抑制作用;CC34PL 对产气肠杆菌的抑制效果与CC34 相当,其他三种肽的抑制效果不及CC34;CC34P11 和CC34PL 对金黄色葡萄球菌和停乳链球菌有较强的抑制效果;CC34PL 对粪链球菌的抑制效果优于其他四种抗菌肽。

表3 抗菌肽的抑菌圈直径(cm)Table 3 Diameter of antimicrobial peptides inhibition zone
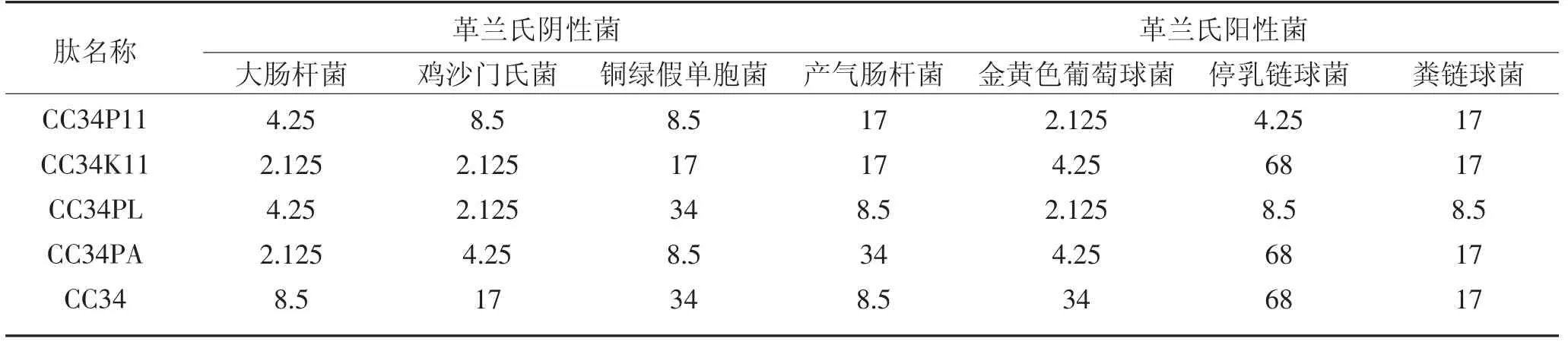
表4 抗菌肽的最小抑菌浓度(MIC)Table 4 MIC of antimicrobial peptides
2.6 杀菌浓度的结果与分析
由杀菌浓度测定结果可知:CC34PA 对大肠杆菌有较强的杀菌作用;CC34K11 对鸡沙门氏菌有较强的杀菌作用;CC34P11 对铜绿假单胞菌有较强的杀菌作用;CC34PL 对产气肠杆菌的杀菌效果与CC34相当,其他三种肽的杀菌效果不及CC34;CC34PL 对金黄色葡萄球菌有较强的杀菌作用;CC34P11 和CC34PL 对停乳链球菌有较强的杀菌作用;CC34PL对粪链球菌有较强的杀菌作用。
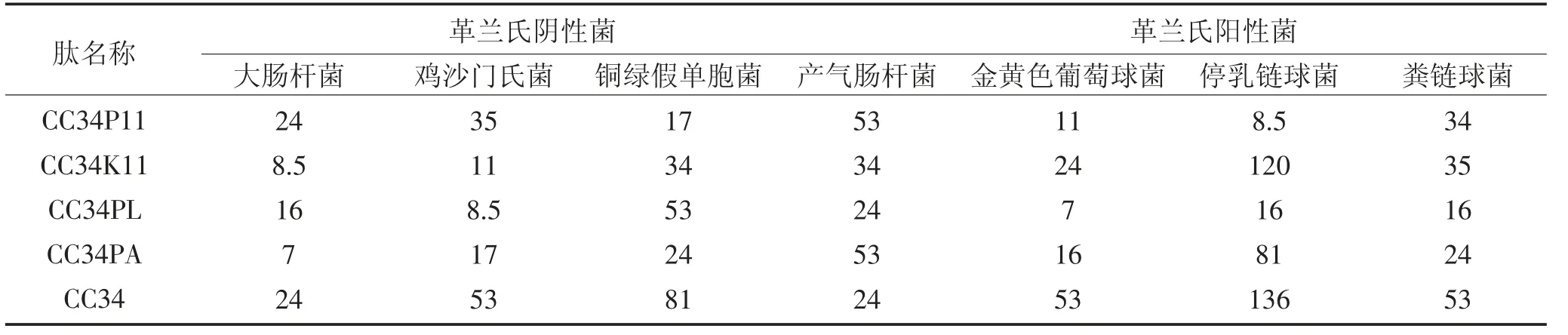
表5 抗菌肽的杀菌浓度(LC)Table 5 LC of antimicrobial peptides
2.7 溶血性的结果与分析
红细胞溶血率随着抗菌肽浓度升高出现升高趋势,但四种改变序列的肽作用红细胞的溶血率均普遍低于CC34。在测定浓度范围(<272 μM)内,五种抗菌肽对的绵羊红细胞溶血率均低于31.35%,5%溶血率对应的抗菌肽浓度为<17 μM;对鸡红细胞的溶血率均小于42.46%,CC34P11 作用引起5%溶血率对应的肽浓度为<17 μM,CC34K11 和CC34PL 作用引起5%溶血率对应的肽浓度为<8.5 μM,CC34PA 作用引起5%溶血率对应的肽浓度为<34 μM;相比对于绵羊和鸡红细胞溶血率,抗菌肽对人血的溶血率较高。
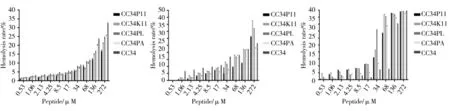
图5 抗菌肽对红细胞溶血率的影响Fig.5 Effect of antimicrobial peptides on hemolysis rate of red blood cells
3 讨论
对抗菌肽进行优化设计的目的主要是通过肽序列的修饰等实现抑菌活性和稳定性的提高,同时降低溶血率和毒性。试验进行位点替换所选用氨基酸的理由如下:赖氨酸属于残基带正电的碱性氨基酸,但与中性和酸性磷脂的结合不如其他的碱性氨基酸,故能在一定程度上降低溶血率,同时电荷量的增加能提高抗菌肽的抑菌作用;丙氨酸、亮氨酸、脯氨酸属于疏水性氨基酸,增加此类氨基酸有利于抗菌肽更好的发挥穿膜作用,也有研究表明脯氨酸的存在可降低抗菌肽的溶血性;丙氨酸、赖氨酸、亮氨酸同时又属于脂肪族氨基酸,抗菌肽脂肪族系数越高稳定性较好[15-17]。研究表明脂肪族氨基酸在一定程度上也可发挥协同抑菌的功能,宁亚维[18]在试验中发现,抗菌肽brevilaterin 与脂肪族氨基ε-聚赖氨酸对金黄色葡萄球菌存在着协同抑菌的作用,ε-聚赖氨酸在一定程度上可以破坏跨膜pH 值梯度,加强了细菌细胞膜的通透性,抑制蛋白质合成并降解蛋白。Zoppi 等[19]用赖氨酸和亮氨酸对牛宿主防御肽Bac2A进行单位点替换,提高了抗菌肽活性和抑菌效果。Park Y 等[20]利用赖氨酸对母肽不同位点氨基酸进行替换,得到了正电荷和疏水性都增强的CA(1-8)-MA(1-12)抗菌肽类似物,抗菌活性得到大幅提高。
比较抑菌圈直径大小、最小抑菌浓度和杀菌浓度的测定结果发现:优化后的抗菌肽对不同种细菌的作用强弱效果不同,CC34PL 对金黄色葡萄球菌和粪链球菌的抑制和杀伤作用较好,CC34PA 对大肠杆菌和铜绿假单胞菌的抑制和杀伤作用较好,CC34K11对大肠杆菌和鸡沙门氏菌的抑制和杀伤作用较好,CC34P11 对铜绿假单胞菌和停乳链球菌的抑制和杀伤作用较好。这在一定程度上可以说明,CC34PL 对部分革兰氏阳性菌的靶向作用明显,而CC34PA 和CC34K11 对部分革兰氏阴性菌作用更明显。革兰氏阳性菌和阴性菌的细胞壁差异很大,阳性菌比阴性菌的细胞壁厚2~8 倍,肽聚糖片层多7~10 倍,CC34PL 总平均疏水值最大,等电点和静电荷数高,故破坏细菌的能力更强。而Mishra 等[21]将大量抗菌肽序列做对比发现,能靶向作用革兰氏阳性菌的肽一般具有高疏水性和低阳离子性的特点,靶向革兰氏阴性菌的肽则相反具有低疏水性和高阳离子性,试验的结果也印证了这一观点。
CD 光谱和结果和α-螺旋占二级结构的百分比的预测结果是一致的,均表明CC34PA 的α-螺旋要多于CC34PL,这说明抗菌肽CC34PA 的溶血性和抑菌作用可能要强于CC34PL,但经试验证明两者的抑菌作用没有太大差异,且CC34PL 的溶血性反高于CC34PA。这验证了α-螺旋在一定阈值内并不会影响抗菌肽对细菌的作用这一观点,α-螺旋抗菌肽是通过静电作用与细菌质膜磷脂带负电的分子结合,通过疏水作用在质膜上形成孔洞引起胞内物质物质外流引起细菌死亡[22]。枚春成[23]利用抗菌肽HPRP-A1设计出二级结构分别为α-螺旋型、β-折叠型、无规卷曲型的新肽,结果发现α-螺旋型抗菌肽HPRP-A2抑菌活性最佳,HPRP-T10 等因氨基酸序列剪短或电荷减少抑菌活性都出现了不同程度的降低,相比其他的二级结构,α-螺旋型抗菌肽的抑菌活性更强。
静电荷数和总平均疏水值是抗菌肽发挥作用的重要影响因素,但疏水值也并非越高越好,过高会使肽链发生自身的缔合影响其穿过原核生物的细胞壁,但是并不会影响对真核生物细胞膜的破坏,所以溶血性会提高,疏水值过低则抑菌效果较差甚至失去作用[24],试验的抗菌肽CC34PL 的平均疏水值高于其他四种抗菌肽,故溶血性高。赵连静[25]利用丙氨酸、赖氨酸等多种氨基酸以单位点替换方式对母体肽HPRP-A1 进行优化设计,合成的F8V、F8L、F8W 等多条抗菌肽的疏水值高于替他组且表现出较好的杀菌特性。
螺旋轮图预测结果显示几种肽的两亲性并非完美,而这种结构可通过破坏极性面形成,减少极性面上同种电荷氨基酸残基相互排斥的作用,进而增加了抗菌肽与细菌作用时产生的静电结合能力。在静电相互作用下,带有正电荷的抗菌肽会向着带有负电荷的细菌细胞扩散,由于细胞膜间的疏水键与亲水键相互作用,抗菌肽非极性面会插入到细胞膜中,从而使抗菌肽与细菌细胞的亲和能力加强,提高抗菌效果。王良等[26]以螺旋轮图为依据,利用亮氨酸和赖氨酸设计得到一种新的得到的α-螺旋型抗菌肽LK,对多种革兰氏阴性菌和阳性菌都有很强的抑菌活性且溶血性和细胞毒性很低。徐欣瑶等[27]用几种疏水性氨基酸替换模板抗菌肽GRX2RX3RX2RG 中X位置,发现用亮氨酸替换得到的GL 抗革兰氏阳性菌和革兰氏阴性菌效果明显,最小抑菌浓度为2~4 μmol·L-2。
4 结论
通过优化后的四种抗菌肽为α 螺旋型抗菌肽,具有较好的生物学活性,对试验的革兰氏阳性菌和阴性菌均有抑制作用,除对产气肠杆菌的作用效果不及原肽CC34 之外,优化肽对不同试验菌种的抑菌作用均有不同程度的提高。四种优化抗菌肽相比于原肽对绵羊红细胞的溶血率降低,溶血率最低的是CC34K11;对鸡红细胞溶血率降低,溶血率最低的是CC34PA;对人红细胞溶血率没有降低作用。

