木薯枯草杆菌蛋白酶家族鉴定及MeSDD1的功能分析
肖 亮 鲍茹雪 曹 升 陆柳英 尚小红 曾文丹聂宣红 严华兵,2,*
(1 广西壮族自治区农业科学院经济作物研究所,广西 南宁 530007;2 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530007;3 中国热带农业科学院热带生物技术研究所,海南 海口 571101;4 越南农业科学院, 河内 12500 越南)
木薯(ManihotesculentaCrantz)是三大薯类作物之一,全球第六大粮食作物,用途广泛,可食用、饲用和加工成各种工业产品,如淀粉、酒精等[1]。随着全球气候变暖,干旱已经成为影响农作物产量的主要环境因子之一[2]。近十年来由于干旱造成的农作物减产损失已达到约300亿美元[3]。在木薯主产区广西,木薯主要种植在旱坡地上,主要土壤类型为砖红壤和赤红壤,土壤条件干旱、贫瘠,干旱是制约木薯产量的重要因素之一[4-5]。因此增强木薯耐旱性具有重要的生物学及经济学意义。
SBT基因家族是一类庞大的家族,例如其在小立碗藓(Physcomitrellapatens)基因组中有23个成员,在拟南芥(Arabidopsisthaliana)中有56个成员[6-7],在水稻(Oryzasativa)中有63个成员[8],在杨树(Populustrichocarpa)中有90个成员[9],在葡萄(Vitisvinifera)中有80个成员[9],在番茄(Solanumlycopersicum)中有15个成员[10]。大量研究表明枯草杆菌蛋白酶(subtilase, SBT)参与植物非生物胁迫反应。拟南芥基因组中SBT基因SDD1(stomataldensityanddistribution1)通过影响气孔密度调节拟南芥植株的抗旱性[11],后续研究结果表明该基因在气孔前体细胞中高表达,并通过产生信号物配体,激活细胞膜上的激酶蛋白,进而控制细胞线性发育并导致保卫细胞形成[12-13]。研究表明,板蓝根(Isatisindigotica)的IiSDD1受干旱和脱落酸处理后下调表达[14]。在玉米(Zeamay)中过表达ZmSDD1后转基因植株的气孔数目下降30%,干旱胁迫后过表达ZmSDD1植株存活率相比于野生型大幅度提高[15]。前期研究表明,干旱胁迫条件下,18个木薯SBT基因下调表达[16],但木薯MeSDD1能否增强植株的抗旱性仍有待研究。
鉴于此,本研究通过生物信息学方法鉴定木薯全基因组中SBT成员,明确其在染色体上的分布,分析各成员的基本结构特点;从木薯基因组中分离与拟南芥SDD1高度同源的基因MeSDD1,研究其抗旱功能,以期为木薯抗旱遗传改良提供理论基础和基因资源。
1 材料与方法
1.1 试验材料
木薯(ManihotesculentaCrantz)品种为新选048,拟南芥(Arabidopsisthaliana)材料为Col生态型;菌株为大肠杆菌(Escherichiacoli)DH5α和根癌农杆菌(Agrobacteriumtumefaciens)GV3101,植物表达载体为pC2 300s-GFP,均由广西壮族自治区农业科学院木薯课题组保存。
1.2 试验方法
1.2.1 木薯SBT家族成员的鉴定、系统进化树的构建及各成员的染色体分布分析 利用Phytozome12(http://phytozome.jgi.doe.gov/pz/portal.html)结合NCBI(www.ncbi.nlm.nih.gov)数据库通过Blast分析,获得所有木薯SBT家族成员的编码区(coding sequence, CDS)、氨基酸、转录本和基因组序列。使用MEGA 5.0软件,将获得的木薯SBT家族成员与56个拟南芥SBT成员构建进化树,并于在线工具EVOLVIEM(https://evolgenius.info//evolview-v2/#login)中对进化树进行编辑。利用MapInspect软件(http://www.plantbreeding.wur.nl/UK/software_mapinspect.html)对木薯SBT家族成员进行染色体定位分析。
1.2.2 木薯SBT家族成员基因结构及保守基序分析 结合进化树,使用GSDS 2.0(http://gsds.cbi.pku.edu.cn/index.php)分析所有成员的基因结构,并使用MEME(http://meme.nbcr.net/meme/cgi-bin/meme.cgi)分析保守模体。
1.2.3 木薯SBT基因家族启动子元件分析 提取所有木薯SBT家族成员基因组序列起始密码子ATG上游2 000 bp序列作为木薯SBT家族基因的启动子,利用在线软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)分析启动子区域的顺式作用元件种类。
1.2.4MeSDD1基因克隆与植物表达载体的构建 使用植物RNA提取试剂盒(宝生物工程大连有限公司)提取正常生长2个月的木薯新选048叶片组织总RNA,用反转录试剂盒(宝生物工程大连有限公司)逆转录合成cDNA,依据Manes.18G044300的编码区序列设计PCR引物19OV104,引物序列见表1。PCR体系50 μL:DNA 1 μL, 10×Buffer 5 μL, dNTP Mixture(10 mmol·L-1)1 μL, 19OV104-F(10 μmol·L-1)1 μL, 19OV104-R(10 μmol·L-1)1 μL, TAQ(1 U·μL-1)1 μL, ddH2O 40 μL。反应程序如下:94℃预变性5 min;98℃变性30 s,56℃退火30 s,68℃延伸3 min,循环32次;68℃终延伸5 min。25℃保存。利用琼脂糖回收试剂盒(宝生物工程大连有限公司)切胶回收PCR产物并纯化,采用TA克隆,挑选3个单克隆送交上海生工测序验证。
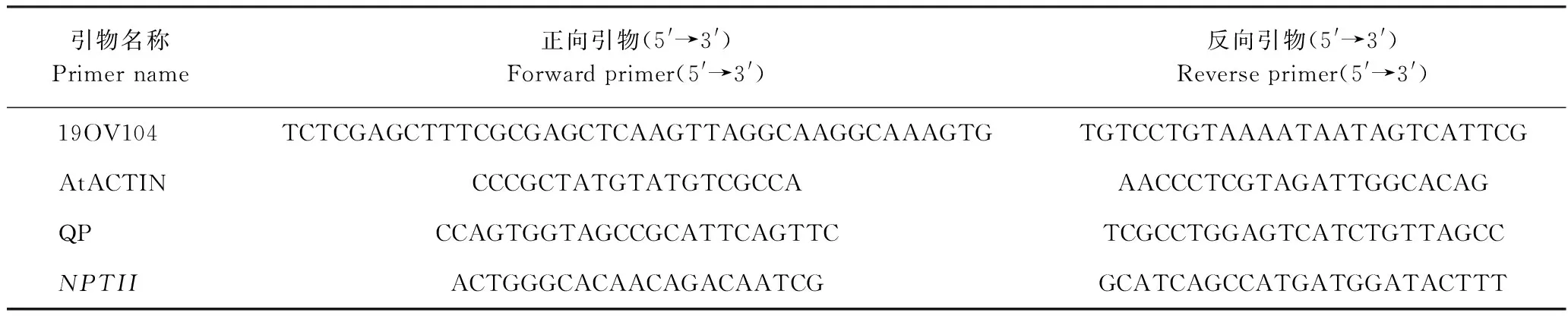
表1 引物序列Table 1 Primers sequence
用SacI与BamHI双酶切处理pC2300s-GFP(35S启动子)表达载体获得线性化载体,将同样纯化的目的片段MeSDD1与线性化pC2300s-GFP载体用T4连接酶连接形成重组质粒19ATK50。
1.2.5 拟南芥遗传转化及阳性植株筛选鉴定 在营养土中点播拟南芥种子,22±2℃培养至开花期备用;采用电转化法将重组质粒19ATK50转化到根癌农杆菌GV3101感受态、挑选阳性单克隆、菌落PCR鉴定后,将其接种在含有利福平和卡那霉素的LB液体培养基上,28℃振荡培养至OD600值在0.4~0.6之间。
采用蘸花法浸染拟南芥花序,使花浸入菌液中60 s,1周后再次转化,浸染后的植株在22℃、12 h光照/12 h黑暗的培养间培养至收获种子(T0代)。利用次氯酸钠对种子消毒后,接种于含50 mg·L-1卡那霉素的MS培养基中,22℃培养1周后,挑选正常萌发的阳性植株移栽到含泥炭土、蛭石(体积比为1∶3)的营养钵中,培养管理至收种获得T1代。利用法抽提10株T1代植株叶片基因组DNA,利用NPTII特异引物进行PCR检测。每个株系单独收种子获得T2代,将T2代种子播种在卡那霉素抗性培养基上,培养7~10 d,用镊子选取生长正常的绿苗,用水轻洗以洗掉根上的培养基,移栽到营养钵后浇定根水,成活苗用于下一步研究。
1.2.6 实时荧光定量PCR表达检测 取转基因T2代阳性植株和野生型植株幼嫩叶片,用Trizol试剂盒(宝生物工程大连有限公司)提取RNA,反转录获得cDNA,利用Primer 3.0(http://bioinfo.ut.ee/primer3-0.4.0/primer3/)在线设计MeSDD1的实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)引物QP,引物序列见表1,以拟南芥基因AtACTIN(At3g18780)为内参基因,采用qRT-PCR技术检测MeSDD1在野生型和转基因株系中的相对表达水平,表达水平以2-ΔΔCt方法计算。
1.2.7 转基因植株的抗旱性分析 以野生型和2个转基因株系OE-1和OE-2为材料,检测叶片相对含水量、离体叶片失水率和气孔密度,并进行抗旱性鉴定。取拟南芥莲座叶,称量重量记为W,放入水中6 h后称重记为Wt,然后烘干至一个恒定的重量,记为Wd,每个基因型设置3个重复。相对含水量=(W-Wd)/(Wt-Wd)×100%。
取拟南芥莲座叶,将离体叶片置于滤纸上,叶背面朝上,每个基因型设置3个重复,在光周期为16 h光照/8 h黑暗的条件下培养。每隔1 h称取叶片的重量,初始叶片重量记为M0,每个时间点测得的叶片重量记为Mn(n=1~8)。失水率=(M0-Mn)/M0×100%。
取野生型和2个转基因拟南芥植株倒数第3片叶进行气孔密度的检测,具体方法参考文献[17]。每个样品至少拍10个不同的视野后进行统计。
将野生型和转基因拟南芥播种在营养钵中后放入穴盘,统一管理,15 d后开始断水处理,断水14 d后观察植株表型。
1.3 数据分析
试验数据用Microsoft Excel 2010和SPSS 11.5软件进行整理和统计分析。
2 结果与分析
2.1 木薯SBT家族成员的鉴定及系统进化树的构建
利用Phytozome12(http://phytozome.jgi.doe.gov/pz/portal.html)结合NCBI数据库通过Blast获得69个木薯SBT家族成员的CDS、氨基酸、转录本和基因组序列。利用MEGA5.0对56个拟南芥枯草杆菌蛋白酶和69个木薯SBT家族成员的氨基酸构建进化树。根据同源性分析,可以将木薯SBT家族成员分成五大类(I~V),I类为Manes.01G070400、Manes.01G070500、Manes.01G070600、Manes.01G167600、Manes.02G028900、Manes.06G020400、Manes.07G122300、Manes.10G021800、Manes.18G039300等9个,Ⅱ类为Manes.01G267200、Manes.05G175300、Manes.06G139800、Manes.16G104900等4个,Ⅲ类为Manes.02G030800、Manes.03G066700、Manes.08G023600、Manes.16G063100等4个,Ⅳ类为Manes.01G088700、Manes.01G158500、Manes.04G005200、Manes.04G146100、Manes.04G153100、Manes.05G041400、Manes.05G175400、Manes.06G013400、Manes.09G057300、Manes.09G072100、Manes.10G021400、Manes.10G021500、Manes.10G021600、Manes.10G021700、Manes.10G079600、Manes.11G010100、Manes.11G010200、Manes.12G067800、Manes.12G081800、Manes.13G059200、Manes.13G123200、Manes.14G157400、Manes.16G106100、Manes.18G039200、Manes.18G044300、Manes.17G027600等26个,V为Manes.01G069100、Manes.01G069200、Manes.01G167700、Manes.01G222700、Manes.02G029000、Manes02G011100、Manes.03G086500、Manes.04G074500、Manes.04G150200、Manes.04G153200、Manes.05G206600、Manes.05G206800、Manes.06G013200、Manes.06G013300、Manes.11G013600、Manes.11G018900、Manes.12G038100、Manes.13G039400、Manes.13G113900、Manes.14G164700、Manes.16G063000、Manes.16G094900、Manes.17G062600、Manes.18G010600、Manes.18G039000、Manes.S08900等26个。其中Manes.18G044300和拟南芥AtSDD1(AT1G04110.1)亲缘关系较近(图1)。因此,该基因被命名为MeSDD1。
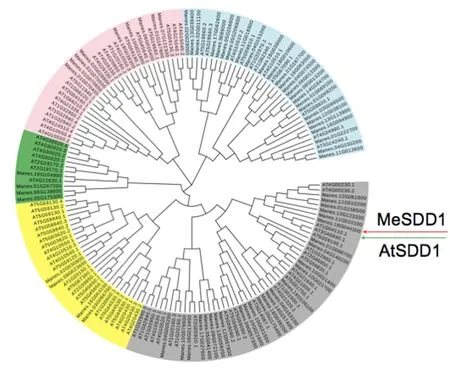
注:红色箭头示木薯MeSDD1,绿色箭头示拟南芥SDD1。Note: The red arrow represented MeSDD1, the green arrow represented AtSDD1.图1 拟南芥和木薯SBT家族成员系统进化树分析Fig.1 Phylogenic tree of Arabidopsis thaliana and cassava SBT family member
2.2 木薯SBT家族成员的染色体分布
基因组染色体定位结果表明,除了第15号染色体,木薯SBT家族成员在其他17条染色体上均有分布。第1号染色体分布最为密集,有12个SBT成员,Manes.S08900位于染色体末端;第2、第11和第13号染色体均有4个SBT成员;第3、第9和第17号染色体均只有2个SBT成员;第4和第10号染色体分别分布了6个SBT成员;第5、第6、第16和第18号染色体均有5个SBT成员;第7和第8号染色体均只有1个SBT成员;第12号染色体有3个SBT成员;第14号染色体有2个SBT成员(图2)。
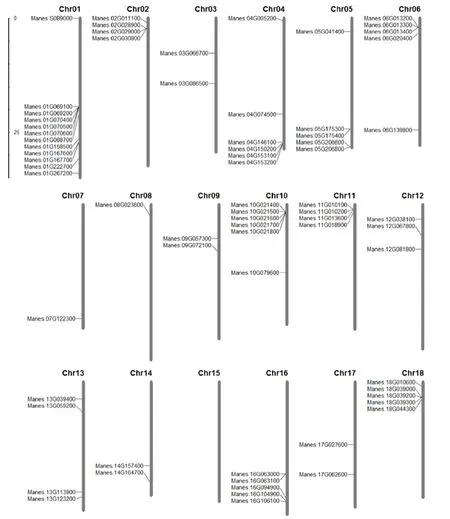
注:左边的数字表示该染色体的大小,标尺为Mb。Note: Left numbers represented size of the chromosome, scale is Mb.图2 木薯SBT基因家族的染色体分布Fig.2 The chromosomal location of SBT members in cassava
进一步分析表明,多数成员在染色体上呈紧密串联分布,第1号染色体有5个SBT成员(Manes.01G069100~Manes.01G069200; Manes.01G070400~Manes.01G070600)呈串联分布,第10号染色体有5个SBT成员(Manes.10G021400~Manes.10G021800)呈簇排列,第2、第4、第5、第6、第11、第16、第18号染色体均有2个成员紧密串联,分别是Manes.02G28900和Manes.02G29000;Manes.04G153100和Manes.04G153200;Manes.05G175300和Manes.05G175400;Manes.06G013200和Manes.06G013300;Manes.11G010100和Manes.010200;Manes.16G063000和Manes.16G063100;Manes.18G039200和Manes.18G039300(图2)。
2.3 木薯SBT家族成员基因结构和保守域分析
为了更好地了解木薯SBT家族基因的结构特征,依据进化树(图3-A)对外显子和内含子结构进行了分析,结果表明,Manes.18G044300(MeSDD1)等22个成员没有内含子,6个成员只有1个内含子,2个成员有2个内含子,2个成员有3个内含子,Manes.063000和Manes.029000分别有4个内含子和5个内含子,4个成员含有7个内含子,7个成员含有8个内含子,13个成员含有9个内含子,11个成员含有10个内含子。多数外显子数目相似成员聚为一类(图3-B)。
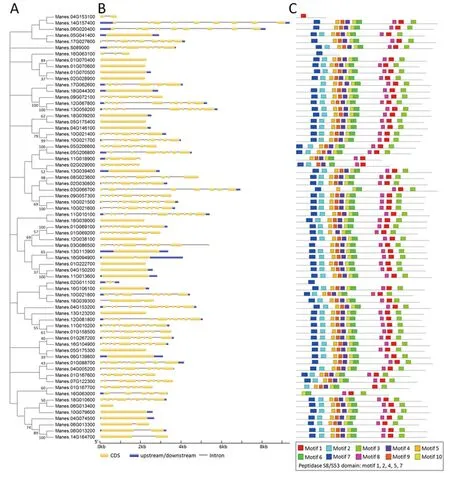
注: A: 进化树分析; B: 基因结构分析; C: 保守模体分析。Note: A: Evolutional tree analysis. B: Gene structure analysis. C: Conserved motif analysis.图3 木薯SBT家族基因结构和保守域分析Fig.3 Cassava SBT genes structural distribution and conserved protein motifs
木薯SBT家族成员共含有10个模体,其中保守结构域为模体1、模体2、模体4、模体5和模体7。Manes.04G153100只含有模体1,Manes.16G063100和Manes.02G011100只含有模体7;5个保守结构域基本均匀分布于57个SBT成员中(图3-C)。保守域基序的序列如图4所示。
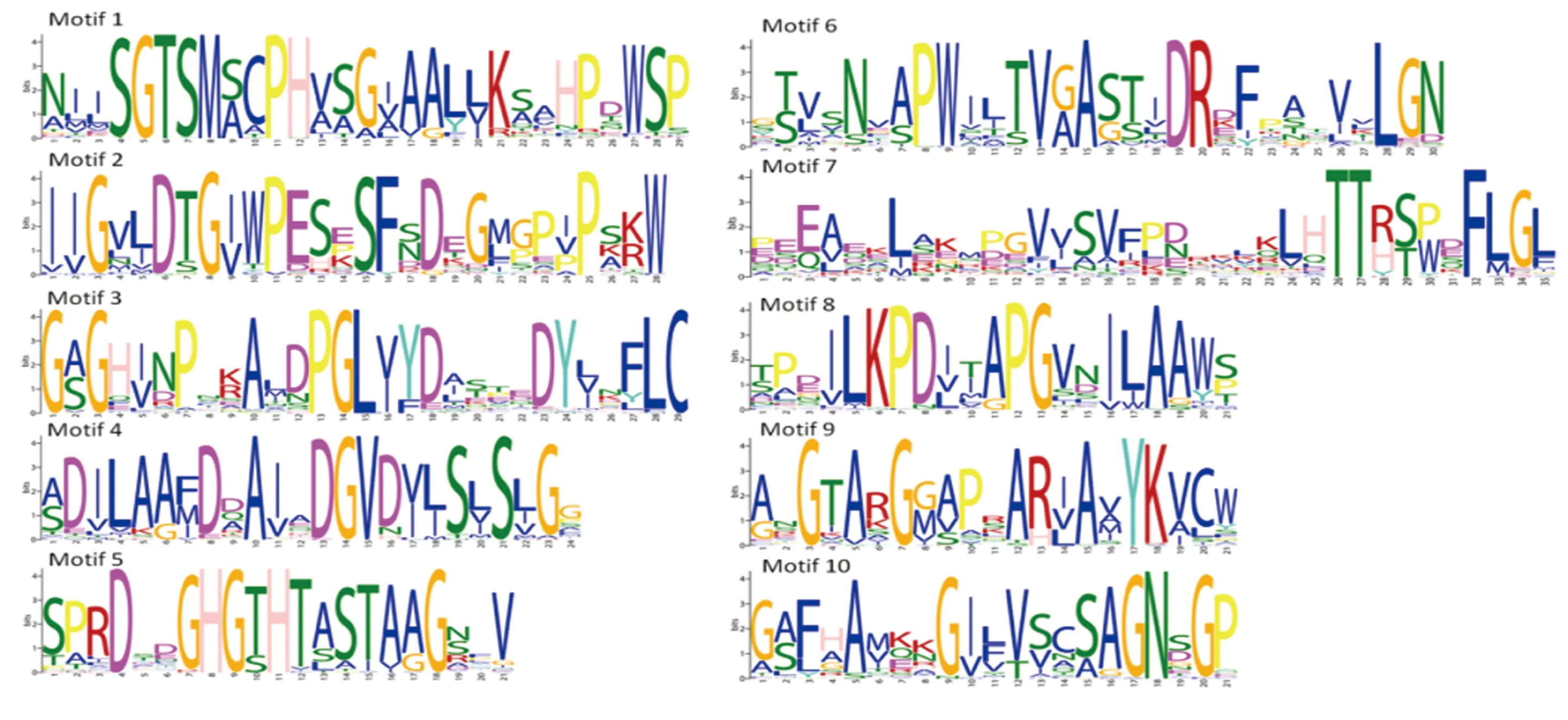
图4 木薯SBT家族蛋白质的10个模体基序的Logo展示Fig.4 Logo display of the ten conserved motifs of cassava SBT family proteins
2.4 木薯SBT基因家族启动子元件分析
为了进一步了解该基因家族成员的功能,对启动子上的顺式作用元件进行了预测分析。结果表明,该基因家族成员含有光反应Box和多种激素类响应元件如ABRE(脱落酸响应元件,TACGTG)、AuxRR-core(生长素响应元件,GGTCCAT)、转录因子GT1的结合位点(GGTTAA/TTAACC)、P-box(赤霉素响应元件,CCTTTTG)、MBS(干旱诱导响应元件,CAACTG)、MYB(V-myb avian myeloblastosis viral oncogene homolog,V-myb禽成髓细胞病病毒癌基因同源物)转录因子结合位点(CAACCA)和MYC[vmyc myelocytomatosis viral oncogene homolog (avian),V-myc髓细胞组织增生病毒癌基因同源物(鸟类)]转录因子结合位点(CAATTG)(表2)。

表2 SBT家族基因启动子顺式作用元件及功能Table 2 Function and cis-acting elements existed in promoters of the SBT family genes
2.5 MeSDD1基因的克隆
MeSDD1基因的PCR扩增结果如图5中箭头所示,测序结果表明,该基因CDS全长为2 316 bp,编码771个氨基酸。序列比对结果表明,MeSDD1与Manes.18G044300相似性为100%。
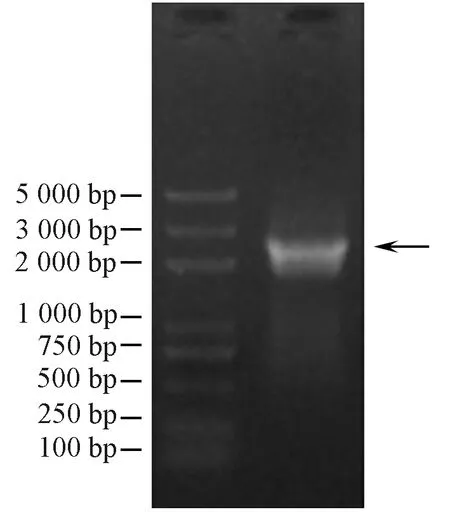
注: 左: DL2000 DNA分子量标准; 右: MeSDD1的cDNA扩增片段。Note: Left: DL 2000 marker. Right: cDNA amplification of MeSDD1.图5 木薯MeSDD1的cDNA扩增Fig.5 cDNA amplification of MeSDD1 in cassava
2.6 转基因拟南芥阳性植株筛选鉴定
将pC2300S-MeSDD1通过遗传转化获得10个独立的T1代转基因材料,利用NPTII特异引物进行PCR检测,表明10个转基因株系均为阳性(图6)。每个株系单独收种子获得T2代,经过卡那霉素抗性培养基筛选,随机挑选2个独立的转基因株系OE-1和OE-2进行qRT-PCR检测。结果显示,2个株系MeSDD1的表达量均显著高于野生型(wildtype,WT)(图7)。
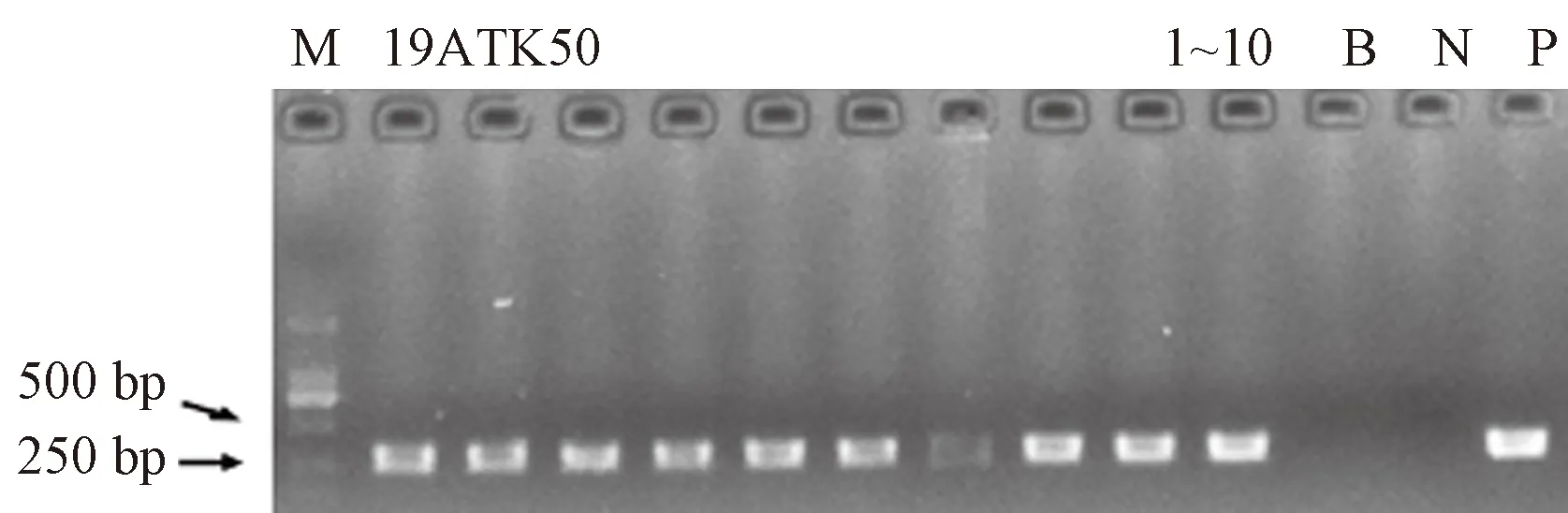
注: M: DL2000 DNA分子量标准; B: 空白对照; N: 阴性对照; P: 阳性对照; 1~10: MeSDD1转基因株系。19ATK50: 目的片段与表达载体形成的重组质粒。Note: M: DL 2000 marker. B: Blank control. N: Negative control. P: Positive control. 1~10: MeSDD1 transgenic lines. 19ATK50: The recombinant plasmid composed of the target fragment and the expression vector.图6 转基因拟南芥T1代阳性株系的PCR鉴定Fig.6 PCR identification of positive T1 generation transgenic Arabidopsis thaliana lines
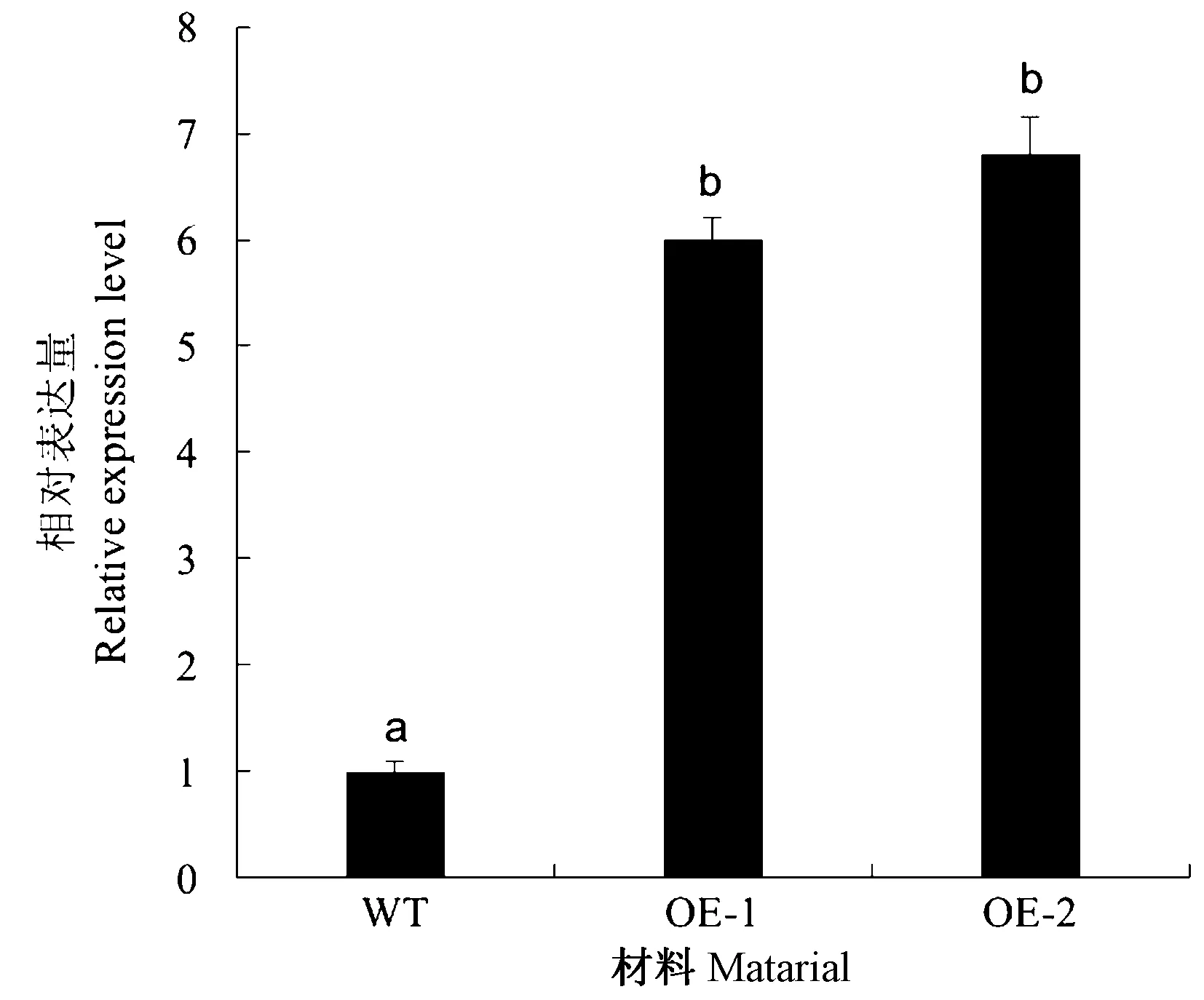
注: 不同小写字母表示在P<0.05水平有显著性差异。下同。Note: Different lowercase letters represent significant different at 0.05 level. The same as following.图7 转基因株系中MeSDD1的表达量Fig.7 Transcript level of MeSDD1 in transgenic lines
2.7 转基因拟南芥的抗旱生理指标鉴定
由图8可知,转基因株系的叶片相对含水量显著大于野生型(图8-A)。转基因株系的叶片失水率小于野生型(图8-B)。转基因株系的气孔密度显著低于野生型(图8-C)。
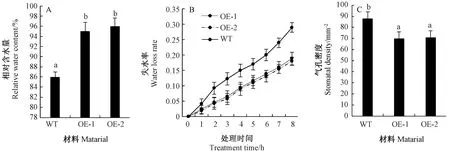
注: A: 野生型和转基因株系的相对含水量; B: 离体叶片失水率; C: 气孔密度。Note: A: The relative water content of wide type and transgenic lines. B: Water loss percentage of detached leaves. C: Stomatal density.图8 转基因拟南芥的抗旱生理指标鉴定Fig.8 Characteristics of physiology index of drought resistance of transgenic Arabidopsis plants
2.8 转基因拟南芥的抗旱表型鉴定
野生型和转基因植株有表型差异,野生型植株生长弱小,莲座叶几乎萎焉且接近死亡,只能观察到少数花;转基因植株生长高大旺盛,莲座叶叶片生长旺盛,植株开花数量明显比野生型多(图9)。

图9 转基因拟南芥植株的抗旱性鉴定Fig.9 Identification of drought resistance of transgenic Arabidopsis plants
3 讨论
SBT家族是一类庞大的基因家族,植物SBT家族基因不仅参与叶片气孔形成,还参与果实成熟[18]、种子发育[19]、细胞程序性死亡[20]、植物与病原菌互作[21]。本研究从木薯基因组中鉴定到69个SBT成员,亲缘关系相近的成员有相似的内含子-外显子结构,接近1/3的成员没有内含子,这种差异可能是SBT基因在进化过程中内含子的获得率与丢失率的差异导致的[22]。拟南芥与番茄中SBT基因同样有大部分成员无内含子[10]。内含子的获得与丢失与基因的进化率相关[22]。例如,一些几乎不含内含子的基因(F-box基因家族、早期生长素响应SAUR、DEAD box RNA解旋酶)通常在进化中经历正向选择[23]。由于内含子处于不断获得与丢失的过程中,在一些基因家族中的分布不会完全一样[24]。木薯SBT基因家族是否具有类似的效应还需要进一步研究。
木薯SBT家族基因在染色体上呈紧密串联分布,如第10号染色体有5个SBT成员呈簇排列,结合这些成员的基因结构,表明基因重复在SBT家族基因扩张过程中发挥了重要作用,且在 SBT 家族基因扩张过程中,伴随了基因的亚功能化、新功能化及表达模式的改变。
在干旱胁迫条件下,植物为了减少水分散失,减少气孔数量是最有效的途径之一[17,25]。气孔发育过程涉及一系列细胞分裂和连续的细胞状态转变。首先,原皮细胞分化为分生组织母细胞,经历不对称分裂产生一个小的三角形细胞和一个大的姊妹细胞(气孔线性细胞)。然后气孔线性细胞分化成叶状密生细胞。最后,分生组织转变成圆形保卫母细胞,单个保卫母细胞对称分裂生成一对保卫细胞,形成气孔[26-27]。该过程受到多个关键基因的调节[28],其中SDD1作为重要的蛋白酶,通过催化底物形成信号物激活下游MAPK信号通路抑制下游3个负责保卫细胞分化bHLH转录因子的转录控制细胞线性发育[12,29]。本研究结果表明,相对于野生型,35S启动子驱动的MeSDD1过表达拟南芥植株叶片细胞产生了更多的信号物,导致气孔发育相关基因表达丰度增加,导致分化出的保卫细胞数量更少,进而引起气孔密度降低;MeSDD1转基因植株相对含水量较野生型显著增加,每个时间点的叶片失水率均小于野生型。综上所述,MeSDD1转基因植株通过减少气孔密度减少水分散失增强了其对干旱胁迫的抗性。
4 结论
本研究利用生物信息学方法,在木薯全基因组水平鉴定到69个SBT成员,其中22个成员无内含子,69个成员的蛋白均携带5个高度保守的结构域,一些SBT成员在染色体上呈紧密的串联分布,启动子存在干旱响应元件和植物生长发育有关的顺式调控元件,其中Manes.18G044300(MeSDD1)与已报道的拟南芥SDD1基因亲缘关系最近,且在拟南芥中过表达MeSDD1,可以增强植株的抗旱性。

